Meniu

Grâu modele de boli
Grâu (Triticum spp.) este a doua cea mai importantă cultură în serie. Grâul este cultivat într-o gamă foarte largă de climate, de la producția de iarnă subtropicală până la climatul rece Scottisch, cultivat timp de 11 luni, cu o productivitate enormă. Ca toate bolile plantelor, unele au aspecte care sunt mai mult istorice și altele care sunt determinate în principal de climă.
Bolile determinate de condițiile climatice sunt: The boli de rugină, care sunt mai importante în zonele cu climă mai caldă, sunt în principal boli determinate de climă. Fusarium head blight și capacitatea sa de a forma toxine este influențată de istoricul câmpului și de situația climatică; nu se va produce dacă climatul nu este favorabil pentru o infecție în timpul înfloririi. De asemenea, Septoria tritici depinde de ploile care stropesc și de umezeala de lungă durată a frunzelor pentru a infecta canopul și, mai departe, porumbul.
Boli cu aspecte istorice: Miliardul pulverulent Blumeria graminis, care apare într-o gamă climatică largă, este influențată în principal de istoria unui teren. Pseudocercosporella herpotrichoides (Boala petelor oculare), Gaeumannomyces graminis (Take- all, Schwarzbeinigkeit) și Rhizoctonia cerealis (lotul galben) depind în mare parte de istoria sitului și nu sunt prea mult influențate de climă.
Boala Pyricularia grisea este descrisă în detaliu în Rice Diseases și denumită aici Magnaporthe grisea.
Rugină maro
Agentul patogen Puccinia triticina are nevoie de aceleași condiții de mediu ca și frunza de grâu. Ciuperca este capabilă să infecteze țesutul vegetal în perioade de rouă de trei ore sau mai puțin, la temperaturi de aproximativ 20°C; cu toate acestea, apar mai multe infecții în cazul unor perioade de rouă mai lungi. La temperaturi mai scăzute, sunt necesare perioade de rouă mai lungi, de exemplu, la 10°C este necesară o perioadă de rouă de 12 ore. Puține sau chiar deloc infecții apar atunci când temperaturile perioadei de rouă sunt peste 32°C (Stubbs et al., 1986) sau sub 2°C.
Cele mai multe epidemii grave apar atunci când uredinia și/sau infecțiile latente supraviețuiesc iernii la un anumit nivel de prag în cultura de grâu sau atunci când grâul semănat primăvara primește inocul exogen la o dată timpurie, de obicei înainte de răsărire. Epidemiile și pierderile grave pot apărea atunci când frunza steagului este infectată înainte de antază (Chester, 1946). Puccinia triticina este în principal un agent patogen al grâului, al strămoșilor săi imediați și al culturii artificiale triticale.
Gazde alternative
Ciuperca își produce gameții sexuali (picniospori și hife receptive) pe gazda alternativă. Majoritatea cercetătorilor în domeniul ruginei presupun că Thalictrum speciosissimum (din familia Ranunculaceae) este principala gazdă alternativă pentru P. recondita f. sp. tritici în Europa. Gazda alternativă este infectată atunci când teliosporii germinează în prezența umidității libere. Se produc bazidiospori (1n) care pot fi transportați pe o distanță scurtă (câțiva metri) pentru a infecta gazdele alternative. La aproximativ șapte până la zece zile de la infectare, apar picniile cu picniospori și hife receptive. Acestea servesc drept gameți, iar fertilizarea are loc atunci când nectarul care conține picniosporii este transportat de insecte, prin stropire de ploaie sau prin coeziune, până la hifele receptive ale celuilalt tip de împerechere. Cupele aeciale apar șapte până la zece zile mai târziu pe suprafața inferioară a frunzei, producând aeciospori care sunt purtați de vânt și care provoacă infecția prin penetrarea stomatelor frunzelor de grâu. Distanțele parcurse de aeciospori par a fi relativ scurte.
Ciclul de viață (rugina brună)
Figura alăturată prezintă ciclul de viață pentru P. triticina și P. triticiduri și ciclul bolii pentru rugina frunzelor de grâu. Momentul fiecărui eveniment și frecvența anumitor evenimente (ciclul sexual, sezonul de cultivare a grâului și podul verde) pot varia în funcție de zonele și regiunile lumii.
În prezent, gazda alternativă furnizează puțin inoculum direct de P. triticina la grâu, dar poate fi un mecanism de schimburi genetice între rase și, probabil, între populații. În multe zone, agentul patogen supraviețuiește în perioada dintre culturile de grâu pe o punte verde de grâu voluntar (autoînsămânțat) (a se vedea secțiunea "Epidemiologie"). Inoculul sub formă de urediniospori poate fi purtat de vânt dintr-o regiune în alta. Ciclul sexual este esențial pentru P. triticiduri. Teliosporii pot germina la scurt timp după dezvoltare, iar infecția cu basidiospori poate avea loc pe tot parcursul ciclului de creștere a grâului.
Urediniosporii inițiază germinația la 30 de minute după contactul cu apa liberă la temperaturi cuprinse între 15° și 25°C. Tubul germinativ crește de-a lungul suprafeței frunzei până când ajunge la un stoma; apoi se formează un appressorium, urmat imediat de dezvoltarea unui cui de penetrare și a unei vezicule substomatale din care se dezvoltă hife primare. O celulă mamă haustorială se dezvoltă pe celula mezofilă și are loc penetrarea directă. Haustoriul se formează în interiorul celulei gazdă vii, în cadrul unei interacțiuni compatibile între gazdă și agent patogen. Se dezvoltă hifele secundare, rezultând celule mamă haustoriale suplimentare și haustorii. În cazul unei reacții incompatibile între gazdă și agent patogen, haustoria nu se dezvoltă sau se dezvoltă într-un ritm mai lent. Când celula gazdă moare, haustoriul ciupercii moare. În funcție de momentul sau de numărul de celule implicate, interacțiunea gazdă-patogen va avea ca rezultat un răspuns de rezistență vizibil (Rowell, 1981, 1982).
Germinarea sporilor până la sporulație poate avea loc într-o perioadă de șapte până la zece zile la temperaturi optime și constante. La temperaturi scăzute (10° - 15°C) sau la fluctuații diurne, sunt necesare perioade mai lungi. Ciuperca poate supraviețui sub formă de miceliu insipid timp de o lună sau mai mult atunci când temperaturile sunt aproape sau sub zero grade. Sporulația maximă este atinsă la aproximativ patru zile de la sporulația inițială (la aproximativ 20°C). Deși numărul poate varia foarte mult, se produc aproximativ 3 000 de spori pe zi pe urediniu. Acest nivel de producție poate continua timp de trei săptămâni sau mai mult, dacă frunza de grâu rămâne în viață atâta timp (Chester, 1946; Stubbs et al., 1986). Urediniile (pustulele) sunt roșii, de formă ovală și împrăștiate și străpung epiderma (planșa 12). Urediniosporii sunt de culoare roșie-portocalie până la roșie închisă, echinulate, sferice și măsoară de obicei 20-28 µm în diametru (planșa 13). Teliosporii (planșa 14) sunt maro închis, bicelulare, cu pereți groși și rotunjite sau aplatizate la vârf (planșa 15). Puccinia triticiduri diferă de P. triticina prin faptul că are nevoie de 10-12 zile pentru apariția urediniosporilor, iar producția inițială de teliospori are loc adesea în termen de 14 zile de la infecția inițială. Urediniile sunt de culoare brun-gălbuie și produc mult mai puține urediniospori per urediniie, iar în câteva zile leziunea produce în principal teliospori. De asemenea, P. triticiduri infecțiile sunt susceptibile de a fi pe suprafața inferioară a frunzelor.
Teliosporii de P. triticina se formează sub epidermă în condiții nefavorabile sau în caz de senescență și rămân împreună cu frunzele. Țesuturile foliare pot fi dispersate sau deplasate de vânt, animale sau oameni la distanțe considerabile. Basidiosporii se formează și se eliberează în condiții de umiditate, ceea ce limitează răspândirea lor. Basidiosporii sunt, de asemenea, hialini și sensibili la lumină, ceea ce limitează și mai mult deplasarea la probabil zeci de metri. Aeciosporii sunt mai asemănători cu urediniosporii în ceea ce privește capacitatea lor de a fi transportați de curenții de vânt, dar transportul pe distanțe lungi nu a fost observat din anumite motive. Puccinia triticiduri va produce teliospori abundenți în câteva săptămâni de la infecția inițială, producând un inel întunecat de telia în jurul fiecărui loc de infecție.
Sursa: Grâul ruginește: R.P. Singh, J. Huerta-Espino, A.P. Roelfs.
Model de infecție cu Puccinia tritici
Puccinia tritici infecțiile au loc după:
- Câteva ore de umezeală a frunzelor în condiții optime de temperatură. Ciuperca se poate infecta într-o gamă largă de temperaturi.
- Modelul presupune că infecția are nevoie de o temperatură a aerului acumulată pe oră de 90°C de umezeală a frunzelor într-un interval de temperatură a aerului cuprins între 5°C și 30°C.
Umiditatea frunzelor pentru temperaturi medii orare acumulate pentru 90°C
- (dacă T <= 22,5°C atunci ∑(Th) altfel ∑ (22,5-(Th-22,5))
- 5°C < Temp. < 30°C
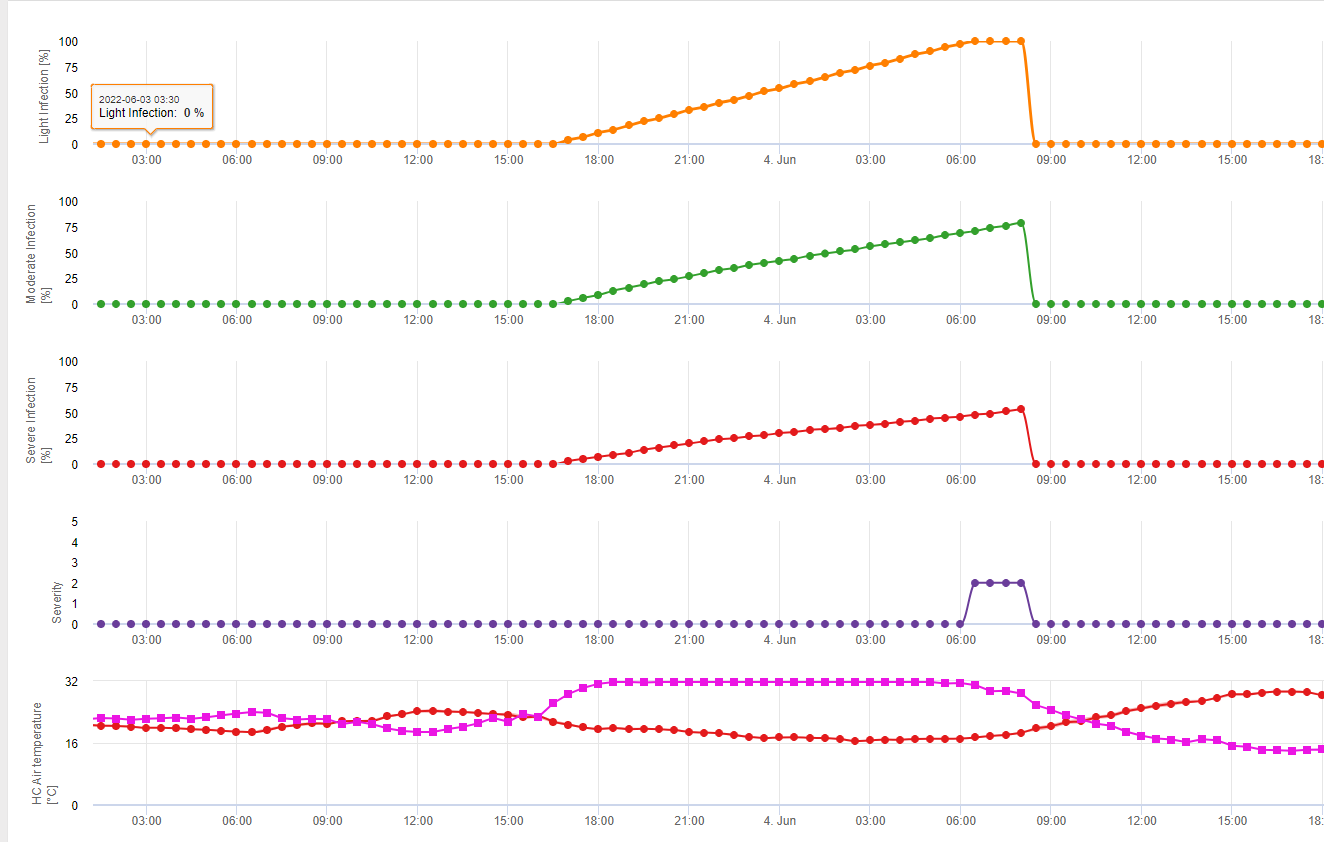
În FieldClimate Puccinia tritici infecția este reprezentată de linia galbenă (a se vedea mai sus). Condițiile sunt similare cu P. graminis, dar cu un prag de temperatură mai mic, de 5°C. În cazul în care se manifestă infecția 100% trebuie să se ia în considerare o măsură de protecție a plantelor curativă (aplicare sistemică). În cazul în care riscul este la 80% și prognoza meteo va prevedea mai multe perioade de umezeală foliară se pot lua aplicații foliare de protecție.
Rugină neagră
Rugina neagră a grâului este cauzată de P. graminis f. sp. tritici. La un moment dat, era o boală de temut în majoritatea regiunilor cultivate cu grâu din lume. Teama de rugina tulpinii era de înțeles, deoarece o cultură aparent sănătoasă cu trei săptămâni înainte de recoltare putea fi redusă la o încurcătură neagră de tulpini rupte și boabe zbârcite până la recoltare. În Europa și în America de Nord, eliminarea gazdei alternative a redus numărul de combinații de virulență și cantitatea de inocul produsă local (aeciospori). În plus, în unele zone, au fost introduse cultivare cu maturitate timpurie pentru a permite o a doua recoltă sau pentru a evita înflorirea și umplerea boabelor pe timp de caniculă. Soiurile cu maturare timpurie scapă de o mare parte din pagubele cauzate de rugina tulpinii prin evitarea perioadei de creștere a ciupercii. Utilizarea pe scară largă a cultivarelor rezistente la nivel mondial a redus importanța bolii ca factor semnificativ în producție. Deși schimbările în virulența agentului patogen au făcut ca unele rezistențe să devină ineficiente, cultivarele rezistente au fost, în general, dezvoltate înaintea agentului patogen. Epidemiile spectaculoase care s-au dezvoltat pe Eureka (Sr6 în Australia) în anii 1940 și pe Lee (Sr9g, Sr11, Sr16), Langdon (Sr9e, +) și Yuma (Sr9e, +) în Statele Unite la mijlocul anilor 1950 au fost cu adevărat excepții în trecut. Experiența din alte părți ale lumii a fost similară (Luig și Watson, 1972; Roelfs, 1986; Saari și Prescott, 1985). Astăzi, rugina tulpinii este în mare parte sub control la nivel mondial.
Epidemiologie
Epidemiologia P. graminis este similar cu P. triticina. Temperaturile minime, optime și maxime pentru germinarea sporilor sunt de 2°, 15° până la 24° și, respectiv, 30°C (Hogg et al., 1969), iar pentru sporulație, 5°, 30° și, respectiv, 40°C, ceea ce înseamnă cu aproximativ 5,5°C mai mult în fiecare categorie decât pentru P. triticina. Rugina tulpinii este mai importantă la sfârșitul perioadei de vegetație, pe cultivarele de grâu semănate și maturate târziu și la altitudini mai mici. Grâul semănat primăvara este deosebit de vulnerabil la latitudini mai mari, dacă sursele de inocul sunt situate sub vânt. În sudul Marilor Câmpii din America de Nord există suprafețe mari de grâu semănat toamna, care furnizează inoculum pentru culturile de grâu semănat primăvara în nord. În climatele calde și umede, rugina tulpinii poate fi deosebit de severă datorită perioadei lungi de timp în care există condiții favorabile pentru dezvoltarea bolii atunci când este disponibilă o sursă locală de inoculum.
Rugina tulpinii diferă de cea a frunzelor prin faptul că necesită o perioadă mai lungă de rouă (sunt necesare șase până la opt ore). În plus, multe dintre țepușele de pătrundere nu se dezvoltă din appressorium decât dacă sunt stimulate de cel puțin 10 000 de lux de lumină timp de trei ore, în timp ce planta se usucă încet după perioada de rouă. Infecția maximă se obține cu 8-12 ore de rouă la 18°C, urmate de 10 000+ lux de lumină în timp ce roua se usucă încet și temperatura crește la 30°C (Rowell, 1984). Lumina este rareori limitată în câmp, deoarece roua apare adesea dimineața. Cu toate acestea, infecția este redusă atunci când roua și/sau ploile de seară sunt urmate de vânturi care provoacă o uscare înainte de răsăritul soarelui. În seră, lumina redusă este adesea cauza ratelor scăzute de infecție. Efectul luminii este, probabil, un efect asupra plantei, mai degrabă decât asupra sistemului fungicid, deoarece urediniosporii injectați în interiorul verticilului frunzei au ca rezultat pătrunderea cu succes a ciupercii fără ca lumina să lovească ciuperca. Urediniile ruginii tulpinii apar atât pe suprafața frunzelor și a tulpinilor, cât și pe tecile frunzelor, pe spice, pe glume, pe coame și chiar pe boabe.
O pustulă de rugină a tulpinii (uredinium) poate produce 10 000 de urediniospori pe zi (Katsuya și Green, 1967; Mont, 1970). Acest număr este mai mare decât cel al ruginii frunzelor, dar infectabilitatea este mai mică, doar un germene din zece ducând la o infecție reușită. Uredinia ruginii tulpinii, care se află mai ales pe țesuturile tulpinii și ale tecii frunzelor, supraviețuiesc adesea mai mult decât cele ale ruginii frunzelor, care se limitează mai des la lamelele frunzelor. Rata de creștere a bolii pentru cele două boli este foarte asemănătoare.
Urediniosporii ruginii tulpinii sunt destul de rezistenți la condițiile atmosferice dacă conținutul lor de umiditate este moderat (20-30%). Transportul pe distanțe lungi are loc anual (800 km) prin marile câmpii nord-americane (Roelfs, 1985a), aproape anual (2000 km) din Australia până în Noua Zeelandă (Luig, 1985) și de cel puțin trei ori în ultimii 75 de ani (8 000 km) din Africa de Est până în Australia (Watson și de Sousa, 1983).
Aeciosporii pot fi, de asemenea, o sursă de inoculum pentru rugina tulpinii grâului. Din punct de vedere istoric, acest lucru a fost important în America de Nord și în Europa de Nord și de Est. Această sursă de inoculum a fost, în general, eliminată sau mult redusă prin îndepărtarea coacăzului comun sau european (Berberis vulgaris) din cauza apropierii de lanurile de grâu. Aeciosporii infectează grâul în mod similar cu urediniosporii.
Gazde
Grâul, orzul, triticale și câteva specii înrudite sunt gazdele principale pentru P. graminis f. sp. tritici. Cu toate acestea, agentul patogen strâns înrudit, P. graminis f. sp. secalis, este virulent pe majoritatea orzurilor și pe unele grâne (de exemplu, Line E). Puccinia graminis f. sp. secalis poate ataca Sr6 și Sr11 într-un fond gazdă din linia E (Luig, 1985). Gazda alternativă principală în natură a fost B. vulgaris L., o specie originară din Europa, deși alte specii au fost sensibile în testele din sere. Gazdele alternative sunt, de obicei, sensibile la toate sau la niciuna dintre formele speciale de P. graminis.
Gazde alternative
Principala gazdă alternativă pentru P. graminis este B. vulgaris, care a fost răspândită de oameni în latitudinile nordice ale emisferei nordice. Datorită creșterii sale verticale, stufoase, cu mulți spini ascuțiți, a constituit un gard viu excelent de-a lungul granițelor câmpurilor. Lemnul era util pentru confecționarea mânerelor de unelte, scoarța oferea un colorant, iar fructele erau folosite pentru a face gemuri. Coloniștii care au venit în America de Nord din Europa au adus cu ei coacăzul. Coacăzul s-a răspândit spre vest odată cu oamenii și s-a stabilit ca plantă naturalizată din Pennsylvania până în estul Dakotei și spre sud, în nord-estul Kansasului. Multe specii de Berberis, Mahonia și Mahoberberberis sunt sensibile la P. graminis (Roelfs, 1985b). Coacăzul canadian sau coacăzul din Allegheny, B. canadensis, ar trebui adăugat la această listă.
Gazda alternativă a fost o sursă majoră de noi combinații de gene pentru virulență și agresivitate la agentul patogen (Groth și Roelfs, 1982). Cantitatea de variație a agentului patogen a făcut ca reproducerea pentru rezistență să fie dificilă, dacă nu chiar imposibilă. Dintre combinațiile de virulență prezente într-un an, multe nu se mai repetau în anul următor, dar apăreau multe altele noi (Roelfs, 1982). Afinul a fost sursa de inocul (aeciospori) la începutul sezonului. În general, arbuștii infectați se aflau în apropierea câmpurilor de cereale din sezonul precedent, astfel încât inoculul a călătorit pe distanțe scurte, fără pierderea numărului și a viabilității asociate cu transportul pe distanțe lungi. Un singur tufiș mare de agriș poate produce aproximativ 64 x 109 aeciospori în câteva săptămâni (Stakman, 1923). Acest lucru este echivalent cu producția zilnică a 20 de milioane de uredini, pe o suprafață de 400 m2.
Afinul a fost o sursă majoră de inoculum de rugină a tulpinii în Danemarca (Hermansen, 1968) și în America de Nord (Roelfs, 1982). Succesul reducerii epidemiilor de rugină a tulpinii în Europa de Nord și în America de Nord, ca urmare a eliminării căpșunului din apropierea lanurilor de grâu, a dus probabil la o supraestimare a rolului acestei gazde alternative în generarea de epidemii anuale în alte părți.
Rezistența la P. graminis în Berberis se pare că este rezultatul incapacității agentului patogen de a penetra direct cuticula dură (Melander și Craigie, 1927). Berberis vulgaris devine rezistent la infecție la aproximativ 14 zile de la desfășurarea frunzelor. Cu toate acestea, infecțiile apar pe boabe, pe spini și pe tulpini, ceea ce sugerează că întărirea cuticulei nu este atât de importantă pe cât se credea inițial. În testele recente efectuate pe cultivare de gazde alternative, s-a observat un răspuns hipersensibil, în special la Berberis spp. (Mahonia).
Ciclul de viață
În cele mai multe zone ale lumii, ciclul de viață al P. graminis f. sp. tritici constă în generații urediniale continue. Ciuperca se răspândește prin intermediul urediniosporilor aeropurtați de la o plantă de grâu la alta și de la un câmp la altul. Inoculul primar poate proveni local (endemic) de la plante spontane sau poate fi transportat pe distanțe mari (exodemic) de vânt și depus prin ploaie. În America de Nord, P. graminis se deplasează anual 2 000 km de la grâul de iarnă din sud la grâul de primăvară din nord în 90 de zile sau mai puțin, iar în ciclul uredinial poate supraviețui iarna la nivelul mării până la cel puțin 35° N. Zăpada poate oferi un strat de acoperire care, ocazional, permite P. graminis să supraviețuiască sub formă de infecții pe grâul de toamnă chiar și la temperaturile severe de sub îngheț înregistrate la 45° N (Roelfs și Long, 1987). Ciclul sexual apare rareori, cu excepția nord-vestului Pacificului din Statele Unite (Roelfs și Groth, 1980) și a unor zone locale din Europa (Spehar, 1975; Zadoks și Bouwman, 1985). Deși ciclul sexual produce o mare diversitate genetică (Roelfs și Groth, 1980), acesta produce, de asemenea, un număr mare de indivizi care sunt mai puțin apți din cauza frecventelor gene recesive de virulență (Roelfs și Groth, 1988) și a reasortării genelor pentru agresivitate. Puccinia graminis a dezvoltat cu succes o strategie de reproducere asexuată care, aparent, permite ciupercii să mențină genele necesare în blocuri care sunt modificate ocazional prin mutație și selecție.
Germinația urediniosporelor începe în una până la trei ore la temperaturi optime (tabelul 13.2) în prezența apei libere. Perioada de umezeală sau de rouă trebuie să dureze între șase și opt ore la temperaturi favorabile pentru ca sporii să germineze și să producă un tub germinativ și un apriorium. Dezvoltarea vizibilă se oprește în stadiul de appressorium până când se asigură o lumină de cel puțin 10 000 lux (16 000 fiind optim). Lumina stimulează formarea unui cui de penetrare care intră într-un stoma închis. În cazul în care germenele se usucă în timpul perioadei de germinare, procesul este oprit ireversibil. Procesul de penetrare durează aproximativ trei ore, pe măsură ce temperatura crește de la 18° la 30°C (Rowell, 1984). Cerința de lumină pentru infecție face ca P. graminis să fie mult mai dificil de lucrat în seră decât P. recondita. Cel mai probabil, lumina are rareori un efect în câmp, cu excepția cazului în care perioadele de rouă se risipesc înainte de răsăritul zilei.
Urediniosporii se dezvoltă în pustule (urediniile) care rup epiderma și expun masele de spori de culoare brun-roșiatică. Urediniile sunt mai mari decât cele ale ruginii frunzelor și sunt de formă ovală sau alungită, cu țesutul epidermic liber sau rupt de-a lungul marginilor (planșa 16). Urediniosporii sunt structuri echinulate, de culoare maro-roșcată, de formă eliptică până la ovoidală, care măsoară 24 până la 32 µm x 18 până la 22 µm (planșa 17).
Pe măsură ce gazda se maturizează, telia (planșa 18) este produsă direct din infecțiile cu urediniospori sau teliosporii pot fi produși într-o pustulă uredinială matură. Teliosporii sunt de culoare maro închis, bicelulare și au o formă oarecum conică. Au pereți groși și măsoară 40-60 µm x 18-26 µm. Celula apicală este rotunjită sau ușor ascuțită (planșa 19). Teliosporii sunt dicarioți (n + n) și rămân cu paiul până primăvara. În această perioadă, are loc cariogamia și teliosporii devin diploizi (2n). În cazul ploilor de primăvară și al temperaturilor favorabile, teliosporul germinează, se desprinde de meioză și produce un bazidium cu patru celule. Fiecare celulă produce un stigmat cu o singură basidiosporă haploidă (1n). Basidiosporul hialin este transportat de vânt pe distanțe scurte (metri) până la tufișul de coacăze. Basidiosporii germinează și penetrează direct. Pentru o infecție maximă, țesutul foliar al afinului trebuie să aibă mai puțin de două săptămâni. Infecția de către o basidiosporă are ca rezultat producerea unui picniu (1n). Picnionul produce hife receptive și picniospori de un singur tip de împerechere (+ sau -), care servesc drept gameți feminini și masculini pentru ciupercă. Picniosporii unui tip de împerechere trebuie să fie transferați la hifele receptive ale tipului de împerechere opus pentru a iniția dezvoltarea ecizporilor. Transferul picniosporilor se face frecvent de către insecte, care sunt atrase de nectarul picnial care se scurge și care este produs de picnium. Împerecherea tipurilor + și - poate fi facilitată și de stropii de ploaie, de perierea frunzelor, de animale mai mari și de infecții vecine care se coalizează. Aeciosporii sunt dicarioți (n + n) și sunt produși în aecii, în general pe suprafața inferioară a frunzelor de afin, la șapte până la zece zile după fecundare. Ecizporii sunt produsul recombinării genetice și pot diferi în ceea ce privește virulența și agresivitatea lor. Gradul de variație depinde de diferențele dintre izolatele parentale. Puccinia graminis f. sp. tritici a fost încruciș ată cu alte formae speciales, iar încrucișările cu P. graminis f. sp. secalis au fost relativ fertile (Johnson, 1949). În Australia, există dovezi care indică recombinarea ruginii tulpinii grâului și a ruginii scabrului (P. graminis f. sp. secalis) (Burdon et al., 1981; Luig și Watson, 1972).
Aeciosporii sunt eliberați hidroscopic din ecidii și sunt purtați în aer până la grâu pe distanțe de la câțiva metri până la câțiva kilometri. Pentru infectare, eciosporii au nevoie de condiții similare cu cele ale urediniosporilor. Infecția cu ecizporii duce la producerea de urediniile dicariote (n + n) cu urediniospori. Ciclul asexuat care se repetă implică apoi urediniosporii care produc urediniile într-un ciclu de aproximativ 14 zile în condiții optime. În condiții de teren, unde temperaturile variază foarte mult, ciclul poate fi fie prelungit, fie scurtat. În general, temperaturile mai scăzute din câmp, cel puțin în primele etape ale ciclului de cultură, tind să prelungească perioada de latență. În nordul Indiei, s-a înregistrat o perioadă de latență de 31 de zile pentru rugina tulpinii (Joshi și Palmer, 1973).
Sursa: Grâul ruginește: R.P. Singh, J. Huerta-Espino, A.P. Roelfs.
Model de infecție cu Puccinia gramnis
Puccinia graminis infecțiile au loc după:
- Câteva ore de umezeală a frunzelor în condiții optime de temperatură. Ciuperca se poate infecta într-o gamă largă de temperaturi.
- Modelul presupune că infecția are nevoie de o temperatură a aerului acumulată pe oră de 80°C de umezeală a frunzelor într-un interval de temperatură a aerului cuprins între 10°C și 35°C. Aceasta preferă temperaturi puțin mai ridicate decât P. tritici iar infecția trebuie să fie urmată de lumina soarelui.
Umiditatea frunzelor pentru temperaturi medii orare cumulate de 80°C, urmată de un gerod de lumină (150 W/m²) pentru temperaturi medii orare cumulate de 30°C.
- (dacă T <= 24°C atunci ∑(Th) altfel ∑ Th-24
- 10°C < Temp. < 35°C
În FieldClimate P. graminis este calculată în condițiile descrise mai sus (linia verde). Atunci când apare infecția 100%, condițiile au fost favorabile pentru ciupercă și trebuie să se ia în considerare o măsură de protecție a plantelor (curativă).
Rugină galbenă
Rugina galbena a grâului cauzată de P. striiformis f. sp. tritici poate fi la fel de dăunătoare ca și rugina tulpinii. Cu toate acestea, rugina striată are o temperatură optimă mai scăzută pentru dezvoltare, ceea ce o limitează ca boală majoră în multe zone ale lumii. Rugina striată este în principal o boală importantă a grâului în timpul iernii sau la începutul primăverii sau la altitudini mari.
Rugina striată a grâului poate fi cauza ruginii striate la orz (Stubbs, 1985). În Europa, o forma specialis de P. striiformis a evoluat și se găsește frecvent pe orz și rareori pe alte soiuri de grâu decât cele mai sensibile (Zadoks, 1961). Puccinia striiformis f. sp. hordei a fost introdusă în America de Sud, unde s-a răspândit pe tot continentul (Dubin și Stubbs, 1986) și a fost identificată ulterior în Mexic și în Statele Unite (Roelfs et al., 1992).
Epidemiologie
Puccinia striiformis are cele mai mici cerințe de temperatură dintre cei trei agenți patogeni ai ruginii grâului. Temperaturile minime, optime și maxime pentru infecția cu rugina striată sunt de 0°, 11° și, respectiv, 23°C (Hogg et al., 1969). Puccinia striiformis poate ierna în mod activ pe grâul semănat toamna. Cea mai mare parte a lucrărilor de epidemiologie au fost efectuate în Europa și au fost analizate recent de Zadoks și Bouwman (1985) și Rapilly (1979).
În Europa, P. striiformis supraaglomerate pe grâu (Zadoks, 1961). Cantitatea de rugină de suprarezistență depinde de cantitatea de grâu voluntar, care, la rândul său, este în funcție de umiditatea din afara sezonului. Urechile-iniospori sunt apoi suflate la grâul semănat toamna. În nord-vestul Europei, iernarea este limitată la urediniomiceli din țesuturile foliare vii, deoarece temperaturile de -4°C ucid leziunile sporulante expuse. Leziunile latente pot supraviețui dacă frunza supraviețuiește. În alte zone ale lumii, zăpada poate izola leziunile sporulante de temperaturile scăzute, astfel încât temperaturile aerului sub -4°C nu reușesc să elimine leziunile de rugină. Perioada de latență a ruginii dungate în timpul iernii poate fi de până la 118 zile și se presupune că poate ajunge până la 150 de zile sub un strat de zăpadă (Zadoks, 1961).
În zonele din apropierea ecuatorului, rugina dungată tinde să cicleze endemic de la altitudini mai mici la altitudini mai mari și să revină în funcție de fenologia culturii (Saari și Prescott, 1985). La latitudini mai nordice, ciclul se prelungește, rugina striată deplasându-se din zonele montane spre podișuri și câmpii.
Din cauza sensibilității lor la lumina ultravioletă, urediniosporii ruginii striate nu sunt probabil transportați în stare viabilă la fel de departe ca cei ai ruginii frunzelor și ai tulpinilor. Maddison și Manners (1972) au constatat că urediniosporii ruginii striate sunt de trei ori mai sensibili la lumina ultravioletă decât cei ai ruginii tulpinii. Cu toate acestea, Zadoks (1961) a raportat că rugina striată a fost transportată de vânt în stare viabilă la peste 800 km. Introducerea ruginii striate a grâului în Australia și Africa de Sud și a ruginii striate a orzului în Columbia a fost probabil favorizată de oameni prin intermediul transportului cu avionul (Dubin și Stubbs, 1986; O'Brien? et al., 1980). Cu toate acestea, răspândirea ruginii striate din Australia până în Noua Zeelandă, pe o distanță de 2 000 km, a fost probabil prin intermediul urediniosporilor transportați prin aer (Beresford, 1982). Poate că un spor mediu al ruginii striate are o probabilitate mai mică de a fi transportat pe cale aeriană în stare viabilă pe distanțe lungi decât cel al altor rugini ale grâului, dar cu siguranță unii spori trebuie să poată supraviețui transportului pe distanțe lungi în condiții speciale și favorabile. Există mai multe exemple de migrație secvențială a ruginii striate. Virulența pentru gena Yr2 (cultivarele Siete Cerros, Kalyansona și Mexipak) a fost înregistrată pentru prima dată în Turcia și, după o perioadă de timp, a fost urmărită până în subcontinentul indian și pakistanez (Saari și Prescott, 1985) și poate fi asociată cu sistemele meteorologice numite "Western Disturbance". După cum s-a menționat, în America de Sud, rugina striată a orzului a migrat de la punctul său de introducere din Columbia până în Chile în decurs de câțiva ani (Dubin și Stubbs, 1986).
Cele mai multe zone din lume studiate par să aibă o sursă locală sau apropiată de inocul de la grâul voluntar (Line, 1976; Stubbs, 1985; Zadoks și Bouwman, 1985). Cu toate acestea, unele dovezi indică faptul că inoculul provine de la graminee care nu sunt cereale (Hendrix et al., 1965; Tollenaar și Houston, 1967). Studiile viitoare privind epidemiologia ruginii striate trebuie să ia în considerare nu numai prezența ruginii pe gramineele din apropiere, ci și faptul că rugina trebuie să apară pe graminee înainte de a apărea pe cereale. Trebuie să se demonstreze că fenotipul de virulență este același pe ambele gazde și că acesta trece de la iarbă la grâu în timpul sezonului de cultură.
În Țările de Jos, epidemiile de rugină striată pot fi generate de un singur urediniu la hectar care supraviețuiește iernii, dacă sezonul de primăvară este favorabil dezvoltării ruginii (Zadoks și Bouwman, 1985). Detectarea vizuală a unui singur urediniu la hectar este puțin probabilă, însă, pe măsură ce se dezvoltă focare în jurul urediniului inițial, acesta devine din ce în ce mai ușor de detectat.
Gazde
Puccinia striiformis este un agent patogen al gramineelor și al culturilor de cereale: grâu, orz, triticale și secară. Rugina striată este singura rugină a grâului care se răspândește în mod constant dincolo de punctul inițial de infecție din interiorul plantei.
Gazde alternative
Sunt cunoscute doar stadiile telial și uredinial ale ruginii striate. Eriksson și Henning (1894) au căutat gazda alternativă printre speciile de Boraginaceae. Tranzschel (1934) a sugerat că Aecidium valerianella, o rugină de valerianella, ar putea fi legată de P. striiformis. Mains (1933) a considerat că P. koeleriae Arth., P. arrhenatheri Eriks. și P. montanensis Ellis, care au stări ecidiene pe Berberis și Mahonia spp. ar putea fi legate de P. striiformis.
Straib (1937) și Hart și Becker (1939) au eșuat în încercările de a infecta Berberis, Mahonia și Valerianella spp.. Gazda alternativă a ruginei, P. agropyri Ell. & Ev., este Clematis vitalba. Această rugină seamănă foarte mult cu P. striiformis Astfel, Viennot-Bourgin (1934) a sugerat că gazda alternativă a ruginii striate ar putea să apară în familia Clematis. Teliosporii germinează imediat pentru a produce bazidiospori (Wright și Lennard, 1980), iar teliosporii probabil că nu ajută ciuperca ca mecanism de supraviețuire în timpul iernii. Un factor epidemiologic care trebuie luat în considerare este posibilitatea de infectare a gazdei alternative la sfârșitul verii, astfel încât aeciosporii ar putea infecta grâul proaspăt semănat sau ierburile târzii din sezonul rece. În unele zone de mare altitudine din Asia de Vest, recolta de grâu poate avea nevoie de 13 luni pentru a ajunge la maturitate. În astfel de cazuri, ar fi posibile infecții ale gazdei alternative la începutul primăverii.
Ciclul de viață
Puccinia striiformis este cel mai probabil o rugină hemiformă, deoarece ciclul de viață pare să fie format doar din stadiile urediniale și teliale. Uredia se dezvoltă sub formă de dungi înguste, galbene, liniare, în principal pe frunze și pe spiculețe (planșa 20). Atunci când căpățânile sunt infectate, pustulele apar pe suprafețele interioare ale glumelor și ale limbilor (Planșa 21). Urediniosporii sunt de culoare galbenă până la portocalie, mai mult sau mai puțin sferici, echinelați și au un diametru de 28 până la 34 µm (Planșa 22). Pe frunze se formează dungi negre înguste în timpul dezvoltării teliare. Teliosporii sunt de culoare maro închis, bicelulare și similare ca mărime și formă cu cele de la P. triticina (Planșa 23). Populațiile de rugină striată pot exista, își pot schimba virulența și pot da naștere la epidemii independent de o gazdă alternativă. Urediniosporii sunt singura sursă cunoscută de inoculum pentru grâu, iar aceștia germinează și infectează la temperaturi mai scăzute.
Sursa: Grâul ruginește: R.P. Singh, J. Huerta-Espino, A.P. Roelfs.
Puccinia striiformis Model de infecție
Puccinia striiformis este rugina grâului din climatele răcoroase, având o temperatură optimă de la 15°C în sus. Infecțiile sale au loc după câteva ore de umezeală a frunzelor în condiții de temperatură optimă. Ciuperca se poate infecta într-o gamă largă de temperaturi. Modelul presupune că infecția are nevoie de o temperatură a aerului acumulată pe oră de 80°C de umezeală a frunzelor într-un interval de temperatură a aerului cuprins între 5°C și 20°C. Nu există infecții în perioadele cu intensități luminoase scăzute.
Umiditatea frunzelor și lumina pentru temperaturi medii orare acumulate pentru 80°C
- (dacă T
- 5°C < Temp. < 20°C
La FieldClimate, o infecție cu P. striiformis este prezentată la 23 august, după o lungă perioadă de umezeală a frunzelor la temperaturi de aproximativ 15°C (linia roșie). După această infecție, trebuie luate în considerare strategiile de protecție a plantelor curative (sistemice), în timp ce înainte ca infecția să ajungă la 100% se poate face o aplicare de protecție.
Fusarium head blight
Fusarium head blight sau scabia boabelor mici este cauzată de ciuperca Fusarium graminearum (Schwabe), deși Țările de Jos și alte zone din Europa Centrală raportează F. culmorum ca fiind cea mai răspândită specie (Snidjers, 1989). În Polonia, F. culmorum, F. graminearum și F. nivale au prezentat niveluri similare de virulență moderată până la severă, în timp ce F. avenaceum s-a dovedit a fi de o virulență medie până la moderată. Cu toate acestea, în mai multe studii care au avut ca scop identificarea organismului cauzal, până la 18 Fusarium spp.. au fost izolate și identificate (Mihuta-Grimm și Foster, 1989; Reis, 1985).
Articol realizat de L. Gilchrist, H.J. Dubin TBC este răspândită în regiunile calde și umede, unde înflorirea coincide cu perioadele ploioase. Incidența acestei boli a crescut în ultimii zece ani din diverse motive. Poate cel mai important motiv este creșterea suprafețelor în care grâul este rotit cu porumb sau alte cereale. Alte motive sunt schimbările în sistemul de cultivare în scopul protecției solului și schimbările în cultivarea grâului din zonele tradiționale în zone mai umede, netradiționale (Gilchrist et al., 1997).
Fusarium scabia cauzează pierderi de producție grave la nivel mondial, care pot ajunge până la 50 %. În mod similar, în Paraguay, condițiile meteorologice din 1972 și 1975 au favorizat epidemiile de Fusarium și Septoria, care împreună au reprezentat pierderi de până la 70% (Viedma, 1989). Polonia, Țările de Jos, Regatul Unit, fosta Cehoslovacie, Federația Rusă, Franța și Austria sunt câteva dintre țările europene care raportează incidența scabiei. Zone din Canada, Statele Unite, Mexic, Guatemala, Brazilia, Ecuador, Uruguay și Argentina din America sunt puternic afectate de Fusarium (Ireta și Gilchrist, 1994).
Scabia poate provoca daune semnificative în ceea ce privește producția și calitatea, precum și toxicoze la animale și oameni (Ireta și Gilchrist, 1994; Baht et al., 1989; Luo, 1988; Snidjers, 1989; Marasas et al., 1988). Pagubele cauzate de tărtăcuță în Statele Unite au fost estimate la peste $1 miliarde de dolari SUA în 1993 și la $500 milioane de dolari SUA în 1994. În China, se estimează că păduchele poate afecta până la 7 milioane de hectare și că în anii epidemici se pot pierde 2,5 milioane de tone de cereale. Bolile legate de micotoxina fusariană la om au fost raportate în China, India și Japonia, în timp ce la animale au fost raportate boli în numeroase părți ale lumii (Dubin et al., 1997).
În prezent, există reglementări la nivel mondial privind micotoxinele (Van Egmond și Dekker, 1995). Cu toate acestea, în multe țări, reglementările nu sunt aplicate, iar mulți oameni, în special din zonele rurale, consumă cereale fără niciun control, fie sub formă de boabe de cereale, fie sub formă indirectă, sub formă de carne provenită de la animale hrănite cu cereale contaminate. Tabelul 16.1 prezintă principalele efecte asupra porcinelor și păsărilor de curte induse de cele mai importante toxine produse de unele Fusarium specii.
Condițiile meteorologice umede și călduroase dintre răsărire și maturitate sporesc severitatea scabiei. Punctul de intrare a F. graminearum este spicul, în special organele florale. Acest lucru afectează formarea semințelor și umplerea boabelor. Spiculii infectați își pierd rapid clorofila și devin de culoare palidă. Ulterior, devin roz sau de culoarea piersicii, în special la baza și marginile glumelor (planșa 41). În cazul în care condițiile de mediu rămân favorabile, infecția avansează la spiculii adiacenți și, în unele cazuri, poate infecta întregul spic, inclusiv rahisul și pedunculul acestuia. În cazul în care infecția este severă, boabele deteriorate sunt acoperite de miceliu și iau aspectul unei mase roz și vâscoase. În cazul în care nivelul bolii este moderat, boabele pot fi zbârcite, cu greutate redusă și de culoare albicioasă (boabe de piatră de mormânt).
Principalele efecte toxice asupra porcinelor și păsărilor de curte induse de cele mai importante toxine produse de unele specii de Fusarium
| Micotoxine | Semne clinice |
| Zearalenona | Vulvă roșie și umflată; prolaps vaginal la porci; purceii care alăptează pot prezenta mărirea vulvei; probleme de fertilitate. |
| Vomitoxină (desoxinivalenol, DON) | Scăderea aportului de hrană și a creșterii în greutate la porci cu DON la >2 mg/kg de hrană; vărsături; refuzul hranei la concentrații foarte mari de DON (>20 mg/kg de hrană)a |
| Alte tricotecene Toxina T-2 Toxina HT-2 Diacetoxiescirpenol>. | Mai toxic decât DON; reducerea consumului de furaje; emeză; iritații cutanate și gastrointestinale; neurotoxicitate; descendenți anormali; sensibilitate crescută la boli; hemoragie. |
| Ocharatoxină | Afectează în principal tubulii proximali ai rinichilor la porci și păsări de curte; rinichii sunt foarte măriți și palizi; ficat gras la păsările de curte. |
amg/kg = părți pe milion (ppm).
Sursa: Trenholm et al., 1984.
Fusarium graminearum (Planșa 42) poate ataca plantele de grâu în toate stadiile de creștere, provocând boli de putregai al semințelor, tulpinilor și rădăcinilor. Infecțiile primare pot apărea fie din ascospori, fie din macroconidii depuse pe glume și antere extrudate. Temperaturile de 10° până la 30°C și umiditatea relativă de peste 95 la sută timp de 40 până la 60 de ore sunt de obicei suficiente pentru ca macroconidia să infecteze cu succes spicele (Ireta, 1989).
Fusarium graminearum este unul dintre puținele Fusarium specie care produce peritecii în condiții de câmp (planșa 43, planșa 44). Periteciile reprezintă stadiul sexual al ciupercii, Gibberella zeae, și sunt produse pe glumele de grâu. Periteciile joacă un rol important în supraviețuirea agentului patogen de la un an la altul (Khonga și Sutton, 1988) și coexistă cu miceliile din reziduurile culturii precedente pentru a constitui sursa inițială de inocul pentru păduche. Cercetările efectuate în China au demonstrat că cea mai scăzută temperatură pentru producerea de peritecii a fost între 7° și 10°C, iar cea mai potrivită a fost între 15° și 20°C. Cel mai scăzut conținut de umiditate a solului pentru producerea de peritecii a fost de 50-60%, iar cel mai potrivit a fost de 70-80% (Wang, 1997).
Factorii care determină dezvoltarea bolii includ climatul, nivelul de inoculum și stadiul de creștere a grâului. Epidemiile de pătarea grâului depind în principal de cantitatea de inocul primar, mai degrabă decât de inoculul secundar. Invazia are loc mai ales în timpul perioadei de înflorire. Infecția secundară cu conidii (planșa 45) are loc după ce spicele bolnave apar în câmp.
Reziduurile de cultură și practicile culturale joacă un rol important în conservarea F. graminearum și, în consecință, epidemii. Infecțiile la grâul semănat într-un câmp cu reziduuri de porumb pot fi de două sau trei ori mai grave (Teich și Nelson, 1984). În general, agentul patogen a fost saprofit doar pe miriște de orez în zonele de rotație orez-viță de grâu și pe tulpinile de porumb în zonele de plantare uscată din China (Wang, 1997). În cazul în care reziduul este arat, supraviețuirea periteciilor scade și reduce sursa primară de inocul (Reis, 1989).
Fusarium graminearum este un parazit facultativ și este patogen pentru multe alte graminee, inclusiv buruieni comune și culturi de cereale (secară, orez, orz și triticale). În cazul în care practicile, cum ar fi rotația cu culturi ne-gazdă sau gestionarea reziduurilor de culturi, nu sunt eficiente singure, acestea pot reduce, în combinație, sursa de inocul primar. Controlul bolii se bazează în mod eficient pe un management integrat, care include practici agronomice adecvate, utilizarea de soiuri rezistente sau tolerante și aplicații chimice.
Biologia bolii Fusarium Head Blight
Agenți patogeni ocazionali
FHB este cauzată de specii fungice din genul Fusarium. Cea mai frecventă specie care provoacă FHB este Fusarium graminearum (etapa sexuală - Gibberella zeae). Această ciupercă este aceeași care este frecvent asociată cu putregaiul tulpinilor de porumb. O altă ciupercă Fusarium specia care provoacă FHB este Fusarium culmorum. Atât F. graminearum și F. culmorum poate provoca, de asemenea, putrezirea rădăcinilor de cereale mici. La orz, alte două Fusarium specii, F. poae și F. avenaceum, poate provoca, de asemenea, arsura boabelor.
Supraviețuire și răspândire
Ciuperca persistă și se înmulțește pe reziduurile infectate ale culturilor de cereale mici și porumb. În timpul vremii umede, sporii ciupercii sunt purtați de vânt sau împrăștiați pe capetele culturilor de cereale. Sporii pot proveni din interiorul unei culturi sau pot fi suflați din culturile învecinate, uneori la distanțe mari. Culturile de grâu și de grâu dur sunt susceptibile la infecție din perioada de înflorire (polenizare) până la stadiul de aluat tare al dezvoltării boabelor. Sporii ciupercii cauzale pot ateriza pe anterele expuse în timpul înfloritului și apoi se pot dezvolta în boabe, glume sau alte părți ale căpățânii. În cazul orzului de primăvară, care înflorește atunci când căpățâna este în botic, infecția este mai frecventă după perioada de înflorire, odată ce căpățâna străpunge teaca frunzei. În ambele culturi, infecția poate continua până aproape de maturitatea boabelor, în condiții de mediu favorabile organismului (organismelor).
Condițiile cele mai favorabile pentru infectare sunt perioadele prelungite (48 până la 72 de ore) de umiditate ridicată și temperaturi ridicate (75 până la 85 de grade Fahrenheit (24°C până la 30°C)). Cu toate acestea, infecția se produce la temperaturi mai scăzute atunci când umiditatea ridicată persistă mai mult de 72 de ore. Infecțiile timpurii pot produce spori aeropurtați, care sunt responsabili de răspândirea secundară a bolii, în special dacă cultura are o înflorire neuniformă din cauza unor butuci întârziați.
Deoarece dezvoltarea FHB depinde de condițiile favorabile de mediu, de la înflorire (apariția căpățânii la orz) până la dezvoltarea boabelor, apariția și severitatea bolii variază de la an la an. O combinație de factori care pot duce la cele mai mari pierderi de producție și calitate sunt: inocul abundent, perioade prelungite sau repetate de umezeală și umiditate ridicată în timpul înfloririi (apariția căpățânii la orz) și până la dezvoltarea bobului și utilizarea unui soi foarte sensibil.
Model de infecție cu Fusarium Head Blight
Se știe că agenții fungici care aparțin complexului Fusarium Head Blight la grâu sunt favorizați de temperaturi calde de 20-30 °C și de perioade lungi de umiditate. Perioadele de umezeală a frunzelor de câteva zile vor duce la apariția timpurie a simptomelor vizibile. Dar simptomele pot fi observate după o perioadă de latență mai lungă dacă infecția este urmată de o perioadă de umezeală a frunzelor de 18 ore sau chiar mai scurtă. Simptomele pot fi observate și după o inoculare artificială la temperaturi de 15°C.
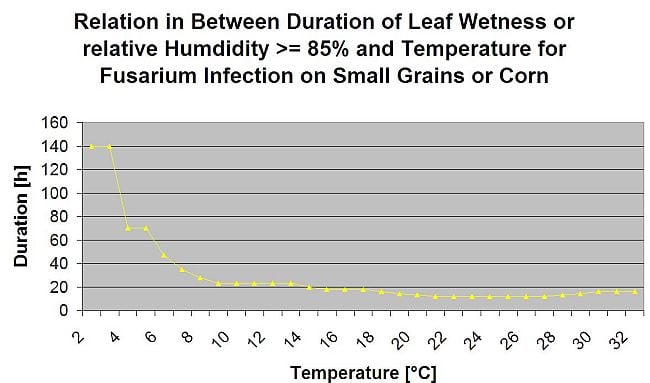


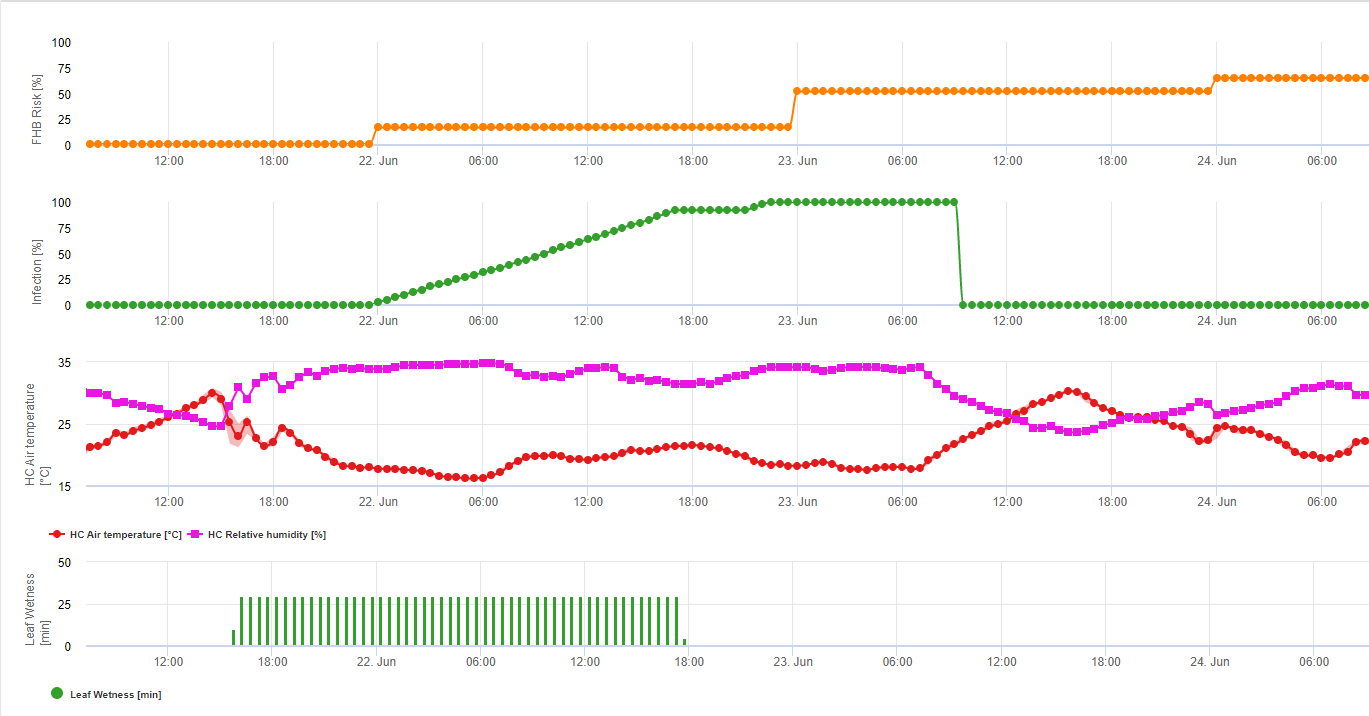
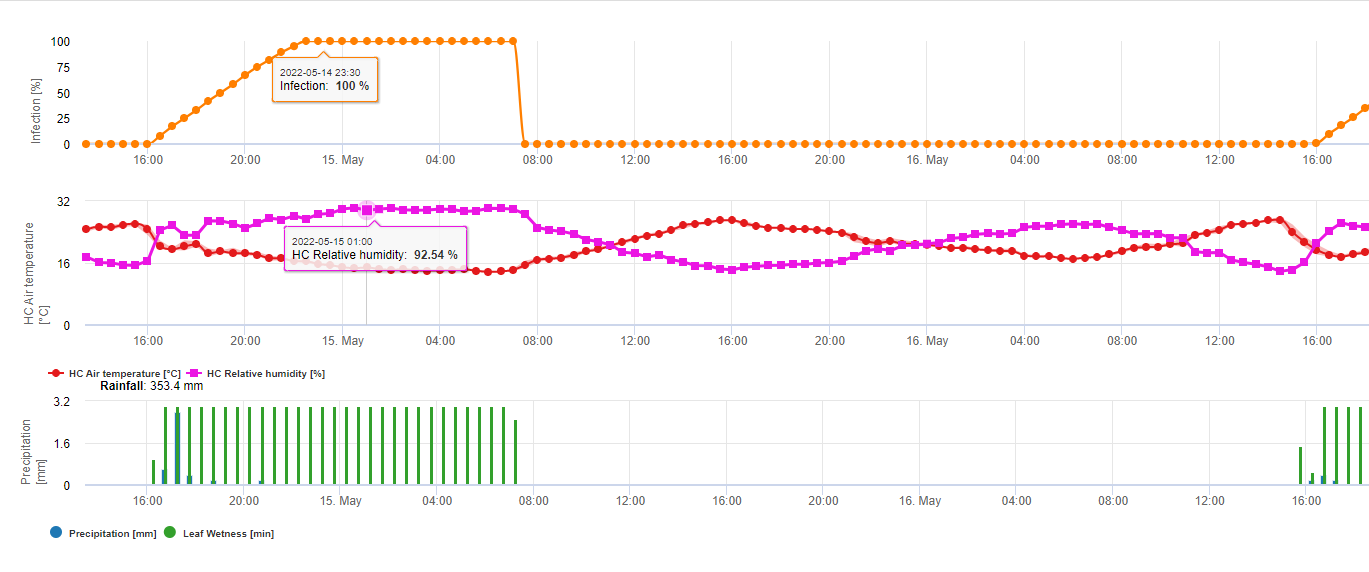
Rezumând toate combinațiile diferite de temperaturi și umiditate pe care le-am găsit în literatura de specialitate, am decis să evidențiem infecțiile cu Fusarium Head Bligh în cazul în care perioada sau perioadele de temperatură și umiditate foliară cu o umiditate relativă mai mare de 85% depășesc valorile vizualizate în graficul următor.
Infecțiile sunt declanșate de o ploaie de 2 mm. Se poate presupune o infecție cu Fusarium Head Blight dacă valoarea progresului infecției atinge 100%. Calculul acestei valori de progres se bazează pe relația dintre durata condițiilor umede și temperatura afișată în graficul de mai sus.
Acest model este utilizat pentru a vizualiza zilele de infecție și condițiile climatice în timpul climatului. Cunoașterea de către cultivatori a stadiului de dezvoltare a diferitelor soiuri de grâu oferă posibilitatea de a decide aplicarea unui tratament curativ imediat după infecție.
Alertă privind micotoxinele Fusarium
Testele de infecție cu perioade prelungite de umezeală a frunzelor de Fusarium head blight conduc la conținuturi ridicate de micotoxine. Pe baza acestor informații, se presupune că o perioadă de umezeală a frunzelor de 48 de ore sau mai mult în timpul stadiilor 61 și 69 prezintă un risc ridicat de micotoxine. Experiențele acumulate pe parcursul analizelor DON în grâul cultivat în scop comercial au arătat că perioadele de umezeală a frunzelor suficient de lungi pentru infecție, după o infecție inițială în stadiile 61-69, pot crește și ele valorile DON. În cazul unor perioade mai lungi de umezeală a frunzelor, micotoxinele pot crește până la stadiul 85. FieldClimate acumulează o cifră de risc proporțională cu progresul infecției pentru fiecare perioadă de infecție succesivă pe parcursul perioadei care a fost selectată ca fiind adecvată pentru aceste calcule. Șase perioade de infecție abia încheiate ar duce la un risc de 100%. În mod normal, perioada de umezeală a frunzelor care duce la o infecție cu fusarium este mai lungă decât minimul necesar. Prin urmare, majoritatea infecțiilor cu fusarium vor duce la o creștere a riscului de peste 17%. Valoarea riscului care indică o situație problematică în ceea ce privește micotoxinele depinde de istoricul câmpului. Grâul cultivat după porumbul fără lucrare a solului sau grâul fără lucrare a solului după porumbul fără lucrare a solului poate prezenta un risc mic doar dacă nu este pulverizat în situația optimă. În cazul grâului nepulverizat, trebuie să ne așteptăm la o creștere a valorilor DON deja după 35% de risc. Grâul după grâul nelucrat, care urmează orice altă cultură decât porumbul sau grâul, poate prezenta un risc mai mare de 50%. În cazul în care avem grâu după porumb sau grâu cu prelucrare a solului, riscul poate fi extins la 70%. Grâul din primul an ar trebui testat pentru DON dacă riscul depășește 100%.
1) Modelul de risc pentru Fusarium Head Blight care calculează perioadele de timp riscante pentru o infecție. Ori de câte ori se atinge nivelul de infecție 100% (linia verde), riscul (linia albastră) este foarte ridicat, iar condițiile pentru ciupercă au fost favorabile pentru infecție. În funcție de metoda de aplicare (curativă, preventivă), perioada de timp de risc este reprezentată de linia albastră.
2) Fusarium Head Blight: în acest model, infecția cu FHB este calculată în funcție de precipitații (2 mm necesari), umiditate relativă (peste 85%) sau umezeală foliară, temperatură în timpul procesului. În cazul în care infecția atinge 100%, condițiile optime pentru ciuperca patogenă au fost atinse. În continuare, modelul calculează riscul de micotoxine FHB.
Pată de frunze pătate
Există două boli majore de septorioză la grâu. Acestea sunt Septoria tritici blotch, provocată de ciuperca Septoria tritici (teleomorf: Mycophaerella graminicola) și Septoria nodorum pată, cauzată de ciuperca Septoria nodorum (teleomorfă: Leptosphaeria nodorum). Ambele boli cauzează pierderi serioase de randament care variază între 31 și 53% (Eyal, 1981; Babadoost și Herbert, 1984; Polley și Thomas, 1991). La nivel mondial, sunt afectate peste 50 de milioane de hectare de grâu, care cresc în principal în zonele cu precipitații abundente. În ultimii 25 de ani, aceste boli au fost în creștere și au devenit un factor limitativ major pentru producția de grâu în anumite zone. În cazul unor epidemii grave, miezul cultivarelor de grâu sensibile se zbârcește și nu este bun pentru măcinare. Epidemiile de Septoria tritici blotch și Septoria nodorum blotch la grâu sunt asociate cu condiții meteorologice favorabile (ploi frecvente și temperaturi moderate), practici culturale specifice, disponibilitatea inoculului și prezența unor soiuri de grâu sensibile (Eyal et al., 1987).
Septoria spp. Biologie
În urma lui Erick De Wolf, Septoria Tritici Blotch, Universitatea de Stat din Kansas, aprilie 2008 Septoria tritici cunoscută sub numele de "pată de frunze pătate", este cauzată de ciuperca Septoria tritici. Este răspândit în toate zonele de cultivare a grâului din lume și reprezintă o problemă gravă în multe regiuni. Septoria tritici este cel mai dăunătoare atunci când boala atacă frunzele superioare și căpățânile soiurilor sensibile la sfârșitul sezonului.
Simptomele
Septoria tritici Simptomele de pete apar pentru prima dată toamna. Simptomele inițiale sunt mici pete galbene pe frunze. Aceste leziuni devin adesea cafeniu deschis pe măsură ce îmbătrânesc, iar corpurile de fructificare ale ciupercii pot fi văzute încorporate în leziunile de pe coame. Leziunile au o formă neregulată și variază de la eliptică la lungă și îngustă (figura 1). Leziunile conțin pete mici, rotunde și negre, care reprezintă corpurile de fructificare ale ciupercii. Corpurile de fructificare negre arată ca niște boabe de piper negru și pot fi văzute, de obicei, fără ajutorul unei lupe. Boala începe pe frunzele inferioare și progresează treptat spre frunza steag. Tecile frunzelor sunt, de asemenea, susceptibile la atac. În anii umezi, ciuperca pătată a frunzelor se poate muta pe căpățâni și poate provoca leziuni brune pe glume și pe coame, cunoscute sub numele de pătarea glumelor. Aceste leziuni devin adesea cafeniu deschis pe măsură ce îmbătrânesc, iar corpurile de fructificare ale ciupercii sunt adesea vizibile încorporate în leziunile de pe coame.
Faza de pătare a glumei poate cauza pierderi semnificative de producție, dar relația dintre severitatea bolii și pierderea de producție nu este bine înțeleasă. Septoria tritici poate fi confundată cu alte boli ale frunzelor care au simptome foarte asemănătoare: pătarea bronzului și Stagonspora nodorum pată, de exemplu. Este obișnuit ca plantele să fie infectate de mai multe dintre aceste boli foliare și poate fi necesară o examinare de laborator pentru a diagnostica cu precizie care sunt cele mai răspândite boli. Examinarea de laborator este aproape întotdeauna necesară pentru a distinge cauza pătării glumei. Cunoașterea speciei nu este importantă pentru deciziile de pulverizare, deoarece toate cele trei boli răspund în mod similar la fungicide. Cu toate acestea, cunoașterea bolilor care sunt cele mai răspândite este o parte importantă a selecției soiurilor, deoarece diferite gene controlează rezistența la boli.
Cel mai sigur mod de a distinge petele de Septoria tritici de celelalte boli este prezența fructificațiilor negre ale ciupercii. Ciuperca care provoacă pătarea bronzată nu produce acest tip de structură reproductivă. Cu toate acestea, în condiții de umiditate, ciuperca care cauzează pata Stagonospora nodorum va produce corpuri fructifere de culoare maro deschis. În plus față de diferența de culoare, aceste structuri sunt, de asemenea, mai mici decât cele produse de Septoria tritici.
Ciclul de viață
Septoria tritici supraviețuiește pe parcursul verii pe reziduurile unei culturi anterioare de grâu și inițiază infecții în toamnă. Există unele dovezi că ciuperca poate supraviețui în asociere cu alte gazde ierboase și semințe de grâu. Aceste surse ale ciupercii sunt probabil cele mai importante atunci când nu există reziduuri de grâu. Indiferent de practicile de rotație sau de gestionare a reziduurilor, există, de obicei, suficient inocul pentru a iniția infecțiile de toamnă. Septoria tritici pătarea este favorizată de vremea rece și umedă. Intervalul optim de temperatură este cuprins între 16 și 21 °C; cu toate acestea, infecțiile pot apărea în timpul lunilor de iarnă la temperaturi de până la 5 °C. Infecția necesită cel puțin 6 ore de umezeală a frunzelor, iar pentru o infecție maximă sunt necesare până la 48 de ore de umezeală. Odată ce a avut loc infecția, ciuperca are nevoie de 21 până la 28 de zile pentru a dezvolta corpurile de fructificare negre caracteristice și pentru a produce o nouă generație de spori. Sporii produși în aceste corpuri de fructificare sunt exsudați în mase lipicioase și au nevoie de ploaie pentru a fi împrăștiați pe frunzele superioare și pe căpățâni.
Infecție prin Septoria tritici
Pycnidiospori de S. tritici germinează în apă liberă de la ambele capete ale sporului sau din celulele intercalare (Weber, 1922). Germinația sporilor nu începe decât după aproximativ 12 ore de la contactul cu frunza. Tuburile germinative se dezvoltă la întâmplare pe suprafața frunzei. Weber (1922) a observat doar penetrarea directă între celulele epidermice, dar alții au concluzionat că penetrarea prin stomatele deschise și închise este principalul mijloc de pătrundere în gazdă (Benedict, 1971; Cohen și Eyal, 1993; Hilu și Bever, 1957). Kema et al. (1996) au observat numai penetrarea prin stomate. Hifele care cresc prin stomate se restrâng până la un diametru de aproximativ 1 μm, apoi se lărgesc după ce ajung în cavitatea substomatală.
Hifele cresc paralel cu suprafața frunzei sub celulele epidermice, apoi prin mezofil până la celulele din partea inferioară a epidermei, dar nu în epidermă. Nu se formează haustorii, iar creșterea hifelor este limitată de celulele sclerenchymatice din jurul fasciculelor vasculare, cu excepția cazului în care hifele sunt foarte dense. Fasciculele vasculare nu sunt invadate. Hifele cresc intercelular de-a lungul pereților celulari prin mezofil, ramificându-se la un sept sau în mijlocul celulei. Nu apar simptome macroscopice timp de aproximativ 9 zile, cu excepția unei celule moarte ocazionale, dar celulele mezofile mor rapid după 11 zile. Picnidele se dezvoltă în camerele substomatice. Hifele rareori se dezvoltă în celulele gazdei (Hilu și Bever, 1957; Kema et al, 1996; Weber, 1922).
O infecție reușită are loc numai după cel puțin 20 de ore de umiditate ridicată. Doar câteva pete maronii s-au dezvoltat dacă frunzele au rămas umede timp de 5-10 ore după depunerea sporilor (Holmes și Colhoun, 1974) sau până la 24 de ore (Kema et al., 1996). Relațiile gazdă-parazit sunt aceleași pe grânele rezistente sau sensibile. Germinația sporilor pe suprafața frunzelor este aceeași, indiferent de sensibilitate. Numărul de penetrări reușite este aproximativ același, dar creșterea ifelor este mai rapidă la cultivarele sensibile, ceea ce duce la mai multe leziuni. Hifele se extind 44 Sesiunea 2 - B.M. Cunfer dincolo de zona necrotică la toate cultivarele. O toxină poate juca un rol în patogeneză (Cohen și Eyal, 1993; Hilu și Bever, 1957). În schimb, colonizarea a fost mult redusă pe o linie rezistentă (Kema et al., 1996).
Stagonospora (Septoria) și Septoria Pathogens of Cereals: Procesul de infectare
B.M. Cunfer, Departamentul de Fitopatologie, Universitatea din Georgia, Griffin, GA
Procesul de infectare a fost studiat cel mai intens pentru Stagonospora (Septoria) nodorum și Septoria tritici. Un studiu aprofundat privind Septoria passerinii este disponibil. Aproape toate informațiile raportate se referă la infecția prin picnidiospori. Cu toate acestea, procesul de infecție pentru alte forme de spori este destul de similar. Informațiile prezentate se referă în principal la infectarea frunzelor în condiții optime. Unele studii au fost realizate cu plante de răsaduri intacte, în timp ce altele au fost realizate cu frunze detașate. Infectarea coleoptilului și a răsadului de grâu de către S. nodorum a fost descrisă în detaliu de Baker (1971) și revizuită de Cunfer (1983). Deși nu s-au făcut comparații precise, se pare că procesul de infecție are multe asemănări în fiecare sistem gazdă-parazit și este tipic pentru mulți agenți patogeni necrotrofi. Informațiile privind factorii care influențează dezvoltarea simptomelor și expresia bolii sunt excluse, dar au fost analizate de alți autori (Eyal et al., 1987; King et al., 1983; Shipton et al., 1971). Este inclus un rezumat al factorilor care influențează longevitatea sporilor pe suprafața frunzelor.
Rolul Cirrusului și supraviețuirea sporilor pe suprafața frunzei Cele mai detaliate informații privind funcția de înveliș al cirrusului care încorporează picnidiosporii exsudați din picnidium sunt pentru S. nodorum. Cirrul este un gel compus din compuși proteici și zaharoizi. Compoziția și funcția sa sunt similare cu cele ale altor ciuperci din familia Sphaeropsidales (Fournet, 1969; Fournet et al., 1970; Griffiths și Peverett, 1980). Rolurile primare ale componentelor cirrului sunt protecția picnidiosporilor împotriva desecării și prevenirea germinării premature.
Cirrusul protejează picnidiosporii, astfel încât unii rămân viabili cel puțin 28 de zile (Fournet, 1969). Atunci când cirrusul a fost diluat cu apă, dacă concentrația soluției de cirrus era >20%, mai puțin de 10% de picnidiospori au germinat. La o concentrație mai mică, componentele furnizează nutrienți care stimulează germinarea sporilor și alungirea tuburilor germinative. Lungimea tuburilor germinative a crescut până la o concentrație de 15% cirrus, apoi a scăzut moderat la concentrații mai mari (Harrower, 1976). Brennan et al. (1986) au raportat o germinație mai mare în fluidul cirrus diluat. Componentele cirrusului au redus germinația la 10-60% umiditate relativă. Odată ce sporii sunt dispersați, efectele stimulatoare ale fluidului cirrus sunt probabil neglijabile (Griffiths și Peverett, 1980).
La o umiditate relativă de 35-45%, sporii de S. tritici în cirri au rămas viabile cel puțin 60 de zile (Gough și Lee, 1985). Componentele cirrilor pot acționa ca un inhibitor al germinării sporilor sau potențialul osmotic ridicat al cirrilor poate împiedica germinarea. Pycnidiosporii de S. nodorum nu au supraviețuit timp de 24 de ore la o umiditate relativă mai mare de 80% la 20 C. Sporii au supraviețuit două săptămâni sau mai mult la o umiditate relativă <10% (Griffiths și Peverett, 1980). Atunci când lichidul de cirrus al S. nodorum a fost diluat cu apă, aproximativ două treimi din picnidiospori și-au pierdut viabilitatea în 8 ore, iar după 30 de ore la lumina zilei, doar 5% au germinat. Atunci când sporii au fost depozitați la întuneric, 40% au rămas viabili după 30 de ore (Brennan et al., 1986).
Conidii uscate de S. nodorum, la umbră și în lumina directă a soarelui, au supraviețuit în aer liber cel puțin 56 de ore (Fernandes și Hendrix, 1986a). Germinația picnidiosporilor de S. nodorum a fost inhibată de UV-B continuu (280-320 nm), în timp ce germinația de S. tritici nu a fost. Extinderea tubului germinativ în condiții de UV-B continuu a fost inhibată pentru ambele ciuperci, în comparație cu întunericul (Rasanayagam et al., 1995).
Infecția cu Septoria nodorum
Procesul de penetrare a gazdei și de dezvoltare a S. nodorum în interiorul frunzei a fost examinată în detaliu de mai mulți cercetători (Baker și Smith, 1978, Bird și Ride 1981, Karjalainen și Lounatmaa, 1986; Keon și Hargreaves, 1984; Straley, 1979; Weber, 1922). Pycnidiosporii au tendința de a se depune în depresiunile dintre două celule epidermice, iar multe încercări de penetrare a frunzelor încep acolo. Sporii germinează pe suprafața frunzei ca răspuns la umiditatea liberă (Fernandes și Hendrix, 1986b). Aceștia încep să germineze la 2-3 ore de la depunere, iar după 8 ore germinația poate ajunge la 90%. Pătrunderea în frunze începe la aproximativ 10 ore după depunerea sporilor (Bird și Ride, 1981; Brönnimann et al., 1972; Holmes și Colhoun, 1974).
La începutul germinației, tubul germinativ este înconjurat de un material amorf care se atașează de frunză. Tuburile germinative care cresc de la ambele capete ale unui spor și din celulele intercalare tind să crească de-a lungul depresiunilor dintre celule și sunt adesea orientate de-a lungul axei lungi a frunzei (O'Reilly și Downes, 1986). Hifele din spori care nu se află în depresiuni cresc la întâmplare, cu ramificări ocazionale (Straley, 1979). Se formează un appressorium cu un vârf de infecție care penetrează cuticula și pereții periclinali ai celulelor epidermice direct în lumenul celular, ceea ce duce la moartea rapidă a celulelor.
Multe penetrări sunt mai întâi subcuticulare sau creșterea laterală a unei hifă are loc în interiorul peretelui celular înainte de creșterea în citoplasmă (Bird și Ride, 1981; O'Reilly și Downes, 1986). De asemenea, are loc o pătrundere prin stomate deschise și închise, care poate fi mai rapidă decât penetrarea directă (Harrower, 1976; Jenkins, 1978; O'Reilly și Downes, 1986; Straley, 1979). Tuburile germinative se ramifică la nivelul stomatelor și al joncțiunilor celulelor epidermice. Penetrarea unui tub germinativ într-un stomat poate avea loc fără formarea unui appressorium. Uneori, penetrarea are loc prin tricomi (Straley, 1979). Aparent, majoritatea încercărilor de penetrare eșuează, formându-se papile dense în celulele de la locul încercării de penetrare (Karjalainen și Lounatmaa, 1986; Bird și Ride, 1981).
După penetrare, celulele epidermice mor rapid și se lignifică, iar hifele cresc în mezofil. Celulele mezofile se deformează, iar materialul lignificat se depune în afara unor celule, care apoi se prăbușesc. Lignificarea are loc înainte ca hifele să ajungă în celulă. Procesul este același la toate soiurile, dar se dezvoltă mai lent la soiurile rezistente. Hifele se dezvoltă intercelular între celulele epidermice, apoi în mezofil. Când mezofilul este penetrat, deteriorarea cloroplastelor începe în 6-9 zile (Karjalainen și Lounatmaa, 1986).
Cu toate acestea, rata de fotosinteză începe să scadă în decurs de o zi după infecție și înainte ca simptomele să fie vizibile (Krupinsky et al., 1973). Țesutul de sclerenchyma din jurul fasciculelor vasculare previne infectarea țesutului vascular. Fasciculele vasculare blochează răspândirea hifelor prin mezofil, cu excepția cazului în care țesutul sclerenchyma este tânăr și nu este complet format (Baker și Smith, 1978).
Stagonospora nodorum eliberează o gamă largă de enzime de degradare a peretelui celular, inclusiv amilază, pectină metil esterază, poligalacturonaze, xilanaze și cellaze in vitro și în timpul infecției frunzelor de grâu (Baker, 1969; Lehtinen, 1993; Magro, 1984). Informațiile legate de degradarea peretelui celular de către enzime sunt în concordanță cu observațiile histologice. aceste enzime pot acționa în combinație cu toxinele. Sensibilitatea enzimatică poate fi legată de rezistență și de rata de colonizare fungică (Magro, 1984). La fel ca mulți necrotrofi, agenții patogeni Septoria și Stagonospora produc compuși fitotoxici in vitro. Deteriorarea ș i moartea celulelor înainte de dezvoltarea hifelor în țesutul mezofil (Bird ș i Ride, 1981) sunt în concordanță cu producția de toxine. Cu toate acestea, nu s-a stabilit un rol definitiv al toxinelor în procesul de infecție și nici relația lor cu rezistența gazdei (Bethenod et al, 1982; Bousquet et al, 1980; Essad și Bousquet, 1981; King et al, 1983). Diferențele în ceea ce privește gama de gazde între tulpinile adaptate la grâu și orz de S. nodorum poate fi legată de producția de toxine (Bousquet și Kollmann, 1998). Inițierea germinării sporilor și procentul de spori germinați nu sunt influențate de sensibilitatea gazdei (Bird și Ride, 1981; Morgan 1974; Straley, 1979; Straley și Scharen, 1979; Baker și Smith, 1978).
Bird și Ride (1981) au raportat că extinderea tuburilor germinative pe suprafața frunzelor a fost mai lentă la cultivarele rezistente decât la cele sensibile. Acest mecanism, exprimat la cel puțin 48 de ore de la depunerea sporilor, indică o rezistență la alungirea tuburilor germinative înainte de penetrare. Au fost mai puține penetrări reușite la cultivarele rezistente, iar penetrarea a decurs mai lent la cultivarele rezistente (Baker și Smith, 1978; Bird și Ride, 1981). S-a propus ca lignificarea să limiteze infecția atât la cultivarele rezistente, cât și la cele sensibile, dar alți factori au încetinit dezvoltarea ciupercii la liniile rezistente. La liniile sensibile, hifele cu creștere mai rapidă pot scăpa de lignificarea celulelor gazdă.La patru zile după inocularea orzului cu un izolat de biotip de grâu de S. nodorum, hifele au crescut prin cuticulă și, uneori, în straturile exterioare de celuloză ale pereților celulari epidermici. Sub hifele de penetrare s-au depus papile groase, iar celulele nu au fost penetrate (Keon și Hargreaves, 1984).
Infecția cu Septoria passerinii
Green și Dickson (1957) prezintă o descriere detaliată a procesului de infectare a S. passerinii pe orz. Procesul de infectare este similar cu S. tritici. Ca și în cazul lui S. tritici, durata de timp necesară pentru penetrarea frunzelor este considerabil mai mare decât pentru S. nodorum. Tuburile germinative se ramifică și cresc pe suprafața frunzei la întâmplare, dar uneori de-a lungul depresiunilor dintre celulele epidermice. Pătrunderea în frunze se face aproape exclusiv prin stomate. Hifele germinative se umflă, iar dacă penetrarea nu reușește, hifele continuă să se alungească. La 48 de ore de la depunerea sporilor, nu se mai produce nicio penetrare. După 72 de ore, tuburile germinative se îngroașă peste stomate, se dezvoltă între celulele de gardă și pe fețele celulelor de acces și în cavitățile substomatice. Pătrunderea directă între celulele epidermice este observată doar rareori.
Germinația sporilor și penetrarea în gazdă sunt identice la cultivarele rezistente și la cele sensibile. Există o extindere mult mai mică a hifelor în interiorul frunzelor la cultivarele rezistente, iar papilele sunt observate pe mulți, dar nu pe toți pereții celulari. Hifele se extind sub epidermă de la un stoma la altul, dar nu pătrund între celulele epidermice. Mezofilmul este colonizat, dar nu se formează haustorii. După ce celulele mezofile devin necrotice, celulele epidermice se prăbușesc. Dezvoltarea miceliului în frunză este rarefiată și, de obicei, blocată de fasciculele vasculare. La frunzele mai tinere, dacă teaca vasculară este mai puțin dezvoltată, hifele trec între fascicul și epidermă. Picnidele se formează în cavități substomatice, mai ales pe suprafața superioară a frunzei (Green și Dickson, 1957).
Factori care afectează longevitatea sporilor pe suprafața frunzelor Dintre agenții patogeni Stagonospora și Septoria de la cereale, informații definitive privind procesul de infecție au fost raportate doar pentru S. nodorum, S. tritici, și S. passerinii. La fel ca mulți alți agenți patogeni necrotrofi, niciunul dintre cei doi grupuri de agenți patogeni nu provoacă reacția de hipersensibilitate. O diferență semnificativă în procesul de infecție între agenții patogeni Septoria și Stagonospora este că germinarea și penetrarea sporilor se desfășoară mult mai rapid în cazul S. nodorum decât pentru S. tritici și S. passerinii. Acest lucru are o influență semnificativă asupra epidemiologiei bolilor.
Agenții patogeni Septoria pătrund în plantă în primul rând prin stomate, în timp ce S. nodorum pătrunde atât direct, cât și prin stomate. S. nodorum penetrează și ucide rapid celulele epidermice, dar S. tritici și S. passerinii nu ucid celulele epidermice până când hifele nu se ramifică prin mezofilul frunzei și începe necroza rapidă. Studiile histologice privind creșterea fungică în urma pătrunderii în gazdă corespund datelor generate de studiile epidemiologice privind rezistența gazdei. Rezistența încetinește rata de colonizare a gazdei, dar nu are un efect apreciabil asupra procesului de dezvoltare a leziunilor.
Mecanismele care controlează răspunsul gazdei, fie că sunt legate de enzime și toxine sau de alți metaboliți eliberați de agenții patogeni în timpul infecției, sunt încă neclare. Există puține informații despre infecția prin ascospori. Procesul de infectare este probabil foarte asemănător cu cel al picnidiosporilor. Ascosporii de Phaeosphaeria nodorum germinează într-o gamă largă de temperaturi, iar tuburile lor germinative pătrund direct în frunze. Cu toate acestea, conform Rapilly et al. (1973), ascosporii, spre deosebire de picnidiospori, nu germinează în apă liberă.
Model de infecție cu Septoria spp.
Infecțiile cu septorioză sunt posibile la temperaturi scăzute, în timp ce temperaturile sub 7°C pot să nu ducă la infecții în decurs de 2 zile. Temperatura optimă a bolii este atinsă în zona de 16-21°C. Infecțiile sunt posibile într-o perioadă de umiditate relativă ridicată sau de umezeală a frunzelor de 14 ore sau mai mult. Pentru a îndeplini aceste condiții, am decis să separăm modelele pentru infecții slabe, moderate și severe. Infecțiile slabe pot fi date în cazul în care este posibil ca agentul patogen să infecteze țesutul gazdei. Acest lucru înseamnă că infecțiile slabe pot avea loc dacă temperaturile sunt minime, iar perioadele de umezeală a frunzelor au o durată critică. O infecție moderată va avea loc în condițiile în care majoritatea testelor de infecție conduc la rezultate rezonabile, iar infecțiile severe au loc în condițiile în care agentul patogen are condiții optime de infectare.
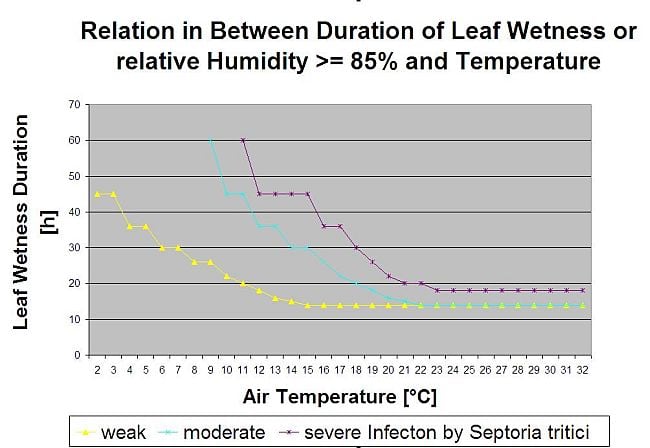


Începe infecția după o ploaie de 0,5 mm. Am decis să nu folosim un model pentru formarea picnidiei. Condiția necesară pentru formarea picnidiei este presupusă a fi o perioadă cu o umiditate relativă mai mare de 85%. Se estimează că durata de viață a picnidiei este de 24 de ore. În toate climatele în care Septoria tritici are șansa de a se infecta, vom găsi 2 ore care îndeplinesc aceste condiții aproape în fiecare zi în jurul răsăritului soarelui.
Evaluarea severității infecției
Pentru a putea evalua presiunea de infecție cu Septoria tritici între stadiul 10 (prima frunză de pe coleoptil) și stadiul 32 (nodul doi la cel puțin 2 cm deasupra nodului 1) și între 32 și 51 (începutul epilării), trebuie să evaluăm severitatea infecțiilor în funcție de condițiile climatice. Această evaluare se face pe o scară de la 1 la 5. Gradul de gravitate 1 este dat dacă sunt îndeplinite condițiile pentru o infecție slabă și a plouat mai puțin de 5 mm, în caz contrar, gradul de gravitate corespunzător va fi 2. Se acordă un grad de severitate 3 dacă este îndeplinită o infecție moderată și a plouat mai puțin de 5 mm. Dacă a plouat mai mult de 5 mm în timpul unei infecții moderate sau mai puțin de 5 mm în timpul unei infecții severe, se acordă un grad de gravitate 4.
O infecție severă, cu mai mult de 5 mm de ploaie, corespunde unei valori de gravitate de 5.
Septoria tritici evaluarea presiunii bolii
Clima este doar unul dintre factorii care influențează presiunea bolilor în câmp. Ceilalți doi factori sunt istoricul câmpului și susceptibilitatea soiului cultivat. Dacă putem acumula valorile severității bolii din stadiul 10 până în stadiul 32 la valoarea 4, ne putem aștepta la o presiune slabă a bolii din cauza climei. Dacă această valoare ajunge la 6, ne putem aștepta la o presiune moderată a bolii, iar dacă ajunge la 10, ne putem aștepta la o presiune ridicată a bolii din partea climei. Cunoașterea sensibilității soiului și a istoricului câmpului ne va determina să pulverizăm sau nu la o presiune slabă sau moderată a bolii în această situație. Dacă valoarea acumulată este de 10, poate duce oricum la o pulverizare în stadiul 32. Decizia de a face o pulverizare într-un stadiu ulterior depinde mai mult de climatul de primăvară. Dacă reușim să acumulăm valorile de severitate din stadiul 10 până la o valoare de 6, ne putem aștepta la o presiune slabă a bolii. Dacă această valoare ajunge la 10, ne putem aștepta la o presiune moderată a bolii, iar dacă această valoare ajunge la 15, ne putem aștepta la o presiune ridicată a bolii, în funcție de situația climatică.
În FieldClimate arătăm Septoria tritici Severitatea împreună cu cele trei grade de infecție diferite într-un singur grafic (a se vedea mai sus). Din cauza precipitațiilor și a perioadelor lungi de umezeală a frunzelor, condițiile pentru o infecție severă cu S. tritici au fost fullfield pe 14 și 16 mai. Nivelurile de gravitate ating cea mai mare valoare de 5 pe 14 mai, ceea ce înseamnă că există acum un risc ridicat de infectare.
Biologia infecției Stagonospora nodorum diferă într-o oarecare măsură de cea a S. tritici, dar această diferență nu este suficient de mare pentru un model separat. Prin urmare, sugerăm să se utilizeze acest model pentru întregul complex de boli ale Stagnospora și Septoria la cereale, inclusiv S. passerinii. S. tritici și S. passerinii au tendința de a avea nevoie de perioade mai lungi de umezire a frunzelor decât S. nodorum. În zonele cu o presiune ridicată de S. nodorum infecțiile clasificate ca fiind slabe, cu o valoare de gravitate 2, trebuie tratate mai serios decât în alte domenii.
Pentru Septoria nodorum un model de risc este prezentat în FieldClimate (a se vedea mai sus). Un risc ridicat a fost determinat la 17 iunie și 7 iulie (100%). În funcție de stadiul plantelor sensibile la infecție, trebuie luate în considerare măsurile de protecție a plantelor dacă riscul ajunge la 80% (a se vedea, de asemenea, prognoza meteo, protecția plantelor). În cazul în care riscul a fost de 100% și s-a constatat deja o infecție, trebuie luate măsuri de protecție sistemică a plantelor (aplicare curativă) pentru a proteja planta.
Explozie de orez
La tropice, sporii de buboi sunt prezenți în aer pe tot parcursul anului, favorizând astfel dezvoltarea continuă a bolii. Infecția provocată de această ciupercă dăunează mai grav orezului de câmpie decât orezului irigat. Atacă rar tecile foliare. Infecția primară începe acolo unde semințele sunt semănate dens în cutii de răsaduri pentru transplantarea mecanică.
În țările temperate, acesta se găsește în reziduurile de culturi infestate sau în semințe. Cerul înnorat, ploile frecvente și stropii favorizează dezvoltarea și severitatea exploziei bacteriene a orezului. Nivelurile ridicate de azot, umiditatea relativă ridicată și frunzele umede favorizează infecția provocată de ciupercă. Rata de sporulație este cea mai mare odată cu creșterea umidității relative de 90% sau mai mare. În cazul umezelii frunzelor, temperatura optimă pentru germinarea agentului patogen este de 25-28 °C. Cultivarea orezului în sol aerob în zonele umede în care predomină stresul de secetă favorizează, de asemenea, infecția.
O ciupercă este cauza exploziei orezului. Conidioforii săi sunt produși în ciorchini din fiecare stomă. Rareori sunt solitari, cu 2-4 septuri. Zona bazală a conidioforilor este umflată și se îngustează spre vârful mai deschis. Conidiile ciupercii măsoară 20-22 x 10-12 µm. Conidiile sunt 2-septate, translucide și ușor întunecate. Ele sunt obclavate și se îngustează la vârf. La bază sunt trunchiate sau prelungite într-un dinte scurt.
În afară de planta de orez, ciuperca supraviețuiește și pe Agropyron repens (L.) Gould, Agrostis palustris, A. tenuis, Alopecurus pratensis, Andropogon sp., Anthoxanthum odoratum, Arundo donax L., Avena byzantina, A. sterilis, A. sativa, Brachiaria mutica (Forssk.) Stapf, Bromus catharticus, B. inermis, B. sitchensis, Canna indica, Chikushichloa aquatica, Costus speciosus, Curcuma aromatica, Cynodon dactylon (L.) Pers, Cyperus rotundus L., C. compressus L., Dactylis glomerata, Digitaria sanguinalis (L.) Scop, Echinochloa crus-galli (L.) P. Beauv.., Eleusine indica (L.) Gaertn., Eragrostis sp., Eremochloa ophiuroides, Eriochloa villosa, Festuca altaica, F. arundinacea, F. elatior, F. rubra, Fluminea sp, Glyceria leptolepis, Hierochloe odorata, Holcus lanatus, Hordeum vulgare, Hystrix patula, Leersia hexandra Sw., L. japonica, L. oryzoides, Lolium italicum, L. multiflorum, L. perenne, Muhlenbergia sp., Musa sapientum, Oplismenus undulatifolius (Ard.) Roem. & Schult., Panicum miliaceum L., P. ramosum (L.) Stapf, P. repens L., Pennisetum typhoides (L.) R. Br., Phalaris arundinacea L., P. canariensis, Phleum pratense, Poa annua L., P. trivialis, Saccharum officinarum, Secale cereale, Setaria italica (L.) P. Beauv., S. viridis (L.) P. Beauv., Sorghum vulgare, Stenotaphrum secundatum, Triticum aestivum, Zea mays L., Zingiber mioga, Z. officinale și Zizania latifolia..
Conidiile sunt produse pe leziunile de pe planta de orez la aproximativ 6 zile după inoculare. Producția de spori crește odată cu creșterea umidității relative. Majoritatea sporilor sunt produși și eliberați în timpul nopții. După germinarea sporilor, urmează infecția. Tuburile de infecție se formează din appressorii și, ulterior, pătrunderea prin cuticulă și epidermă. După ce pătrunde în celulă, tubul de infecție formează o veziculă pentru a da naștere la hife. În celulă, hifele se dezvoltă liber.
Buba orezului infectează planta de orez în orice stadiu de creștere. Răsadurile de orez sau plantele aflate în stadiul de formare a brazdei sunt adesea complet ucise. De asemenea, infecțiile puternice de pe paniculă provoacă, de obicei, o pierdere a producției de orez.
Antracnoză
Modelul de R. solani în câmpuri evaluează riscul de apariție a acestei boli pe baza temperaturii, a umezelii frunzelor și a radiației globale. Controalele durează 120 de ore:
- În cazul umezelii consecutive a frunzelor, se acumulează valori dependente de temperatură pentru fiecare minut.
- între 12 °C și 15 °C se acumulează 1 pe minut
- 16 °C până la 17 °C se acumulează 2 pe minut
- 18°C și mai mult se acumulează 4 pe minut - La sfârșitul perioadelor de umezeală a frunzelor, se evaluează valorile acumulate
- dacă acestea sunt mai mari de 4096, crește riscul cu 64 de puncte și scade 4096 din valoare>.
- dacă reziduul este mai mare de 2048, crește riscul cu 16 și scade 2048 din valoare.
- în cazul în care reziduul este mai mare de 1024, crește riscul cu 4 și scade 1024 din valoare. - Dacă radiația globală este consecutiv mai mare de 800 W/m², se acumulează timpul în minute, iar dacă radiația devine mai mică, se evaluează valorile:
- Valoare > 512 = ValoareRisc - 32 puncte , Valoare - 512
- Valoare > 256 = RiskValue - 8 puncte , Value - 256
- Valoare >128= RisKValue - 2 puncte, Valoare -128
Modelul are ca rezultat o valoare a riscului între 0 și 100, indicând momentele favorabile pentru R. solani în câmpuri.
Sistem de sprijin
Modelul evidențiază perioadele cu un risc ridicat pentru această boală. În perioadele în care riscul este scăzut, nu va fi necesară aplicarea de stropiri. În perioadele cu risc moderat, intervalul de pulverizare poate fi prelungit, iar în perioadele cu risc ridicat este posibil ca intervalul de pulverizare să trebuiască redus sau să se utilizeze compuși mai eficienți.
Literatură
Boli de rugină
- Anikster, Y., Bushnell, W.R., Eilam, T., Manisterski, J. & Roelfs, A.P. 1997. Puccinia recondita cauzează rugina frunzelor pe grâu cultivat, grâu sălbatic și secară. Can. J. Bot., 75: 2082-2096.
- Azbukina, Z. 1980. Importanța economică a gazdelor speciale ale ciupercilor de rugină a cerealelor în Extremul Orient Sovietic. În "Proc. 5th European and Mediterranean Cereal Rusts Conf.", p.199-201. Bari, Roma.
- Beresford, R.M. 1982. Rugina striată (Puccinia striiformis), o nouă boală a grâului în Noua Zeelandă. Cer. Rusts Bull, 10: 35-41.
- Biffen, R.H. 1905. Legile lui Mendel privind moștenirea și ameliorarea grâului. J. Agric. Sci, 1: 4-48.
- Borlaug, N.E. 1954. Producția mexicană de grâu și rolul său în epidemiologia ruginii tulpinii în America de Nord. Phytopathology, 44: 398-404.
- Buchenauer, H. 1982. Combaterea chimică și biologică a ruginii cerealelor. În K.J. Scott & A.K. Chakravorty, eds. The rust fungi, p. 247-279. Londra, Academic Press.
- Burdon, J.J., Marshall, D.R. & Luig, N.H. 1981. Analiza izoenzimatică indică faptul că un agent patogen virulent al ruginii cerealelor este un hibrid somatic. Nature, 293: 565-566.
- Casulli, F. 1988. Suprasezonarea ruginii frunzelor de grâu în sudul Italiei. În "Proc. 7th European and Mediterranean Cereal Rusts Conf.", 5-9 septembrie, p. 166-168. Viena.
- Chester, K.S. 1946. Natura și prevenirea ruginii cerealelor, exemplificate prin rugina frunzelor de grâu. În Chronica botanica. Walthan, MA, SUA. 269 pp.
- Craigie, J.H. 1927. Experimente privind sexul la ciupercile de rugină. Nature, 120: 116-117.
- Cummins, G.B. & Caldwell, R.M. 1956. Valabilitatea binomiilor în complexul de ciuperci de rugină a frunzelor de cereale și ierburi. Phytopathology, 46: 81-82.
- Cummins, G.B. & Stevenson, J.A. 1956. O listă de verificare a ciupercilor de rugină din America de Nord (Uredinales). Plant Dis. Rep. Supliment, 240: 109-193.
- d'Oliveira, B. & Samborski, D.J. 1966. Stadiul ecial al Puccinia recondita pe Ranunculaceae și Boraginaceae în Portugalia. În Proc. Cereal Rusts Conf., Cambridge, p 133-150.
- DeBary, A. 1866. Neue Untersuchungen uber die Uredineen insbesondere die Entwicklung der Puccinia graminis und den Zusammenhang duselben mit Aecidium berberis. În Monatsber Preuss. Akad. Wiss, Berlin, p. 15-20.
- de Candolle, A. 1815. Uredo rouille des cereales. În Flora francaise, famille des champignons, p. 83.
- Dubin, H.J. & Stubbs, R.W. 1986. Răspândirea epidemică a ruginii striate a orzului în America de Sud. Plant Dis, 70: 141-144.
- Dubin, H.J. & Torres, E. 1981. Cauzele și consecințele epidemiei de rugină a frunzelor de grâu din 1976-1977 în nord-vestul Mexicului. Ann. Rev. Phytopath. 19: 41-49.
- Eriksson, J. 1894. Uber die Spezialisierung des Parasitismus bei dem Getreiderostpilzen. Ber. Deut. bot. Ges. 12: 292-331.
- Eriksson, J. & Henning, E. 1894. Die Hauptresultate einer neuen Untersuchung uber die Getreideroste. Z. Pflanzenkr., 4: 66-73, 140-142, 197-203, 257-262.
- Eriksson, J. & Henning, E. 1896. Die Getreideroste. Ihre Geschichte und Natur sowie Massregein gegen dieselben, p. 463. Stockholm, P.A. Norstedt și Soner.
- Ezzahiri, B., Diouri, S. & Roelfs, A.P. 1992. Rolul gazdei alternative, Anchusa italica, în epidemiologia Puccinia recondita f. sp. tritici pe grâul dur în Maroc. În F.J. Zeller & G. Fischbeck, eds. Proc. 8th European and Mediterranean Cereal Rusts and Mildews Conf., 1992, p. 69-70. Heft 24 Weihenstephan, Germania.
- Fontana, F. 1932. Observații asupra ruginei cerealelor. P.P. Pirone, trad.: P.P. Pirone. Clasici nr. 2. Washington, DC, Amer. Phytopathol. Society. (Publicată inițial în 1767).
- Green, G.J. & Campbell, A.B. 1979. Culturi de grâu rezistente la Puccinia graminis tritici în vestul Canadei: dezvoltarea, performanța și valoarea lor economică. Can. J. Plant Pathol. 1: 3-11.
Groth, J.V. & Roelfs, A.P. 1982. Efectul reproducerii sexuate și asexuate asupra abundenței rasei în populațiile de ciuperci de rugină a cerealelor. Phytopathology, 72: 1503-1507. - Hare, R.A. & McIntosh, R.A. 1979. Studii genetice și citogenetice ale rezistenței durabile a plantelor adulte din soiul "Hope" și din soiurile înrudite la rugina grâului. Z. Pflanzenzüchtg, 83: 350-367.
- Hart, H. & Becker, H. 1939. Beitrage zur Frage des Zwischenwirts fur Puccinia glumarum Z. Pflanzenkr. (Pflanzenpathol.) Pflanzenschutz, 49: 559-566.
- Hendrix, J.W., Burleigh, J.R. & Tu, J.C. 1965. Supraexpansiunea de vară a ruginii striate la altitudini mari în Pacific Northwest-1963. Plant Dis. Rep., 49: 275-278.
- Hermansen, J.E. 1968. Studii privind răspândirea și supraviețuirea bolilor ruginii și a mucegaiului cerealelor în Danemarca. Contrib. No. 87. Copenhaga, Departamentul de fitopatologie, Royal Vet. Agriculture College. 206 pp.
- Hirst, J.M. & Hurst, G.W. 1967. Transportul sporilor pe distanțe lungi. În P.H. Gregory & J.L. Monteith, eds. Airborne microbes, p. 307-344. Cambridge University Press.
- Hogg, W.H., Hounam, C.E., Mallik, A.K. & Zadoks, J.C. 1969. Factori meteorologici care afectează epidemiologia ruginii grâului. OMM Tech. Note No. 99. 143 pp.
- Huerta-Espino, J. & Roelfs, A.P. 1989. Specializarea fiziologică asupra ruginii frunzelor la grâul dur. Phytopathology, 79: 1218 (abstr.).
- Hylander, N., Jorstad, I. & Nannfeldt, J.A. 1953. Enumeratio uredionearum Scandinavicarum. Opera Bot, 1: 1-102.
- Johnson, R. 1981. Rezistența durabilă la boli. În J.F. Jenkyn & R.T. Plumb, eds. Strategii de control al bolilor cerealelor, p. 55-63. Oxford, Marea Britanie, Blackwell.
- Johnson, T. 1949. Încrucișări intervarietale la Puccinia graminis. Can. J. Res. Sect. C, 27: 45-63.
- Joshi, L.M. & Palmer, L.T. 1973. Epidemiologia ruginii tulpinii, a frunzelor și a ruginilor de grâu în nordul Indiei. Plant Dis. Rep., 57: 8-12.
- Katsuya, K. & Green, G.J. 1967. Potențialul de reproducere al raselor 15B și 56 de rugină a tulpinii grâului. Can. J. Bot., 45: 1077-1091.
- Kilpatrick, R.A. 1975. Noi soiuri de grâu și longevitatea rezistenței la rugină, 1971-1975. USDA, Agric. Res. Serv. Northeast Reg (Rep.), ARS-NE 64. 20 pp.
- Le Roux, J. & Rijkenberg, F.H.J. 1987. Pathotypes of Puccinia graminis f. sp. tritici with increased virulence for Sr24. Plant Dis., 71: 1115-1119.
- Lewellen, R.T., Sharp, E.L. & Hehn, E.R. 1967. Gene majore și minore la grâu pentru rezistența la Puccinia striiformis și răspunsul lor la schimbările de temperatură. Can. J. Bot., 45: 2155-2172.
- Line, R.F. 1976. Factorii care au contribuit la o epidemie de rugină striată la grâu în Valea Sacramento din California în 1974. Plant Dis. Rep., 60: 312-316.
- Line, R.F., Qayoum, A. și Milus, E. 1983. Rezistența durabilă la rugina dungată a grâului. În Proc. 4th Int. Cong. Plant Pathol., p. 204. Melbourne.
- Luig, N.H. 1985. Epidemiologia în Australia și Noua Zeelandă. În A.P. Roelfs & W.R. Bushnell, eds. Cereal rusts, vol. 2, Diseases, distribution, epidemiology, and control, p. 301-328. Orlando, FL, SUA, Academic Press.
- Luig, N.H. & Rajaram, S. 1972. Efectul temperaturii și al fondului genetic asupra expresiei genei gazdei și a interacțiunii cu Puccinia graminis tritici. Phytopathology, 62: 1171-1174.
- Luig, N.H. & Watson, I.A. 1972. Rolul ierburilor sălbatice și cultivate în hibridizarea formelor speciale de Puccinia graminis. Aust. J. Biol. Sci, 25: 335-342.
- Maddison, A.C. & Manners, J.G. 1972. Lumina soarelui și viabilitatea urediosporilor de rugină a cerealelor. Trans. Br. Mycol. Soc., 59: 429-443.
- Mains, E.B. 1932. Specializarea gazdei în rugina frunzelor de graminee Puccinia rubigovera. Mich. Acad. Sci., 17: 289-394.
- Mains, E.B. 1933. Studii privind rugina heteroică. Mycologia, 25: 407-417.
- Mains, E.B. & Jackson, H.S. 1926. Specializarea fiziologică la rugina frunzelor de grâu, Puccinia triticina Erikss. Phytopathology, 16: 89-120.
- Manners, J.G. 1960. Puccinia striiformis Westend. var. dactylidis var. nov. Trans. Br. Mycol. Soc., 43: 65-68.
- McIntosh, R.A. 1976. Genetica grâului și a ruginii grâului de la Farrer încoace: Farrer memorial oration 1976. J. Aust. Inst. Agric. Sci, 42: 203-216.
- McIntosh, R.A. 1992. Legătura genetică strânsă a genelor care conferă rezistența plantelor adulte la rugina frunzelor și la rugina striată la grâu. Plant Pathol. 41: 523-527.
- McIntosh, R.A., Luig, N.H., Milne, D.L. & Cusick, J. 1983. Vulnerabilitatea triticalei la rugina tulpinii grâului. Can. J. Plant Pathol. 5: 61-69.
- McIntosh, R.A., Hart, G.E., Devos, K.M., Gale, M.D. & Rogers, W.J. 1998. Catalogul simbolurilor genetice pentru grâu. În Proc. 9th Int. Wheat Genetics Symp., 2-7 august 1998. Saskatoon Saskatchewan, Canada.
- Melander, L.W. & Craigie, J.H. 1927. Natura rezistenței Berberis spp. la Puccinia graminis. Phytopathology, 17: 95-114.
- Mont, R.M. 1970. Studii privind rezistența nespecifică la rugina tulpinii la grâul de primăvară. Teză de masterat. St Paul, MN, SUA, Universitatea din Minnesota. 61 pp.
- Nagarajan, S. & Joshi, L.M. 1985. Epidemiologia în subcontinentul indian. În A.P. Roelfs & W.R. Bushnell, eds. The cereal rusts, vol. 2, Diseases, distribution, epidemiology, and control, p. 371-402. Orlando, FL, SUA, Academic Press.
- O'Brien, L., Brown, J.S., Young, R.M. & Pascoe, T. 1980. Prezența și distribuția ruginii striate a grâului în Victoria și sensibilitatea culturilor comerciale de grâu. Aust. Plant Pathol. Soc. Newsl., 9: 14.
- Perez, B. & Roelfs, A.P. 1989. Rezistența la rugina frunzelor de grâu a cultivarelor de teren și a derivatelor acestora. Phytopathology, 79: 1183 (abstr.).
- Pretorius, Z.A., Singh, R.P., Wagoire, W.W. & Payne, T.S. 2000. Detectarea virulenței la gena de rezistență Sr31 a ruginii tulpinii grâului la Puccinia graminis f. sp. tritici în Uganda. Phytopathology, 84: 203.
- Rajaram, S., Singh, R.P. & van Ginkel, M. 1996. Abordări pentru ameliorarea grâului în vederea unei adaptări largi, a rezistenței la rugină și la secetă. În R.A. Richards, C.W. Wrigley, H.M. Rawson, G.J. Rebetzke, J.L. Davidson & R.I.S. Brettell, eds. Proc. 8th Assembly Wheat Breeding Society of Australia, p. 2-30. Canberra, Universitatea Națională Australiană.
- Rapilly, F. 1979. Epidemiologia ruginii galbene. Ann. Rev. Phytopathol, 17: 5973.
- Robbelen, G. & Sharp, E.L. 1978. Modul de moștenire, interacțiunea și aplicarea genelor care condiționează rezistența la rugina galbenă. Fortschr. Pflanzenzucht. Beih. Z. Pflanzenzucht, 9: 1-88.
- Roelfs, A.P. 1978. Estimarea pierderilor cauzate de rugină la cerealele pentru boabe mici în Statele Unite 1918-1976. Diverse. Publ. USDA, 1363: 1-85.
Roelfs, A.P. 1982. Efecte ale eradicării afinului asupra ruginii tulpinii în Statele Unite. Plant Dis. 66: 177-181. - Roelfs, A.P. 1985a. Epidemiologia în America de Nord. În A.P. Roelfs & W.R. Bushnell, eds. The cereal rusts, vol. 2, Diseases, distribution, epidemiology, and control, p. 403-434. Orlando, FL, SUA, Academic Press.
- Roelfs, A.P. 1985b. Rugina tulpinii grâului și secarei. În A.P. Roelfs & W.R. Bushnell, eds. The cereal rusts, vol. 2, Diseases, distribution, epidemiology, and control, p. 3-37. Orlando, FL, SUA, Academic Press.
- Roelfs, A.P. 1986. Dezvoltarea și impactul epidemiilor regionale de rugină a cerealelor. În K.J. Leonard & W.E. Fry, eds. Plant disease epidemiology, vol. 1, p. 129-150. New York, NY, SUA, MacMillan.
- Roelfs, A.P. 1988. Controlul genetic al fenotipurilor în cazul ruginii tulpinii grâului. Ann. Rev. Phytopathol, 26: 351-367.
- Roelfs, A.P. & Groth, J.V. 1980. O comparație a fenotipurilor de virulență în populațiile de rugină a tulpinii grâului care se reproduc pe cale sexuală și asexuată. Phytopathology, 70: 855-862.
- Roelfs, A.P. & Groth, J.V. 1988. Puccinia graminis f. sp. tritici, rugina neagră a tulpinii de Triticum spp. În G.S. Sidhu, ed., 1988. Advances in plant pathology, vol. 6, Genetics of pathogenic fungi, p. 345-361. Londra, Academic Press.
- Roelfs, A.P. & Long, D.L. 1987. Dezvoltarea Puccinia graminis în America de Nord în 1986. Plant Dis., 71: 1089-1093.
- Roelfs, A.P. & Martell, L.B. 1984. Dispersia ureei-dosporilor de la o sursă punctiformă în cadrul unui coronament de grâu. Phytopathology, 74: 1262-1267.
- Roelfs, A.P., Huerta-Espino, J. & Marshall, D. 1992. Rugina striată a orzului în Texas. Plant Dis. 76: 538.
- Rowell, J.B. 1981. Relația dintre evenimentele de postpenetrare în răsadul de grâu Idaed 59 și receptivitatea scăzută la infecția cu Puccinia graminis f. sp. tritici. Phytopathology, 71: 732-736.
- Rowell, J.B. 1982. Controlul ruginii tulpinii grâului prin receptivitate scăzută la infecție condiționată de o singură genă dominantă. Phytopathology, 72: 297-299.
- Rowell, J.B. 1984. Infecția controlată de Puccinia graminis f. sp. tritici în condiții artificiale. În: "In. A.P. Roelfs & W.R. Bushnell, eds. The cereal rusts, vol. 1, Origins, specificity, structure, and physiology, p. 291-332. Orlando, FL, SUA, Academic Press.
- Saari, E.E. & Prescott, J.M. 1985. Distribuția mondială în raport cu pierderile economice. În A.P. Roelfs & W.R. Bushnell, eds. The cereal rusts, vol. 2, Diseases, distribution, epidemiology, and control, p. 259-298. Orlando, FL, SUA, Academic Press.
Saari, E.E., Young, H.C., Jr. și Fernkamp, M.F. 1968. Infecția Thalictrum spp. din America de Nord cu Puccinia recondita f. sp. tritici. Phytopathology, 58: 939-943. - Samborski, D.J. 1985. Rugina frunzelor de grâu. În A.P. Roelfs și W.R. Bushnell, eds. The cereal rusts, vol. 2, Diseases, distribution, epidemiology, and control, p. 39-59. Orlando, FL, SUA, Academic Press.
- Savile, D.B.O. 1984. Taxonomia ciupercilor ruginii cerealelor. În W.R. Bushnell & A.P. Roelfs, eds. The cereal rusts, vol. 1, Origins, specificity, structures, and physiology, p. 79-112. Orlando, FL, SUA, Academic Press.
- Sharp, E.L. & Volin, R.B. 1970. Gene aditive în grâu care condiționează rezistența la rugina striată. Phytopathology, 601: 1146-1147.
- Singh, R.P. 1992. Asocierea genetică a genei de rezistență la rugina frunzelor Lr34 cu rezistența plantelor adulte la rugina striată la grâul de pâine. Phytopathology, 82: 835-838.
- Singh, R.P. & Rajaram, S. 1992. Genetica rezistenței plantelor adulte la rugina frunzelor la "Frontana" și la trei soiuri de grâu CIMMYT. Genom, 35: 24-31.
- Singh, R.P. & Rajaram, S. 1994. Genetica rezistenței plantelor adulte la rugina striată la zece soiuri de grâu de primăvară. Euphytica, 72: 1-7.
- Singh, R.P., Mujeeb-Kazi, A. & Huerta-Espino, J. 1998. Lr46: O genă care conferă rezistență la rugina frunzelor la grâu. Phytopathology, 88: 890-894.
- Skovmand, B., Fox, P.N. & Villareal, R.L. 1984. Triticale în agricultura comercială: progrese și promisiuni. Adv. Agron, 37: 1-45.
- Spehar, V. 1975. Epidemiologia ruginii grâului în Europa. În Proc. 2nd Int. Winter Wheat Conf., 9-19 iunie, p. 435-440. Zagreb, Iugoslavia.
- Stakman, E.C. 1923. Bolile grâului. 14. Problema ruginii grâului în Statele Unite. În Proc. 1st Pan Pac. Congr. științific, p. 88-96.
- Straib, W. 1937. Untersuchungen uben dasn Vorkommen physiologischen Rassen der Gelbrostes (Puccinia glumarum) in den Jahren 1935-1936 und uber die Agressivitat eninger neuer Formes auf Getreide un Grasern. Arb. Biol. Reichsant. Land. Fortw. Berlin-Dahlem, 22: 91-119.
- Stubbs, R.W. 1985. Rugina striată. În A.P. Roelfs & W.R. Bushnell, eds. The cereal rusts, vol. 2, Diseases, distribution, epidemiology, and control, p. 61-101. Orlando, FL, SUA, Academic Press.
- Stubbs, R.W. & de Bruin, T. 1970. Bestrijding van gele roest met het systemische fungicide oxycaroxin 'Plantvax'. Gewasbescherming, 1: 99-104.
- Stubbs, R.W., Prescott, J.M., Saari, E.E. & Dubin, H.J. 1986. Manualul de metodologie privind bolile cerealelor, p. 46. Mexico, DF, CIMMYT.
- Sunderwirth, S.D. & Roelfs, A.P. 1980. Evaluarea în seră a rezistenței plantelor adulte Sr2 la rugina tulpinii grâului. Phytopathology, 70: 634-637.
- Tollenaar, H. & Houston, B.R. 1967. Studiu privind epidemiologia ruginii striate, Puccinia striiformis West în California. Can. J. Bot., 45: 291-307.
- Tozzetti, G.T. 1952. V. Alimurgia: Adevărata natură, cauzele și tristele efecte ale ruginii, ale păduchelui, ale pucioasei și ale altor boli ale grâului și ovăzului în câmp. În L.R. Tehon, trad. L.R. Tehon. Fitopatologia clasică nr. 9, p. 139. St Paul, MN, SUA, American Phytopathol. Society. (Publicată inițial în 1767).
- Tranzschel, W. 1934. Promezutocnye chozjaeva rzavwiny chlebov i ich der USSR. (Gazdele alternative ale ciupercilor ruginii cerealelor și distribuția lor în URSS). În Bull. Plant Prot., Ser. 2, p. 4-40. (În limba rusă cu rezumat în limba germană).
- Viennot-Bourgin, G. 1934. La rouille jaune der graminees. Ann. Ec. Natl. Agric. Grignon Ser., 3, 2: 129-217.
- Wallwork, H. și Johnson, R. 1984. Separarea transgresivă pentru rezistența la rugina galbenă la grâu. Euphytica, 33: 123-132.
- Watson, I.A. & de Sousa, C.N.A. 1983. Transportul pe distanțe lungi al sporilor de Puccinia graminis tritici în emisfera sudică. În Proc. Linn. Soc. N.S.W., 106: 311-321.
- Wright, R.G. & Lennard, J.H. 1980. Originea unei noi rase de Puccinia striiformis. Trans. Br. Mycol. Soc., 74: 283-287.
- Zadoks, J.C. 1961. Rugina galbenă la grâu: studii de epidemiologie și specializare fiziologică. Neth. J. Plant Pathol., 67: 69-256.
- Zadoks, J.C. & Bouwman, J.J. 1985. Epidemiologia în Europa. În A.P. Roelfs & W.R. Bushnell, eds. The cereal rusts , vol. 2, Diseases, distribution, epidemiology, and control , p. 329-369. Orlando, FL, SUA, Academic Press
Fusarium Head Blight
- Baht, C.V., Beedu, R., Ramakrishna, Y. & Munshi, R.L. 1989. Focar de toxicoză tricotecenică asociată cu consumul de produse din grâu deteriorate de mucegai în Valea Kashmir, India. Lancet, p. 35-37.
- Bai, G. 1995. Scabia grâului: epidemiologie, moștenirea rezistenței și markeri moleculari legați de rezistența culturilor. Teză de doctorat. West Lafayette, IN, SUA, Universitatea Purdue.
- Chen, P., Liu, D. și Sun, W. 1997. Noi contramăsuri de ameliorare a grâului pentru rezistența la păduche. În H.J. Dubin, L. Gilchrist, J. Reeves & A. McNab, eds. Fusarium head scab: global status and future prospects. Mexico, DF, CIMMYT.
- Diaz de Ackermann, M. & Kohli, M.M. 1997. Cercetări privind fuzarioza capului de grâu în Uruguay. În H.J. Dubin, L. Gilchrist, J. Reeves & A. McNab, eds. Fusarium head scabia capului: situația globală și perspectivele viitoare. Mexico, DF, CIMMYT.
- Dill-Macky, R. 1997. Fusarium head blight: Epidemii recente și eforturi de cercetare în partea superioară a vestului mijlociu al Statelor Unite. În H.J. Dubin, L. Gilchrist, J. Reeves & A. McNab, eds. Fusarium head scabia: situația globală și perspectivele viitoare. Mexico, DF, CIMMYT.
- Dubin, H.J., Gilchrist, L., Reeves, J. & McNab?, A. 1997. Fusarium head scab: situația globală și perspectivele viitoare. Mexico, DF, CIMMYT.
- Galich, M.T.V. 1997. Fusarium head blight în Argentina. În H.J. Dubin, L. Gilchrist, J. Reeves & A. McNab, eds. Fusarium head scabia: situația globală și perspectivele viitoare. Mexico, DF, CIMMYT.
- Gilchrist, L., Rajaram, S., Mujeeb-Kazi?, A., van Ginkel, M.,Vivar, H. & Pfeiffer, W. 1997. În H.J. Dubin, L. Gilchrist, J. Reeves & A. McNab, eds. Fusarium head scab: situația globală și perspectivele viitoare. Mexico, DF, CIMMYT.
- Ireta, J. 1989. Seleccion de un model de creștere pentru fuzarioza grâului cauzată de Fusarium graminearum Schw. În M.M. Kohli, ed. M.M. Kohli. Taller sobre la Fusariosis de la espiga en America del Sur. Mexico, DF, CIMMYT.
- Ireta, M.J. & Gilchrist, L. 1994. Fusarium head scab de grâu (Fusarium graminearum Schwabe). Raport special privind grâul nr. 21b. Mexic, DF, CIMMYT.
- Khonga, E.B. & Sutton, J.C. 1988. Producția de inoculum și supraviețuirea Giberella zeae în reziduurile de porumb și grâu. Can. J. Plant Pathol. 10(3): 232-240.
- Luo, X.Y. 1988. Contaminarea cu toxine Fusarium în China. Proc. Japan Assoc. mycotoxicology Suppl. 1: 97-98. Marasas, W.F.O., Jaskiewickz, K., Venter, F.S. & Schalkwyk, D.J. 1988. Contaminarea cu Fusarium moniliforme a porumbului în zonele cu cancer esofagian din Transkei. S. AF. Med. J., 74: 110-114.
- Mihuta-Grimm, L. & Foster, R.L. 1989. Scabia pe grâu și orz în sudul Idaho și evaluarea tratamentului semințelor pentru eradicarea Fusarium spp. Plant Dis., 73: 769-771.
- Miller, J.D. & Armison, P.G. 1986. Degradarea deoxinivalenolului de către culturile în suspensie ale cultivarului de grâu Frontana, rezistent la Fusarium head blight. Can. J. Plant Pathol. 8: 147-150.
- Miller, J.D., Young, J.C. & Sampson, D.R. 1985. Rezistența la deoxinivalenol și la Fusarium head blight la cerealele de primăvară. J. Phytopathol, 113: 359-367.
- Reis, E.M. 1985. Doencas do trigo III. Fusariose. Brazilia, Merck Sharp Dohme.
- Reis, E.M. 1989. Fusarioza: biologia și epidemiologia Gibberella zeae în trigo. În M.M. Kohli, ed. Taller sobre la Fusariosis de la espiga en America del Sur. Mexico, DF, CIMMYT.
- Schroeder, H.W. & Christensen, J.J. 1963. Factorii care afectează rezistența grâului la păduchele cauzat de Gibberella zeae. Phytopathology, 53: 831-838.
- Snidjers, C.H.A. 1989. Stadiul actual al cultivării grâului pentru rezistența la Fusarium head blight și problema micotoxinelor în Țările de Jos. Fundația pentru ameliorarea plantelor agricole, Wageningen. În M.M. Kohli, Ed. Taller sobre la Fusariosis de la espiga en America del Sur. Mexico, DF, CIMMYT.
- Snijders, C.H.A. 1990. Moștenirea rezistenței la arsura capului cauzată de Fusarium culmorum la grâul de iarnă Euphytica, 50: 11-18.
- Teich, A.H. & Nelson, K. 1984. Studiu privind fuzarioza capului și posibilele efecte ale practicilor culturale în lanurile de grâu din Lambton County în 1983. Can. Plant Dis. Surv. 64(1): 11-13.
- Trenholm, H.L., Friend, D.H. & Hamilton, R.M.G. 1984. Vomitoxina și zearalenona în hrana animalelor. Agriculture Canada Publication 1745 E.
- Van Egmond, H.P. & Dekker, W.H. 1995. Reglementări mondiale privind micotoxinele în 1994. Nat. Toxins, 3: 332.
- Viedma, L. 1989. Importanța și distribuția fuzariozei de trigo în Paraguay. În M.M. Kohli, ed. Taller sobre la Fusariosis de la espiga en America del Sur. Mexico, DF, CIMMYT.
- Wang, Y.Z. 1997. Epidemiologia și managementul scabiei grâului în China În H.J. Dubin, L. Gilchrist, J. Reeves & A. McNab, eds. Fusarium head scab: situația globală și perspectivele viitoare. Mexico, DF, CIMMYT.
- Wang, Y.Z. & Miller, J.D. 1988. Efectele metaboliților asupra țesutului de grâu în legătură cu rezistența la Fusarium head blight. J. Phytopathol, 122: 118-125.
Fusarium Head Blight
- Infektion und Ausbreitung von Fusarium spp. an Weizen in Abhängigkeit der Anbaubedingungen im Rheinland, Lienemann, K.
- E.-C. Oerke și H.-W. Dehne
Efectele activității apei, temperaturii și pH-ului asupra creșterii izolatelor Fusarium moniliforme și Fusarium proliferatum din porumb, Sonia Marin, Vicente Sanchis și Naresh Magan - Interacțiunea dintre Fusarium graminearum și F. moniliforme în urechile de porumb: evoluția bolii, biomasa fungică și acumularea de micotoxine, L. M. Reid, R. W. Nicol, T. Ouellet, M. Savard, J. D. Miller, J. C. Young, D. W. Stewart și A. W. Schaafsma
- Evaluierung von Einflussfaktoren auf den Fusarium-Ährenbefall des Weizens, Wolf, P. F. J.; Schempp, H.; Verreet, J.-A.
Septoria spp.
- Baker, C.J. 1971. Morfologia infecției răsadurilor cu Leptosphaeria nodorum. Trans. Brit. Mycol. Soc. 56:306-309.
- Baker, C.J. 1969. Studii privind Leptosphaeria nodorum Müller și Septoria tritici Desm. pe grâu. Teză de doctorat. Universitatea din Exeter.
- Baker E.A., și Smith, I.M. 1978. Dezvoltarea reacțiilor de rezistență și sensibilitate la grâu la inocularea cu Septoria nodorum. Trans. Brit. Mycol. Soc. 71:475-482.
- Benedict, W.G. 1971. Efectul diferențial al intensității luminoase asupra infecției grâului cu Septoria tritici Desm. în condiții de mediu controlate. Physiol. Pl. Pathol. 1:55-56.
- Bird, P.M., și Ride, J.P. 1981. Rezistența grâului la Septoria nodorum: dezvoltarea ciupercii în raport cu lignificarea gazdei. Physiol. Pl. Pathol. 19:289-299.
- Agenți patogeni Stagonospora și Septoria din cereale: Procesul de infecție 45 Bethenod, O., Bousquet, J., Laffray, D. și Louguet, P. 1982. Reexamen des modalités d'action de l'ochracine sur la conductance stomatique des feuilles de plantules de blé, Triticum aestivum L., cv "Etoile de Choisy".Agronomie 2:99-102.
- Bousquet, J.F., și Kollman, A. 1998. Variația producției de metaboliți de către izolatele de Septoria nodorum adaptate la grâu sau la orz. J. Phytopathol. 146:273-277.
- Bousquet, J.F., Belhomme de Franqueville, H., Kollmann, A., și Fritz, R. 1980. Action de la septorine, phytotoxine synthétisée par Septoria nodorum, sur la phosphorylation oxydative dans les mitochondries isolées de coléoptiles de blé. Can. J. Bot. 58:2575-2580.
- Brennan, R.M., Fitt, B.D.L., Colhoun, J., și Taylor, G.S. 1986. Factorii care afectează germinația pycnidiosporilor Septoria nodorum. J. Phytopathol. 117:49-53.
- Brönnimann, A., Sally, B.K., și Sharp, E.L. 1972. Investigații privind Septoria nodorum la grâul de primăvară din Montana. Plant Dis. Reptr. 56:188-191.
- Cohen, L., și Eyal, Z. 1993. Histologia proceselor asociate cu infecția cultivarelor de grâu rezistente și sensibile la Septoria tritici. Plant Pathol. 42:737-743.
- Cunfer, B.M. 1983. Epidemiologia și combaterea Septoria nodorum, care se transmite prin semințe. Seed Sci. Tecnol. 11:707- 718.
- Essad, S., și Bousquet, J.F. 1981. Action de l'ochracine, phytotoxine de Septoria nodorum Berk., sur le cycle mitotique de Triticum aestivum L. Agronomie 1:689-694.
- Eyal, Z., Scharen, A.L., Prescott, J.M., și van Ginkel, M. 1987. Bolile Septoria la grâu: Concepte și metode de combatere a bolilor. CIMMYT. Mexico D.F. 46 pp.
- Fernandes, J.M.C., și Hendrix, J.W. 1986a. Viabilitatea conidiilor de Septoria nodorum expuse la condiții naturale în Washington. Fitopathol. Bras. 11:705-710.
- Fernandes, J.M.C., și Hendrix, J.W. 1986b. Efectele umezelii frunzelor și ale temperaturii asupra creșterii hifelor și dezvoltării simptomelor pe frunzele de grâu infectate de Septoria nodorum. Fitopathol. Bras. 11:835-845.
- Fournet, J. 1969. Properiétés et role du cirrhe du Septoria nodorum Berk. Ann. Phytopathol. 1:87-94. Fournet, J., Pauvert, P., și Rapilly, F. 1970. Propriétés des gelées sporifères de quelques Sphaeropsidales et Melanconiales. Ann. Phytopathol. 2:31-41.
- Gough, F.J., și Lee, T.S. 1985. Efectele umezelii asupra descărcării și supraviețuirii conidiilor de Septoria tritici. Phytopathology 75:180-182.
- Green, G.J., și Dickson, J.G. 1957. Histologia patologică și reacțiile varietale la pătarea septorioasă a frunzelor de orz. Fitopatologie 47:73-79.
- Griffiths, E., și Peverett, H. 1980. Efectele umidității și ale extractului de cirrus asupra supraviețuirii sporilor de Septoria nodorum. Trans. Brit. Mycol. Soc. 75:147-150.
- Harrower, K.M. 1976. Funcția Cirrus la Leptosphaeria nodorum. APPS Newsletter 5:20-21.
- Hilu, H.M., și Bever, W.M. 1957. Inocularea, supraînsămânțarea și relația suscept-patogen a speciilor de Triticum. Fitopatologie 47:474-480.
- Holmes, S.J.I., și Colhoun, J. 1974. Infecția grâului cu Septoria nodorum și S. tritici. Trans. Brit. Mycol. Soc. 63:329-338.
- Jenkins, P.D. 1978. Interacțiunea în bolile cerealelor. Teză de doctorat. Universitatea din Țara Galilor.
- Karjalainen, R., și Lounatmaa, K. 1986. Ultrastructura penetrării și colonizării frunzelor de grâu de către Septoria nodorum. Physiol. Mol. Pl. Pathol. 29:263-270.
- Kema, G.H.J., DaZhao, Y., Rijkenberg, F.H.J., Shaw, M.W., și Baayen, R.P. 1996. Histologia patogenezei lui Mycosphaerella graminicola în grâu. Phytopathology 86:777-786.
- Keon, J.P.R., și Hargreaves, J.A. 1984. Răspunsul celulelor epidermice ale frunzelor de orz la infecția cu Septoria nodorum. New Phytol. 98:387-398.
- King, J.E., Cook, R.J., și Melville, S.C. 1983. O analiză a bolilor septoriale ale grâului și orzului. Ann.Appl. Biol. 103:345-373.
- Krupinsky, J.M., Scharen, A.L., și Schillinger, J.A. 1973. Variația agentului patogen la Septoria nodorum Berk. în legătură cu specificitatea organului, rata fotosintetică aparentă și producția de grâu. Physiol. Pl. Pathol. 3:187-194.
- Lehtinen, U. 1993. Enzimele de degradare a peretelui celular vegetal de la Septoria nodorum. Physiol. Mol. Pl. Pathol. 43:121-134.
- Magro, P. 1984. Producerea de enzime de degradare a polizacidelor în cultură și în timpul patogenezei. Plant Sci. Letters 37:63-68.
- Morgan, W.M. 1974. Studii fiziologice ale bolilor de grâu cauzate de Septoria spp. și Fusarium culmorum. Teză de doctorat. Universitatea din Londra.
- O'Reilly, P., și Downes, M.J. 1986. Forma de supraviețuire a Septoria nodorum pe grâul de iarnă fără simptome. Trans. Brit. Mycol. Soc. 86:381-385.
- Rapilly, F., Foucault, B., și Lacazedieux, J. 1973. Études sur l'inoculum de Septoria nodorum Berk. (Leptosphaeria nodorum Müller) agent de la septoriose du blé I. Les ascospores. Ann. Phytopathol. 5:131-141.
- Rasanayagam, M.S., Paul, N.D., Royle, D.J., și Ayres, P.G. 1995. Variația răspunsurilor lui Septoria tritici și S. nodorum la iradierea UV-B in vitro. Mycol. Res. 99:1371-1377.
- Shipton, W.A., Boyd, W.R.J., Rosielle, A.A., și Shearer, B.L. 1971. Bolile Septoria comune ale grâului. Bot. Rev. 37:231-262.
- Straley, M. L. 1979. Patogeneza Septoria nodorum (Berk.) Berk. pe cultivare de grâu cu rezistență diferită la pătarea glumei. Teză de doctorat. Universitatea de Stat din Montana. 99 pp.
- Straley, M.L., și Scharen, A.L. 1979. Dezvoltarea Septoria nodorum în frunzele de grâu rezistente și sensibile. Phytopathology 69:920-921.
- Weber, G.F. 1922. Bolile septorioase ale cerealelor. Phytopathology 12:537-585.
- Babadoost, M. & Herbert, T.T. 1984. Factorii care influențează infectarea răsadurilor de grâu cu Septoria nodorum. Phytopathology, 74: 592-595.
- Eyal, Z.E. 1981. Combaterea integrată a bolilor Septoria la grâu. Plant Dis., 65: 763-768.
- Eyal, Z., Sharen, A.L., Prescott, J.M. & van Ginkel, M. 1987. Bolile septorioase ale grâului: concepte și metode de combatere a bolilor. Mexico, DF, CIMMYT.
- Polley, R.W. & Thomas, M.R. 1991. Anchete privind bolile grâului în Anglia și Țara Galilor, 1976-1988. Ann. Appl. biol. 119: 1-20.
- Henze, Mathias: Entwicklung einer anbauparameter- und witterunsabhängigen Befallsprognose von Septoria tritici, CUVILLER VERLAG, Göttingen 2008
- B.M. Cunfer: Stagonospora și Septoria Pathogens of Cereals: The Infection Process, în Septoria and Stagonospora Diseases of Cereals: A Compilation of Global Research, M. van Ginkel, A. McNab și J. Krupinsky editori, Proceedings of the Fifth International Septoria Workshop September 20-24, 1999, CIMMYT, Mexico.
Echipament recomandat
Verificați ce set de senzori este necesar pentru monitorizarea bolilor potențiale ale acestei culturi.