
Blé modèles de maladies
La pyriculariose du blé
Agent pathogène
Pyricularia griseaégalement connu sous le nom de Magnaporthe oryzaeest un champignon pathogène responsable de la pyriculariose du blé, une maladie importante qui affecte les cultures de blé. Le pathogène se reproduit principalement de manière asexuée par l'intermédiaire de conidies (spores asexuées), qui servent d'inoculum primaire pour initier les infections. Ces conidies sont produites sur des conidiophores et sont dispersées par le vent, la pluie et des moyens mécaniques, tels que l'équipement agricole. Lorsqu'elles atterrissent sur un hôte sensible, les conidies germent et forment des appressoria - des structures spécialisées qui facilitent la pénétration dans les tissus de la plante. Une fois à l'intérieur, le champignon colonise les cellules de l'hôte, ce qui entraîne le développement de la maladie. Les conditions environnementales jouent un rôle crucial dans le processus d'infection du champignon. P. grisea. Le champignon se développe dans les climats chauds et humides, avec des températures comprises entre 15°C et 30°C et des périodes prolongées d'humidité des feuilles ou d'humidité relative élevée. Une humidification continue des feuilles pendant au moins 14 heures est nécessaire pour déclencher l'infection, ce qui fait qu'une couverture nuageuse excessive, une humidité élevée, une irrigation excessive et une irrigation mal programmée favorisent le développement de la maladie. En outre, des facteurs de stress tels que la sécheresse, le compactage du sol, les faibles hauteurs de tonte et une fertilisation azotée excessive peuvent exacerber la gravité de la maladie.
Symptômes
Les premiers symptômes de la pyriculariose du blé se manifestent par des lésions en forme de losange, imbibées d'eau, sur les feuilles, qui deviennent grises au fur et à mesure que la maladie progresse. Ces lésions peuvent s'étendre et fusionner, entraînant une brûlure et une nécrose étendues des feuilles. Les épis infectés présentent un blanchiment partiel ou complet, souvent à partir d'un point d'infection gris noirâtre au niveau du rachis ou de la base des épis. En cas de forte pression d'inoculum, plusieurs points d'infection peuvent apparaître sur un seul rachis, ce qui entraîne des pertes de rendement significatives. En plus des symptômes foliaires, P. grisea peut infecter d'autres parties aériennes de la plante de blé, y compris les nœuds et les collets, ce qui entraîne la pourriture du collet ou la pyriculariose des nœuds. Les parties affectées peuvent alors se briser, ce qui entraîne la verse et une réduction supplémentaire du rendement. La capacité du pathogène à infecter diverses parties de la plante tout au long de la période de végétation le rend particulièrement destructeur, surtout dans des conditions environnementales favorables.
Modèle FieldClimate
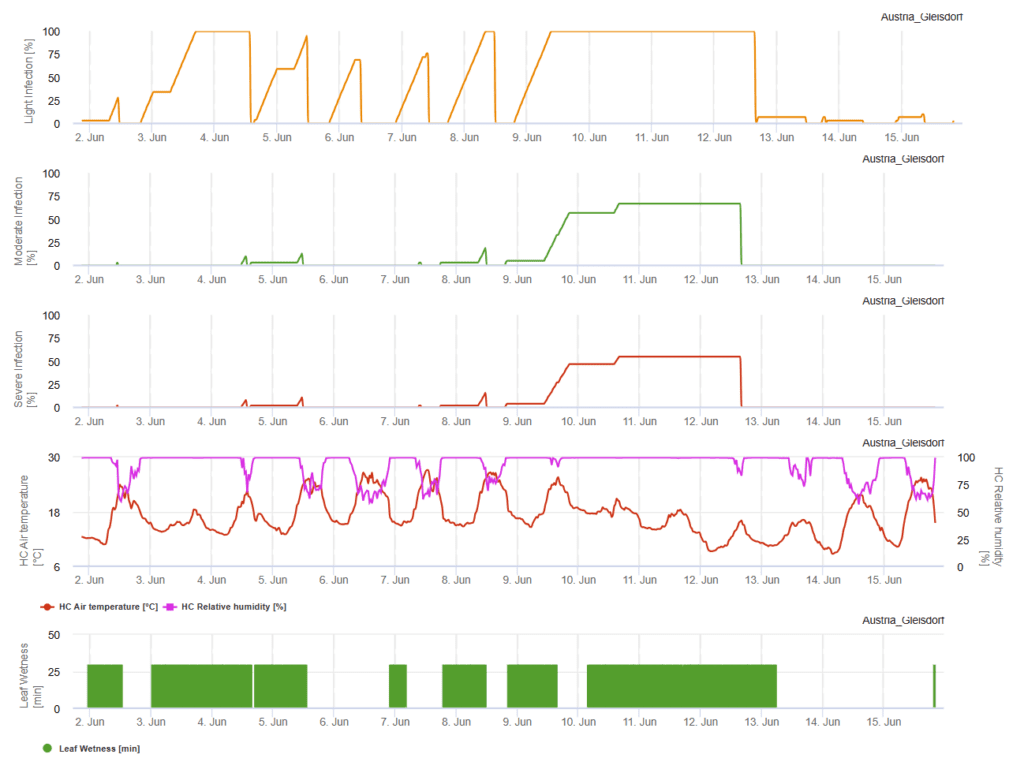
Capteurs nécessaires :
- Température de l'air
- Humidité relative
- Humidité des feuilles
Un ciel nuageux, des conditions humides et des bruines favorisent le développement et la gravité de la maladie. En FieldClimate, nous calculons trois classes de gravité et lorsque 100% d'infection sont atteintes, les conditions optimales pour le champignon pathogène sont réunies dans le champ. En fonction de la variété, de l'historique du champ, des mesures phytosanitaires curatives doivent être prises en compte lorsqu'une infection légère, modérée ou sévère a atteint 100%.
Littérature
- Cruz, C. D., et Valent, B. (2017). La pyriculariose du blé : un danger en mouvement. Pathologie végétale tropicale, 42(3), 210-222.
- Islam, M. T., Croll, D., Gladieux, P., Soanes, D. M., Persoons, A., Bhattacharjee, P., ... & Talbot, N. J. (2016). L'émergence de la pyriculariose du blé au Bangladesh a été causée par une lignée sud-américaine de Magnaporthe oryzae. BMC Biology, 14(1), 84.
Pyrenophora teres
Agent pathogène
Pyrenophora teres (Drechslera teres) existe sous deux formes - P. teres f. teres et P. teres f. maculata qui induisent respectivement une tacheture nette et une tacheture ponctuelle.
Les ascospores libérées par les pseudothèces infectent les résidus, déclenchant ainsi l'infection primaire. Les mycéliums et les conidies transmis par les semences servent également d'inoculum primaire dans certains cas. Les spores germent sur les feuilles et pénètrent la paroi externe de l'épiderme, ce qui permet au pathogène de se développer dans une grande vésicule intracellulaire. Le stade asexué suit, au cours duquel des conidies sont produites et déclenchent l'infection secondaire, augmentant ainsi la gravité de la maladie. À la fin de la saison de croissance, le pathogène produit des pseudothèces comme source de sursaisonnement et ils restent sur les débris d'orge infectés.
Symptômes
Les symptômes se manifestent sur les feuilles, les tiges et les grains, la maladie progressant du bas vers le haut des plantes. Les plantes plus âgées ont tendance à subir des dommages moins graves, car elles possèdent une cuticule plus épaisse qui empêche la pénétration des pathogènes et une plus grande capacité à produire des composés antifongiques. Les agents pathogènes produisent des toxines qui sont responsables des symptômes, contribuant à la nécrose et à la chlorose ou perturbant l'équilibre hydrique au niveau cellulaire.
Dans le cas de la maladie des taches en filet, les symptômes se présentent sous la forme de lésions longitudinales étroites, de couleur brun foncé. Seules quelques petites lésions ressemblant à des points se développent sur les variétés très résistantes, sans qu'il y ait formation d'un réseau distinct. En revanche, la plupart des variétés sensibles peuvent présenter des zones chlorotiques ou imbibées d'eau autour des lésions nécrotiques.
Dans le cas de la tache commune, les symptômes consistent en des lésions brun foncé, circulaires ou elliptiques, souvent entourées d'un halo chlorotique ou nécrotique plus ou moins large. Chez les variétés moins sensibles, les lésions sont généralement plus petites et peuvent ne pas être entourées d'un halo chlorotique.
Les infections graves peuvent entraîner la mort complète des feuilles, qui deviennent alors sèches. Les feuilles les plus âgées sont généralement les premières à se flétrir, suivies par les feuilles les plus jeunes.
Modèle FieldClimate
Drechslera teres Modèle
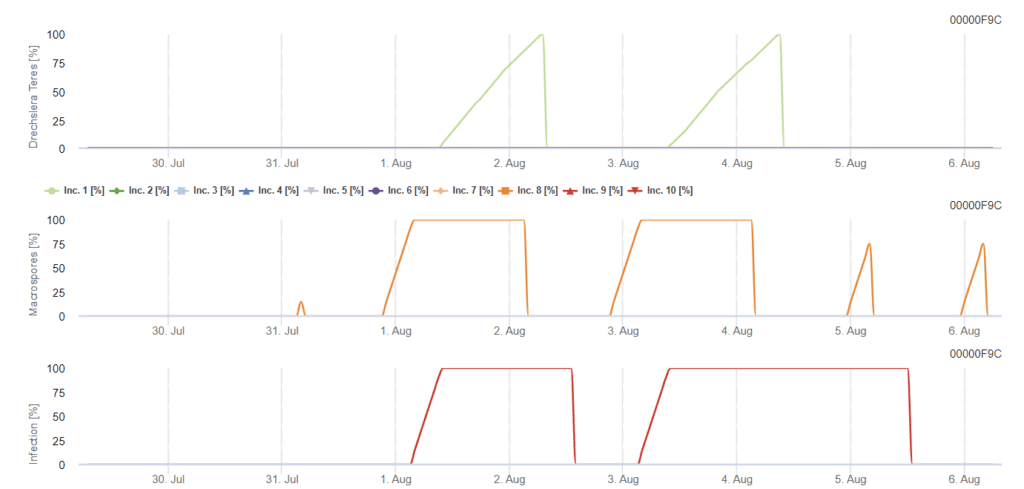
Capteurs nécessaires :
- Température de l'air
- Humidité relative
- Humidité des feuilles
- Précipitations
L'inoculum primaire se développe à des températures optimales comprises entre 15°C et 25°C, l'optimum se situant à 20°C. Des conditions de plus de 6 heures d'obscurité conduisent à une croissance optimale des conidies, comme le montre un graphique de sporulation des conidies. Si le graphique de sporulation atteint 100%, les conditions optimales sont réunies sur le terrain.
La dispersion se fait ensuite par le vent ou la pluie. Les infections des tissus végétaux nécessitent des conditions humides telles que l'humidité des feuilles ou une humidité relative élevée pendant environ 10 à 30 heures avec des températures optimales de 15°C et 25°C, comme le montre un graphique d'infection. Lorsqu'il atteint 100%, on détermine que les conditions optimales ont été mesurées pour l'infection sur le terrain. La lumière du soleil peut également favoriser la croissance des conidophores qui produisent des conidies dans des conditions modifiées de périodes humides et sèches avec un rayonnement solaire élevé et une humidité relative faible, et le vent favorise le développement de la maladie.
Littérature
- Backes, A., Guerriero, G., Ait Barka, E., & Jacquard, C. (2021). Pyrenophora teres : taxonomie, morphologie, interaction avec l'orge et mode de lutte. Frontières de la science des plantes, 12, 614951.
- Liu, Z., Ellwood, S. R., Oliver, R. P. et Friesen, T. L. (2011). Pyrenophora teres : profil d'un pathogène de l'orge de plus en plus nuisible. Pathologie végétale moléculaire, 12(1), 1-19.
- Obst, A., & Paul, VH (1993). Maladies et ravageurs des céréalesVerlag Th. Mann, Gelsenkirchen-Buer.
Tout à emporter
Agent pathogène
La maladie du "Take-all", causée par Gaeumannomyces graminisest l'une des maladies les plus dévastatrices pour les céréales. Le nom de cette maladie a été donné par les agriculteurs du sud de l'Australie, car elle est si préjudiciable qu'elle ne laisse aucun grain à récolter. L'agent pathogène endommage le système racinaire et la tige, provoquant une carence en eau et en nutriments, et entraînant finalement la mort de la plante.
Le champignon survit sous forme de mycéliums dans les débris de culture de manière saprophyte et les fragments présents dans le sol peuvent être transportés par le vent, l'eau et les animaux. L'infection primaire se produit lorsque les racines des plantules entrent en contact avec des débris infectés, suivie par la croissance et l'extension des hyphes. En pénétrant l'épiderme de la racine et en envahissant le cortex de la racine, il colonise et détruit les tissus. L'infection progresse vers le haut et vers le bas. L'infection secondaire se produit par contact racinaire à racine, les plantes gravement infectées se présentant en plaques.
Symptômes
La maladie du piétin-échaudage du blé affecte généralement les semis et le tallage, provoquant des symptômes près de la surface du sol. Les plantes infectées peuvent devenir rabougries, avec des feuilles jaunies et des épis prématurément mûrs sans grains complètement développés. Les taches mortes circulaires, de quelques centimètres à quelques mètres, sont souvent bordées de jaune-orange ou de bronze et peuvent réapparaître dans la même zone les années suivantes.
Les principaux symptômes sont des épis blancs blanchis ou vides, des bases de tiges noircies et des racines sombres et pourries avec de petites lésions noires qui s'étendent. Les racines gravement endommagées sont fragiles et une décoloration noire et brillante peut apparaître sur la tige basale. Les plantes peuvent être facilement arrachées du sol en raison de l'affaiblissement de leur système racinaire. La maladie peut ressembler à un stress dû à la sécheresse car elle perturbe l'écoulement de l'eau vers les parties supérieures de la plante, ce qui provoque un dépérissement prématuré.
Modèle FieldClimate
Tout à emporter
Modèle Capteurs :
- Température du sol
Le modèle de risque d'envahissement utilise la durée du jour et la température du sol pour déterminer les périodes à risque. Les journées avec moins de 13 heures d'ensoleillement et les températures du sol entre 10°C et 20°C favorisent le développement de la maladie.
Lorsque la valeur de risque atteint 100%, les conditions optimales pour le développement du pathogène sont réunies dans le champ. La rotation des cultures avec des intervalles d'au moins 2 à 3 ans entre les céréales sensibles est la stratégie de protection la plus importante.
Littérature
- Cook, R. J. (2003). L'ensilage du blé. Pathologie végétale physiologique et moléculaire, 62(2), 73-86.
- Palma-Guerrero, J., Chancellor, T., Spong, J., Canning, G., Hammond, J., McMillan, V. E., & Hammond-Kosack, K. E. (2021). Take-all disease : new insights into an important wheat root pathogen. Tendances de la science des plantes, 26(8), 836-848. https://www.apsnet.org/edcenter/disandpath/fungalasco/pdlessons/Pages/Takeall.aspx
Fusariose de l'épi
Agent pathogène
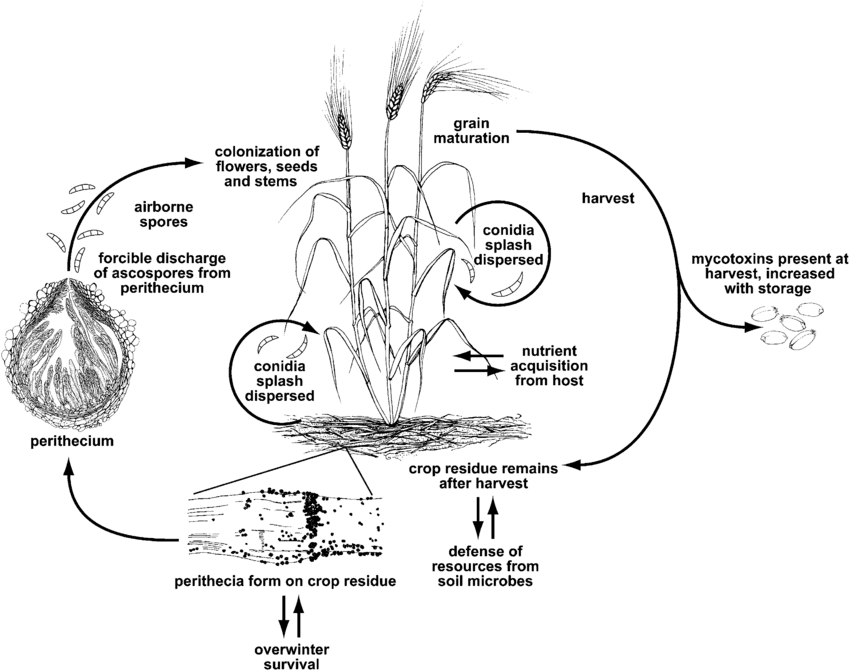
La brûlure de l'épi ou la tavelure est causée par le genre Fusarium. L'espèce la plus courante est Fusarium graminearum mais les espèces les plus répandues peuvent varier selon les régions.
F. graminearum peut infecter les plantes de blé à tous les stades de croissance. Il survit à l'hiver sur les résidus de culture infectés et, au printemps, l'infection primaire se produit lorsque les ascospores des périthèces et les conidies sont dispersées sur les glumes ou les anthères du blé. Les fleurons infectés produisent des grains ratatinés ou flétris, souvent appelés grains "pierre tombale". Même si les grains ne semblent pas affectés, ils peuvent être contaminés par des mycotoxines. L'infection secondaire se produit par l'intermédiaire des conidies, mais les épidémies de blé dépendent principalement de la quantité d'inoculum primaire plutôt que des sources secondaires.
La fusariose de l'épi entraîne également l'accumulation de mycotoxines nocives dans les cultures, ce qui constitue un risque potentiel pour les animaux. Ces mycotoxines désactivent les mécanismes de défense des plantes ou protègent le champignon contre d'autres organismes. La principale toxine est le déoxynivalénol (DON), qui inhibe la synthèse des protéines et perturbe le fonctionnement normal des cellules. Les humains qui ont consommé du blé contenant du DON présentent des symptômes tels que des nausées, de la fièvre ou des vomissements.
Symptômes

Chez le blé et le blé dur, une partie ou la totalité de l'épi peut apparaître blanchie. Les épis partiellement blancs et verts permettent de diagnostiquer la maladie chez le blé. Le champignon peut également infecter la tige, provoquant une décoloration brune à violette. Des masses de spores roses à orange saumon sont souvent observées sur les épillets et les glumes infectés lorsque les conditions sont humides. De nombreux grains sont ratatinés et légers et sont parfois appelés "pierres tombales" en raison de leur aspect crayeux et sans vie. Dans des conditions favorables, l'infection peut se propager aux épillets adjacents et infecter l'ensemble de l'épi, y compris le rachis et le pédoncule. Les grains peuvent avoir un aspect terne et une décoloration rose de taille normale lorsque l'infection s'est produite à un stade avancé du développement.
Chez l'orge, les épillets infectés deviennent blanchis et ont l'air imbibés d'eau. Les grains peuvent également présenter une décoloration et, occasionnellement, des masses de spores orange saumon peuvent être observées sur les épillets et les glumes en conditions humides.
Modèles FieldClimate
Les estimations des niveaux de fusariose dans un champ sont basées sur le comptage des têtes ou des grains fusariés. L'échelle visuelle colorée permettant d'estimer la gravité de la fusariose du blé est disponible auprès du service de vulgarisation du NDSU (publication PP-1095) : https://library.ndsu.edu/ir/bitstream/handle/10365/9187/PP1095_1998.pdf?sequence=1&isAllowed=y.
Modèle d'infection de la fusariose de l'épi (risque de fusariose de l'épi)
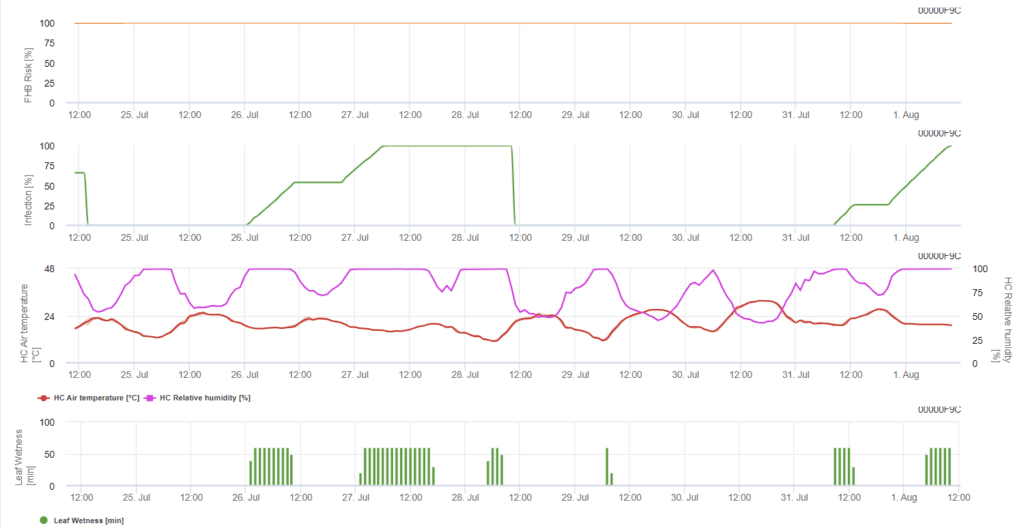
Capteurs nécessaires :
- Température de l'air
- Humidité relative
- Humidité des feuilles
Le modèle détermine les périodes à risque pour une infection. Lorsque l'infection 100% est atteinte, le risque est très élevé et les conditions pour le champignon ont été favorables à l'infection. Les connaissances de l'agriculteur sur le stade de développement des différentes variétés de blé lui permettent de décider de l'application d'une pulvérisation curative immédiatement après l'infection.
Les agents fongiques de la fusariose de l'épi du blé sont favorisés par des températures chaudes de 20°C à 30°C et de longues périodes d'humidité. Des périodes d'humidité foliaire de plusieurs jours conduisent à des symptômes visibles précoces. Les symptômes peuvent également être observés après une longue période de latence si l'infection est suivie d'une période d'humidité foliaire de 18 heures ou même plus courte et après un inoculum artificiel à des températures de 15°C.
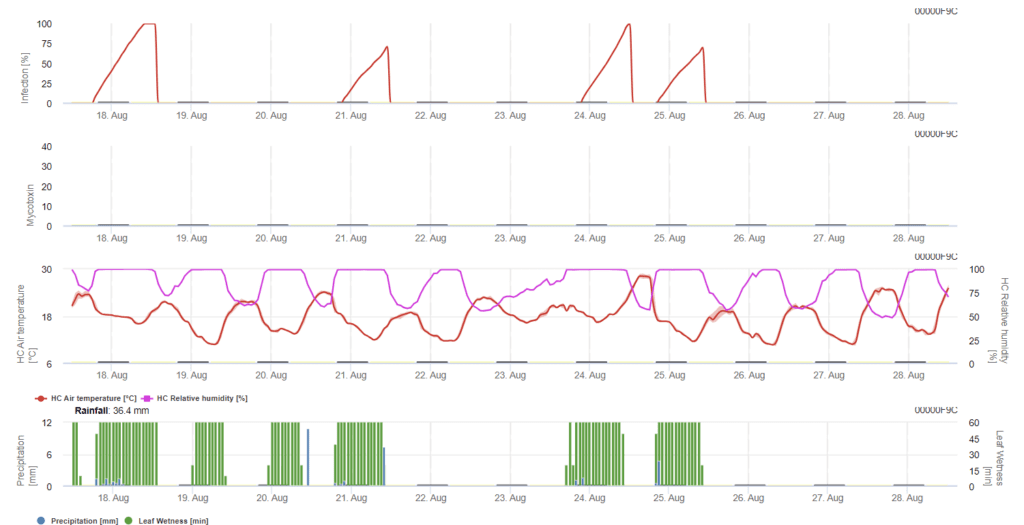
En résumant toutes les différentes combinaisons de températures et d'humidité que nous avons trouvées dans la littérature, nous avons décidé de signaler les infections de fusariose de l'épi si la température et la période d'humidité foliaire ou les périodes avec plus de 85% d'humidité relative dépassent les valeurs visualisées dans le graphique suivant. Le calcul de la valeur de progression suit la relation entre la durée des conditions humides et la température.
Modèle d'alerte aux mycotoxines du Fusarium (Fusariose)
Capteurs nécessaires :
- Température de l'air
- Humidité relative
- Humidité des feuilles
- Précipitations
Dans ce modèle, l'infection de la fusariose est calculée en fonction des précipitations (2 mm nécessaires), de l'humidité relative (supérieure à 85%) ou de l'humidité des feuilles, de la température pendant le processus. Si l'infection atteint 100%, les conditions optimales pour le champignon pathogène sont réunies. Le modèle calcule ensuite le risque de mycotoxine FHB.
Les essais d'infection avec des périodes prolongées d'humidité foliaire de la fusariose de l'épi conduisent à des teneurs élevées en mycotoxines. Sur la base de ces informations, une période d'humidité des feuilles de 48 heures ou plus au cours des stades 61 et 69 est considérée comme présentant un risque élevé de mycotoxines.
Les expériences faites tout au long de l'analyse du DON dans le blé cultivé commercialement ont montré que des périodes d'humidité foliaire suffisamment longues pour l'infection après une infection initiale aux stades 61 à 69 peuvent augmenter les valeurs de DON. En cas de périodes d'humidité foliaire plus longues, les mycotoxines peuvent augmenter jusqu'au stade 85.
- Stade BBCH 61 : Début de la floraison ; premières anthères visibles
- Stade BBCH 69 : Fin de la floraison ; tous les épillets ont terminé leur floraison mais il peut rester des anthères déshydratées.
- BBCH stade 85 : Au milieu de la maturation ; pâte molle avec une teneur en grains molle mais sèche, l'empreinte de l'ongle n'est pas maintenue.
Le modèle accumule le chiffre du risque proportionnellement à la progression de l'infection pour chaque période d'infection réussie au cours de la période sélectionnée pour le calcul. Six infections terminées conduiraient à un risque de 100%. Normalement, la période d'humidité des feuilles qui conduit à une infection par le fusarium est plus longue que le minimum requis. Par conséquent, la plupart des infections par le fusarium entraîneront une augmentation du risque de plus de 17%.
La valeur du risque de mycotoxines dépend de l'historique du champ. Le blé cultivé après un semis direct ne peut présenter qu'un faible risque s'il n'est pas pulvérisé dans des conditions optimales. Dans le cas du blé non pulvérisé, il faut s'attendre à une augmentation des valeurs de DON après 35% du risque. Le blé qui suit un blé non labouré après une autre culture peut présenter un risque plus élevé de 50%. Si le blé suit un blé labouré, le risque peut atteindre 70%. Le blé de première année doit être testé pour le DON si le risque atteint 100%.
Littérature
- https://www.fao.org/4/y4011e/y4011e0j.htm
- https://scabusa.org/pdfs/NDSU_PP-804_FHB-Small-Grains.pdf
- Lancashire, P. D., Bleiholder, H., Boom, T. V. D., Langelüddeke, P., Stauss, R., Weber, E., & Witzenberger, A. (1991). Un code décimal uniforme pour les stades de croissance des plantes cultivées et des mauvaises herbes. Annales de biologie appliquée, 119(3), 561-601.
- Trail, F. (2009). Pour des vagues de grains brûlés : Fusarium graminearum dans l'ère post-génomique. Physiologie végétale, 149(1), 103-110.
- Schumann, G. L. (2010). L'instructeur phytosanitaire| Volume : 10| Année : 2010| Type d'article : Plans de cours. Santé des plantes, 10.
Rayure orge
Agent pathogène
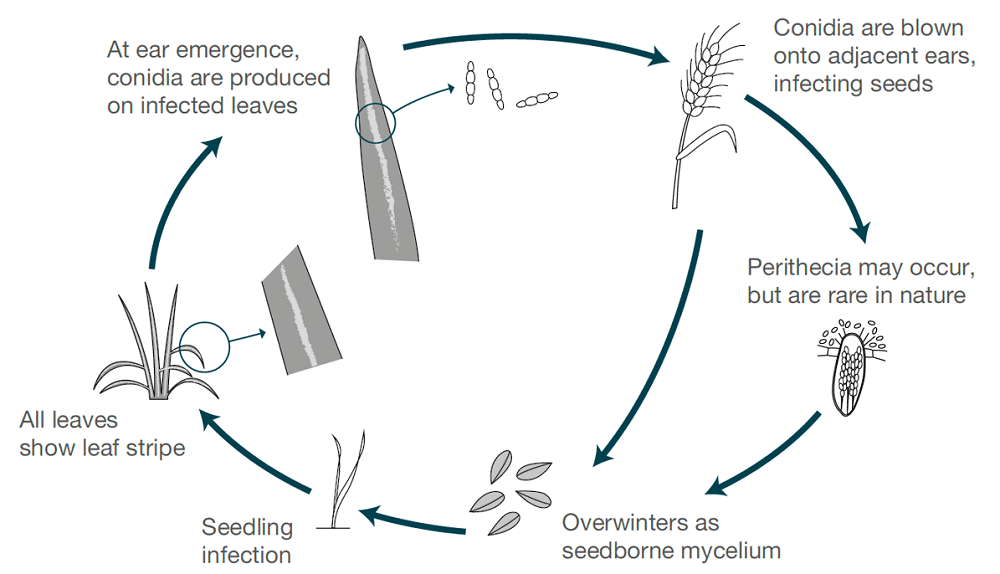
La strie de l'orge est causée par Pyrenophora graminea (Drechslera graminea)Le champignon est un agent pathogène transmis par les semences qui survit dans l'épiderme d'une semence infectée. Le champignon infecte les semis dans des conditions fraîches et humides. Le champignon se développe de manière systémique dans la plante, infecte la plante entière, produit des toxines, tue les cellules et décolore le tissu foliaire entre les nervures, provoquant ainsi des lésions striées. La striure est plus fréquente dans l'orge d'hiver que dans l'orge de printemps.
Lorsque les conditions sont humides, les spores sont produites à la surface des feuilles lorsque les épis sains fleurissent. Les spores sont dispersées par le vent vers ces épis en développement, germent et provoquent des infections. Les grains sont les plus sensibles au début de leur développement. Il n'y a qu'un seul cycle d'infection et de production de spores par saison.
Symptômes

Les symptômes se manifestent surtout au stade de l'émergence de l'épi.
Des bandes vert pâle à jaunes apparaissent d'abord à la partie basale de la feuille et de la gaine foliaire. Ces bandes deviennent progressivement brunes à brun foncé, suivies d'un dessèchement et d'un éclatement du limbe. Elles s'étendent sur toute la longueur de la feuille, se nécrosent et fusionnent, entraînant finalement la mort de la plante.
Les plantes peuvent paraître rabougries, produire peu de talles et, dans les cas les plus graves, ne pas s'épandre ou ne pas produire de graines. La longueur de l'épi peut également être réduite en raison du développement insuffisant des grains bruns.
Modèle FieldClimate
Pyrenophora graminea Modèle
Capteurs nécessaires :
- Température de l'air
- Humidité relative
- Humidité des feuilles
- Précipitations
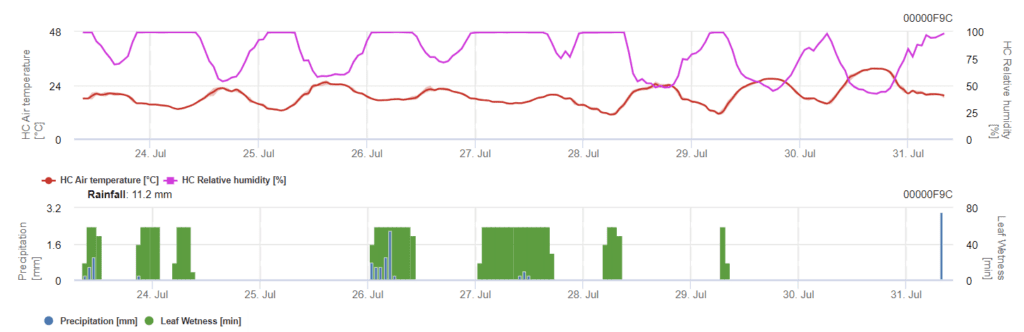
Le modèle comporte deux étapes. Le premier stade correspond aux périodes à risque pendant les périodes d'urgence de la plante, les premiers stades. Le deuxième stade correspond à la période de floraison et au développement de l'épiaison de l'orge. Lorsque l'infection atteint 100%, les conditions optimales ont été créées dans le champ pour que le champignon infecte les tissus de la plante et se développe systématiquement à l'intérieur.
Littérature
- Richardson, M. J. (1996). Seed mycology. Recherche mycologique, 100(4), 385-392. https://ahdb.org.uk/knowledge-library/barley-leaf-stripe-life-cycle-and-disease-symptoms https://plantwiseplusknowledgebank.org/doi/full/10.1079/pwkb.species.46115
Septoriose
Agent pathogène
Il existe deux maladies principales de la septoriose du blé : la tache septorienne causée par la bactérie Septoria tritici et la tache Septoria nodorum causée par Septoria nodorum.
Septoria tritici survit sur les résidus de culture infectés pendant l'été et commence à infecter les plants de blé à l'automne. Le champignon se développe dans des conditions fraîches et humides. Il existe deux phases : une phase de latence et une phase de nécrose. Pendant la phase de latence, le champignon inocule de nouveaux tissus végétaux et, en pénétrant par les stomates, il se colonise et se développe de manière intercellulaire dans les tissus végétaux. S. tritici n'a pas besoin de structures d'alimentation physiques, il se nourrit lui-même en extrayant les nutriments des cellules de l'hôte qui ont perdu leur intégrité structurelle. Les plantes peuvent présenter une réponse hypersensible et des lésions nécrotiques peuvent se développer sur les tissus affectés en réponse à l'infection.
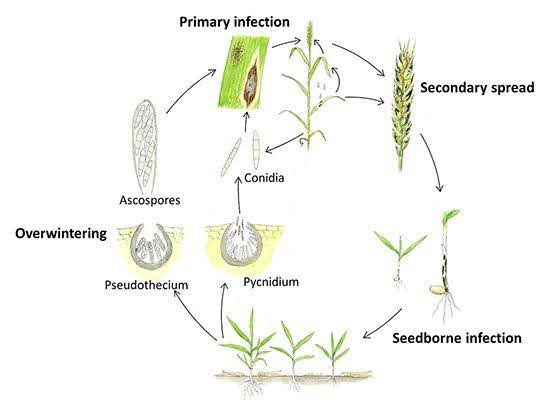
Septoria nodorum survit pendant l'été sous forme de mycéliums, de pycnides et de pseudothèces dormants sur les résidus de culture. L'infection commence généralement à l'automne lorsque les pycnidiospores des pycnides et les ascospores des pseudothèces sont dispersées par le vent et la pluie, déclenchant ainsi une infection primaire. Ces spores pénètrent la cuticule de la feuille et la formation de pycnides suit l'infection. L'infection secondaire se produit lorsque les pycnidiospores sont produites et dispersées des feuilles inférieures vers les feuilles supérieures et les glumes. Le pathogène produit également des toxines qui contribuent au développement de la maladie.
Symptômes
Septoria tritici blotch
À l'automne, Septoria tritici Les symptômes apparaissent d'abord sous la forme de petites taches jaunes sur les feuilles, contenant de minuscules points noirs, qui sont des fructifications fongiques. Les lésions sont de forme irrégulière, allant d'elliptiques à longues et étroites, s'élargissent et deviennent brunes à brun rougeâtre à mesure qu'elles mûrissent. La maladie commence généralement sur les feuilles inférieures et se déplace progressivement vers le haut, affectant finalement la feuille étendard. Lorsque les conditions sont humides, le champignon peut se propager aux épis de blé, provoquant des lésions brunes sur les glumes et les aulnes, connues sous le nom de tache des glumes. La tache septoriale peut être confondue avec d'autres maladies du blé. Cependant, la présence de corps fongiques noirs est une caractéristique clé de la tache de Septoria tritici. S. tritici. Bien que Septoria nodorum puisse également produire des corps fructifères bruns dans des conditions humides, ils diffèrent par leur couleur et leur taille. Septoria tritici les organes de fructification étant plus grands.
Septoria nodorum blotch
Septoria nodorum Les symptômes apparaissent d'abord sur les feuilles supérieures. Au début, des taches brun foncé avec un halo jaune apparaissent sur les feuilles. La brûlure de l'extrémité des feuilles est une autre indication initiale. Les lésions s'étendent et deviennent nécrotiques avec un centre brun foncé à mesure qu'elles mûrissent. De minuscules structures brun foncé sont visibles à l'intérieur des lésions, ce sont des fructifications. Les conidies libérées par les fructifications ressemblent à des masses blanches ou roses. Les feuilles gravement infectées peuvent être complètement recouvertes de lésions, entraînant finalement la mort du tissu foliaire. Le champignon peut également affecter les glumes et les hampes : des lésions brunes similaires apparaissent et la maladie progresse vers le bas.
Modèle FieldClimate
Les infections par la septoriose sont possibles à des températures basses, alors que les températures inférieures à 7°C peuvent ne pas entraîner d'infection dans les deux jours. La température optimale de la maladie est atteinte dans une zone de 16 à 21°C. Les infections sont possibles pendant une période d'humidité relative élevée ou d'humidification des feuilles de 14 heures ou plus.
Septoria tritici Modèle
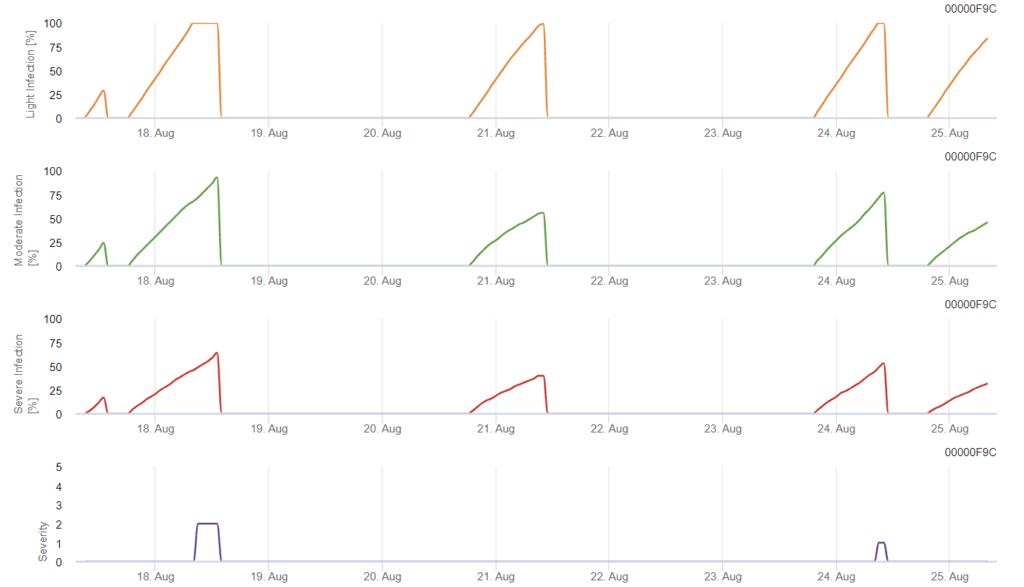
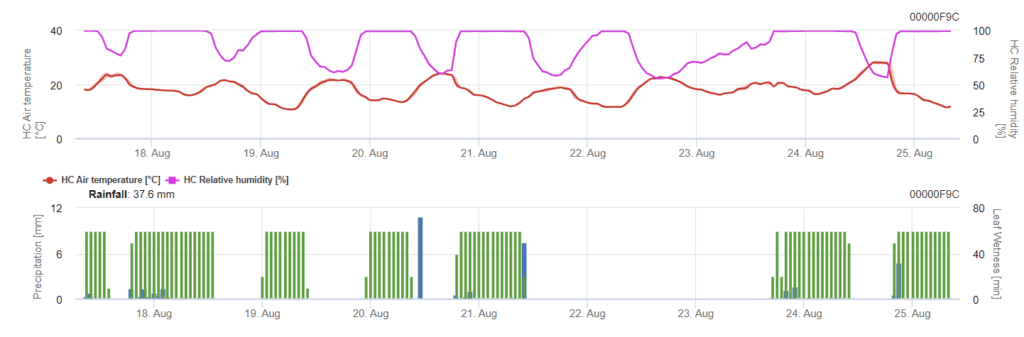
L'infection commence après une pluie de 0,5 mm. Les températures optimales pour les infections à Septoria se situent autour de 16°C à 21°C et l'humidité des feuilles ou une humidité relative élevée pendant 14 heures. La Septoria tritici est calculée en trois classes de gravité. En outre, nous déterminons des niveaux de gravité qui permettent d'évaluer la pression d'infection entre les stades BBCH 10 à 32 du blé.
- BBCH stade 10 : Développement des feuilles ; première feuille à travers le coléoptile
- BBCH stade 32 : Allongement de la tige ; nœud 2 au moins 2 cm au-dessus du nœud 1
- BBCH stade 51 : Émergence de l'inflorescence et épiaison ; début de l'épiaison avec la pointe de l'inflorescence sortie de la gaine et le premier épillet à peine visible.
Nous avons décidé de ne pas utiliser de modèle pour la formation des pycnides. La condition nécessaire à la formation des pycnides est supposée être une période où l'humidité relative est supérieure à 85%. La durée de vie des pycnides est de 24 heures. Dans tous les climats où le champignon a une chance de s'infecter, nous trouverons deux heures remplissant cette condition presque tous les jours autour du lever du soleil.
Évaluation de la gravité de l'infection
Évaluer les Septoria tritici Pour évaluer la pression d'infection entre les stades 10 et 32 et entre 32 et 51, il faut évaluer la gravité des infections en fonction des conditions climatiques. La gravité de l'infection est évaluée sur une échelle de 1 à 5 :
- 1 : faible infection avec des pluies inférieures à 5mm
- 2 : faible infection avec des pluies de plus de 5mm
- 3 : infection modérée avec des pluies inférieures à 5 mm
- 4 : infection modérée avec une pluie de plus de 5mm/ infection sévère avec une pluie de moins de 5mm
- 5 : infection sévère avec des pluies de plus de 5 mm
Évaluation de la pression de la maladie
Il y a trois facteurs pour la pression de la maladie dans le champ - le climat, l'historique du champ et la sensibilité de la variété cultivée. Si nous pouvons accumuler les valeurs de gravité de la maladie du stade 10 au stade 32 jusqu'à la valeur 4, nous pouvons nous attendre à une faible pression de la maladie par le climat. Si cette valeur atteint 6, nous pouvons nous attendre à une pression modérée de la maladie, et si elle atteint 10, à une pression plus forte de la maladie de la part du climat.
La connaissance de la sensibilité de la variété et de l'historique du champ nous conduira à pulvériser ou non en cas de pression faible ou modérée de la maladie dans la situation. Une valeur cumulée de 10 peut de toute façon conduire à une pulvérisation au stade 32.
La décision de pulvériser à un stade plus avancé dépend du climat printanier. Si nous pouvons accumuler les valeurs de gravité à partir du stade 10 jusqu'à une valeur de 6, nous pouvons nous attendre à une faible pression de la maladie. Si cette valeur atteint 10, on peut s'attendre à une pression de maladie modérée et si cette valeur atteint 15, on peut s'attendre à une pression de maladie élevée en raison de la situation climatique.
En FieldClimate, le Septoria tritici ainsi que les trois différentes sévérités d'infection. En raison des précipitations et des longues périodes d'humidité des feuilles, les conditions d'une infection sévère par S. tritici sont réunies. Les niveaux de gravité atteignent la valeur maximale de 5, ce qui signifie qu'un risque élevé d'infection est présent.
Modèle Septoria nodorum
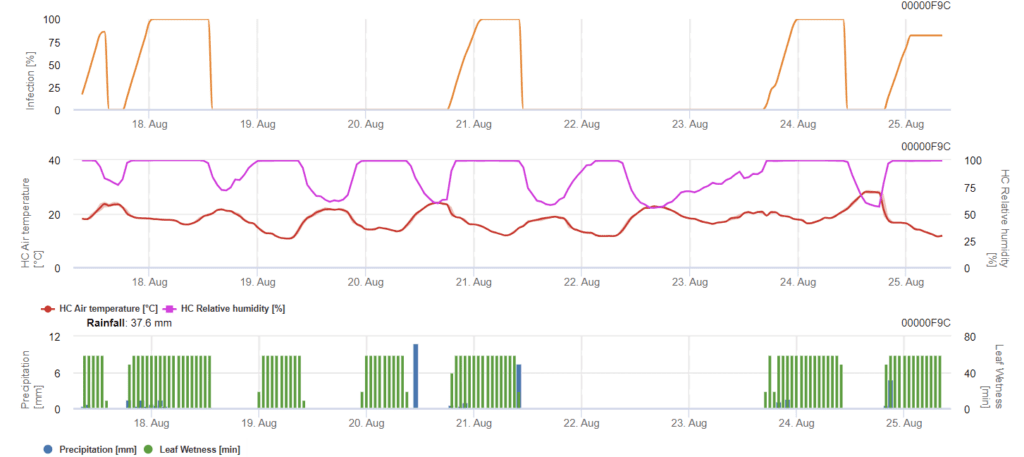
Septoria nodorumLa biologie de l'infection de l'homme diffère dans une certaine mesure de celle de l'homme de la rue. Septoria tritici mais la différence n'est pas suffisamment importante pour justifier un modèle distinct. Par conséquent, nous suggérons d'utiliser le modèle tritici pour l'ensemble du complexe de la maladie de Septoria. Dans les zones à forte pression de S. nodorumLes infections classées comme faibles avec une valeur de gravité de 2 doivent être traitées plus sérieusement que dans d'autres domaines.
Le Septoria nodorum calcule le risque de la maladie. Des mesures phytosanitaires doivent être envisagées si le risque atteint 80%. Lorsque le risque est de 100% et que l'infection est déjà déterminée, des mesures phytosanitaires systémiques (applications curatives) doivent être prises.
Littérature
- Brennan, C. J., Benbow, H. R., Mullins, E. et Doohan, F. M. (2019). Un examen des inconnues connues dans les premiers stades de la maladie de la tache septoriale du blé. Pathologie végétale, 68(8), 1427-1438.
- De Wolf, E. D. (2008). Septoria tritici blotch. Mehra, L. K., Adhikari, U., Ojiambo, P. S. et Cowger, C. (2019). Septoria nodorum blotch of wheat (tache de Septoria nodorum sur le blé). L'instructeur en santé végétale.
- Solomon, P. S., Lowe, R. G., TAN, K. C., Waters, O. D., & Oliver, R. P. (2006). Stagonospora nodorum : cause de la tache stagonospora nodorum du blé. Pathologie végétale moléculaire, 7(3), 147-156.
Tache foliaire
Agent pathogène
La tache foliaire est causée par Rynchosporium secalis.
L'infection primaire se produit par des ascospores ou des conidies sur des débris de culture. Ces spores sont dispersées par le vent et la pluie, germent et, lorsque les cellules de l'épiderme et du mésophylle s'effondrent après une infection, les symptômes deviennent visibles. L'infection secondaire est provoquée par les conidies des feuilles infectées. Dans des conditions humides, les conidies germent à la surface des feuilles et produisent des hyphes qui pénètrent la cuticule directement au-dessus des cellules épidermiques. La croissance fongique qui s'ensuit est confinée à la région sous-cutanée de l'épiderme.
Symptômes
R. secalis peut infecter n'importe quelle partie des feuilles. Les taches de forme irrégulière sont la caractéristique principale et l'infection commence du bas vers le haut des feuilles. Les taches apparaissent d'abord comme des zones imbibées d'eau. Au fur et à mesure que la maladie progresse, elles deviennent grisâtres au centre en raison de la formation de spores, avec une marge brune. La nécrose et la chlorose peuvent suivre. Les taches fusionnent et détruisent les feuilles entières.
Modèle FieldClimate
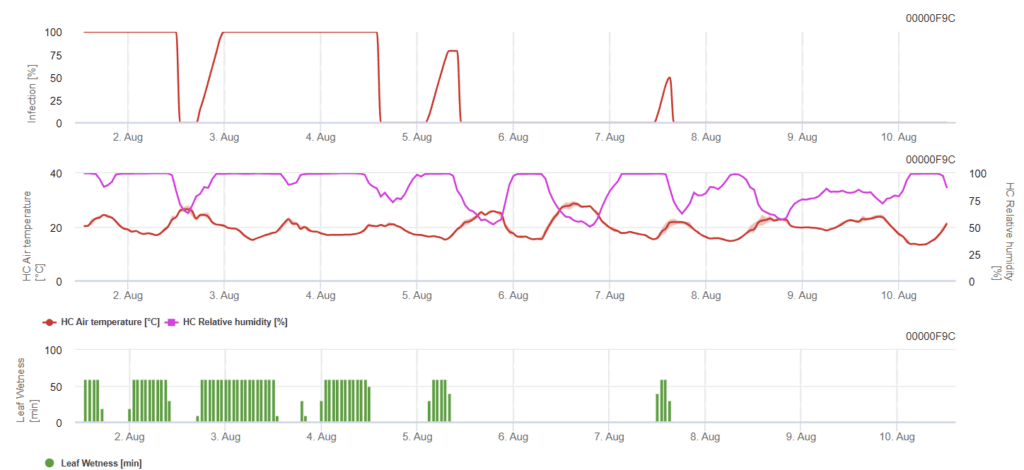
Modèle de Rynchosporiose de la tache foliaire
Capteurs nécessaires :
- Température de l'air
- Humidité relative
- Humidité des feuilles
Pour qu'une infection se produise, un minimum de 7 à 15 heures d'humidité du plomb est nécessaire, en fonction de la température (optimum à 20'C). Lorsque le graphique atteint 100%, cela signifie que les conditions optimales ont été déterminées sur le terrain.
Littérature
- Brooks, F. T. (1928). Observations sur Rhynchosporium secalis (Oud.) Davis, tache foliaire de l'orge et du seigle. New Phytologist, 27(4), 215-219.
- Fowler, A. M., & Owen, H. (1971). Etudes sur la tache foliaire de l'orge (Rhynchosporium secalis). Transactions de la Société Mycologique Britannique, 56(1), 137-152.
- Zhan, J., Fitt, B. D., Pinnschmidt, H. O., Oxley, S. J. P. et Newton, A. C. (2008). Résistance, épidémiologie et gestion durable des populations de Rhynchosporium secalis sur l'orge. Pathologie végétale, 57(1), 1-14.
Tache de la ramulariose
Agent pathogène
Ramularia collo-cygniL'agent responsable de la tache foliaire de la Ramularia sur l'orge se propage principalement par reproduction asexuée via les conidies, qui ont besoin d'humidité pour germer et se développer rapidement. Après la germination à la surface de la feuille, le champignon pénètre dans la feuille par les stomates et colonise les tissus de manière intercellulaire. Les plants d'orge infectés peuvent ne présenter aucun symptôme au départ, mais les dégâts apparaissent généralement après la floraison.
Le cycle de vie de R. collo-cygni n'est pas entièrement comprise, mais elle implique une transmission verticale par le biais de semences infectées, ce qui permet à l'agent pathogène de survivre entre les saisons de croissance. Les conidies en suspension dans l'air contribuent également à la propagation secondaire, en déclenchant de nouvelles infections dans des conditions favorables. Si les semences constituent le principal mécanisme d'hivernage, le rôle des hôtes alternatifs et d'une structure fongique secondaire appelée Asteromella reste incertaine et fait encore l'objet d'études.
Symptômes

Les symptômes apparaissent sur les deux faces des feuilles après la floraison en général, mais sont plus fréquents sur les feuilles supérieures. Les premiers symptômes se présentent sous la forme de taches jaunes à brunes sur les nervures des feuilles, entourées d'un halo chlorotique. Une fois les taches apparues, la feuille devient chlorotique et nécrosée, généralement à partir de l'extrémité et des bords de la feuille. Les taches voisines peuvent se rejoindre, créant des zones sombres plus larges. De petites taches punctiformes peuvent également être observées. Bien que les symptômes de la Ramularia puissent être confondus avec ceux d'autres maladies, la caractéristique principale est que les taches foliaires sont délimitées aux nervures des feuilles.
Il existe ce que l'on appelle les 5R pour distinguer les taches foliaires de la ramulariose :
- Annelé d'une marge jaune de chlorose
- Forme rectangulaire
- Limité par les nervures de la feuille
- Coloration brun-rouge
- Jusqu'au bout de la feuille
FieldClimate Modèle
Modèle Ramularia
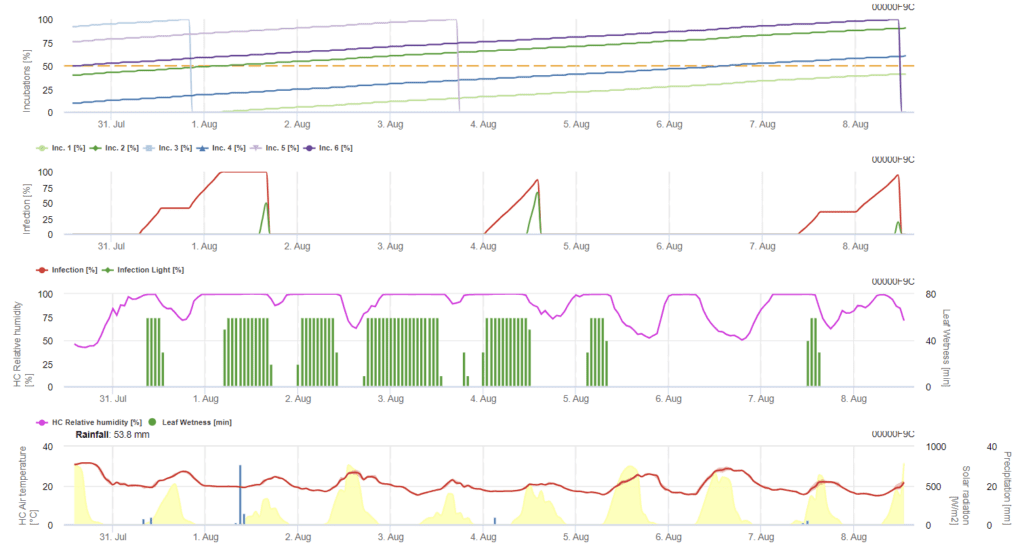
L'infection de l'orge par la Ramularia est principalement due à des conditions humides. Nous commençons donc le calcul par un événement pluvieux, suivi d'une humidité foliaire ou d'une humidité relative supérieure à 85%.
L'infection est décrite de deux manières :
- Infection : lorsque les conditions d'humidité ne font que favoriser l'apparition d'une infection
- Infection : une fois lorsque le rayonnement global est nécessaire pour terminer un événement d'infection.
Ensuite, lorsque l'infection atteint 100%, le modèle commence à déterminer le temps d'incubation. Lorsque l'incubation atteint 50%, il est recommandé de contrôler le champ à la recherche de nouveaux inoculums et lorsqu'elle atteint 100%, des lésions nécrotiques sur les feuilles sont prévues.
Littérature
- Havis, N. D., Brown, J. K., Clemente, G., Frei, P., Jedryczka, M., Kaczmarek, J., ... & Hess, M. (2015). Ramularia collo-cygni-un pathogène émergent des cultures d'orge. Phytopathologie, 105(7), 895-904.
- Huss, H. (2002, avril). La biologie de Ramularia collo-cygni. In Proc. Second Int. Workshop Barley Leaf Blights. Alep, Syrie (pp. 321-328).
- Walters, D. R., Havis, N. D., & Oxley, S. J. (2008). Ramularia collo-cygni : la biologie d'un pathogène émergent de l'orge. Lettres de microbiologie FEMS, 279(1), 1-7. https://grdc.com.au/__data/assets/pdf_file/0025/443509/GRDC_FS2103_Ramularia_03.pdf
Rhizoctonia solani
Agent pathogène
Le rhizoctone des racines du blé est causé par Rhizoctonia solani. Le pathogène peut survivre pendant de nombreuses années dans le sol sous forme de sclérotes. Dans certains cas, il survit également sous forme de mycélium sur des débris végétaux. Dès que la température augmente, les sclérotes deviennent actifs et génèrent une masse d'hyphes, permettant l'infection en s'attachant aux racines. Le mycélium produit ce que l'on appelle des "coussins d'infection" et le champignon envahit et colonise le tissu racinaire. L'infection des racines affaiblit les plantules, entraînant une faible croissance, et réduit la capacité de transport de l'eau et des nutriments vers les tissus supérieurs de la plante, ce qui conduit finalement à la mort de la plante.
Symptômes
Très tôt, des zones dénudées apparaissent, dont la taille varie de quelques centimètres à plusieurs mètres de diamètre. Ces taches dénudées sont souvent associées à des plantes rabougries qui peuvent présenter un jaunissement, un flétrissement ou même une coloration pourpre. Les plantes infectées peuvent être gravement rabougries et présenter des signes de stress dû à la sécheresse ou de carence en nutriments, ce qui peut entraîner une mort prématurée dans certains cas.
Des lésions brun rougeâtre se développent sur les tiges et les racines sous la ligne du sol, et ces lésions s'enfoncent au fur et à mesure que la maladie progresse. La pourriture des racines peut réduire la nodulation et rendre le cortex des racines facilement cassable, ce qui donne des pointes de lance brunes.
Modèle FieldClimate
Modèle de risque pour Rhizoctonia solani
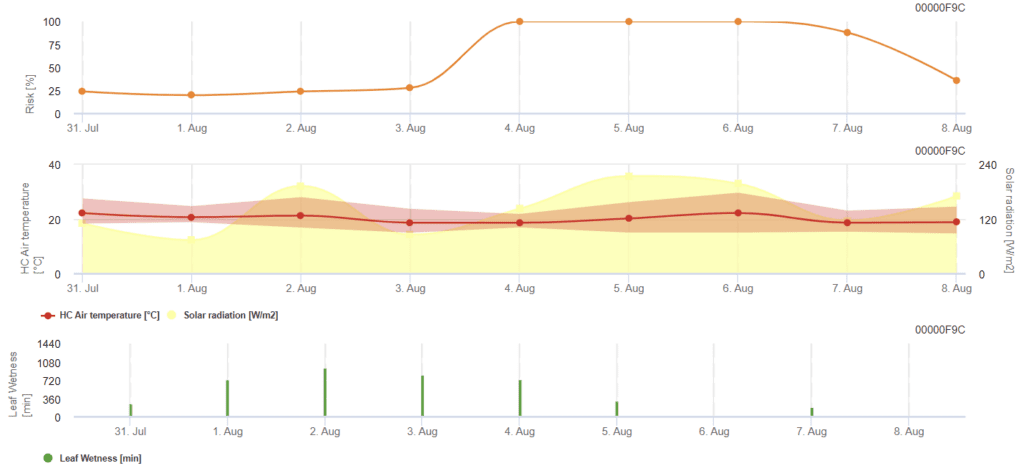
Capteurs nécessaires :
- Température de l'air
- Rayonnement solaire
- Humidité des feuilles
Le modèle calcule les périodes de risque de Rhizoctonia solani en vérifiant les conditions des 120 dernières heures. Il en résulte une valeur de risque de 0 à 100, indiquant des conditions favorables à la maladie.
Aucune pulvérisation n'est nécessaire lorsque le risque est faible. En période de risque modéré, l'intervalle entre les pulvérisations peut être prolongé, et en période de risque élevé, il peut être nécessaire de le réduire ou de recommander l'utilisation d'un composé plus efficace.
En cas de mouillage consécutif des feuilles, il accumule des valeurs dépendant de la température pour chaque minute :
- 12 °C à 15 °C : accumulation de 1 par minute
- 16 °C à 17 °C : accumulation de 2 par minute
- 18°C et plus : accumulation de 4 par minute
À la fin des périodes d'humectation des feuilles, il évalue les valeurs accumulées :
- Valeurs > 4096 : Le risque augmente de 64 points et la soustraction de 4096 à la valeur
- Valeurs résiduelles > 2048 : le risque augmente de 16 points et la valeur est soustraite de 2048.
- Valeurs résiduelles >1024 : Le risque augmente de 4 et on soustrait 1024 de la valeur.
Si le rayonnement global est consécutivement supérieur à 800 W/m², il accumule le temps en minutes et évalue les valeurs lorsque le rayonnement diminue :
- Valeur > 512 : Risque - 32 points, valeur - 512
- Valeur > 256 : Risque - 8 points, valeur - 256
- Valeur > 128 : Risque - 2 points, valeur - 128
Littérature
- https://cropprotectionnetwork.org/encyclopedia/rhizoctonia-root-rot-of-wheat#:~:text=It%20is%20caused%20by%20Rhizoctonia,result%20in%20premature%20plant%20death.
- https://ahdb.org.uk/knowledge-library/rhizoctonia-stunt-symptoms-and-risk-in-cereals
- https://cropwatch.unl.edu/rhizoctonia-root-rot#:~:text=Disease%20Symptoms&text=These%20reddish%20brown%20lesions%20may,uneven%20because%20of%20stunted%20plants.
- https://extensionaus.com.au/FieldCropDiseasesVic/docs/identification-management-of-field-crop-diseases-in-victoria/soil-borne-diseases/rhizoctonia-root-rot/
- https://www.florimond-desprez.com/es/wp-content/uploads/sites/6/2015/11/rhizoctonia_eng.pdf
Oïdium
Agent pathogène
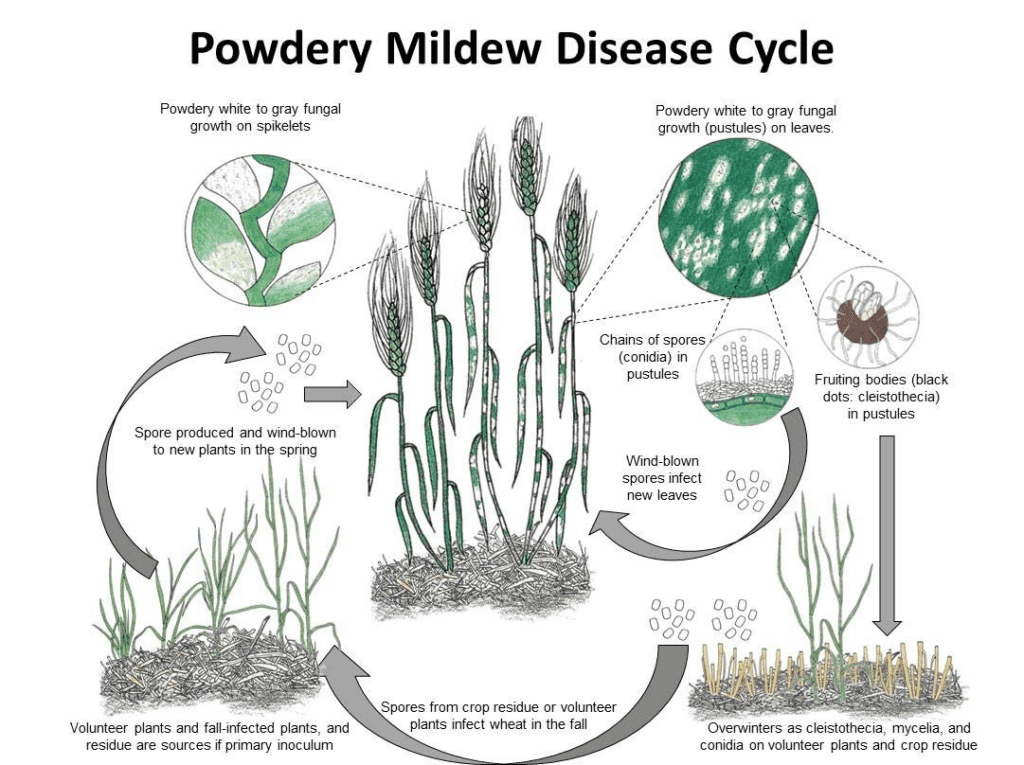
Blumeria graminis est l'agent pathogène de l'oïdium du blé et de l'orge. Il peut passer l'hiver sous forme de mycéliums ou de cleistothèces. Au printemps, les spores germent et infectent les plantes hôtes dans des conditions fraîches et humides, sans avoir besoin d'eau à la surface des plantes.
Le champignon se reproduit à la fois de manière asexuée et sexuée.
Dans le cycle asexué, l'agent pathogène subit des cycles rapides d'infection et de production de conidies (spores asexuées), qui sont essentiels à la propagation de la maladie. Les conidies sont produites dans le mycélium tous les 7 à 10 jours dans des conditions favorables. Une fois dispersées par le vent, ces conidies atterrissent sur un nouvel hôte, germent et forment des appressoria et des haustoria pour extraire les nutriments de la plante. Les conidies de Blumeria graminis peuvent germer même à faible humidité et à différentes températures.
Au cours du cycle sexuel, le champignon produit des cleistothèces, des structures robustes qui peuvent survivre à des conditions défavorables. Les cleistothèces contiennent des ascospores (spores sexuelles) et de nouvelles infections sont déclenchées lorsque ces spores sont libérées.
Symptômes

L'oïdium du blé et de l'orge affecte le rendement en réduisant le nombre d'épis et en diminuant la taille et le poids des grains. Plus l'infection est précoce, plus les dégâts sont importants.
L'orge présente une résistance à l'oïdium liée à l'âge. À mesure que l'orge mûrit, au lieu des taches de mycélium typiques, des taches brun-noir bien définies ("tar-spot") peuvent apparaître sur les feuilles.
Le blé est particulièrement sensible à l'oïdium entre la période de tallage et la période de maturation du lait, surtout lorsque les feuilles étendard et les enveloppes sont touchées. Cependant, comparé à l'orge, le blé peut mieux tolérer les infections précoces.
L'oïdium blanc-grisâtre se développe sur les feuilles, les tiges et les têtes. La croissance fongique est plus importante sur la face supérieure des feuilles, mais elle peut aussi se développer sur la face inférieure. Au début, les pustules semblent blanches, mais elles deviennent progressivement grises à brunes au fur et à mesure qu'elles mûrissent et peuvent fusionner, formant des masses plus importantes souvent entourées de chlorose. Sur la face opposée des feuilles infectées, les tissus jaunissent, puis deviennent bronzés ou bruns. Cleistothecia sont également visibles, sous forme de petits points ronds et noirs à l'intérieur de colonies grises plus anciennes. Dans les cas les plus graves, les feuilles peuvent mourir.
Modèle FieldClimate
Modèle d'oïdium du blé
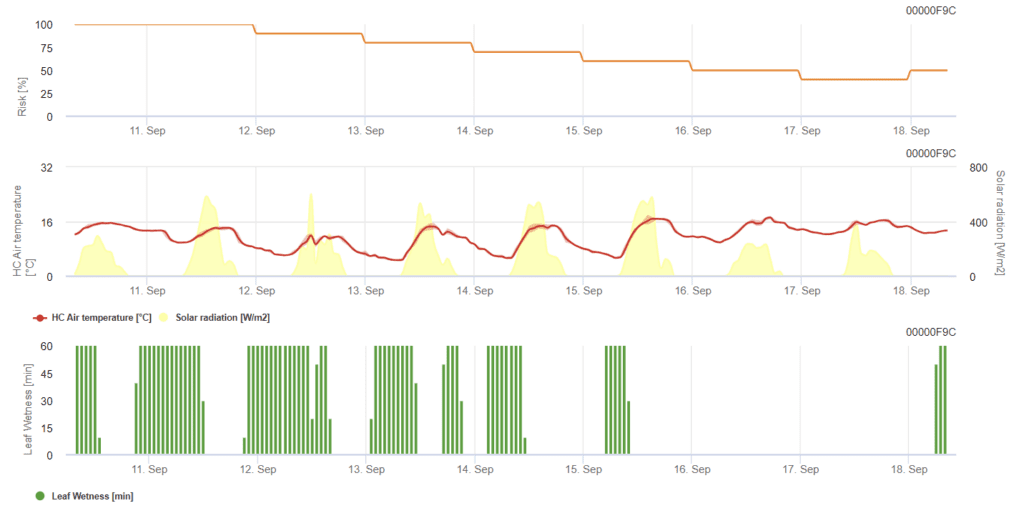
Capteurs nécessaires :
- Température de l'air
- Humidité des feuilles
- Rayonnement solaire
Le modèle détermine le risque d'oïdium sur une échelle allant de 0 (pas d'infection) à 100% (infection totale). Il est pertinent pendant le stade BBCH de 21 à 39 pour l'orge et de 21 à 75 pour le blé et l'avoine.
Le stade BBCH est une échelle de croissance qui décrit le développement des plantes. Elle comporte deux chiffres et s'étend de 00 à 99 - 00 correspond au traitement des semences et 99 au traitement post-récolte. Le premier chiffre indique le stade spécifique de développement : 0 correspond à la germination, 1 au développement des feuilles, 2 au labourage, 3 à l'élongation de la tige, 4 à l'enracinement, 5 à l'émergence de l'inflorescence et à l'épiaison, 6 à la floraison et à l'anthèse, 7 au développement des fruits, 8 à la maturation et 9 à la sénescence.
- BBCH 21 : tallage - Début du tallage ; première talle détectable.
- BBCH 39 : Élongation de la tige - stade de la feuille étendard ; feuille étendard complètement déroulée et ligule à peine visible.
- BBCH 75 : Développement du fruit - lait moyen ; teneur en grains laiteux et les grains atteignent leur taille finale mais sont encore verts.
Le risque augmente lorsque les températures sont comprises entre 12 °C et 21 °C pendant la plupart des heures de la journée et que le rayonnement global est faible. En revanche, l'humidité des feuilles, un rayonnement global élevé et des températures supérieures à 32°C diminuent le risque.
Littérature
- Both, M. et Spanu, P. D. (2004). Blumeria graminis f. sp. hordei, un pathogène obligatoire de l'orge. Revue annuelle des plantes, 11, 202-218.
- Cunfer, B. M. (2002). L'oïdium. Blé panifiable : amélioration et production, 30, 317-330.
- Der Gräser, E. M. Krankheiten und Schädlinge des Getreides. Lancashire, P. D., Bleiholder, H., Boom, T. V. D., Langelüddeke, P., Stauss, R., Weber, E., & Witzenberger, A. (1991). Un code décimal uniforme pour les stades de croissance des plantes cultivées et des mauvaises herbes. Annales de biologie appliquée, 119(3), 561-601. https://ohioline.osu.edu/factsheet/plpath-cer-11
Rouille brune
Agent pathogène
Il existe trois types de rouille et d'agents pathogènes importants :
- Feuille/ Rouille brune : Puccinia triticina
- Tige/ Rouille noire : Puccinia graminis
- Rayure/ Rouille jaune : Puccinia striiformis
La rouille brune est la maladie de la rouille du blé la plus courante. La rouille noire est également connue sous le nom de rouille d'été en raison du développement abondant de téleutospores noires et brillantes. C'est la maladie de la rouille la plus dévastatrice, causant 50 % des pertes en un mois dans des conditions favorables. La rouille jaune est une maladie du blé dans les climats plus froids, généralement associée à des altitudes plus élevées et à des latitudes plus septentrionales. Elle se caractérise par des urédospores de couleur jaune. Elle peut également causer des dégâts aussi importants que la rouille noire dans les cas les plus graves.
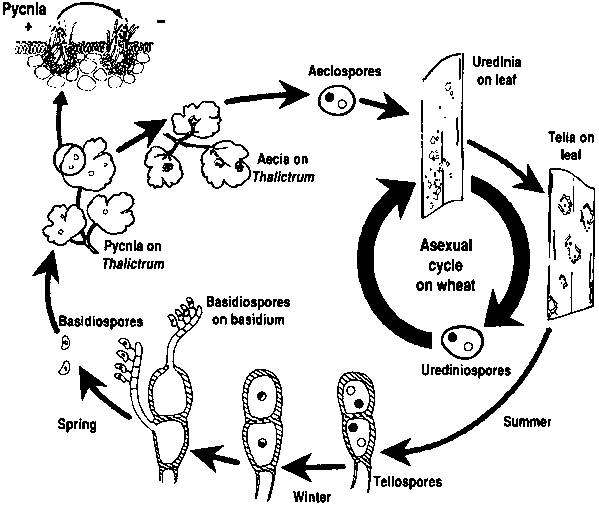
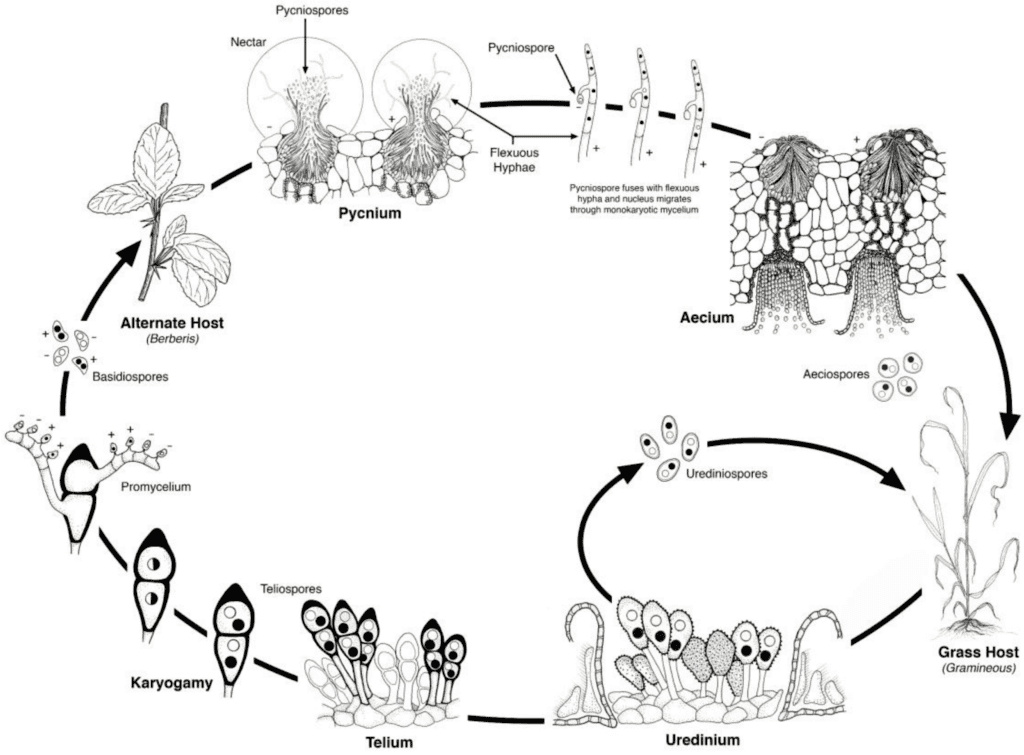
Les pathogènes de la rouille du blé subissent des cycles de reproduction asexués et sexués et ont besoin de deux plantes hôtes - un hôte économique et un hôte alternatif. L'hôte économique est le blé, et l'hôte alternatif est généralement une mauvaise herbe ou une plante indigène, ce qui permet aux champignons de passer par la phase sexuelle. Puccinia striiformis n'a pas d'hôte alternatif connu, et se compose de stades urédinaux et téleutosporiens.
Dans le cycle asexué, les urédospores sont produites sur la plante hôte et peuvent continuer à l'infecter à plusieurs reprises, ce qui entraîne une infection rapide et généralisée dans des conditions favorables.
Le cycle sexuel du pathogène commence lorsque les téleutospores, formées lors d'infections urinaires sur la plante hôte, germent et subissent une méiose pour produire des basidiospores. Ces basidiospores sont dispersées vers un autre hôte, où elles déclenchent l'infection, ce qui entraîne la formation d'une pycnie contenant des pycniospores et des hyphes réceptives. La fécondation a lieu lorsque les pycniospores d'un type d'accouplement sont transférées à l'hôte opposé par l'intermédiaire du nectar. Après la fécondation, des cupules écidiennes se développent sur la face inférieure des feuilles de l'hôte alternatif, qui libèrent des écidiospores. Ces écidiospores sont dispersées et infectent de nouveaux hôtes, l'infection uréinienne suit, complétant le cycle de vie du pathogène.
Symptômes

A) Puccinia graminis
B) Puccinia striiformis
C) Puccinia triticina
Puccinia triticina
P. triticina infecte principalement le limbe des feuilles, mais peut occasionnellement affecter les gaines foliaires, les glumes et les aunes, en formant de petites taches jaunes sur la surface supérieure des feuilles. Ces taches se transforment en pustules de couleur orange entourées d'un halo jaune au fur et à mesure que la maladie progresse. Les pustules produisent des spores orange ou noires visibles sur les feuilles. Contrairement à la rouille noire, la maladie produit moins de téleutospores. Certaines taches hypersensibles ou urédines peuvent être entourées de zones chlorotiques ou nécrotiques.
Puccinia graminis
P. graminis vise principalement les tiges mais peut également infecter les feuilles, les gaines, les glumes, les awns et même les graines. Au début, des lésions brun rougeâtre apparaissent et, au fur et à mesure que la maladie progresse, des téleutospores noires se forment à l'intérieur des pustules. Des masses d'urédospores rouge-brique se développent d'abord sur les tiges et les gaines des feuilles et de petites taches chlorotiques apparaissent, qui se transforment en pustules linéaires ou en forme de losange qui peuvent s'étendre. À maturité, la production d'urédiniospores s'arrête et une couche de téleutospores noires est produite, ce qui donne aux tiges un aspect noirci en fin de saison. Dans les cas les plus graves, l'infection affaiblit les tiges de la plante et provoque la verse.
Puccinia striiformis
La caractéristique de la P. striiformis est la présence de pustules jaunes à faces droites. Les pustules apparaissent en bandes étroites et allongées de différentes longueurs, souvent accompagnées de chlorose et de nécrose. Au fur et à mesure que la maladie évolue, des spores jaune-orange se développent à l'intérieur des pustules et les tissus environnants brunissent et se dessèchent, donnant un aspect roussi.
Modèle FieldClimate
Modèle de rouille Puccinia
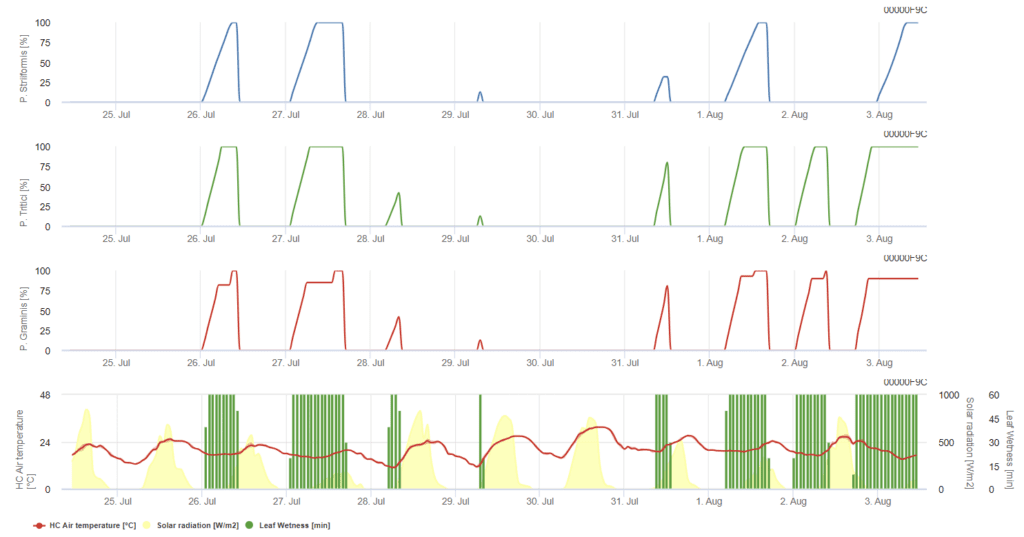
P. triticina, P. graminis, P. striiformis sont présentés dans trois graphiques de couleurs différentes.
Modèle d'infection par Puccinia triticna
Le modèle suppose que l'infection nécessite une température horaire cumulée de 90°C d'humidité foliaire dans une plage de température de l'air comprise entre 5°C et 30°C. Les conditions sont similaires à celles de la P. graminismais avec un seuil de température plus bas de 5°C.
En cas d'infection à 100%, une mesure phytosanitaire curative doit être envisagée. Si le risque est de 80% et que les prévisions météorologiques annoncent davantage de périodes d'humidité foliaire, des applications foliaires de protection peuvent être effectuées.
Humidité des feuilles pour des températures moyennes horaires cumulées de 90°C :
- (si T <= 22,5°C alors ∑(Th) sinon ∑ (22,5-(Th-22,5))
- 5°C < Temp. < 30°C
Modèle d'infection par Puccinia graminis
Les infections ont lieu après quelques heures d'humidité des feuilles dans des conditions de température optimales. Le modèle suppose que l'infection a besoin d'une température horaire cumulée de 80°C d'humidité foliaire dans une plage de température de l'air allant de 10°C à 35°C. Elle préfère une température un peu plus élevée que P. triticina et l'infection doit être suivie d'une exposition au soleil.
Lorsque l'infection par 100% est mise en évidence, les conditions ont été favorables au champignon et des mesures phytosanitaires doivent donc être envisagées.
Humidité des feuilles pour des températures horaires moyennes cumulées de 80°C, suivie d'une période de lumière (150 W/m²) pour des températures horaires moyennes cumulées de 30°C :
- (si T <= 24°C alors ∑(Th) sinon ∑ (Th-24))
- 10°C < Temp. < 35°C
Modèle d'infection par Puccinia striiformis
Puccinia striiformis est la rouille du blé des climats frais dont la température optimale se situe déjà à partir de 15°C. Les infections ont lieu après quelques heures d'humidité des feuilles dans des conditions de température optimales. Le modèle suppose que l'infection nécessite une température horaire cumulée de 80°C d'humidité foliaire dans une plage de température de l'air de 5°C à 20°C. Il n'y a pas d'infection pendant les périodes de faible intensité lumineuse.
Avant que le graphique n'atteigne 100%, une application protectrice pourrait être effectuée, tandis qu'après, des stratégies de protection curative (systémique) devraient être envisagées.
Humidité des feuilles et lumière pour des températures moyennes horaires cumulées de 80°C :
- (si T <= 15°C alors ∑(Th) sinon ∑ (Th-15))
- 5°C < Temp. < 20°C
Littérature
- Bolton, M. D., Kolmer, J. A. et Garvin, D. F. (2008). Rouille foliaire du blé causée par Puccinia triticina. Pathologie végétale moléculaire, 9(5), 563-575.
- Chen, X. M. (2005). Épidémiologie et lutte contre la rouille jaune [Puccinia striiformis f. sp. tritici] sur le blé. Revue canadienne de pathologie végétale, 27(3), 314-337.
- Figueroa, M., Hammond-Kosack, K. E., & Solomon, P. S. (2018). Une revue des maladies du blé - une perspective de terrain. Pathologie végétale moléculaire, 19(6), 1523-1536.
- Guide, A. Maladies de la rouille des feuilles, de la tige et de la raie du blé. Leonard, K. J., & Szabo, L. J. (2005). Rouille de la tige des petites céréales et des graminées causée par Puccinia graminis. Pathologie végétale moléculaire, 6(2), 99-111.
- Kolmer, J. (2013). Rouille foliaire du blé : biologie du pathogène, variation et résistance de l'hôte. Forêts, 4(1), 70-84.
- Singh, R. P., Huerta-Espino, J., Roelfs, A. P. et Curtis, B. C. (2002). Les rouilles du blé. Croissance, 2(25), 35.
Équipement recommandé
Vérifiez quel jeu de capteurs est nécessaire pour surveiller les maladies potentielles de cette culture.
