
Pszenica modele choroby
Podmuch pszenicy
Patogen
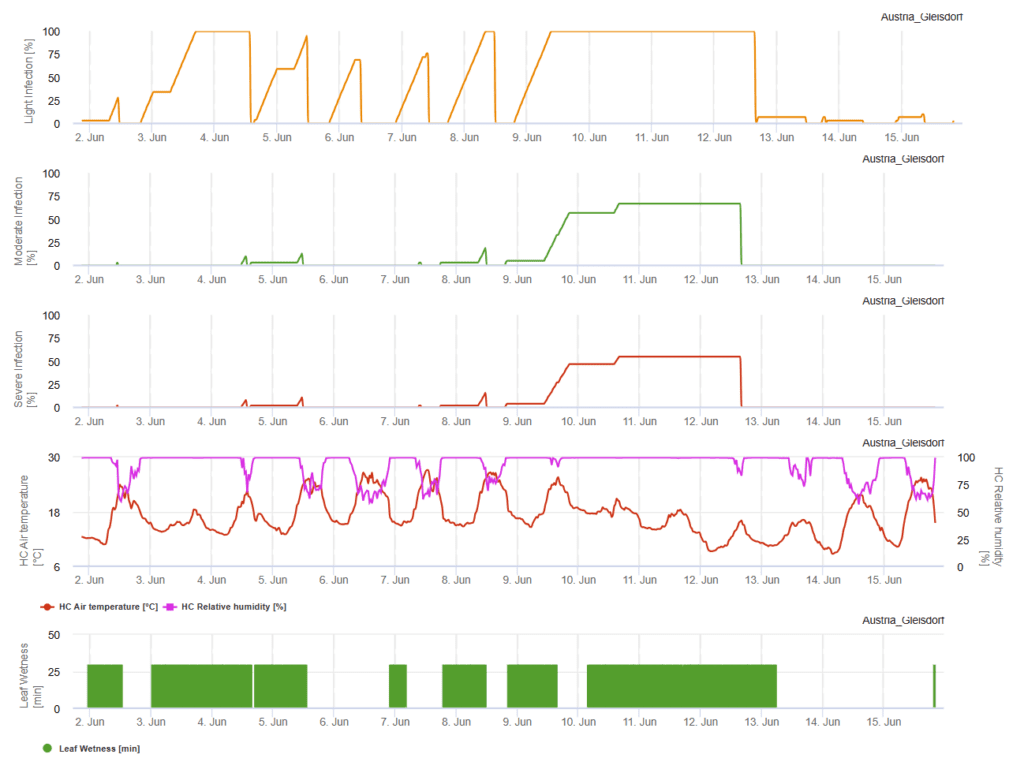
Pyricularia grisea, znany również jako Magnaporthe oryzaejest patogenem grzybowym odpowiedzialnym za zgniliznę twardzikową pszenicy, istotną chorobę dotykającą uprawy pszenicy. Patogen rozmnaża się głównie bezpłciowo poprzez konidia (bezpłciowe zarodniki), które służą jako główne inokulum do inicjowania infekcji. Konidia te są wytwarzane na konidioforach i są rozpraszane przez wiatr, deszcz i środki mechaniczne, takie jak sprzęt rolniczy. Po wylądowaniu na podatnym żywicielu pszenicy, konidia kiełkują i tworzą appressoria - wyspecjalizowane struktury, które ułatwiają penetrację tkanki roślinnej. Po dostaniu się do środka, grzyb kolonizuje komórki gospodarza, prowadząc do rozwoju choroby. Warunki środowiskowe odgrywają kluczową rolę w procesie infekcji P. grisea. Grzyb rozwija się w ciepłym, wilgotnym klimacie, z temperaturami w zakresie od 15°C do 30°C i wydłużonymi okresami zwilżenia liści lub wysokiej wilgotności względnej. Ciągła wilgotność liści przez co najmniej 14 godzin jest niezbędna do zainicjowania infekcji, co sprawia, że nadmierne zachmurzenie, wysoka wilgotność, nadmierne nawadnianie i nieprawidłowe nawadnianie sprzyjają rozwojowi choroby. Ponadto czynniki stresowe, takie jak susza, zagęszczenie gleby, niska wysokość koszenia i nadmierne nawożenie azotem mogą nasilać nasilenie choroby.
Symptomy
Początkowe objawy zarazy pszenicy objawiają się jako nasiąknięte wodą zmiany w kształcie rombu na liściach, które później stają się szare w miarę postępu choroby. Zmiany te mogą się rozszerzać i łączyć, prowadząc do rozległej zarazy liści i nekrozy. Zainfekowane kłosy wykazują częściowe lub całkowite bielenie, często rozpoczynające się od czarno-szarego punktu infekcji na koniuszku lub podstawie kłosów. Przy wysokim ciśnieniu inokulum, na jednym kłosie może wystąpić wiele punktów infekcji, co powoduje znaczne straty w plonach. Oprócz objawów dolistnych, P. grisea może infekować inne nadziemne części roślin pszenicy, w tym węzły i szyjki, prowadząc do zgnilizny szyjki lub zgnilizny węzłów. Może to powodować pękanie porażonych części, co skutkuje wyleganiem i dalszym spadkiem plonów. Zdolność patogenu do infekowania różnych części rośliny przez cały sezon wegetacyjny czyni go szczególnie niszczycielskim, zwłaszcza w sprzyjających warunkach środowiskowych.
Model FieldClimate
Potrzebne czujniki:
- Temperatura powietrza
- Wilgotność względna
- Wilgotność liści
Pochmurne niebo, wilgotne warunki i mżawki sprzyjają rozwojowi i nasileniu choroby. W FieldClimate obliczamy trzy klasy nasilenia, a po osiągnięciu 100% infekcji na polu panują optymalne warunki dla patogenu grzybowego. W zależności od odmiany, należy wziąć pod uwagę pomiary leczniczej ochrony roślin, gdy lekka, umiarkowana lub ciężka infekcja osiągnęła 100%.
Literatura
- Cruz, C. D., & Valent, B. (2017). Podmuchowa choroba pszenicy: niebezpieczeństwo w ruchu. Tropical Plant Pathology, 42(3), 210-222.
- Islam, M. T., Croll, D., Gladieux, P., Soanes, D. M., Persoons, A., Bhattacharjee, P., ... & Talbot, N. J. (2016). Pojawienie się zarazy pszenicy w Bangladeszu było spowodowane przez południowoamerykańską linię Magnaporthe oryzae. BMC Biology, 14(1), 84.
Pyrenophora teres
Patogen
Pyrenophora teres (Drechslera teres) występuje w dwóch formach - P. teres f. teres oraz P. teres f. maculata które wywołują odpowiednio plamistość siatkową i plamistość punktową.
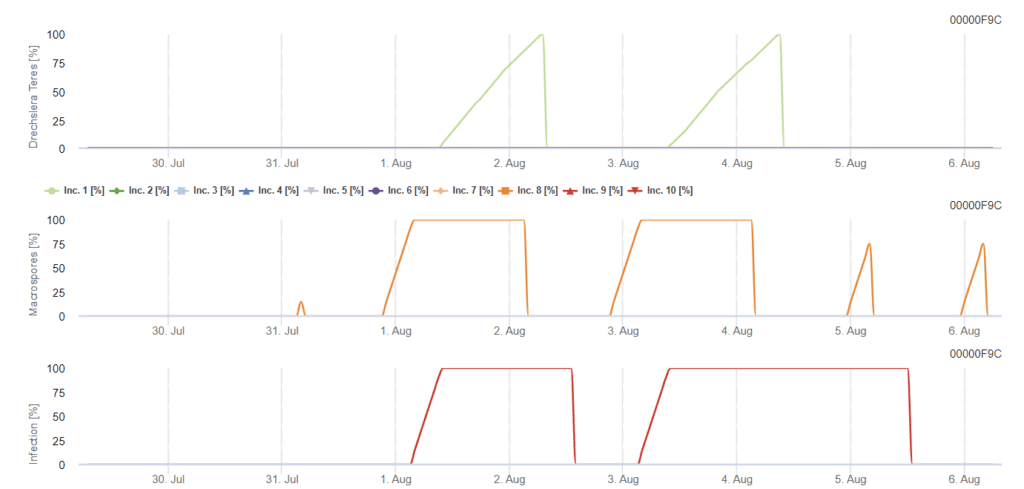
Askospory uwalniane z pseudotecji infekują pozostałości, inicjując pierwotną infekcję. W niektórych przypadkach pierwotnym inokulum są również grzybnie i konidia przenoszone przez nasiona. Zarodniki kiełkują na liściach i penetrują zewnętrzną ścianę komórkową naskórka, dzięki czemu patogen może rozwijać się w dużym pęcherzyku wewnątrzkomórkowym. Następnie następuje etap bezpłciowy, podczas którego wytwarzane są konidia i wywołują wtórną infekcję, zwiększając nasilenie choroby. Pod koniec sezonu wegetacyjnego patogen wytwarza pseudotecja, które pozostają na zainfekowanych resztkach jęczmienia.
Symptomy
Objawy pojawiają się na liściach, łodygach i ziarnach, a choroba postępuje od dołu do góry roślin. Starsze rośliny zwykle doświadczają mniej poważnych uszkodzeń, ponieważ mają grubszą skórkę, która zapobiega przenikaniu patogenów i większą zdolność do wytwarzania związków przeciwgrzybiczych. Patogeny wytwarzają toksyny, które są odpowiedzialne za objawy, przyczyniając się do martwicy i chlorozy lub zakłócając równowagę wodną na poziomie komórkowym.
W przypadku plamistości siatkowej objawy pojawiają się jako wąskie, ciemnobrązowe, podłużne zmiany. Na odmianach wysoce odpornych pojawi się tylko kilka małych zmian przypominających kropki, bez wyraźnego wzoru przypominającego siatkę. W przeciwieństwie do tego, większość podatnych odmian może wykazywać chlorotyczne lub nasiąknięte wodą obszary otaczające nekrotyczne zmiany.
W przypadku plamistości objawy składają się z ciemnobrązowych, okrągłych lub eliptycznych zmian, które często otoczone są chlorotyczną lub nekrotyczną otoczką o różnej szerokości. U mniej podatnych odmian zmiany są zazwyczaj mniejsze i mogą być pozbawione otaczającej chlorotycznej otoczki.
Ciężkie infekcje mogą prowadzić do całkowitego obumarcia liści, powodując ich wysuszenie. Zazwyczaj najpierw więdną starsze liście, a następnie młodsze.
Model FieldClimate
Drechslera teres Model
Potrzebne czujniki:
- Temperatura powietrza
- Wilgotność względna
- Wilgotność liści
- Opady
Inokulum pierwotne rozwija się w optymalnych temperaturach od 15°C do 25°C, z optimum w 20°C. Warunki powyżej 6 godzin ciemności prowadzą do optymalnego wzrostu konidiów, co widać na wykresie sporulacji konidiów. Jeśli wykres sporulacji osiągnie 100%, optymalne warunki są ustalone w terenie.
Dalsze rozprzestrzenianie odbywa się za pośrednictwem wiatru lub deszczu. Infekcja tkanek roślinnych wymaga wilgotnych warunków, takich jak zwilżenie liści lub wysoka wilgotność względna przez około 10 do 30 godzin przy optymalnych temperaturach 15°C i 25°C, jak pokazano na wykresie infekcji. Gdy osiągnie 100%, określa się, że zmierzono optymalne warunki dla infekcji w terenie. Światło słoneczne może również zwiększać wzrost konidoforów, które wytwarzają konidia w zmienionych warunkach wilgotnych i suchych okresów z wysokim promieniowaniem słonecznym i niską wilgotnością względną, a wiatr sprzyja rozwojowi choroby.
Literatura
- Backes, A., Guerriero, G., Ait Barka, E., & Jacquard, C. (2021). Pyrenophora teres: taksonomia, morfologia, interakcja z jęczmieniem i sposób zwalczania. Frontiers in plant science, 12, 614951.
- Liu, Z., Ellwood, S. R., Oliver, R. P., & Friesen, T. L. (2011). Pyrenophora teres: profil coraz bardziej szkodliwego patogenu jęczmienia. Molekularna patologia roślin, 12(1), 1-19.
- Obst, A., & Paul, VH (1993). Choroby i szkodniki zbóż, Verlag Th. Mann, Gelsenkirchen-Buer.
Take-all
Patogen
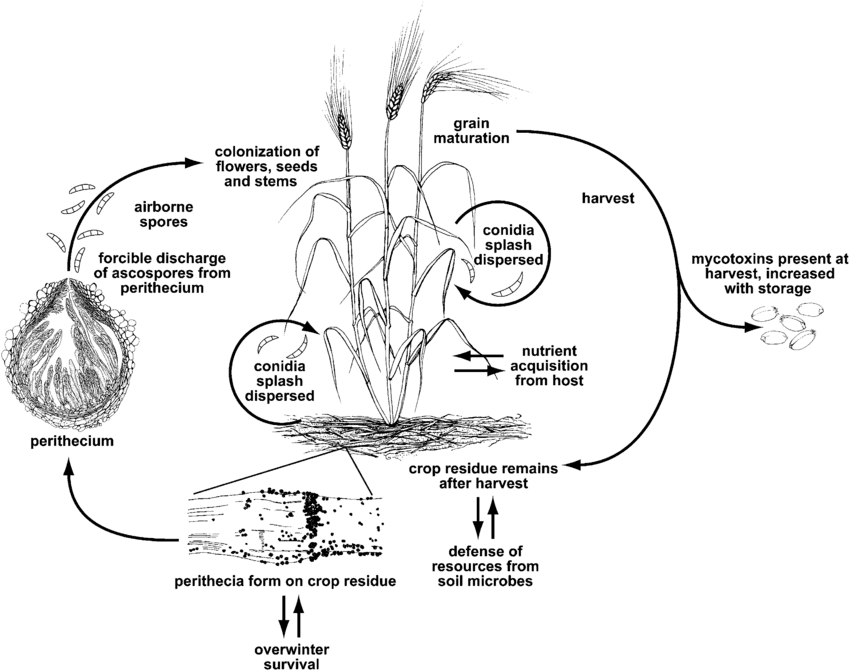
Choroba "Take-all", wywoływana przez Gaeumannomyces graminisjest jedną z najbardziej niszczycielskich chorób zbóż. Nazwa pochodzi od rolników z południowej Australii, ponieważ choroba jest tak szkodliwa, że nie pozostawia ziarna do zbioru. Patogen uszkadza system korzeniowy i łodygę, powodując niedobór wody i składników odżywczych, co ostatecznie prowadzi do śmierci rośliny.
Grzyb przeżywa jako grzybnia w saprofitycznych resztkach pożniwnych, a jego fragmenty znajdujące się w glebie mogą być przenoszone przez wiatr, wodę i zwierzęta. Pierwotna infekcja następuje po kontakcie korzeni sadzonek z zainfekowanymi odpadkami, po czym następuje wzrost i ekspansja strzępek. Przenikając przez naskórek korzenia i atakując korę korzenia, kolonizuje i niszczy tkanki. Infekcja postępuje w górę i w dół. Wtórna infekcja odbywa się poprzez kontakt między korzeniami, a silnie zainfekowane rośliny występują w postaci plam.
Symptomy
Choroba take-all w pszenicy zazwyczaj występuje w fazie siewek i krzewienia, powodując objawy przy powierzchni gleby. Zainfekowane rośliny mogą stać się skarłowaciałe, z żółknącymi liśćmi i przedwcześnie dojrzewającymi kłosami, które nie mają w pełni rozwiniętych ziaren. Okrągłe martwe plamy, o wielkości od kilku centymetrów do metrów, często mają żółto-pomarańczowe lub brązowe brzegi i mogą pojawiać się ponownie na tym samym obszarze w kolejnych latach.
Kluczowe objawy obejmują bielone białe lub puste pędy, poczerniałe podstawy łodyg i ciemne, gnijące korzenie z małymi czarnymi zmianami, które się rozszerzają. Poważnie uszkodzone korzenie są kruche, a na podstawie łodygi może pojawić się błyszczące czarne przebarwienie. Rośliny można łatwo wyrwać z gleby ze względu na ich osłabiony system korzeniowy. Choroba może przypominać stres suszy, ponieważ zakłóca przepływ wody do górnych części rośliny, powodując przedwczesne więdnięcie.
Model FieldClimate
Take-all
Model Czujniki:
- Temperatura gleby
Model ryzyka take-all wykorzystuje długość dnia i temperaturę gleby do określenia okresów ryzyka. Dni z mniej niż 13 godzinami nasłonecznienia i temperaturą gleby między 10°C a 20°C sprzyjają rozwojowi choroby.
Gdy wartość ryzyka osiąga 100%, na polu panują optymalne warunki dla rozwoju patogenu. Najważniejszą strategią ochrony jest płodozmian z co najmniej 2-3-letnimi odstępami między podatnymi zbożami.
Literatura
- Cook, R. J. (2003). Take-all of wheat. Fizjologiczna i molekularna patologia roślin, 62(2), 73-86.
- Palma-Guerrero, J., Chancellor, T., Spong, J., Canning, G., Hammond, J., McMillan, V. E., & Hammond-Kosack, K. E. (2021). Choroba Take-all: nowe spojrzenie na ważny patogen korzeni pszenicy. Trends in Plant Science, 26(8), 836-848. https://www.apsnet.org/edcenter/disandpath/fungalasco/pdlessons/Pages/Takeall.aspx
Fusarium head blight
Patogen
Fusarium head blight lub parch jest wywoływany przez rodzaj Fusarium. Najpopularniejszym gatunkiem jest Fusarium graminearum ale najbardziej rozpowszechnione gatunki mogą się różnić w zależności od regionu.
F. graminearum może infekować rośliny pszenicy na każdym etapie wzrostu. Przetrwa zimę na zainfekowanych resztkach pożniwnych, a wiosną dochodzi do pierwotnej infekcji, gdy askospory z perytecjów i konidiów są rozpraszane na kiełkach lub pylnikach pszenicy. Zainfekowane kwiatostany wytwarzają pomarszczone lub zwiędłe ziarniaki, często określane jako ziarniaki "nagrobne". Nawet jeśli ziarna wyglądają na nienaruszone, nadal mogą być zanieczyszczone mikotoksynami. Wtórna infekcja następuje poprzez konidia, ale epidemie pszenicy zależą głównie od ilości pierwotnego inokulum, a nie od źródeł wtórnych.
Fusarium head blight prowadzi również do akumulacji szkodliwych mikotoksyn w uprawach, stanowiąc potencjalne zagrożenie dla zwierząt. Mikotoksyny te wyłączają mechanizmy obronne roślin lub chronią grzyby przed innymi organizmami. Główną toksyną jest deoksyniwalenol (DON), który hamuje syntezę białek, zakłócając normalne funkcjonowanie komórek. Ludzie, którzy spożyli pszenicę zawierającą DON, doświadczają objawów takich jak nudności, gorączka lub wymioty.
Symptomy

W przypadku pszenicy i durum każda część lub cała główka może być bielona. Częściowo białe i zielone główki są charakterystyczne dla choroby pszenicy. Grzyb może również infekować łodygi, powodując brązowe lub fioletowe przebarwienia. W wilgotnych warunkach na zainfekowanych kłosach i źdźbłach często widoczne są masy zarodników w kolorze od różowego do łososiowo-pomarańczowego. Wiele ziaren jest pomarszczonych i lekkich i czasami nazywane są "nagrobkami" ze względu na ich kredowy, pozbawiony życia wygląd. W sprzyjających warunkach infekcja może rozprzestrzenić się na sąsiednie kłoski i zainfekować cały kłos, w tym rachis i szypułkę. Jądra mogą mieć matowy wygląd i różowe przebarwienia w normalnym rozmiarze, gdy infekcja wystąpiła na późnym etapie rozwoju.
U jęczmienia zainfekowane kłoski bielą się i wyglądają na nasiąknięte wodą. Jądra mogą również wykazywać przebarwienia, a czasami łososiowo-pomarańczowe masy zarodników mogą być widoczne na kłoskach i źdźbłach w wilgotnych warunkach.
Modele FieldClimate
Szacunkowe poziomy FHB na polu opierają się na liczbie porażonych główek lub ziaren. Kolorowa skala wizualna do szacowania nasilenia FHB w pszenicy jest dostępna w NDSU Extension Service (publikacja PP-1095): https://library.ndsu.edu/ir/bitstream/handle/10365/9187/PP1095_1998.pdf?sequence=1&isAllowed=y.
Model zakażenia zarazą głowową Fusarium (ryzyko wystąpienia zarazy głowowej Fusarium)
Potrzebne czujniki:
- Temperatura powietrza
- Wilgotność względna
- Wilgotność liści
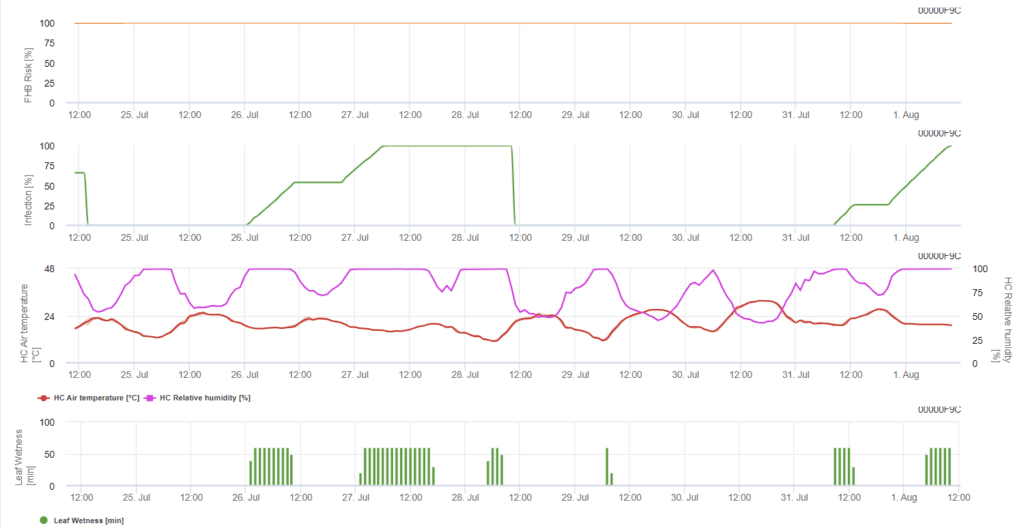
Model określa ryzykowne okresy infekcji. W przypadku infekcji 100% ryzyko jest bardzo wysokie, a warunki dla grzyba sprzyjają infekcji. Wiedza rolnika na temat etapu rozwoju różnych odmian pszenicy daje możliwość podjęcia decyzji o zastosowaniu oprysku leczniczego natychmiast po infekcji.
Czynnikom grzybiczym wywołującym Fusarium Head Blight na pszenicy sprzyjają ciepłe temperatury od 20°C do 30°C i długie okresy wilgotności. Kilkudniowe okresy zwilżenia liści prowadzą do wczesnych widocznych objawów. Objawy można również zaobserwować po długim okresie utajenia, jeśli po infekcji nastąpi okres zwilżenia liści trwający 18 godzin lub nawet krótszy oraz po sztucznym zaszczepieniu w temperaturze 15°C.
Podsumowując wszystkie różne kombinacje temperatur i wilgotności, które znaleźliśmy w literaturze, zdecydowaliśmy się wskazać infekcje Fusarium Head blight, jeśli temperatura i okres wilgotności liści lub okresy o wilgotności względnej większej niż 85% przekraczają wartości przedstawione na poniższym wykresie. Obliczenie wartości postępu jest zgodne z zależnością między czasem trwania wilgotnych warunków a temperaturą.
Model ostrzeżenia o mikotoksynach Fusarium (Fusarium Head Blight)
Potrzebne czujniki:
- Temperatura powietrza
- Wilgotność względna
- Wilgotność liści
- Opady
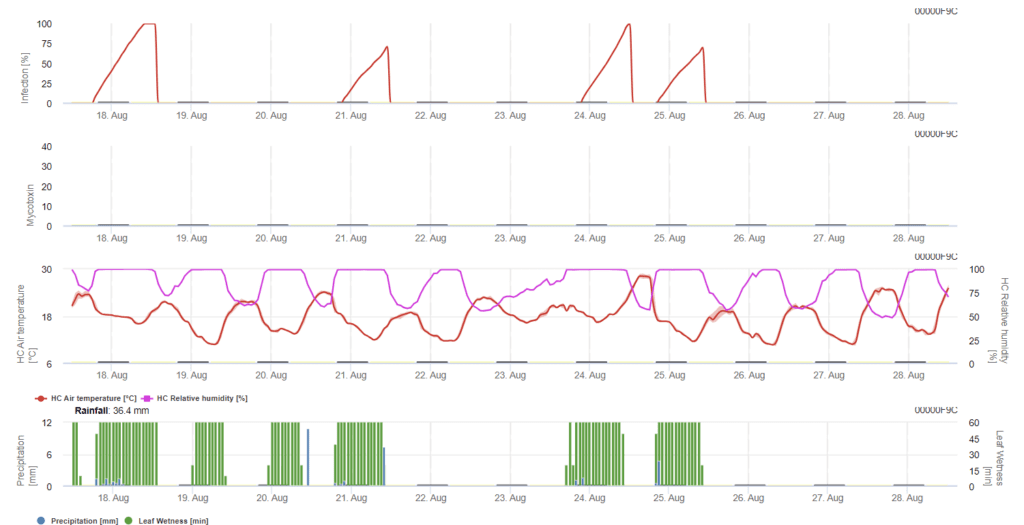
W tym modelu infekcja FHB jest obliczana na podstawie opadów (potrzebne 2mm), wilgotności względnej (powyżej 85%) lub wilgotności liści, temperatury podczas procesu. Jeśli infekcja osiągnie 100% optymalne warunki dla patogenu zostały osiągnięte. Dalej model oblicza ryzyko wystąpienia mikotoksyn w FHB.
Próby infekcji z wydłużonymi okresami zwilżenia liści przez Fusarium head blight prowadzą do wysokiej zawartości mikotoksyn. Na podstawie tych informacji przyjmuje się, że okres zwilżenia liści wynoszący 48 godzin lub więcej w stadiach 61 i 69 stwarza wysokie ryzyko mikotoksyn.
Doświadczenia poczynione podczas analizy DON w pszenicy uprawianej komercyjnie wykazały, że okresy zwilżenia liści wystarczająco długie dla infekcji po początkowej infekcji w stadiach 61-69 mogą zwiększyć wartości DON. W przypadku dłuższych okresów zwilżenia liści poziom mikotoksyn może wzrosnąć do stadium 85.
- Stadium 61 BBCH: Początek kwitnienia; widoczne pierwsze pylniki
- Stadium BBCH 69: Koniec kwitnienia; wszystkie kłoski zakończyły kwitnienie, ale mogą pozostać odwodnione pylniki.
- BBCH etap 85: W połowie dojrzewania; miękkie ciasto z miękkim, ale suchym ziarnem, brak odcisku paznokcia
Model kumuluje wartość ryzyka proporcjonalną do postępu infekcji dla każdego udanego okresu infekcji w wybranym okresie obliczeń. Sześć zakończonych infekcji prowadziłoby do ryzyka 100%. Zwykle okres wilgotności liści prowadzący do infekcji fuzarium jest dłuższy niż wymagane minimum. Dlatego większość infekcji fusarium prowadzi do wzrostu ryzyka o więcej niż 17%.
Wartość ryzyka mikotoksyn zależy od historii pola. Pszenica uprawiana po pszenicy nieuprawianej może nieść ze sobą niewielkie ryzyko tylko wtedy, gdy nie jest opryskiwana w optymalnej sytuacji. W przypadku pszenicy nieopryskiwanej musimy spodziewać się zwiększonych wartości DON po 35% ryzyka. Pszenica po pszenicy nieuprawianej po jakiejkolwiek innej uprawie może nieść ze sobą wyższe ryzyko 50%. Jeśli mamy pszenicę po pszenicy z uprawą, ryzyko może wzrosnąć do 70%. Pszenica w pierwszym roku powinna zostać przetestowana na obecność DON, jeśli ryzyko osiągnie 100%.
Literatura
- https://www.fao.org/4/y4011e/y4011e0j.htm
- https://scabusa.org/pdfs/NDSU_PP-804_FHB-Small-Grains.pdf
- Lancashire, P. D., Bleiholder, H., Boom, T. V. D., Langelüddeke, P., Stauss, R., Weber, E., & Witzenberger, A. (1991). Jednolity kod dziesiętny dla stadiów wzrostu roślin uprawnych i chwastów. Annals of applied Biology, 119(3), 561-601.
- Trail, F. (2009). Na fale zarazy zbożowej: Fusarium graminearum w erze postgenomiki. Fizjologia roślin, 149(1), 103-110.
- Schumann, G. L. (2010). Instruktor zdrowia roślin| Tom: 10| Rok: 2010| Typ artykułu: Plany lekcji. Zdrowie roślin, 10.
Jęczmienny pasek
Patogen
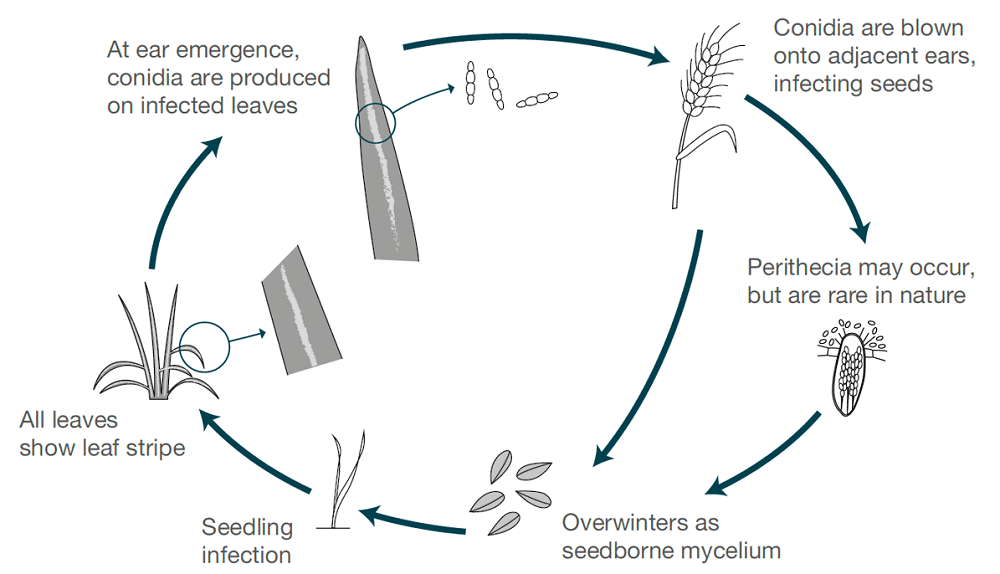
Pasiastość jęczmienia jest powodowana przez Pyrenophora graminea (Drechslera graminea), patogen przenoszony przez nasiona, który przeżywa w naskórku zainfekowanych nasion. Grzyb infekuje sadzonki w chłodnych i wilgotnych warunkach. Grzyb rośnie systemicznie w roślinie, infekuje całą roślinę, wytwarza toksyny, zabija komórki i odbarwia tkankę liścia między żyłkami, powodując w ten sposób pasiaste zmiany. Pasiastość jest bardziej rozpowszechniona w jęczmieniu ozimym niż w jęczmieniu jarym.
Gdy warunki są mokre lub wilgotne, zarodniki są wytwarzane na powierzchni liści, gdy zdrowe pędy roślin kwitną. Zarodniki są rozpraszane przez wiatr na rozwijające się kłosy, kiełkują i powodują infekcje. Jądra są najbardziej podatne podczas wczesnego rozwoju. W każdym sezonie występuje tylko jeden cykl infekcji i produkcji zarodników.
Symptomy

Objawy są najbardziej widoczne na etapie pojawienia się ucha.
Bladozielone do żółtych paski pojawiają się początkowo w dolnej części liścia i pochewki liścia. Paski te stopniowo stają się brązowe do ciemnobrązowych, po czym następuje zasychanie i rozszczepienie blaszki liściowej. Rozszerzają się na całą długość liścia, stają się nekrotyczne i łączą się, ostatecznie prowadząc do śmierci rośliny.
Rośliny mogą wydawać się skarłowaciałe, wytwarzać niewiele kłosów, a w ciężkich przypadkach nie wytwarzać główek ani nasion. Długość kłosa może być również zmniejszona z powodu słabo rozwiniętych brązowych ziaren.
Model FieldClimate
Pyrenophora graminea Model
Potrzebne czujniki:
- Temperatura powietrza
- Wilgotność względna
- Wilgotność liści
- Opady
Model składa się z dwóch etapów. Pierwszy etap to ryzykowne okresy podczas okresów awaryjnych rośliny, wczesne stadia. Drugi etap przypada na okres kwitnienia i rozwoju główki jęczmienia. Kiedy infekcja osiąga 100%, na polu zostały stworzone optymalne warunki dla grzyba, aby zainfekować tkanki roślinne i systematycznie w nich rosnąć.
Literatura
- Richardson, M. J. (1996). Mikologia nasion. Mycological Research, 100(4), 385-392. https://ahdb.org.uk/knowledge-library/barley-leaf-stripe-life-cycle-and-disease-symptoms https://plantwiseplusknowledgebank.org/doi/full/10.1079/pwkb.species.46115
Septoria
Patogen
Istnieją dwie główne choroby Septoria w pszenicy - Septoria tritici plamistość spowodowana przez Septoria tritici i Septoria nodorum plamistość spowodowana przez Septoria nodorum.
Septoria tritici przeżywa na zainfekowanych resztkach pożniwnych latem i zaczyna infekować rośliny pszenicy jesienią. Grzyb rozwija się w chłodnych i wilgotnych warunkach. Ma dwa etapy - fazę utajoną i fazę nekrotyczną. W fazie utajonej grzyb inokuluje nowe tkanki roślinne i poprzez wnikanie przez aparaty szparkowe następuje kolonizacja, w wyniku której rozwija się międzykomórkowo w tkankach roślinnych. S. tritici nie wymaga żadnych fizycznych struktur żerowania, a raczej odżywia się poprzez ekstrakcję składników odżywczych z komórek gospodarza, które utraciły integralność strukturalną. Rośliny mogą wykazywać nadwrażliwość, a w odpowiedzi na infekcję na zaatakowanych tkankach mogą pojawić się nekrotyczne zmiany.
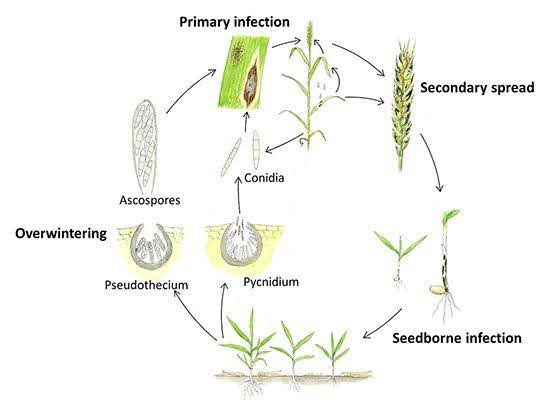
Septoria nodorum przetrwa lato w postaci uśpionych grzybni, piknidiów i pseudotecjów na resztkach pożniwnych. Infekcja zwykle rozpoczyna się jesienią, kiedy piknidiospory z piknidiów i askospory z pseudotecjów są rozpraszane przez wiatr i deszcz, inicjując infekcję pierwotną. Zarodniki te penetrują kutikulę liści, a po infekcji następuje formowanie piknidiów. Wtórna infekcja występuje, gdy piknidiozy są wytwarzane i rozpraszane z dolnych liści do górnych liści i kiełków. Patogen wytwarza również toksyny, które przyczyniają się do rozwoju choroby.
Symptomy
Septoria tritici plamistość
Jesienią, Septoria tritici Objawy początkowo pojawiają się jako małe żółte plamki na liściach, zawierające drobne czarne plamki, które są owocnikami grzyba. Zmiany mają nieregularny kształt, od eliptycznego do długiego i wąskiego, powiększają się, a w miarę dojrzewania stają się brązowe do czerwonawo-brązowych. Choroba zwykle rozpoczyna się na dolnych liściach i stopniowo przesuwa się w górę, ostatecznie atakując liść flagowy. W wilgotnych warunkach grzyb może rozprzestrzeniać się na główki pszenicy, powodując brązowe zmiany na źdźbłach i kłosach, znane jako plamistość źdźbłowa. Septoria tritici może być mylona z innymi chorobami pszenicy. Jednak obecność czarnych ciałek grzyba jest kluczową cechą S. tritici. Chociaż Septoria nodorum może również wytwarzać brązowe owocniki w wilgotnych warunkach, różnią się one kolorem i rozmiarem. Septoria tritici owocniki są większe.
Septoria nodorum blotch
Septoria nodorum Objawy pojawiają się najpierw głównie na górnych liściach. Początkowo na liściach pojawiają się ciemnobrązowe plamy z żółtą otoczką. Innym początkowym objawem jest oparzenie końcówek liści. Zmiany rozszerzają się i stają się nekrotyczne z ciemnobrązowym środkiem w miarę dojrzewania. Wewnątrz zmian widoczne są małe ciemnobrązowe struktury, które są owocnikami. Konidia uwalniane z owocników wyglądają jak białe lub różowe masy. Silnie zainfekowane liście mogą być całkowicie pokryte zmianami chorobowymi, co ostatecznie prowadzi do obumarcia tkanki liścia. Grzyb może również atakować źdźbła i szypułki: pojawiają się podobne brązowe zmiany, a choroba postępuje w dół.
Model FieldClimate
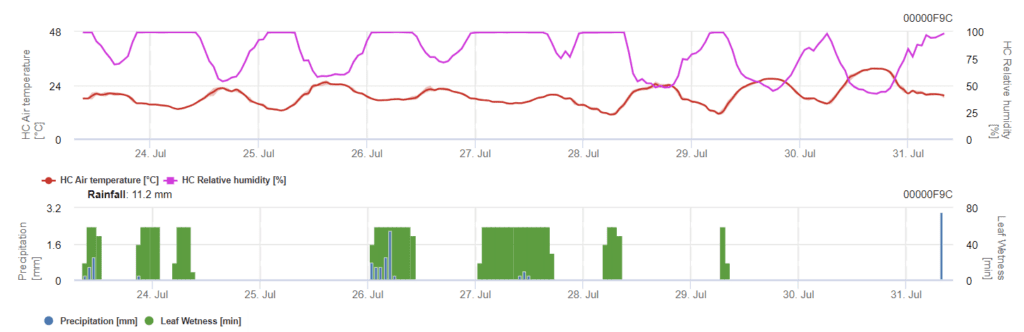
Infekcje Septoria są możliwe w niskich temperaturach, podczas gdy temperatury poniżej 7°C mogą nie doprowadzić do infekcji w ciągu 2 dni. Optymalna temperatura dla choroby jest osiągana w zakresie od 16 do 21°C. Infekcje są możliwe w okresie wysokiej wilgotności względnej lub zwilżenia liści przez 14 godzin lub dłużej.
Septoria tritici Model
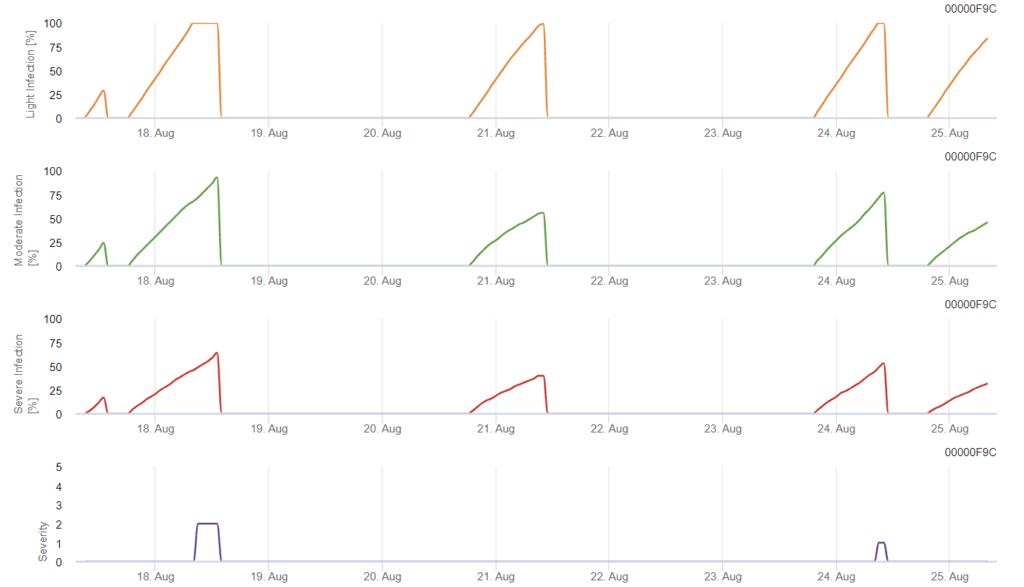
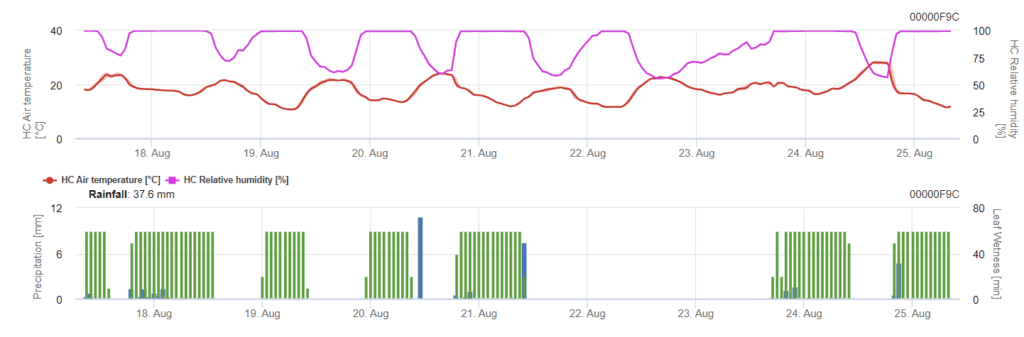
Infekcja rozpoczyna się po deszczu 0,5 mm. Optymalne temperatury dla infekcji Septoria to około 16°C do 21°C i wilgotność liści lub wysoka wilgotność względna przez 14 godzin. Septoria tritici jest obliczana w trzech klasach nasilenia. Ponadto określamy poziomy nasilenia, które pomagają w ocenie presji infekcji między stadiami BBCH od 10 do 32 pszenicy.
- Stadium BBCH 10: Rozwój liści; pierwszy liść przez koleoptyl
- Stadium BBCH 32: Wydłużenie łodygi; węzeł 2 co najmniej 2 cm powyżej węzła 1
- BBCH etap 51: Pojawienie się kwiatostanu i główkowanie; początek główkowania z wierzchołkiem kwiatostanu wyłonionym z osłonki i widocznym pierwszym kłoskiem.
Zdecydowaliśmy się nie używać modelu do tworzenia piknidiów. Założono, że warunkiem koniecznym do powstania piknidii jest okres z wilgotnością względną wyższą niż 85%. Żywotność piknidiów wynosi 24 godziny. We wszystkich klimatach, w których grzyb ma szansę na infekcję, znajdziemy dwie godziny spełniające ten warunek prawie każdego dnia o wschodzie słońca.
Ocena ciężkości zakażenia
Aby ocenić Septoria tritici ciśnienie infekcji między stadiami 10 i 32 oraz między 32 i 51, musimy ocenić nasilenie infekcji w oparciu o warunki klimatyczne. Nasilenie infekcji ocenia się w skali od 1 do 5:
- 1: słaba infekcja z deszczem poniżej 5 mm
- 2: słaba infekcja z deszczem powyżej 5 mm
- 3: umiarkowana infekcja z deszczem poniżej 5 mm
- 4: umiarkowana infekcja przy opadach deszczu powyżej 5 mm / ciężka infekcja przy opadach deszczu poniżej 5 mm
- 5: ciężka infekcja z deszczem powyżej 5 mm
Ocena ciśnienia choroby
Istnieją trzy czynniki wpływające na presję choroby na polu - klimat, historia pola i podatność uprawianej odmiany. Jeśli możemy skumulować wartości nasilenia choroby od stadium 10 do stadium 32 do wartości 4, możemy spodziewać się słabej presji choroby ze strony klimatu. Jeśli wartość ta osiągnie 6, możemy spodziewać się umiarkowanej presji choroby, a jeśli osiągnie 10, wyższej presji choroby ze strony klimatu.
Znajomość podatności odmiany i historii pola doprowadzi nas do oprysku lub nie w przypadku słabej lub umiarkowanej presji choroby w danej sytuacji. Skumulowana wartość 10 może i tak prowadzić do oprysku w stadium 32.
Decyzja o oprysku na późniejszym etapie zależy od wiosennego klimatu. Jeśli możemy skumulować wartości nasilenia od etapu 10 do wartości 6, możemy spodziewać się słabej presji choroby. Jeśli wartość ta osiągnie 10, możemy spodziewać się umiarkowanej presji choroby, a jeśli wartość ta osiągnie 15, możemy spodziewać się wysokiej presji choroby wynikającej z sytuacji klimatycznej.
W FieldClimate Septoria tritici wraz z trzema różnymi stopniami nasilenia infekcji. Ze względu na opady deszczu i długie okresy zwilżenia liści, warunki dla ciężkiej infekcji przez S. tritici zostały spełnione. Poziomy nasilenia osiągają najwyższą wartość 5, co oznacza, że istnieje wysokie ryzyko infekcji.
Septoria nodorum Model
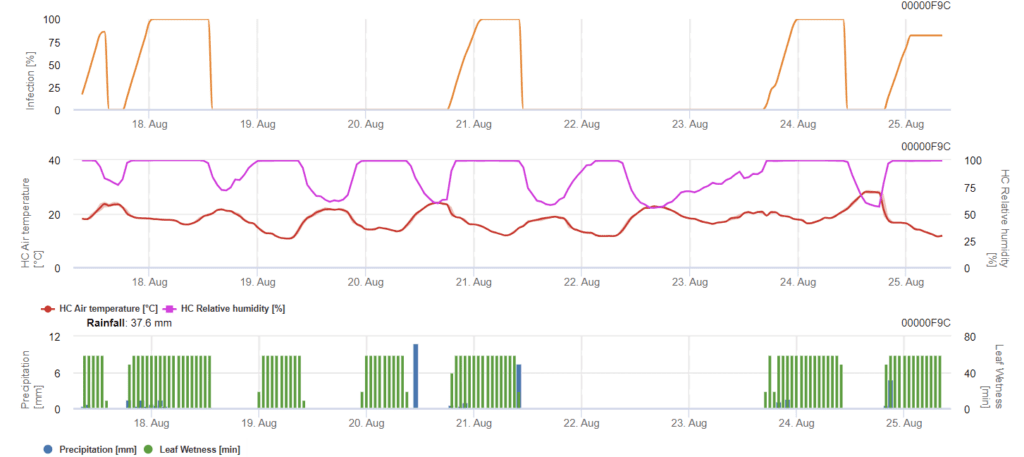
Septoria nodorumBiologia infekcji różni się do pewnego stopnia od Septoria tritici ale różnica nie jest wystarczająco duża, aby stworzyć oddzielny model. Dlatego sugerujemy stosowanie modelu tritici dla całego kompleksu chorób Septoria. Na obszarach o wysokiej presji S. nodorumInfekcje sklasyfikowane jako słabe z wartością dotkliwości 2 powinny być traktowane poważniej niż w innych obszarach.
Na stronie Septoria nodorum model oblicza ryzyko wystąpienia choroby. Pomiary ochrony roślin należy rozważyć, jeśli ryzyko osiągnie 80%. Gdy ryzyko wynosi 100%, a infekcja jest już określona, należy wykonać systemiczne pomiary ochrony roślin (zastosowania lecznicze).
Literatura
- Brennan, C. J., Benbow, H. R., Mullins, E., & Doohan, F. M. (2019). Przegląd znanych niewiadomych we wczesnych stadiach choroby plamistości pszenicy wywołanej przez Septoria tritici. Patologia roślin, 68(8), 1427-1438.
- De Wolf, E. D. (2008). Septoria tritici blotch. Mehra, L. K., Adhikari, U., Ojiambo, P. S., & Cowger, C. (2019). Septoria nodorum plamistość pszenicy. Instruktor zdrowia roślin.
- Solomon, P. S., Lowe, R. G., TAN, K. C., Waters, O. D., & Oliver, R. P. (2006). Stagonospora nodorum: przyczyna plamistości pszenicy wywołanej przez Stagonospora nodorum. Molekularna patologia roślin, 7(3), 147-156.
Plamistość liści
Patogen
Plamistość liści jest powodowana przez Rynchosporium secalis.
Pierwotna infekcja następuje przez askospory lub konidia na resztkach pożniwnych. Zarodniki te są rozpraszane przez wiatr i deszcz, kiełkują, a gdy komórki naskórka i mezofilu zapadają się po infekcji, objawy stają się widoczne. Wtórna infekcja jest powodowana przez konidia z zainfekowanych liści. W wilgotnych warunkach konidia kiełkują na powierzchni liścia i wytwarzają strzępki, które penetrują kutikulę bezpośrednio nad komórkami naskórka. Późniejszy wzrost grzyba ogranicza się do podskórnego obszaru naskórka.
Symptomy
R. secalis może zainfekować dowolną część liści. Kluczową cechą są plamy o nieregularnym kształcie, a infekcja rozpoczyna się od dołu do góry liści. Plamy początkowo pojawiają się jako obszary nasiąknięte wodą. W miarę postępu choroby stają się one szarawe w środku z powodu tworzenia się zarodników z brązowym brzegiem. Może wystąpić martwica i chloroza. Plamy łączą się, niszcząc całe liście.
Model FieldClimate
Model plamistości liści Rynchosporium
Potrzebne czujniki:
- Temperatura powietrza
- Wilgotność względna
- Wilgotność liści
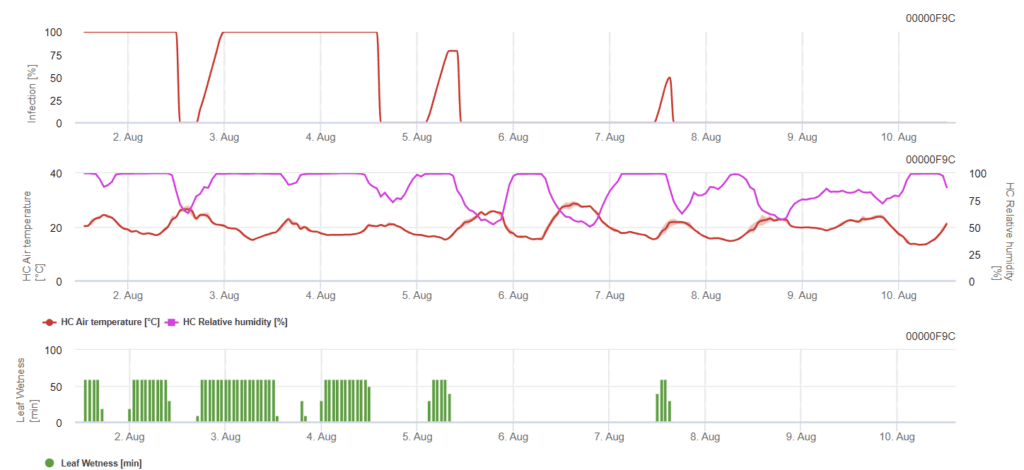
Aby doszło do infekcji, potrzeba co najmniej 7 do 15 godzin zwilżenia ołowiu, w zależności od temperatury (optymalna temperatura to 20'C). Gdy wykres osiągnie wartość 100%, oznacza to, że w terenie ustalono optymalne warunki.
Literatura
- Brooks, F. T. (1928). Obserwacje dotyczące Rhynchosporium secalis (Oud.) Davis, plamistości liści jęczmienia i żyta. New Phytologist, 27(4), 215-219.
- Fowler, A. M., & Owen, H. (1971). Badania nad plamistością liści jęczmienia (Rhynchosporium secalis). Transactions of the British Mycological Society, 56(1), 137-152.
- Zhan, J., Fitt, B. D., Pinnschmidt, H. O., Oxley, S. J. P., & Newton, A. C. (2008). Odporność, epidemiologia i zrównoważone zarządzanie populacjami Rhynchosporium secalis na jęczmieniu. Patologia roślin, 57(1), 1-14.
Ramularia plamistość liści
Patogen
Ramularia collo-cygniRamularia, czynnik sprawczy plamistości liści jęczmienia, rozprzestrzenia się głównie poprzez rozmnażanie bezpłciowe za pośrednictwem konidiów, które wymagają wilgoci do kiełkowania i wczesnego rozwoju. Po wykiełkowaniu na powierzchni liścia grzyb wnika do liścia przez aparaty szparkowe i kolonizuje tkankę międzykomórkowo. Zainfekowane rośliny jęczmienia mogą początkowo nie wykazywać żadnych objawów, ale uszkodzenia zwykle pojawiają się po kwitnieniu.
Cykl życia R. collo-cygni nie jest w pełni poznany, ale obejmuje pionową transmisję przez zainfekowane nasiona, umożliwiając patogenowi przetrwanie między sezonami wegetacyjnymi. Unoszące się w powietrzu konidia również przyczyniają się do wtórnego rozprzestrzeniania, inicjując nowe infekcje w sprzyjających warunkach. Podczas gdy nasiona są głównym mechanizmem zimowania, rola alternatywnych żywicieli i wtórnej struktury grzyba zwanej Asteromella pozostaje niepewna i jest nadal badana.
Symptomy

Objawy pojawiają się ogólnie po obu stronach liści po kwitnieniu, ale częściej występują na górnych liściach. Początkowe objawy pojawiają się w postaci żółtych do brązowych plam na żyłkach liści otoczonych chlorotyczną otoczką. Po pojawieniu się plam liść staje się chlorotyczny i nekrotyczny, zwykle zaczynając od końcówki liścia i brzegów. Sąsiednie plamy mogą się łączyć, tworząc większe ciemne obszary. Można również zaobserwować małe punkcikowate plamki. Chociaż objawy plamistości liści Ramularia mogą być mylone z innymi chorobami, kluczową cechą jest to, że plamy na liściach są ograniczone do żyłek liści.
Istnieje tak zwane 5R do rozróżniania plam na liściach Ramularia:
- Obwódka z żółtym marginesem chlorozy
- Prostokątny kształt
- Ograniczone przez żyłki liści
- Czerwonawo-brązowe zabarwienie
- Prosto przez liść
Model FieldClimate
Model Ramularia
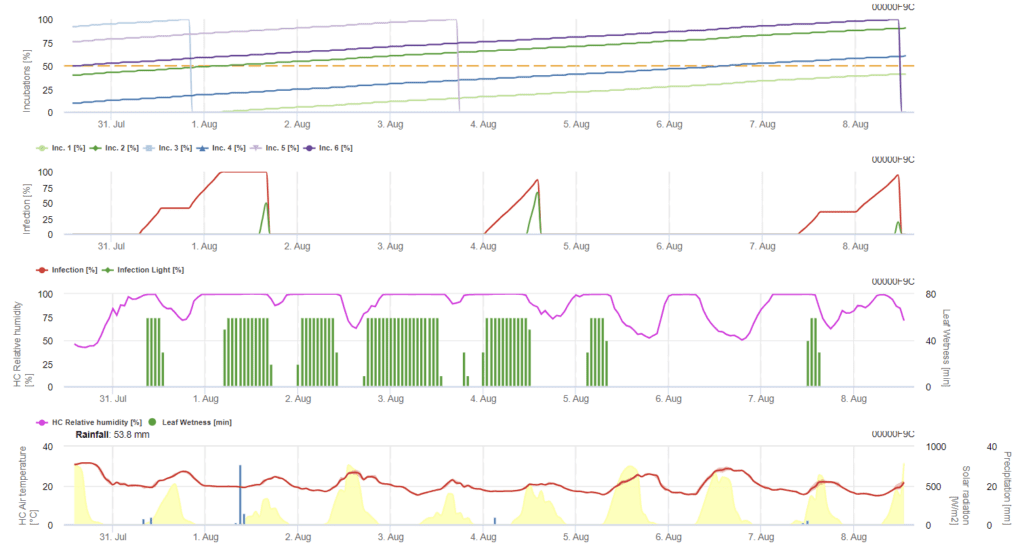
Infekcja Ramularia na jęczmieniu jest głównie spowodowana wilgotnymi warunkami. W związku z tym obliczenia rozpoczynamy od wystąpienia deszczu, a następnie wilgotności liści lub wilgotności względnej wyższej niż 85%.
Istnieją dwa opisane sposoby infekcji:
- Infekcja: gdy wilgotne warunki jedynie sprzyjają wystąpieniu infekcji
- Infekcja: raz, gdy do zakończenia infekcji potrzebne jest globalne promieniowanie.
Następnie, gdy infekcja osiągnie 100%, model zaczyna określać czas inkubacji. Gdy inkubacja osiągnie 50%, zaleca się kontrolowanie pola pod kątem nowego inokulum, a gdy osiągnie 100%, przewiduje się nekrotyczne zmiany na liściach.
Literatura
- Havis, N. D., Brown, J. K., Clemente, G., Frei, P., Jędryczka, M., Kaczmarek, J., ... & Hess, M. (2015). Ramularia collo-cygni - pojawiający się patogen upraw jęczmienia. Fitopatologia, 105(7), 895-904.
- Huss, H. (2002, kwiecień). Biologia Ramularia collo-cygni. In Proc. Second Int. Workshop Barley Leaf Blights. Aleppo, Syria (pp. 321-328).
- Walters, D. R., Havis, N. D., & Oxley, S. J. (2008). Ramularia collo-cygni: biologia pojawiającego się patogenu jęczmienia. FEMS Microbiology Letters, 279(1), 1-7. https://grdc.com.au/__data/assets/pdf_file/0025/443509/GRDC_FS2103_Ramularia_03.pdf
Rhizoctonia solani
Patogen
Zgnilizna korzeni Rhizoctonia w pszenicy jest powodowana przez Rhizoctonia solani. Patogen może przetrwać wiele lat w glebie w postaci przetrwalników. W niektórych przypadkach przeżywa również jako grzybnia na resztkach roślinnych. Gdy temperatura wzrasta, sklerocja stają się aktywne i wytwarzają masę strzępek, umożliwiając infekcję poprzez przyczepianie się do korzeni. Grzybnia wytwarza tak zwane "poduszki infekcyjne", a grzyb atakuje i kolonizuje tkankę korzenia. Infekcja korzeni osłabia sadzonki, powodując słaby wzrost i zmniejsza zdolność transportu wody i składników odżywczych do nadziemnych tkanek roślin, ostatecznie prowadząc do śmierci rośliny.
Symptomy
Na początku pojawiają się nagie plamy o średnicy od kilku centymetrów do kilku metrów. Te nagie plamy są często związane z karłowatymi roślinami, które mogą wykazywać żółknięcie, więdnięcie, a nawet fioletowe zabarwienie. Zainfekowane rośliny mogą być poważnie skarłowaciałe i wykazywać oznaki stresu suszy lub niedoboru składników odżywczych, co w niektórych przypadkach może prowadzić do przedwczesnej śmierci.
Czerwonawo-brązowe zmiany rozwijają się na łodygach i korzeniach poniżej linii gleby, a zmiany te zapadają się w miarę postępu choroby. Zgnilizna korzeni może ograniczać nodulację i powodować łatwe pękanie kory korzeniowej, co skutkuje brązowymi końcówkami włóczni.
Model FieldClimate
Model ryzyka Rhizoctonia solani
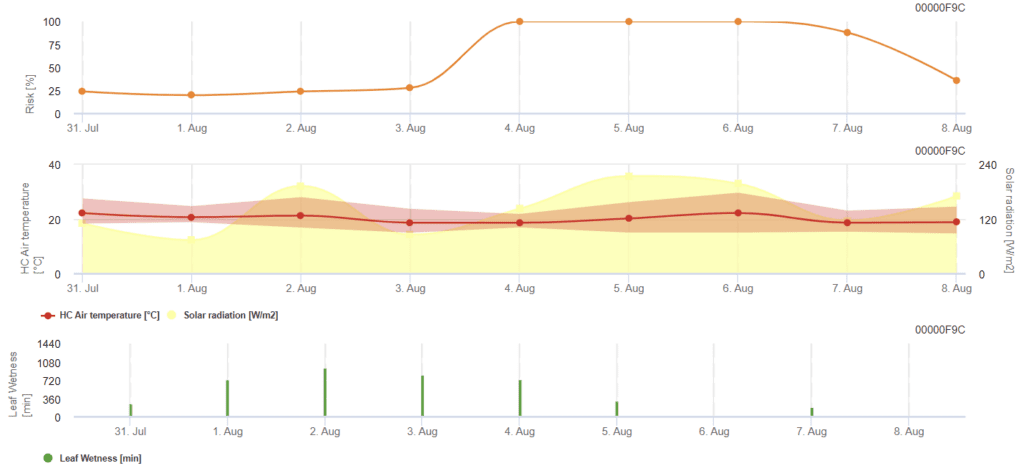
Potrzebne czujniki:
- Temperatura powietrza
- Promieniowanie słoneczne
- Wilgotność liści
Model oblicza ryzykowne okresy Rhizoctonia solani sprawdzając warunki z ostatnich 120 godzin. Wynikiem jest wartość ryzyka od 0 do 100, wskazująca na korzystne warunki dla choroby.
Opryski nie są potrzebne, gdy ryzyko jest niskie. W okresach umiarkowanego ryzyka odstępy między opryskami można wydłużyć, a w okresach wysokiego ryzyka może być konieczne ich skrócenie lub zalecane będzie bardziej skuteczne stosowanie związków chemicznych.
W przypadku kolejnego zwilżenia liści, gromadzi on wartości zależne od temperatury dla każdej minuty:
- 12°C do 15°C: akumulacja 1 na minutę
- 16 °C do 17 °C: akumulacja 2 na minutę
- 18°C i więcej: akumulacja 4 na minutę
Pod koniec okresów wilgotności liści ocenia skumulowane wartości:
- Wartości > 4096: Ryzyko wzrasta o 64 punkty i odjęcie 4096 od wartości
- Wartości pozostałości > 2048: Ryzyko wzrasta o 16 punktów i odejmuje 2048 od wartości.
- Wartości pozostałości >1024: Ryzyko wzrasta o 4 i odjęcie 1024 od wartości
Jeśli globalne promieniowanie jest kolejno wyższe niż 800 W/m², gromadzi czas w minutach i ocenia wartości, gdy promieniowanie spada:
- Wartość > 512: Ryzyko - 32 punkty, wartość - 512
- Wartość > 256: Ryzyko - 8 punktów, wartość - 256
- Wartość > 128: Ryzyko - 2 punkty, wartość - 128
Literatura
- https://cropprotectionnetwork.org/encyclopedia/rhizoctonia-root-rot-of-wheat#:~:text=It%20is%20caused%20by%20Rhizoctonia,result%20in%20premature%20plant%20death.
- https://ahdb.org.uk/knowledge-library/rhizoctonia-stunt-symptoms-and-risk-in-cereals
- https://cropwatch.unl.edu/rhizoctonia-root-rot#:~:text=Disease%20Symptoms&text=These%20reddish%20brown%20lesions%20may,uneven%20because%20of%20stunted%20plants.
- https://extensionaus.com.au/FieldCropDiseasesVic/docs/identification-management-of-field-crop-diseases-in-victoria/soil-borne-diseases/rhizoctonia-root-rot/
- https://www.florimond-desprez.com/es/wp-content/uploads/sites/6/2015/11/rhizoctonia_eng.pdf
Mączniak rzekomy
Patogen
Blumeria graminis jest patogenem mączniaka prawdziwego pszenicy i jęczmienia. Może zimować w postaci grzybni lub cleistothecia. Wiosną zarodniki kiełkują i infekują rośliny żywicielskie w chłodnych i wilgotnych warunkach, nie wymagając wolnej wody na powierzchni roślin.
Grzyb rozmnaża się zarówno bezpłciowo, jak i płciowo.
W cyklu bezpłciowym patogen przechodzi szybkie cykle infekcji i produkcji konidiów (bezpłciowych zarodników), które są kluczem do rozprzestrzeniania się choroby. W sprzyjających warunkach konidia są wytwarzane w grzybni co 7 do 10 dni. Po rozproszeniu przez wiatr, konidia te lądują na nowym żywicielu, kiełkują i tworzą appressoria i haustoria, aby wydobywać składniki odżywcze z rośliny. Konidia Blumeria graminis mogą kiełkować nawet przy niskiej wilgotności i w różnych temperaturach.
W cyklu płciowym grzyb wytwarza cleistothecia, odporne struktury, które mogą dobrze przetrwać niekorzystne warunki. Cleistothecia zawierają askospory (zarodniki płciowe), a nowe infekcje są inicjowane po uwolnieniu tych zarodników.
Symptomy

Mączniak prawdziwy w pszenicy i jęczmieniu wpływa na plon ziarna poprzez zmniejszenie liczby główek oraz zmniejszenie wielkości i masy ziarna. Im wcześniej dojdzie do infekcji, tym większe będą szkody.
Jęczmień wykazuje zależną od wieku odporność na mączniaka prawdziwego. W miarę dojrzewania jęczmienia, zamiast typowych plam grzybni, na liściach mogą pojawiać się ostro zarysowane, czarno-brązowe plamy ("smoliste plamy").
Pszenica jest szczególnie podatna na mączniaka prawdziwego w okresie od krzewienia do dojrzałości mlecznej, zwłaszcza gdy porażone są liście flagowe i plewy. Jednak w porównaniu z jęczmieniem pszenica lepiej znosi wczesne infekcje.
Biało-szary mączniak prawdziwy rozwija się na liściach, łodygach i główkach. Wzrost grzyba jest najbardziej widoczny na górnej powierzchni liścia, choć może również rozwijać się na spodniej stronie. Początkowo krosty wydają się białe, ale stopniowo stają się szare do brązowych w miarę dojrzewania i mogą się łączyć, tworząc większe masy często otoczone chlorozą. Po przeciwnej stronie zainfekowanych liści tkanki stają się żółte, a następnie brązowe lub brązowe. Cleistothecia są również widoczne jako małe, okrągłe, czarne kropki w starszych szarych koloniach. W ciężkich przypadkach liście mogą obumierać.
Model FieldClimate
Model mączniaka prawdziwego pszenicy
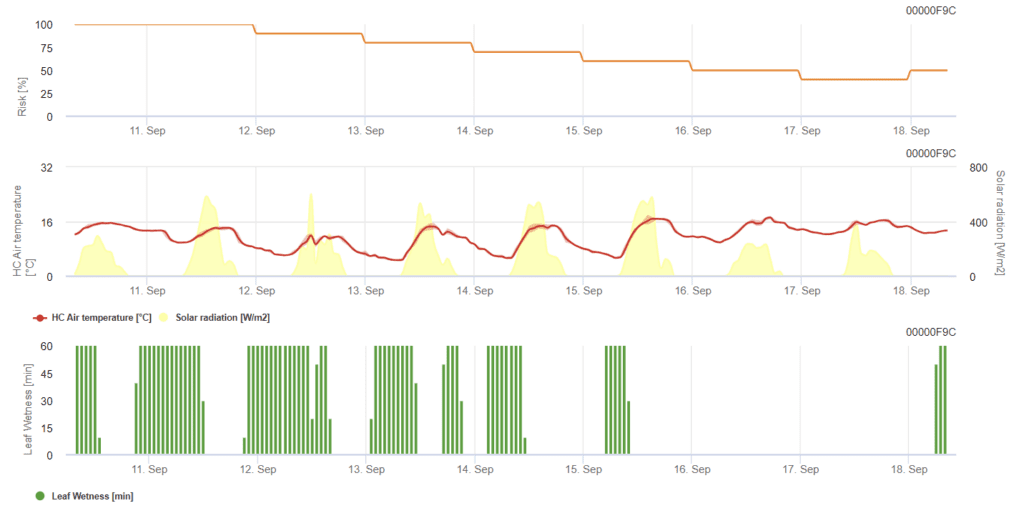
Potrzebne czujniki:
- Temperatura powietrza
- Wilgotność liści
- Promieniowanie słoneczne
Model określa ryzyko wystąpienia mączniaka prawdziwego w skali od 0 (brak infekcji) do 100% (pełna infekcja). Jest to istotne na etapie BBCH od 21 do 39 dla jęczmienia i od 21 do 75 dla pszenicy i owsa.
Stadium BBCH to skala wzrostu opisująca rozwój roślin. Składa się z dwóch cyfr, skala waha się od 00 do 99 - 00 odnosi się do traktowania nasion, a 99 do traktowania po zbiorach. Pierwsza cyfra wskazuje konkretny etap rozwoju; 0 to kiełkowanie, 1 to rozwój liści, 2 to uprawa, 3 to wydłużenie łodygi, 4 to kiełkowanie, 5 to pojawienie się kwiatostanu i główkowanie, 6 to kwitnienie i antyeza, 7 to rozwój owoców, 8 to dojrzewanie, a 9 to starzenie się.
- BBCH 21: Krzewienie - Początek krzewienia; wykrywalny pierwszy krzew.
- BBCH 39: Wydłużenie łodygi - stadium liścia flagowego; liść flagowy w pełni rozwinięty i widoczny ligule.
- BBCH 75: Rozwój owoców - średnio mleczny; zawartość ziarna mleczna i ziarna osiągają ostateczny rozmiar, ale nadal są zielone.
Ryzyko wzrasta w temperaturach od 12°C do 21°C przez większość godzin w ciągu dnia i przy niskim promieniowaniu globalnym. Z kolei wilgotność liści, wysokie promieniowanie globalne i wysokie temperatury powyżej 32°C zmniejszają ryzyko.
Literatura
- Both, M., & Spanu, P. D. (2004). Blumeria graminis f. sp. hordei, obligatoryjny patogen jęczmienia. Annual Plant Reviews, 11, 202-218.
- Cunfer, B. M. (2002). Mączniak prawdziwy. Pszenica chlebowa: ulepszanie i produkcja, 30, 317-330.
- Der Gräser, E. M. Krankheiten und Schädlinge des Getreides. Lancashire, P. D., Bleiholder, H., Boom, T. V. D., Langelüddeke, P., Stauss, R., Weber, E., & Witzenberger, A. (1991). Jednolity kod dziesiętny dla stadiów wzrostu roślin uprawnych i chwastów. Annals of applied Biology, 119(3), 561-601. https://ohioline.osu.edu/factsheet/plpath-cer-11
Brązowa rdza
Patogen
Istnieją trzy znaczące rdze i patogeny:
- Rdza brunatna liści: Puccinia triticina
- Trzpień / czarna rdza: Puccinia graminis
- Pasek/żółta rdza: Puccinia striiformis
Rdza brunatna jest najczęstszą chorobą rdzy pszenicy. Rdza czarna jest również znana jako rdza letnia ze względu na obfity rozwój błyszczących czarnych teliospor. Jest to najbardziej niszczycielska choroba rdzy, powodująca 50% strat w ciągu jednego miesiąca w sprzyjających warunkach. Rdza żółta to choroba pszenicy występująca w chłodniejszym klimacie, zwykle związana z wyższymi wysokościami i północnymi szerokościami geograficznymi. Jej cechą charakterystyczną są żółte urediniospory. W ciężkich przypadkach może również powodować uszkodzenia tak znaczące jak czarna rdza.
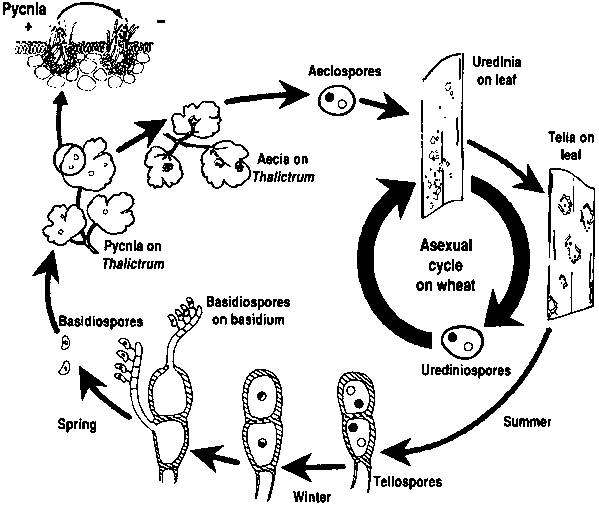
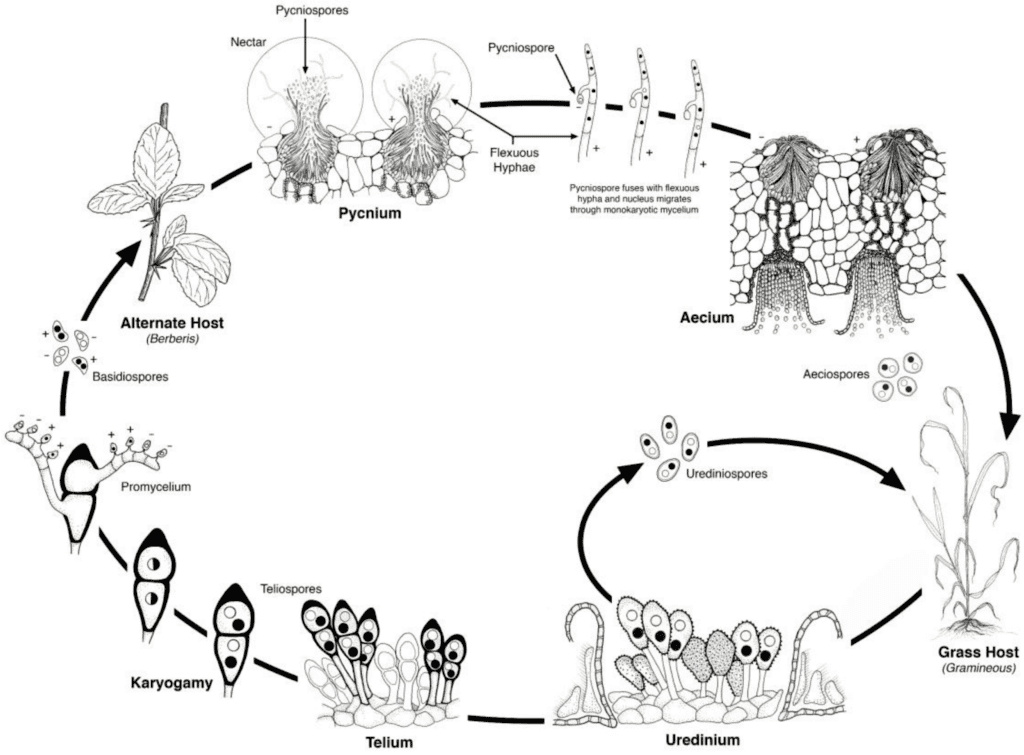
Patogeny rdzy pszenicy przechodzą zarówno bezpłciowy, jak i płciowy cykl reprodukcyjny i wymagają dwóch roślin żywicielskich - żywiciela ekonomicznego i żywiciela alternatywnego. Żywicielem ekonomicznym jest pszenica, a żywicielem alternatywnym jest zazwyczaj chwast lub roślina rodzima, co umożliwia grzybom przejście przez fazę płciową. Puccinia striiformis nie ma alternatywnego żywiciela, składa się ze stadiów uredinialnych i telialnych.
W cyklu bezpłciowym urediniospory są produkowane na roślinie żywicielskiej i mogą ją wielokrotnie infekować, prowadząc do szybkiej i powszechnej infekcji w sprzyjających warunkach.
Cykl płciowy patogenu rozpoczyna się, gdy teliospory, powstałe w infekcjach uredinialnych na roślinie żywicielskiej, kiełkują i przechodzą mejozę w celu wytworzenia podstawczaków. Te bazidiospory są rozpraszane do alternatywnego żywiciela, gdzie inicjują infekcję, w wyniku czego powstaje piknia, która zawiera pikniospory i strzępki receptywne. Do zapłodnienia dochodzi, gdy pikospory z jednego typu godowego są przenoszone do drugiego przez nektar. Po zapłodnieniu na spodniej stronie liści alternatywnego żywiciela rozwijają się kubki aecialne, które uwalniają aeciospory. Te aeciospory są rozpraszane i infekują nowych żywicieli, po czym następuje infekcja uredinialna, kończąca cykl życiowy patogenu.
Symptomy

A) Puccinia graminis
B) Puccinia striiformis
C) Puccinia triticina
Puccinia triticina
P. triticina Głównie infekuje blaszki liściowe, ale czasami może wpływać na pochewki liściowe, kłębki i szypułki, tworząc małe żółte plamki na górnej powierzchni liścia. W miarę postępu choroby plamy te przekształcają się w pomarańczowe krosty otoczone żółtą otoczką. Krostki wytwarzają pomarańczowe lub czarne zarodniki widoczne na liściach. Choroba wytwarza mniej teliospor, w przeciwieństwie do czarnej rdzy. Niektóre mogą wykazywać nadwrażliwe plamki lub uredinia otoczone obszarami chlorotycznymi lub nekrotycznymi.
Puccinia graminis
P. graminis atakuje głównie łodygi, ale może również infekować liście, pochewki, źdźbła, szypułki, a nawet nasiona. Początkowo pojawiają się czerwonawo-brązowe zmiany, a w miarę postępu choroby w krostach tworzą się czarne teliospory. Masy czerwono-ceglastych urediniospor rozwijają się najpierw na łodygach i pochewkach liści, a następnie pojawiają się małe chlorotyczne plamki, które przekształcają się w liniowe lub rombowe krosty, które mogą się powiększać. W miarę dojrzewania produkcja urediniospor zatrzymuje się i powstaje warstwa czarnych teliospor, powodując czernienie łodyg pod koniec sezonu. W ciężkich przypadkach infekcja osłabia łodygi roślin, prowadząc do wylegania.
Puccinia striiformis
Charakterystyczną cechą P. striiformis jest obecność żółtych krost o prostych bokach. Pojawiają się one w postaci wąskich, wydłużonych pasów o różnej długości, którym często towarzyszy chloroza i nekroza. W miarę dojrzewania choroby w krostach rozwijają się żółto-pomarańczowe zarodniki, a otaczające tkanki brązowieją i wysychają, tworząc przypalony wygląd.
Model FieldClimate
Model rdzy Puccinia
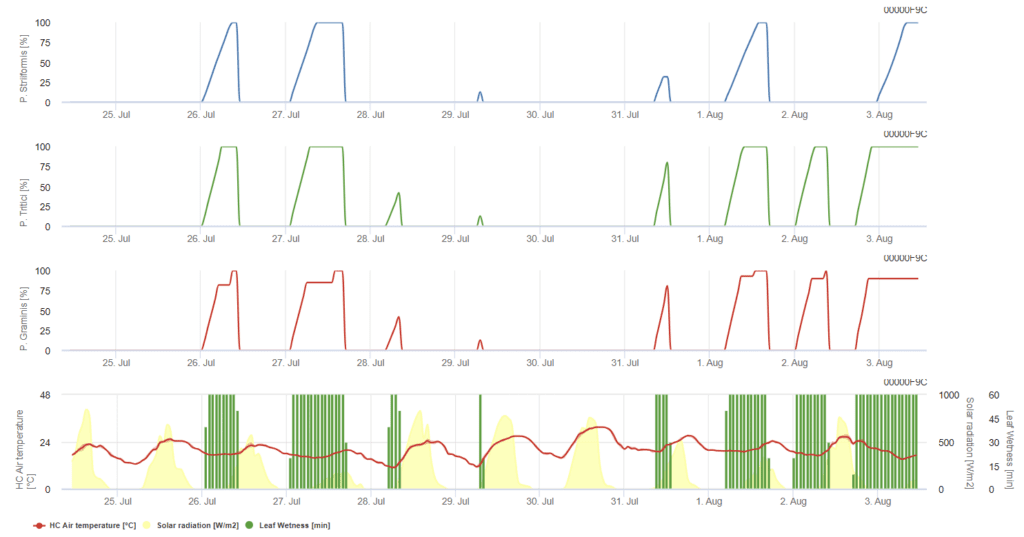
P. triticina, P. graminis, P. striiformis są przedstawione na trzech różnych kolorowych wykresach.
Model zakażenia Puccinia triticna
Model zakłada, że infekcja wymaga skumulowanej godzinowej temperatury 90°C wilgotności liści w zakresie temperatur powietrza od 5°C do 30°C. Warunki są podobne do P. graminisale z niższym progiem temperatury wynoszącym 5°C.
Jeśli zostanie wykazana infekcja 100%, należy rozważyć leczniczy pomiar ochrony roślin. Jeśli ryzyko wynosi 80%, a prognoza pogody przewiduje więcej okresów zwilżenia liści, można zastosować opryski ochronne liści.
Wilgotność liści dla skumulowanych średnich godzinowych temperatur dla 90°C:
- (if T <= 22,5°C then ∑(Th) else ∑ (22,5-(Th-22,5))
- 5°C < Temp. < 30°C
Model zakażenia Puccinia graminis
Infekcje mają miejsce po kilku godzinach zwilżenia liści w optymalnych warunkach temperaturowych. Model zakłada, że infekcja wymaga skumulowanej godzinnej temperatury 80°C wilgotności liści w zakresie temperatur powietrza od 10°C do 35°C. Preferuje nieco wyższą temperaturę niż P. triticina a po infekcji musi nastąpić światło słoneczne.
Gdy wykazano infekcję 100%, warunki były korzystne dla grzyba, a zatem należy rozważyć pomiary ochrony roślin.
Wilgotność liści dla skumulowanych średnich godzinowych temperatur dla 80°C, a następnie okres oświetlenia (150 W/m²) dla skumulowanych średnich godzinowych temperatur dla 30°C:
- (jeśli T <= 24°C, to ∑(Th), w przeciwnym razie ∑ (Th-24))
- 10°C < Temp. < 35°C
Model zakażenia Puccinia striiformis
Puccinia striiformis to rdza pszenicy występująca w chłodnym klimacie, której optymalna temperatura wynosi już od 15°C. Do infekcji dochodzi po kilku godzinach zwilżenia liści w optymalnych warunkach temperaturowych. Model zakłada, że infekcja wymaga skumulowanej godzinnej temperatury 80°C wilgotności liści w zakresie temperatur powietrza od 5°C do 20°C. Infekcje nie występują w okresach o niskim natężeniu światła.
Zanim wykres osiągnie 100%, można zastosować aplikację ochronną, natomiast po jej osiągnięciu należy rozważyć strategie ochrony leczniczej (systemowej).
Wilgotność liści i światło dla skumulowanych średnich godzinowych temperatur dla 80°C:
- (jeśli T <= 15°C, to ∑(Th), w przeciwnym razie ∑ (Th-15))
- 5°C < Temp. < 20°C
Literatura
- Bolton, M. D., Kolmer, J. A., & Garvin, D. F. (2008). Rdza liści pszenicy powodowana przez Puccinia triticina. Molekularna patologia roślin, 9(5), 563-575.
- Chen, X. M. (2005). Epidemiologia i zwalczanie rdzy paskowanej [Puccinia striiformis f. sp. tritici] na pszenicy. Kanadyjskie czasopismo patologii roślin, 27(3), 314-337.
- Figueroa, M., Hammond-Kosack, K. E., & Solomon, P. S. (2018). Przegląd chorób pszenicy - perspektywa polowa. Molekularna patologia roślin, 19(6), 1523-1536.
- Guide, A. Leaf, Stem, and Stripe Rust Diseases of Wheat. Leonard, K. J., & Szabo, L. J. (2005). Rdza źdźbłowa drobnych zbóż i traw powodowana przez Puccinia graminis. Molekularna patologia roślin, 6(2), 99-111.
- Kolmer, J. (2013). Rdza liściowa pszenicy: biologia patogenów, zmienność i odporność żywiciela. Lasy, 4(1), 70-84.
- Singh, R. P., Huerta-Espino, J., Roelfs, A. P., & Curtis, B. C. (2002). Rdza pszenicy. Wzrost, 2(25), 35.
Zalecane wyposażenie
Sprawdź, jaki zestaw czujników jest potrzebny do monitorowania potencjalnych chorób tej uprawy.
