
Пшеница модели заболеваний
Взрыв пшеницы
Патоген
Pyricularia grisea, также известный как Magnaporthe oryzaeЭто грибковый патоген, вызывающий взрыв пшеницы - серьезное заболевание, поражающее посевы пшеницы. Патоген размножается в основном бесполым путем с помощью конидий (бесполых спор), которые служат первичным инокулятом для начала инфекции. Эти конидии образуются на конидиофорах и разносятся ветром, дождем и механическими средствами, например, сельскохозяйственным оборудованием. Попадая на восприимчивого хозяина пшеницы, конидии прорастают и образуют аппрессории - специальные структуры, облегчающие проникновение в ткани растения. Попадая внутрь, гриб колонизирует клетки хозяина, что приводит к развитию болезни. Условия окружающей среды играют решающую роль в процессе заражения P. grisea. Гриб процветает в теплом, влажном климате, при температуре от 15 до 30 °C и длительном периоде увлажнения листьев или высокой относительной влажности. Для возникновения инфекции необходимо непрерывное увлажнение листьев в течение не менее 14 часов, поэтому развитию болезни способствуют чрезмерная облачность, высокая влажность, избыточное орошение и неправильный полив. Кроме того, стрессовые факторы, такие как засуха, уплотнение почвы, низкая высота скашивания и чрезмерное внесение азотных удобрений, могут усугубить тяжесть заболевания.
Симптомы
Начальные симптомы пшеничной болезни проявляются в виде пропитанных водой ромбовидных поражений на листьях, которые по мере развития болезни становятся серыми. Эти поражения могут расширяться и сливаться, приводя к обширному поражению листьев и некрозу. Зараженные колосья частично или полностью обесцвечиваются, часто начиная с черновато-серого очага инфекции на рахисе или у основания колосьев. При высокой инокуляционной нагрузке на одном рахисе может возникнуть несколько очагов инфекции, что приводит к значительным потерям урожая. В дополнение к листовым симптомам, P. grisea может заражать другие надземные части растения пшеницы, включая узлы и шейки, что приводит к гниению шейки или взрыву узлов. В результате пораженные части могут сломаться, что приведет к полеганию и дальнейшему снижению урожая. Способность патогена заражать различные части растения в течение всего вегетационного периода делает его особенно разрушительным, особенно при благоприятных условиях окружающей среды.
модель FieldClimate
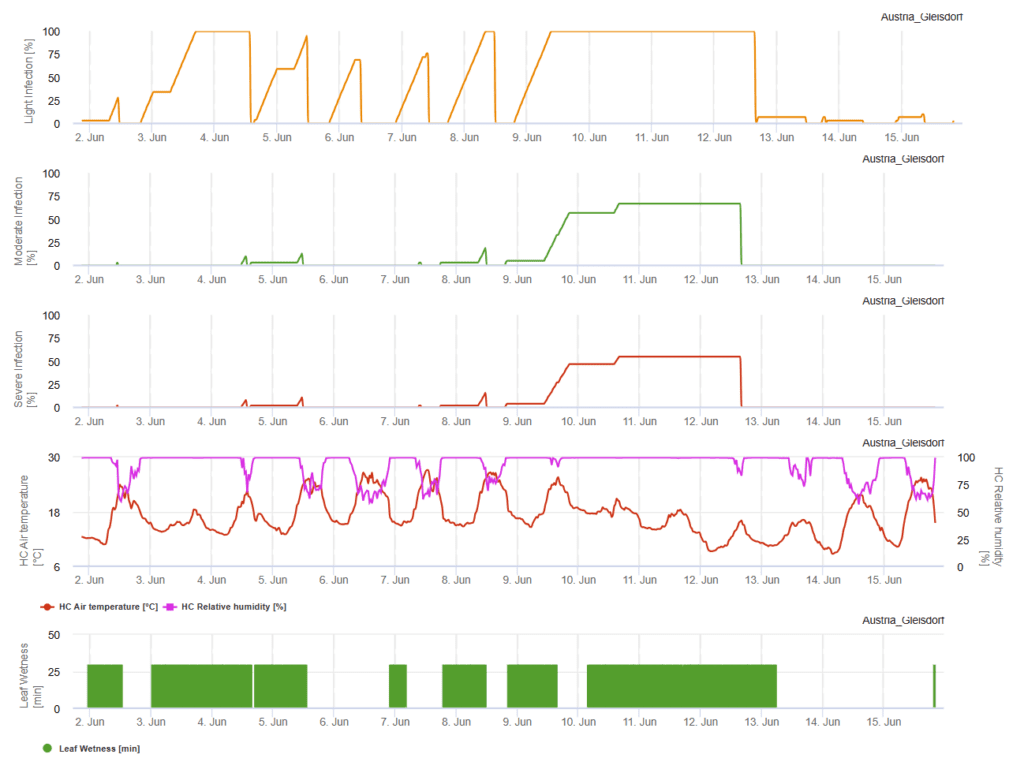
Необходимы датчики:
- Температура воздуха
- Относительная влажность
- Влажность листьев
Облачное небо, влажность и моросящие дожди способствуют развитию и тяжести заболевания. В FieldClimate мы рассчитываем три класса тяжести, и при достижении 100% инфекции в поле создаются оптимальные условия для грибкового патогена. В зависимости от сорта, полевой истории лечебные мероприятия по защите растений должны учитываться при достижении 100% легкой, умеренной или тяжелой инфекции.
Литература
- Круз, К. Д., и Валент, Б. (2017). Взрывная болезнь пшеницы: опасность в движении. Тропическая патология растений, 42(3), 210-222.
- Ислам, М. Т., Кролл, Д., Гладье, П., Соанес, Д. М., Персунс, А., Бхаттачарджи, П., ... и Талбот, Н. Дж. (2016). Возникновение пшеничного бласта в Бангладеш было вызвано южноамериканской линией Magnaporthe oryzae. BMC Biology, 14(1), 84.
Pyrenophora teres
Патоген
Pyrenophora teres (Drechslera teres) существует в двух формах -. P. teres f. teres и P. teres f. maculata которые вызывают сетчатую и точечную формы сетчатой пятнистости, соответственно.
Аскоспоры, высвобождающиеся из псевдотеций, заражают остатки, инициируя первичную инфекцию. В некоторых случаях первичным инокулятом служат также мицелий и конидии, переносимые семенами. Споры прорастают на листьях и проникают через внешнюю эпидермальную клеточную стенку, так что патоген может развиваться в большой внутриклеточной везикуле. Затем наступает асексуальная стадия, во время которой образуются конидии, вызывающие вторичную инфекцию и усиливающие тяжесть заболевания. В конце вегетационного периода патоген производит псевдотеции в качестве источника перегноя, которые остаются на зараженных остатках ячменя.
Симптомы
Симптомы проявляются на листьях, стеблях и зернах, причем болезнь распространяется снизу вверх по растениям. Более старые растения, как правило, повреждаются не так сильно, поскольку они обладают более толстой кутикулой, препятствующей проникновению патогенов, и большей способностью вырабатывать противогрибковые соединения. Патогены вырабатывают токсины, которые и вызывают симптомы заболевания, способствуя некрозу и хлорозу или нарушая водный баланс на клеточном уровне.
В случае заболевания пятнистостью сетчатого типа симптомы проявляются в виде узких, темно-коричневых, продольных поражений. На высокоустойчивых сортах развивается лишь несколько мелких точечных поражений, без образования четкого сетчатого рисунка. Напротив, у большинства восприимчивых сортов вокруг некротических поражений могут появляться хлоротичные или пропитанные водой участки.
Симптомы пятнистости - темно-коричневые, круглые или эллиптические поражения, которые часто окружены хлоротическим или некротическим ореолом различной ширины. У менее восприимчивых сортов поражения обычно меньше и могут не иметь хлоротичного ореола вокруг.
Тяжелые инфекции могут привести к полной гибели листьев, в результате чего они выглядят сухими. Как правило, сначала увядают старые листья, а затем молодые.
модель FieldClimate
Drechslera teres Модель
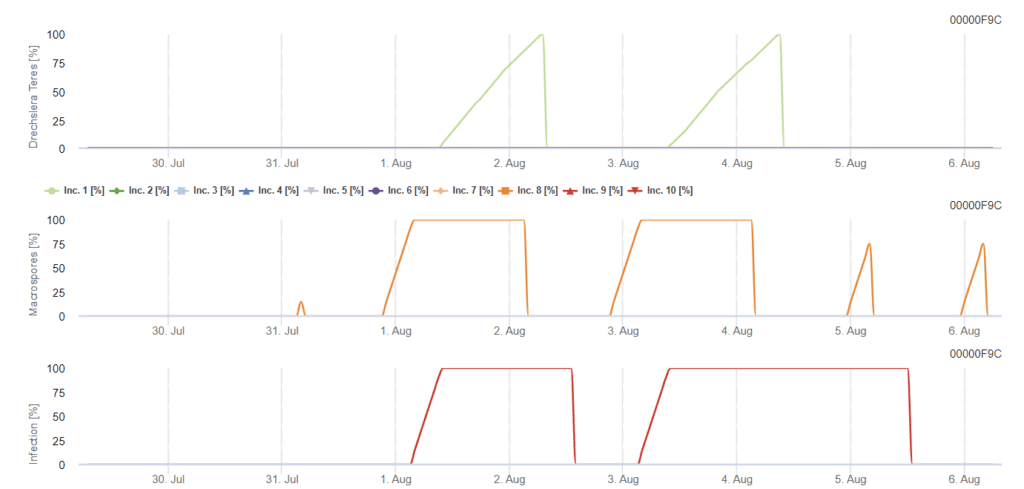
Необходимы датчики:
- Температура воздуха
- Относительная влажность
- Влажность листьев
- Осадки
Первичная инокуляция развивается при оптимальных температурах от 15 до 25 °C, при этом оптимум составляет 20 °C. Условия более 6 часов темноты приводят к оптимальному росту конидий, что отображается на графике споруляции конидий. Если график споруляции достигает 100%, в полевых условиях устанавливаются оптимальные условия.
Дальнейшее рассеивание происходит с помощью ветра или дождя. Для заражения тканей растений необходимы влажные условия, такие как увлажнение листьев или высокая относительная влажность воздуха в течение примерно 10-30 часов при оптимальных температурах 15°C и 25°C, как показано на графике заражения. Когда температура достигает 100%, считается, что для инфекции в полевых условиях созданы оптимальные условия. Солнечный свет также может усилить рост конидофоров, которые производят конидии после изменения условий влажных и сухих периодов с высокой солнечной радиацией и низкой относительной влажностью, а ветер благоприятствует развитию болезни.
Литература
- Backes, A., Guerriero, G., Ait Barka, E., & Jacquard, C. (2021). Pyrenophora teres: таксономия, морфология, взаимодействие с ячменем и способы борьбы. Грани науки о растениях, 12, 614951.
- Liu, Z., Ellwood, S. R., Oliver, R. P., & Friesen, T. L. (2011). Pyrenophora teres: профиль все более вредоносного патогена ячменя. Молекулярная патология растений, 12(1), 1-19.
- Obst, A., & Paul, VH (1993). Болезни и вредители зерновых культур, Verlag Th. Mann, Gelsenkirchen-Buer.
Забрать все
Патоген
Заболевание "Забрать все", вызываемое Gaeumannomyces graminisЭто одно из самых разрушительных заболеваний зерновых культур. Название произошло от имени фермеров Южной Австралии, поскольку болезнь настолько разрушительна, что не оставляет зерна для сбора урожая. Патоген поражает корневую систему и стебель, вызывая дефицит воды и питания, что в конечном итоге приводит к гибели растений.
Гриб выживает в виде мицелия в растительном мусоре сапрофитным путем, а его фрагменты, переносимые почвой, могут переноситься ветром, водой и животными. Первичное заражение происходит при контакте корней проростков с инфицированным мусором, после чего начинается рост и разрастание гиф. Проникая через эпидермис корня и вторгаясь в кору корня, они колонизируют и разрушают ткани. Инфекция распространяется вверх и вниз. Вторичное заражение происходит при контакте корня с корнем, при этом сильно зараженные растения встречаются в виде пятен.
Симптомы
Болезнь пшеницы обычно поражает пшеницу на стадии всходов и кущения, вызывая симптомы у поверхности почвы. Зараженные растения могут стать низкорослыми, с пожелтевшими листьями и преждевременно созревающими колосьями, в которых отсутствуют полностью развитые ядра. Круглые мертвые пятна размером от нескольких сантиметров до метра часто имеют желто-оранжевые или бронзовые края и могут появляться на том же участке в последующие годы.
Основные симптомы: обесцвеченные белые или пустые колосья, почерневшие основания стеблей и темные, гниющие корни с небольшими черными повреждениями, которые расширяются. Сильно поврежденные корни становятся хрупкими, а на основании стебля может появиться блестящее черное пятно. Растения легко выдергиваются из почвы из-за ослабленной корневой системы. Болезнь может напоминать стресс от засухи, поскольку она нарушает приток воды к верхним частям растения, вызывая преждевременное увядание.
модель FieldClimate
Забрать все
Модель датчиков:
- Температура почвы
Модель риска take-all использует длину дня и температуру почвы для определения рискованных периодов. Дни с менее чем 13 часами солнечного света и температура почвы от 10°C до 20°C благоприятствуют развитию болезни.
Когда значение риска достигает 100%, в поле создаются оптимальные условия для развития патогена. Севооборот с интервалом между восприимчивыми зерновыми культурами не менее 2-3 лет является наиболее важной стратегией защиты.
Литература
- Кук, Р. Дж. (2003). Забрать всю пшеницу. Физиологическая и молекулярная патология растений, 62(2), 73-86.
- Пальма-Герреро, Ж., Ченселлор, Т., Спонг, Ж., Каннинг, Г., Хаммонд, Ж., Макмиллан, В. Е., и Хаммонд-Косак, К. Е. (2021). Болезнь дубль-алле: новые сведения о важном корневом патогене пшеницы. Тенденции в науке о растениях, 26(8), 836-848. https://www.apsnet.org/edcenter/disandpath/fungalasco/pdlessons/Pages/Takeall.aspx
Фузариозная головня
Патоген
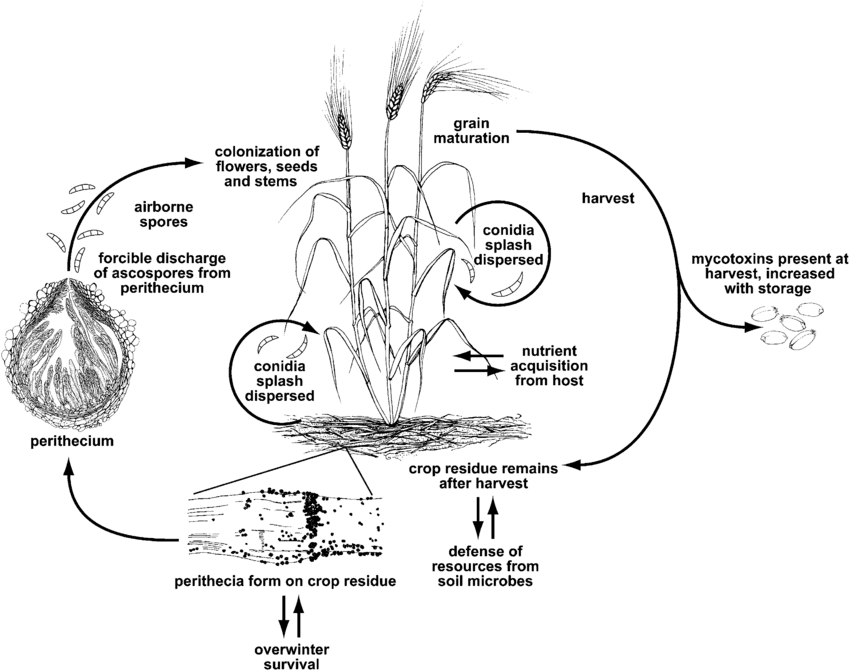
Фузариозная головня или парша вызывается представителями рода Fusarium. Наиболее распространенным видом является Fusarium graminearum но наиболее распространенные виды могут отличаться в зависимости от региона.
F. graminearum может заражать растения пшеницы на любой стадии роста. Он выживает зимой на зараженных растительных остатках, а весной происходит первичное заражение, когда аскоспоры из перитециев и конидии рассеиваются на бобовых или пыльниках пшеницы. Зараженные соцветия дают щуплые или увядшие зерна, часто называемые "надгробными". Даже если зерна выглядят незатронутыми, они все равно могут быть загрязнены микотоксинами. Вторичное заражение происходит через конидии, но эпидемии пшеницы зависят в первую очередь от количества первичной инокуляции, а не от вторичных источников.
Фузариозная головня также приводит к накоплению в посевах вредных микотоксинов, представляющих потенциальную опасность для животных. Эти микотоксины отключают защитные механизмы растений или защищают гриб от других организмов. Основной токсин - дезоксиниваленол (ДОН), он подавляет синтез белка, нарушая нормальное функционирование клеток. Люди, употреблявшие пшеницу с DON, испытывают такие симптомы, как тошнота, лихорадка или рвота.
Симптомы

У пшеницы и дурума любая часть или вся головка может выглядеть обесцвеченной. Частично белая и зеленая головня является диагностическим признаком заболевания у пшеницы. Гриб также может поражать стебель, вызывая его обесцвечивание от коричневого до пурпурного цвета. Во влажных условиях на зараженных колосках и бобовых часто видны розовые или лососево-оранжевые споровые массы. Многие зерна сморщенные и легкие, их иногда называют "могильными камнями" за их меловой, безжизненный вид. При благоприятных условиях инфекция может распространиться на соседние колоски и заразить весь колос, включая рахис и цветоносы. Зерна могут иметь тусклый вид и розовую окраску при нормальном размере, если заражение произошло на поздней стадии развития.
На ячмене зараженные колоски обесцвечиваются и выглядят пропитанными водой. Зерна также могут обесцвечиваться, а иногда во влажных условиях на колосках и бобах можно увидеть лососево-оранжевые споровые массы.
Модели FieldClimate
Оценки уровня FHB на поле основаны на подсчете пораженных голов или зерен. Цветную визуальную шкалу для оценки тяжести FHB на пшенице можно получить в Службе расширения NDSU (публикация PP-1095): https://library.ndsu.edu/ir/bitstream/handle/10365/9187/PP1095_1998.pdf?sequence=1&isAllowed=y.
Модель заражения фузариозной головней (риск заражения фузариозной головней)
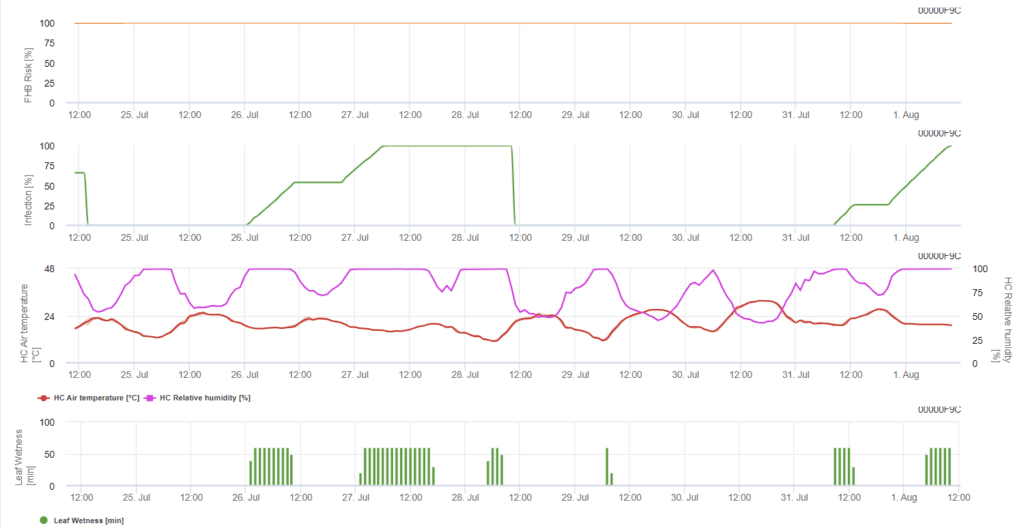
Необходимы датчики:
- Температура воздуха
- Относительная влажность
- Влажность листьев
Модель определяет рискованные периоды для инфекции. При достижении заражения 100% риск очень высок, а условия для гриба были благоприятными для заражения. Знания фермера о стадии развития различных сортов пшеницы дают возможность принять решение о применении лечебного опрыскивания сразу после заражения.
Возбудителям фузариозной головни на пшенице благоприятствуют теплые температуры от 20 до 30 °C и длительный влажный период. Несколько дневных периодов увлажнения листьев приводят к появлению ранних видимых симптомов. Симптомы могут проявиться и после длительного латентного периода, если после заражения наступит период увлажнения листьев в течение 18 часов или даже короче, а также после искусственной инокуляции при температуре 15°C.
Обобщив все различные комбинации температуры и влажности, которые мы нашли в литературе, мы решили отметить заражение фузариозной головней, если температура и период увлажнения листьев или периоды с относительной влажностью более 85% превышают значения, представленные на следующем графике. При расчете величины прогресса учитывается зависимость между продолжительностью влажных условий и температурой.
Модель оповещения о микотоксинах фузариума (фузариозная головня)
Необходимы датчики:
- Температура воздуха
- Относительная влажность
- Влажность листьев
- Осадки
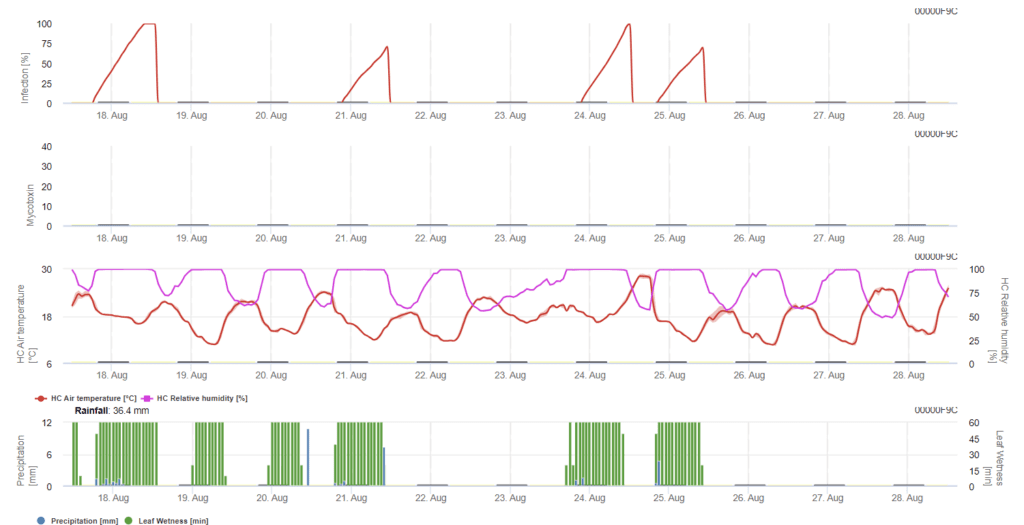
в этой модели заражение FHB рассчитывается по осадкам (необходимо 2 мм), относительной влажности (выше 85%) или влажности листьев, температуре во время процесса. Если заражение достигает 100%, то оптимальные условия для грибкового патогена достигнуты. Далее модель рассчитывает риск микотоксинов FHB.
Испытания на заражение с длительным периодом увлажнения листьев при фузариозной головне привели к высокому содержанию микотоксинов. Исходя из этой информации, можно предположить, что период увлажнения листьев в течение 48 часов или более на стадиях 61 и 69 приводит к высокому риску образования микотоксинов.
Опыты, проведенные при анализе содержания ДОН в пшенице, выращенной в коммерческих условиях, показали, что периоды увлажнения листьев, достаточно длительные для заражения после первоначального заражения на стадиях 61-69, могут увеличить значения ДОН. В случае более длительных периодов увлажнения листьев микотоксины могут увеличиваться вплоть до стадии 85.
- Стадия BBCH 61: Начало цветения; видны первые пыльники
- Стадия 69 BBCH: Конец цветения; все колоски завершили цветение, но некоторые обезвоженные пыльники могут остаться
- Стадия BBCH 85: В середине созревания; мягкое тесто с содержанием зерна, мягкое, но сухое, отпечаток ногтя не держится
Модель накапливает показатель риска, пропорциональный прогрессу инфекции, за каждый успешный период заражения в течение выбранного для расчета периода. Шесть завершенных инфекций приведут к риску 100%. Обычно период увлажнения листьев, приводящий к заражению фузариозом, превышает необходимый минимум. Поэтому большинство фузариозных инфекций приведет к увеличению риска более чем на 17%.
Величина риска микотоксинов зависит от истории поля. Пшеница, выращенная после необработки почвы, может нести лишь небольшой риск, если ее не опрыскивать в оптимальной ситуации. В неопрыскиваемой пшенице следует ожидать повышенных значений DON после 35% риска. Пшеница после необработанной пшеницы, следующей за любой другой культурой, может нести более высокий риск - 50%. Если пшеница идет после пшеницы с обработкой почвы, риск может быть повышен до 70%. Пшеница первого года должна быть проверена на DON, если риск достигает 100%.
Литература
- https://www.fao.org/4/y4011e/y4011e0j.htm
- https://scabusa.org/pdfs/NDSU_PP-804_FHB-Small-Grains.pdf
- Ланкашир, П. Д., Блейхолдер, Х., Бум, Т. В. Д., Лангелюддеке, П., Штаусс, Р., Вебер, Э., и Витценбергер, А. (1991). Единый десятичный код для стадий роста сельскохозяйственных культур и сорняков. Анналы прикладной биологии, 119(3), 561-601.
- Трейл, Ф. (2009). За затухающие волны зерна: Fusarium graminearum в эпоху постгеномики. Физиология растений, 149(1), 103-110.
- Шуман, Г. Л. (2010). Инструктор по гигиене растений| Объем: 10| Год: 2010| Тип статьи: Поурочные планы. Здоровье растений, 10.
Ячменная полоска
Патоген
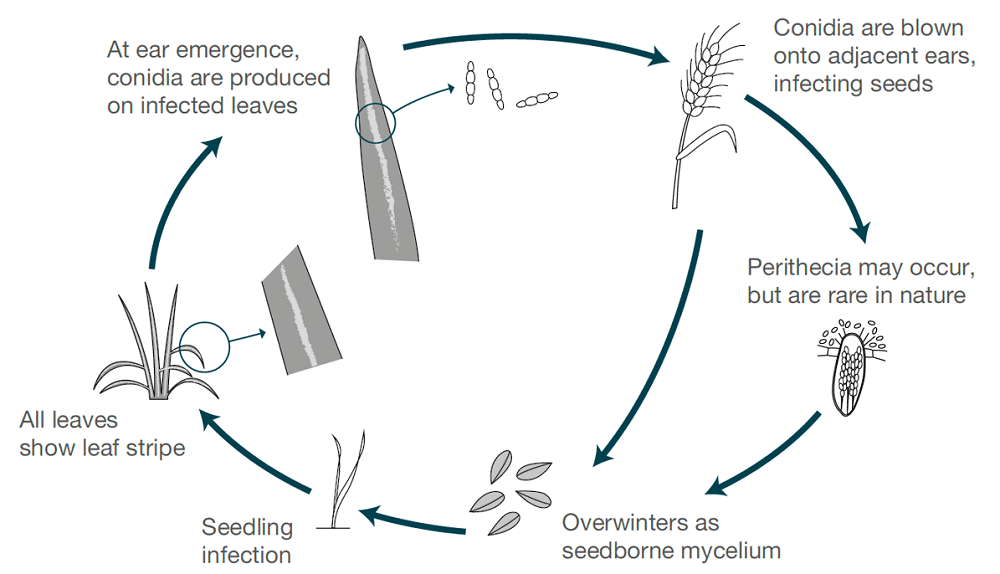
Ячменная полосатость вызывается Pyrenophora graminea (Drechslera graminea)Патоген, переносимый семенами, выживает в эпидермисе зараженного семени. Гриб заражает проростки в прохладных, влажных условиях. Гриб разрастается внутри растения, заражает все растение, вырабатывает токсины, убивает клетки и обесцвечивает ткани листьев между жилками, вызывая полосатые поражения. Полосатость более распространена на озимом ячмене, чем на яровом.
При влажной или сырой погоде споры образуются на поверхности листьев, когда распускаются здоровые шипы растений. Споры разносятся ветром на развивающиеся колосья, прорастают и вызывают инфекцию. Ядра наиболее восприимчивы на ранних стадиях развития. В каждом сезоне происходит только один цикл заражения и образования спор.
Симптомы

Симптомы проявляются в основном на стадии появления колоса.
Вначале на базальной части листа и листовых влагалищах появляются бледно-зеленые или желтые полосы. Постепенно эти полосы становятся коричневыми или темно-коричневыми, затем происходит усыхание и расщепление листовой пластинки. Они увеличиваются в размерах на всю длину листа, становятся некротическими и сливаются, что в конечном итоге приводит к гибели растения.
Растения могут выглядеть чахлыми, иметь мало почек, в тяжелых случаях не образуют головки и не производят семян. Длина колоса также может быть уменьшена из-за плохо развитых коричневых зерен.
модель FieldClimate
Pyrenophora graminea Модель
Необходимы датчики:
- Температура воздуха
- Относительная влажность
- Влажность листьев
- Осадки
В модели показаны две стадии. Первая стадия - это рискованные периоды во время чрезвычайных ситуаций в растении, ранние стадии. Вторая стадия - во время цветения и развития головки ячменя. Когда инфекция достигает 100%, в поле создаются оптимальные условия для того, чтобы грибок заразил ткани растения и планомерно развивался внутри.
Литература
- Ричардсон, М. Дж. (1996). Микология семян. Микологические исследования, 100(4), 385-392. https://ahdb.org.uk/knowledge-library/barley-leaf-stripe-life-cycle-and-disease-symptoms https://plantwiseplusknowledgebank.org/doi/full/10.1079/pwkb.species.46115
Септория
Патоген
Существует два основных заболевания пшеницы септориозом - пятнистость Septoria tritici, вызываемая Septoria tritici и пятнистость Septoria nodorum, вызванная Septoria nodorum.
Septoria tritici выживает на зараженных растительных остатках в течение лета и начинает поражать растения пшеницы осенью. Гриб процветает в прохладных и влажных условиях. Он имеет две стадии - латентную и некротическую. Во время латентной фазы гриб инокулирует новые ткани растения и, проникая через стоматы, колонизирует их, разрастаясь межклеточно в тканях растения. S. tritici не требует физических питательных структур, а питается сам, извлекая питательные вещества из клеток хозяина, потерявших структурную целостность. Растения могут проявлять гиперчувствительность, и в ответ на инфекцию на пораженных тканях могут развиваться некротические поражения.
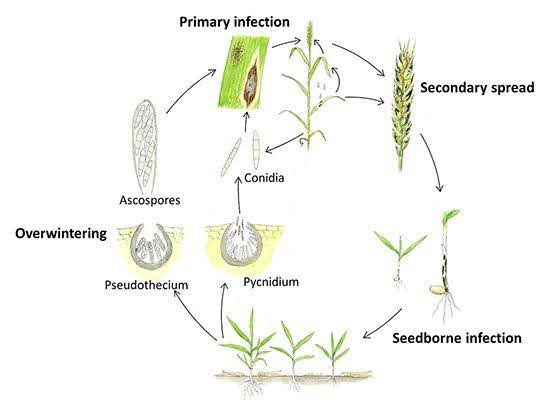
Septoria nodorum сохраняется в течение лета в виде спящего мицелия, пикнид и псевдотеций на растительных остатках. Заражение обычно начинается осенью, когда пикнидиоспоры из пикнид и аскоспоры из псевдотеций разносятся ветром и дождем, инициируя первичную инфекцию. Эти споры проникают в кутикулу листа, и после заражения происходит образование пикнид. Вторичная инфекция происходит по мере образования пикнидиоспор, которые распространяются от нижних листьев к верхним и бобовым. Патоген также вырабатывает токсины, которые способствуют развитию болезни.
Симптомы
Пятнистость Septoria tritici
Осенью, Septoria tritici Вначале симптомы проявляются в виде небольших желтых пятен на листьях, содержащих крошечные черные крапинки, которые являются плодовыми телами гриба. Поражения имеют неправильную форму, от эллиптической до длинной и узкой, увеличиваются и по мере созревания становятся коричневыми или красновато-коричневыми. Болезнь обычно начинается на нижних листьях и постепенно продвигается вверх, в конечном итоге поражая флаговый лист. Во влажных условиях грибок может распространиться на головки пшеницы, вызывая коричневые поражения на ботве и остях, известные как пятнистость ботвы. Пятнистость Septoria tritici можно спутать с другими болезнями пшеницы. Однако наличие черных грибковых тел является ключевым признаком S. tritici. Хотя Septoria nodorum также может производить коричневые плодовые тела во влажных условиях, они отличаются по цвету и размеру, с Septoria tritici Плодовые тела крупнее.
Пятнистость Septoria nodorum
Septoria nodorum Симптомы появляются в основном на верхних листьях. Вначале на листьях появляются темно-коричневые пятна с желтым ореолом. Еще одним первым признаком является ожог кончиков листьев. По мере созревания поражения расширяются и становятся некротическими с темно-коричневым центром. Внутри поражений видны крошечные темно-коричневые структуры, которые являются плодовыми телами. Конидии, выходящие из плодовых тел, выглядят как белые или розовые массы. Сильно зараженные листья могут быть полностью покрыты поражениями, что в конечном итоге приводит к гибели тканей листа. Гриб также может поражать ботву и ости: появляются аналогичные коричневые поражения, и болезнь прогрессирует вниз.
модель FieldClimate
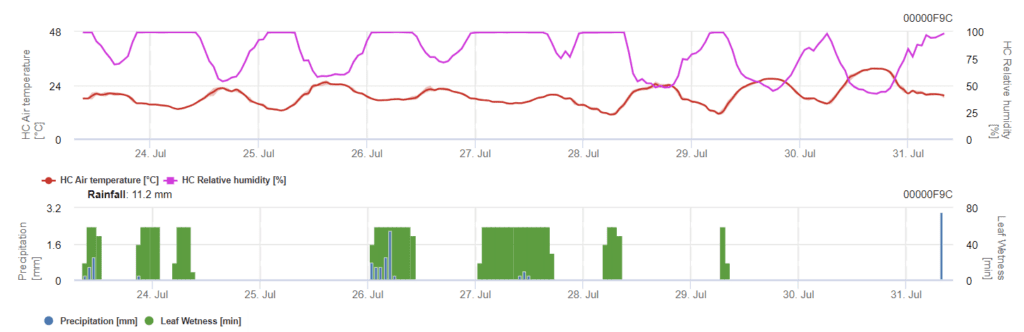
Заражение септориозом возможно при низких температурах, тогда как при температуре ниже 7°C инфекция может не проявиться в течение 2 дней. Оптимальная температура для развития болезни достигается в области от 16 до 21°C. Заражение возможно в период высокой относительной влажности или увлажнения листьев в течение 14 часов и более.
Septoria tritici Модель
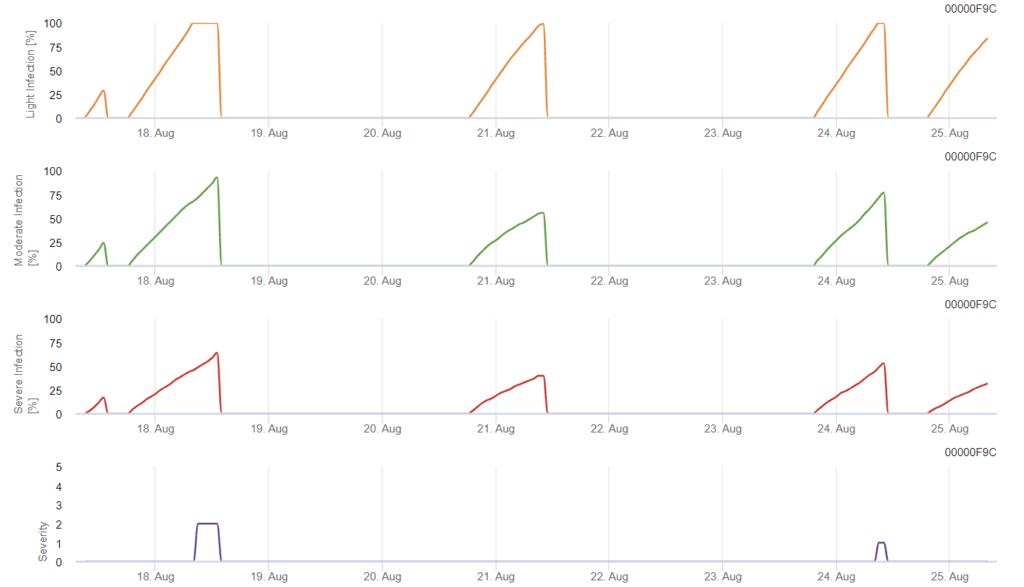
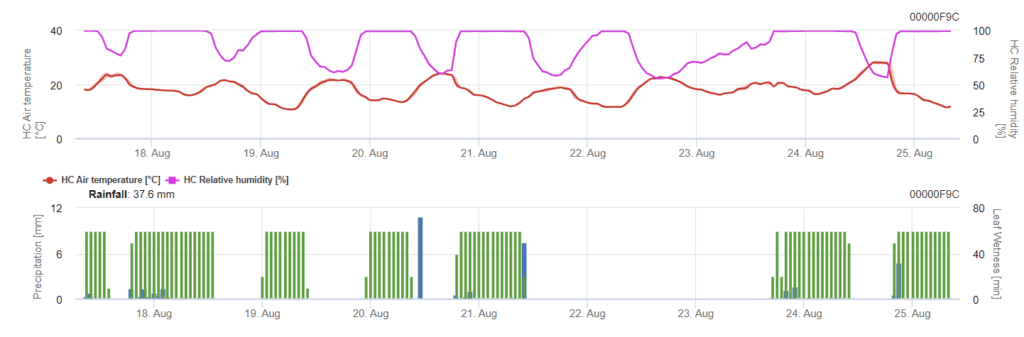
Заражение начинается после дождя в 0,5 мм. Оптимальная температура для заражения септориозом составляет от 16 до 21°C, а влажность листьев или высокая относительная влажность воздуха - более 14 часов. Septoria tritici рассчитывается по трем классам тяжести. Далее мы определяем уровни тяжести, которые помогают оценить давление инфекции между 10 и 32 стадиями BBCH пшеницы.
- Стадия 10: Развитие листьев; первый лист через колеоптиль
- Стадия BBCH 32: Удлинение стебля; узел 2 как минимум на 2 см выше узла 1
- Стадия BBCH 51: Появление соцветия и завязь; начало завязи, когда верхушка соцветия выходит из влагалища и только что виден первый колосок.
Мы решили не использовать модель для формирования пикнид. Условием, необходимым для образования пикнидий, считается период с относительной влажностью выше 85%. Время жизни пикнид составляет 24 часа. Во всех климатических условиях, где гриб имеет шанс заразиться, мы найдем два часа, удовлетворяющие этому условию, почти каждый день около восхода солнца.
Оценка тяжести инфекции
Чтобы оценить Septoria tritici инфекционного давления между стадиями 10 и 32 и между 32 и 51, мы должны оценить тяжесть инфекций в зависимости от климатических условий. Тяжесть инфекции оценивается по шкале от 1 до 5:
- 1: слабая инфекция с дождем менее 5 мм
- 2: слабая инфекция с дождем более 5 мм
- 3: умеренная инфекция с дождем менее 5 мм
- 4: умеренная инфекция при дожде более 5 мм/ сильная инфекция при дожде менее 5 мм
- 5: сильная инфекция с дождем более 5 мм
Оценка давления при заболевании
Существует три фактора давления болезней на поле - климат, история поля и восприимчивость выращиваемого сорта. Если мы можем накопить значения тяжести болезни от стадии 10 до стадии 32 до значения 4, мы можем ожидать слабого давления болезни со стороны климата. Если это значение достигнет 6, то можно ожидать умеренного давления болезни, а если достигнет 10, то более сильного давления болезни со стороны климата.
Знание восприимчивости сорта и истории поля поможет нам выбрать опрыскивание или нет при слабом или умеренном давлении болезни в данной ситуации. Накопленное значение 10 может привести к опрыскиванию на стадии 32 в любом случае.
Решение об опрыскивании на более поздней стадии зависит от весеннего климата. Если мы можем накопить значения тяжести от стадии 10 до значения 6, мы можем ожидать слабого давления болезни. Если это значение достигнет 10, то можно ожидать умеренного давления болезни, а если значение достигнет 15, то можно ожидать сильного давления болезни в зависимости от климатической ситуации.
В FieldClimate Septoria tritici показаны три варианта тяжести инфекции. Благодаря дождям и длительному периоду влажности листьев были созданы условия для сильного заражения S. tritici. Уровень тяжести достигает наивысшего значения 5, что означает высокий риск заражения.
Модель Septoria nodorum
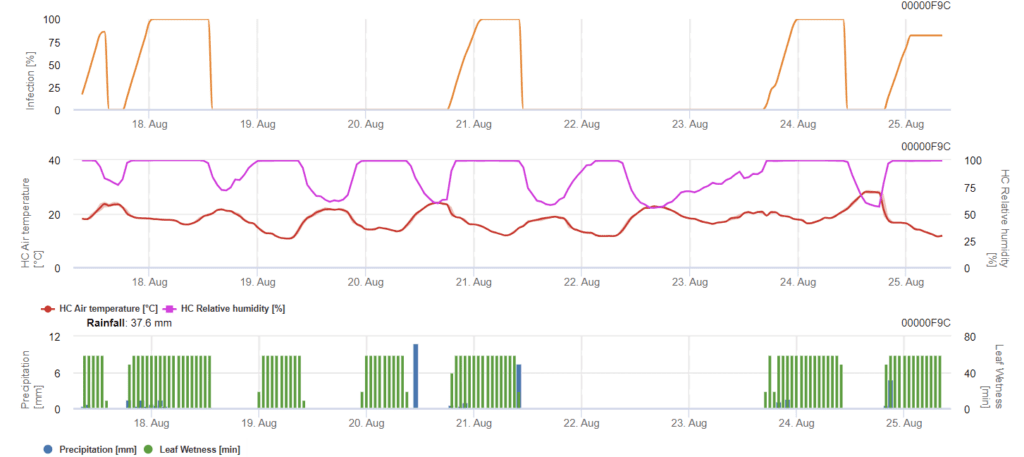
Septoria nodorumБиология инфекции в некоторой степени отличается от Septoria tritici но разница недостаточно велика для отдельной модели. Поэтому мы предлагаем использовать модель tritici для всего комплекса болезней Septoria. В районах с высоким давлением S. nodorumИнфекции, классифицированные как слабые со степенью тяжести 2, следует лечить более серьезно, чем в других областях.
Сайт Septoria nodorum Модель рассчитывает риск заболевания. Если риск достигает 80%, следует рассмотреть возможность проведения мероприятий по защите растений. Если риск составляет 100% и инфекция уже определена, необходимо провести системные мероприятия по защите растений (лечебные аппликации).
Литература
- Бреннан, К. Дж., Бенбоу, Х. Р., Маллинз, Э., и Духан, Ф. М. (2019). Обзор известных и неизвестных ранних стадий заболевания пшеницы пятнистостью septoria tritici. Патология растений, 68(8), 1427-1438.
- Де Вольф, Е. Д. (2008). Пятнистость Septoria tritici. Mehra, L. K., Adhikari, U., Ojiambo, P. S., & Cowger, C. (2019). Пятнистость пшеницы Septoria nodorum. Инструктор по здоровью растений.
- Соломон, П. С., Лоу, Р. Г., Тэн, К. К., Уотерс, О. Д., и Оливер, Р. П. (2006). Stagonospora nodorum: причина пятнистости пшеницы Stagonospora nodorum. Молекулярная патология растений, 7(3), 147-156.
Пятнистость листьев
Патоген
Пятнистость листьев вызывается Rynchosporium secalis.
Первичное заражение происходит с помощью аскоспор или конидий на растительном мусоре. Эти споры разносятся ветром и дождем, прорастают, и по мере разрушения клеток эпидермиса и мезофилла после заражения симптомы становятся заметными. Вторичная инфекция распространяется конидиями с зараженных листьев. Во влажных условиях конидии прорастают на поверхности листа и образуют гифы, которые проникают в кутикулу непосредственно над эпидермальными клетками. Последующий рост гриба ограничивается подкутикулярной областью эпидермиса.
Симптомы
R. secalis может поражать любую часть листьев. Основной признак - пятна неправильной формы, заражение начинается с нижних и до верхних листьев. Вначале пятна выглядят как пропитанные водой участки. По мере развития болезни они становятся сероватыми в центре из-за образования спор с коричневым краем. Затем могут последовать некроз и хлороз. Пятна сливаются, уничтожая все листья.
модель FieldClimate
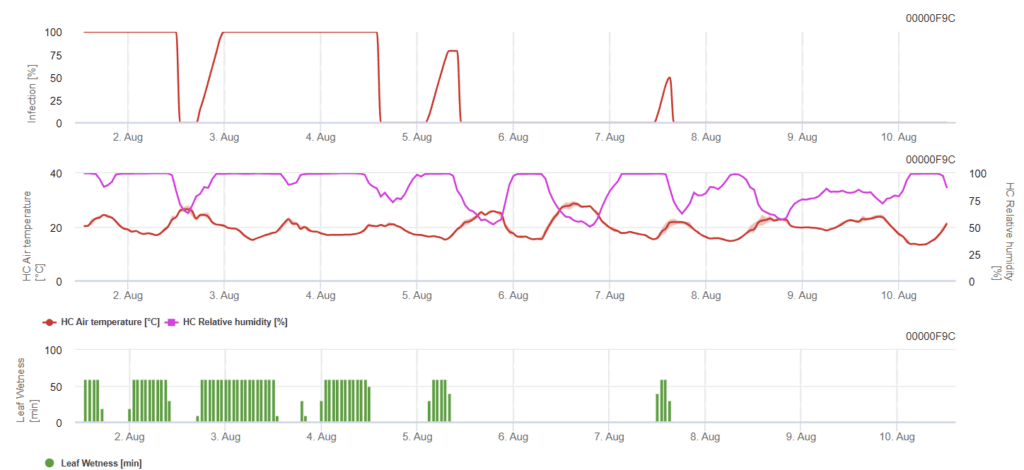
Модель ринхоспориума листового пятнистого
Необходимы датчики:
- Температура воздуха
- Относительная влажность
- Влажность листьев
Чтобы произошло заражение, необходимо как минимум 7-15 часов увлажнения свинца в зависимости от температуры (оптимально при 20'C). Когда график достигает значения 100%, это означает, что в полевых условиях были определены оптимальные условия.
Литература
- Брукс, Ф. Т. (1928). Наблюдения над Rhynchosporium secalis (Oud.) Davis, листовой пятнистостью ячменя и ржи. Новый фитолог, 27(4), 215-219.
- Фаулер, А. М., и Оуэн, Х. (1971). Исследования листовой пятнистости ячменя (Rhynchosporium secalis). Трансакции Британского микологического общества, 56(1), 137-152.
- Чжан, Дж., Фитт, Б. Д., Пинншмидт, Х. О., Оксли, С. Дж. П., и Ньютон, А. К. (2008). Устойчивость, эпидемиология и устойчивое управление популяциями Rhynchosporium secalis на ячмене. Патология растений, 57(1), 1-14.
Листовая пятнистость рамулярии
Патоген
Рамулярия колло-цигниВозбудитель листовой пятнистости ячменя Ramularia распространяется преимущественно бесполым путем с помощью конидий, которые требуют влаги для прорастания и раннего развития. После прорастания на поверхности листа гриб проникает в лист через стоматы и межклеточно колонизирует ткани. Зараженные растения ячменя могут изначально не проявлять никаких симптомов, но повреждения обычно появляются после цветения.
Жизненный цикл R. collo-cygni до конца не изучена, но она включает в себя вертикальную передачу через зараженные семена, что позволяет патогену выживать между вегетационными сезонами. Конидии, передающиеся воздушно-капельным путем, также способствуют вторичному распространению, инициируя новые инфекции при благоприятных условиях. Хотя семена являются основным механизмом перезимовки, роль альтернативных хозяев и вторичной грибковой структуры, называемой Asteromella остается неопределенным и до сих пор изучается.
Симптомы

Симптомы появляются на обеих сторонах листьев после цветения, но чаще всего на верхних листьях. Первые симптомы проявляются в виде желтых или коричневых пятен на жилках листа, окруженных хлоротическим ореолом. После появления пятен лист становится хлоротичным и некротичным, как правило, начиная с кончиков и краев листа. Соседние пятна могут пересекаться, образуя большие темные участки. Также могут наблюдаться небольшие точечные пятна. Хотя симптомы листовой пятнистости рамулярии можно спутать с другими заболеваниями, ключевой особенностью является то, что пятна на листьях ограничены жилками листа.
Существует так называемый 5R для различения пятен на листьях рамулярии:
- Кольцо с желтым краем хлороза
- Прямоугольная форма
- Ограничены жилками листа
- Красновато-коричневая окраска
- Прямо сквозь лист
Модель FieldClimate
Модель Ramularia
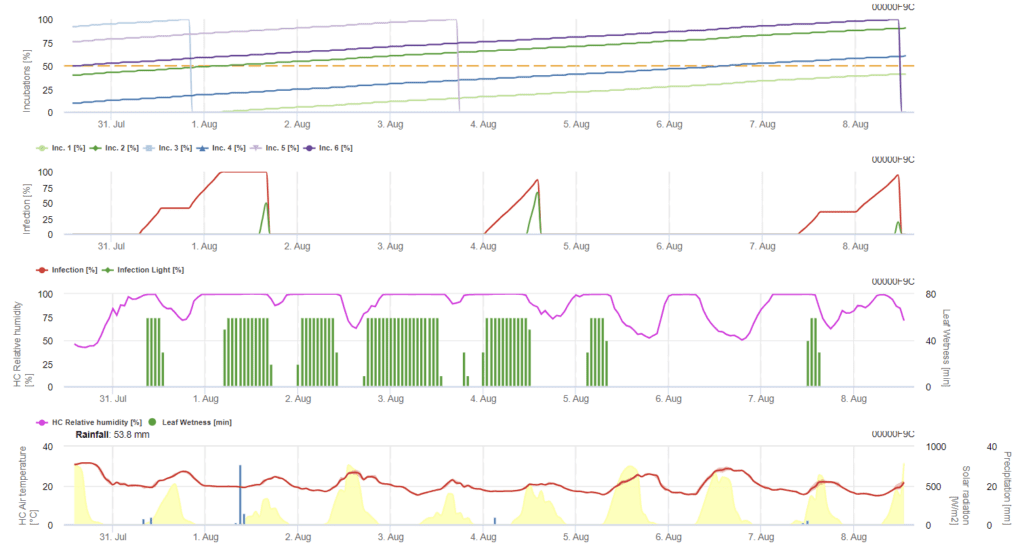
Инфекция Ramularia на ячмене в основном обусловлена влажными условиями. Поэтому мы начинаем расчеты с дождя, за которым следует увлажнение листьев или относительная влажность выше 85%.
Описаны два способа заражения:
- Инфекция: один раз, когда влажные условия только способствуют развитию инфекции.
- Инфекция: один раз, когда глобальное излучение необходимо для завершения события инфекции
Далее, при достижении заражения 100%, модель начинает определять время инкубации. Когда инкубационный период достигает 50%, рекомендуется контролировать поле на наличие нового инокулята, а когда он достигает 100%, прогнозируется появление некротических поражений на листьях.
Литература
- Хавис, Н. Д., Браун, Дж. К., Клементе, Г., Фрей, П., Едрычка, М., Качмарек, Дж. ... и Хесс, М. (2015). Ramularia collo-cygni- новый патоген ячменных культур. Фитопатология, 105(7), 895-904.
- Хусс, Х. (2002, апрель). Биология Ramularia collo-cygni. In Proc. Second Int. Workshop Barley Leaf Blights. Алеппо, Сирия (стр. 321-328).
- Уолтерс, Д. Р., Хавис, Н. Д., и Оксли, С. Дж. (2008). Ramularia collo-cygni: биология нового патогена ячменя. FEMS Microbiology Letters, 279(1), 1-7. https://grdc.com.au/__data/assets/pdf_file/0025/443509/GRDC_FS2103_Ramularia_03.pdf
Rhizoctonia solani
Патоген
Корневая гниль пшеницы вызывается ризоктонией Rhizoctonia solani. Патоген может выживать в течение многих лет в почве в виде склероций. В некоторых случаях он также сохраняется в виде мицелия на растительных остатках. При повышении температуры склероции активизируются и образуют массу гиф, что позволяет заражать растения, прикрепляясь к корням. Мицелий образует так называемые "инфекционные подушки", и гриб вторгается в ткани корня и колонизирует их. Корневая инфекция ослабляет проростки, что приводит к плохому росту, и снижает способность транспортировать воду и питательные вещества к надземным тканям растений, что в конечном итоге приводит к их гибели.
Симптомы
На ранних стадиях появляются голые участки, размер которых варьируется от нескольких сантиметров до нескольких метров в диаметре. Эти оголенные участки часто ассоциируются с чахлыми растениями, которые могут желтеть, увядать или даже приобретать пурпурную окраску. Зараженные растения могут сильно отставать в росте и проявлять признаки стресса от засухи или дефицита питательных веществ, что в некоторых случаях может привести к преждевременной гибели.
На стеблях и корнях ниже линии почвы появляются красновато-коричневые поражения, которые по мере развития болезни становятся все более утопленными. Корневая гниль может снижать нодуляцию и приводить к тому, что корневая кора легко ломается, в результате чего кончики копья становятся коричневыми.
модель FieldClimate
Модель риска Rhizoctonia solani
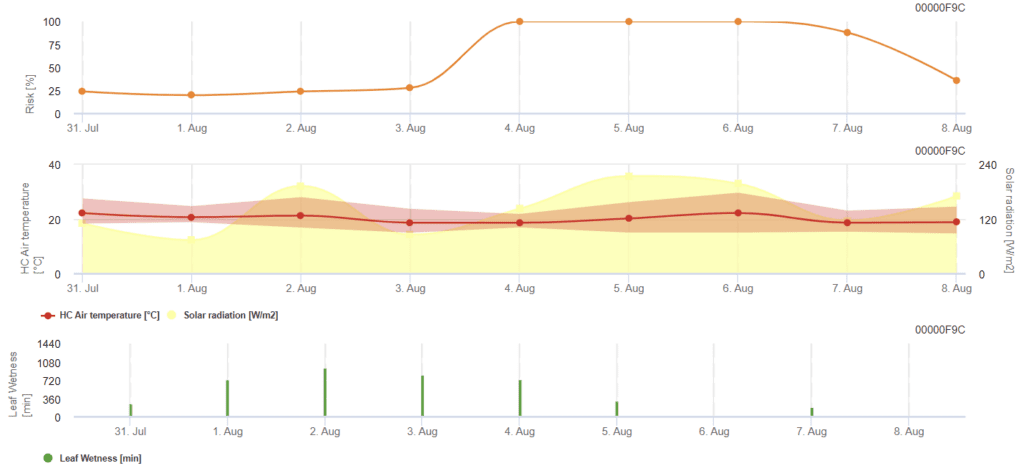
Необходимы датчики:
- Температура воздуха
- Солнечная радиация
- Влажность листьев
Модель рассчитывает рискованные периоды Rhizoctonia solani путем проверки условий за последние 120 часов. В результате получается значение риска от 0 до 100, что указывает на благоприятные условия для развития заболевания.
При низком риске опрыскивание не требуется. В периоды умеренного риска интервал между опрыскиваниями может быть увеличен, а в периоды высокого риска - сокращен, или рекомендовано использование более эффективных препаратов.
В случае последовательного увлажнения листьев он накапливает значения, зависящие от температуры, за каждую минуту:
- От 12 °C до 15 °C: накопление 1 в минуту
- 16 °C - 17 °C: накопление 2 в минуту
- 18°C и выше: накопление 4 в минуту
По окончании периодов увлажнения листьев он оценивает накопленные значения:
- Значения > 4096: Риск увеличивается на 64 пункта и вычитание 4096 из значения
- Значения остатка > 2048: риск увеличивается на 16 пунктов и вычитание 2048 из значения
- Значения остатков >1024: Риск увеличивается на 4 и вычитание 1024 из значения
Если глобальное излучение последовательно превышает 800 Вт/м², он накапливает время в минутах и оценивает значения, когда излучение становится меньше:
- Значение > 512: риск - 32 балла, значение - 512
- Значение > 256: Риск - 8 баллов, значение - 256
- Стоимость > 128: Риск - 2 балла, ценность - 128
Литература
- https://cropprotectionnetwork.org/encyclopedia/rhizoctonia-root-rot-of-wheat#:~:text=It%20is%20caused%20by%20Rhizoctonia,result%20in%20premature%20plant%20death.
- https://ahdb.org.uk/knowledge-library/rhizoctonia-stunt-symptoms-and-risk-in-cereals
- https://cropwatch.unl.edu/rhizoctonia-root-rot#:~:text=Disease%20Symptoms&text=These%20reddish%20brown%20lesions%20may,uneven%20because%20of%20stunted%20plants.
- https://extensionaus.com.au/FieldCropDiseasesVic/docs/identification-management-of-field-crop-diseases-in-victoria/soil-borne-diseases/rhizoctonia-root-rot/
- https://www.florimond-desprez.com/es/wp-content/uploads/sites/6/2015/11/rhizoctonia_eng.pdf
Мучнистая роса
Патоген
Blumeria graminis является возбудителем мучнистой росы на пшенице и ячмене. Он может перезимовать в виде мицелия или клейстотеции. Весной споры прорастают и заражают растения-хозяева в прохладных и влажных условиях, не требуя свободной воды на поверхности растений.
Гриб размножается как бесполым, так и половым путем.
В асексуальном цикле патоген проходит быстрые циклы инфицирования и производства конидий (бесполых спор), которые играют ключевую роль в распространении заболевания. При благоприятных условиях конидии образуются в мицелии каждые 7-10 дней. Распространяясь ветром, конидии попадают на нового хозяина, прорастают и образуют аппрессории и гаустории для извлечения питательных веществ из растения. Конидии Blumeria graminis могут прорастать даже при низкой влажности и различных температурах.
В половом цикле гриб производит клейстотеции - выносливые структуры, способные хорошо переносить неблагоприятные условия. Клистотеции содержат аскоспоры (половые споры), и новые инфекции начинаются, когда эти споры высвобождаются.
Симптомы

Мучнистая роса на пшенице и ячмене влияет на урожайность зерна, уменьшая количество головок и снижая размер и вес ядра. Чем раньше происходит заражение, тем сильнее ущерб.
Ячмень проявляет возрастную устойчивость к мучнистой росе. По мере созревания ячменя вместо типичных пятен мицелия на листьях могут появляться резко очерченные черно-коричневые пятна ("tar-spots").
Пшеница особенно восприимчива к мучнистой росе между периодом кущения и молочной спелости, особенно когда поражаются флаговые листья и шелуха. Однако, по сравнению с ячменем, пшеница лучше переносит раннее заражение.
Бело-серая мучнистая роса развивается на листьях, стеблях и головках. Грибковые образования наиболее заметны на верхней поверхности листьев, но могут развиваться и на нижней стороне. Первоначально пустулы выглядят белыми, но по мере созревания постепенно становятся серыми или коричневыми и могут сливаться, образуя большие массы, часто окруженные хлорозом. На противоположной стороне зараженных листьев ткани становятся желтыми, а затем приобретают коричневый оттенок. Cleistothecia также видны как маленькие, круглые, черные точки в старых серых колониях. В тяжелых случаях листья могут отмирать.
модель FieldClimate
Модель мучнистой росы пшеницы
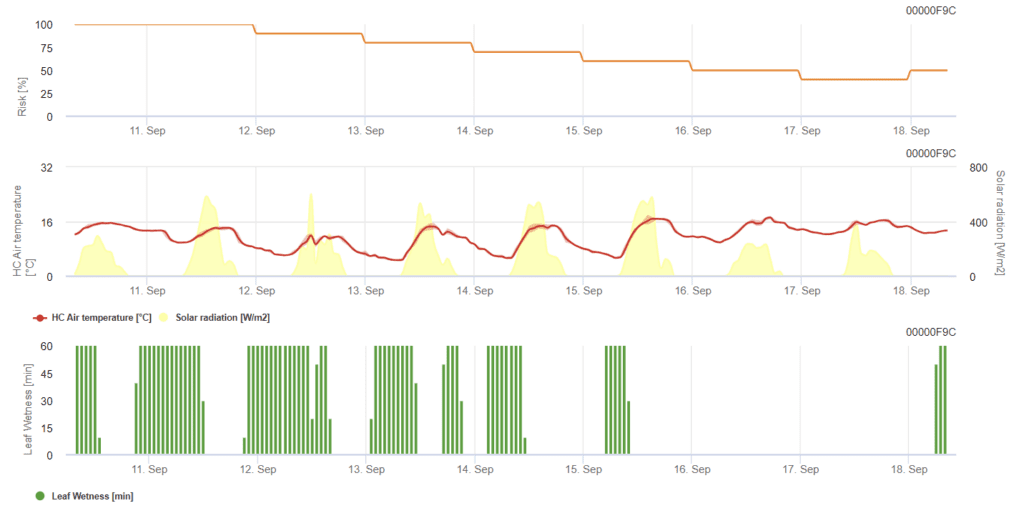
Необходимы датчики:
- Температура воздуха
- Влажность листьев
- Солнечная радиация
Модель определяет риск возникновения мучнистой росы по шкале от 0 (отсутствие инфекции) до 100% (полная инфекция). Она актуальна на стадии BBCH от 21 до 39 для ячменя и от 21 до 75 для пшеницы и овса.
Стадия BBCH - это шкала роста для описания развития растений. Имеет две цифры, шкала варьируется от 00 до 99 - 00 относится к обработке семян, а 99 - к послеуборочной обработке. Первая цифра указывает на конкретную стадию развития: 0 - прорастание, 1 - развитие листьев, 2 - обработка почвы, 3 - удлинение стебля, 4 - ботва, 5 - появление соцветий и головки, 6 - цветение и антезис, 7 - развитие плодов, 8 - созревание и 9 - сенисценция.
- BBCH 21: Кущение - Начало кущения; можно обнаружить первый кущение.
- BBCH 39: Удлинение стебля - стадия флагового листа; флаговый лист полностью развернут, лигула только видна.
- BBCH 75: Развитие плодов - средняя молочность; зерно молочное, зерна достигают конечного размера, но еще зеленые.
Риск повышается при температуре от 12 °C до 21 °C в течение большей части дня и низкой глобальной радиации. Влажность листьев, высокая глобальная радиация и высокие температуры выше 32 °C, напротив, снижают риск.
Литература
- Both, M., & Spanu, P. D. (2004). Blumeria graminis f. sp. hordei, облигатный патоген ячменя. Ежегодные обзоры растений, 11, 202-218.
- Канфер, Б. М. (2002). Мучнистая роса. Хлебная пшеница: улучшение и производство, 30, 317-330.
- Der Gräser, E. M. Krankheiten und Schädlinge des Getreides. Lancashire, P. D., Bleiholder, H., Boom, T. V. D., Langelüddeke, P., Stauss, R., Weber, E., & Witzenberger, A. (1991). Единый десятичный код для стадий роста сельскохозяйственных культур и сорняков. Анналы прикладной биологии, 119(3), 561-601. https://ohioline.osu.edu/factsheet/plpath-cer-11
Коричневая ржавчина
Патоген
Существует три основных вида ржавчины и патогенов:
- Листовая/бурая ржавчина: Puccinia triticina
- Стебель/Черная ржавчина: Puccinia graminis
- Полоска/желтая ржавчина: Puccinia striiformis
Бурая ржавчина - наиболее распространенное ржавчинное заболевание пшеницы. Черная ржавчина также известна как летняя ржавчина из-за обильного развития блестящих черных телиоспор. Это самое разрушительное ржавчинное заболевание, которое при благоприятных условиях вызывает 50 % потерь за один месяц. Желтая ржавчина - это болезнь пшеницы в более холодном климате, обычно связанная с высокими горами и северными широтами. Ее характерными признаками являются урединиоспоры желтого цвета. В тяжелых случаях она может нанести такой же значительный ущерб, как и черная ржавчина.
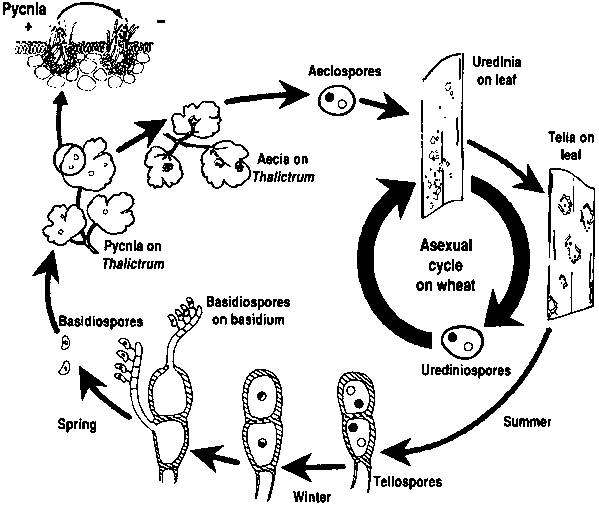
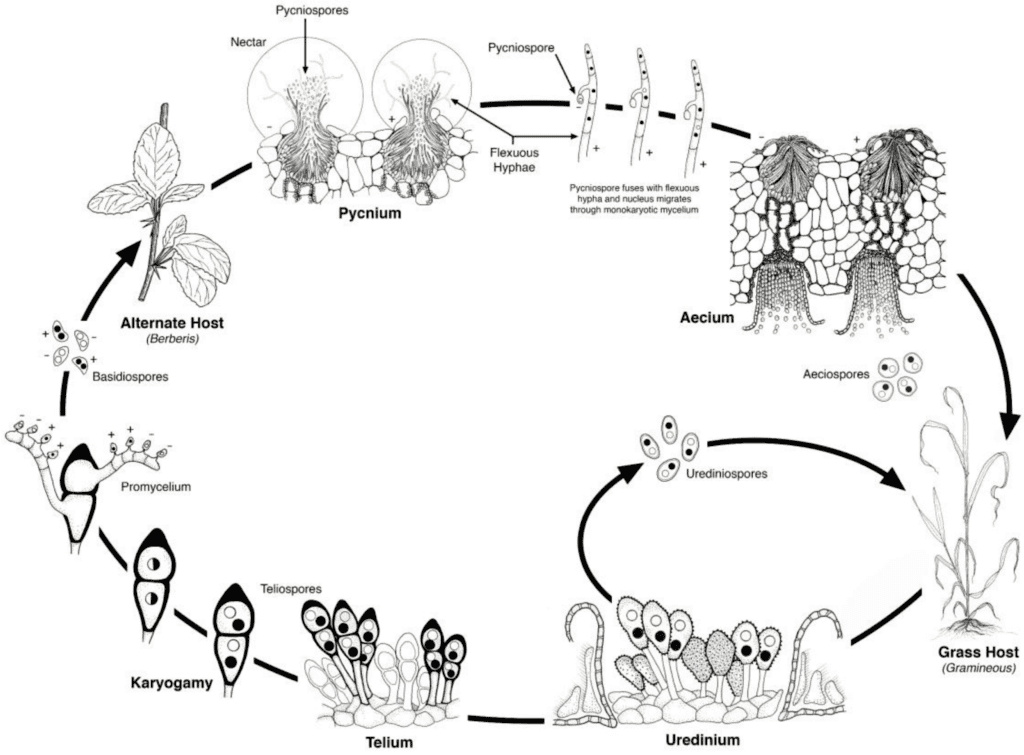
Патогены ржавчины пшеницы проходят как бесполый, так и половой репродуктивные циклы и нуждаются в двух растениях-хозяевах - хозяйственном и альтернативном. Хозяйственным хозяином является пшеница, а альтернативным - обычно сорняк или местное растение, позволяющее грибкам пройти половую фазу. Puccinia striiformis не имеет альтернативного хозяина, состоит из урединиальной и телиальной стадий.
При бесполом цикле урединиоспоры образуются на растении-хозяине и могут продолжать заражать его многократно, что приводит к быстрому и широкому распространению инфекции при благоприятных условиях.
Половой цикл патогена начинается с того, что телиоспоры, образующиеся при урединиальной инфекции на растении-хозяине, прорастают и подвергаются мейозу, в результате чего образуются базидиоспоры. Эти базидиоспоры распространяются на альтернативного хозяина, где инициируют инфекцию, в результате чего образуется пикнида, содержащая пикниоспоры и восприимчивые гифы. Оплодотворение происходит, когда пикниоспоры из одного вида спаривания переносятся в противоположный через нектар. После оплодотворения на нижней стороне листьев альтернативного хозяина развиваются аэциальные чашечки, из которых выходят аэциоспоры. Эти аэциоспоры рассеиваются и заражают новых хозяев, после чего происходит урединиальное заражение, завершающее жизненный цикл патогена.
Симптомы

A) Puccinia graminis
Б) Puccinia striiformis
C) Puccinia triticina
Puccinia triticina
P. triticina В основном поражает листовые пластинки, но иногда может поражать влагалища листьев, ботву и ости, образуя небольшие желтые пятна на верхней поверхности листьев. По мере развития болезни эти пятна превращаются в пустулы оранжевого цвета, окруженные желтым ореолом. Пустулы производят оранжевые или черные споры, видимые на листьях. В отличие от черной ржавчины, она производит меньше телиоспор. На некоторых листьях могут появляться сверхчувствительные пятна или урединии, окруженные хлоротическими или некротическими участками.
Puccinia graminis
P. graminis В основном поражает стебли, но может также поражать листья, влагалища, ботву, ости и даже семена. Вначале появляются красновато-коричневые поражения, а по мере развития болезни внутри пустул образуются черные телиоспоры. Массы красно-кирпичных урединиоспор сначала развиваются на стеблях и влагалищах листьев, появляются мелкие хлоротичные пятна, которые перерастают в линейные или ромбовидные пустулы, которые могут увеличиваться в размерах. По мере созревания урединиоспор их образование прекращается, и появляется слой черных телиоспор, из-за чего стебли в конце сезона выглядят почерневшими. В тяжелых случаях инфекция ослабляет стебли растений, что приводит к полеганию.
Puccinia striiformis
Характерная особенность P. striiformis это наличие желтых пустул прямой формы. Пустулы появляются в виде узких, вытянутых полос различной длины, часто сопровождаются хлорозом и некрозом. По мере созревания болезни внутри пустул развиваются желто-оранжевые споры, а окружающие ткани становятся коричневыми и высыхают, создавая выжженный вид.
модель FieldClimate
Модель пучковой ржавчины
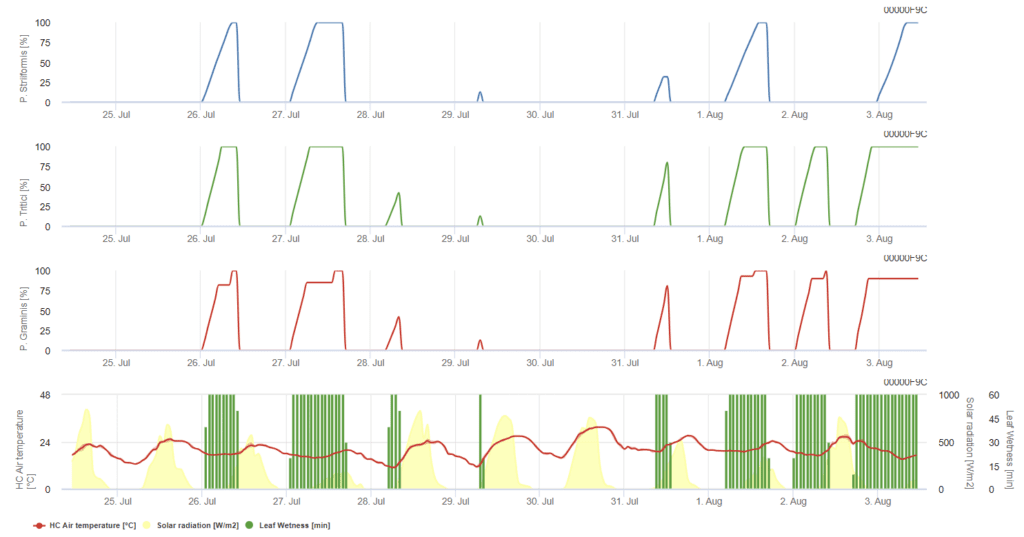
P. triticina, P. graminis, P. striiformis представлены в виде трех различных цветных графиков.
Модель заражения Puccinia triticna
Модель предполагает, что для заражения необходима часовая температура увлажнения листьев 90°C в диапазоне температур воздуха от 5°C до 30°C. Условия похожи на P. graminisно с более низким температурным порогом в 5°C.
При заражении 100% следует рассмотреть возможность проведения лечебных мероприятий по защите растений. Если риск находится на уровне 80% и прогноз погоды предсказывает большее количество периодов увлажнения листьев, можно провести защитные мероприятия по листьям.
Влажность листьев при накопленной среднечасовой температуре 90°C:
- (если T <= 22,5°C, то ∑(Th) иначе ∑ (22,5-(Th-22,5))
- 5°C < Темп. < 30°C
Модель заражения Puccinia graminis
Заражение происходит через несколько часов после увлажнения листьев при оптимальных температурных условиях. Модель предполагает, что инфекции необходима часовая температура увлажнения листьев 80°C в диапазоне температур воздуха от 10°C до 35°C. Она предпочитает немного более высокую температуру, чем P. triticina и инфекция должна сопровождаться солнечным светом.
Когда проявляется инфекция 100%, условия благоприятны для гриба, поэтому следует рассмотреть возможность проведения мероприятий по защите растений.
Влажность листьев для накопленной среднечасовой температуры 80°C, затем световой период (150 Вт/м²) для накопленной среднечасовой температуры 30°C:
- (если T <= 24°C, то ∑(Th), иначе ∑ (Th-24))
- 10°C < Темп. < 35°C
Модель заражения Puccinia striiformis
Puccinia striiformis это ржавчина пшеницы прохладного климата с оптимальной температурой уже от 15°C. Заражение происходит через несколько часов после увлажнения листьев при оптимальных температурных условиях. Модель предполагает, что для заражения необходима накопленная часовая температура увлажнения листьев 80°C в диапазоне температур воздуха от 5°C до 20°C. В периоды с низкой интенсивностью освещения заражения не происходит.
До того, как график достигнет 100%, можно провести защитное применение, в то время как после этого следует рассмотреть стратегии лечебной защиты (системные).
Влажность и освещенность листьев для накопленной среднечасовой температуры 80°C:
- (если T <= 15°C, то ∑(Th), иначе ∑ (Th-15))
- 5°C < Темп. < 20°C
Литература
- Bolton, M. D., Kolmer, J. A., & Garvin, D. F. (2008). Листовая ржавчина пшеницы, вызываемая Puccinia triticina. Молекулярная патология растений, 9(5), 563-575.
- Чен, X. М. (2005). Эпидемиология и борьба с полосатой ржавчиной [Puccinia striiformis f. sp. tritici] на пшенице. Канадский журнал патологии растений, 27(3), 314-337.
- Фигероа, М., Хаммонд-Косак, К. Е., и Соломон, П. С. (2018). Обзор болезней пшеницы - полевая перспектива. Молекулярная патология растений, 19(6), 1523-1536.
- Guide, A. Leaf, Stem, and Stripe Rust Diseases of Wheat. Leonard, K. J., & Szabo, L. J. (2005). Стеблевая ржавчина мелких зерновых и трав, вызываемая Puccinia graminis. Молекулярная патология растений, 6(2), 99-111.
- Колмер, Дж. (2013). Листовая ржавчина пшеницы: биология патогена, вариабельность и устойчивость хозяина. Леса, 4(1), 70-84.
- Сингх, Р. П., Уэрта-Эспино, Х., Роелфс, А. П., и Кертис, Б. К. (2002). Ржавчина пшеницы. Рост, 2(25), 35.
Рекомендуемое оборудование
Проверьте, какой набор датчиков необходим для мониторинга возможных заболеваний этой культуры.
