
Grapevine modele choroby
Mączniak rzekomy
Patogen
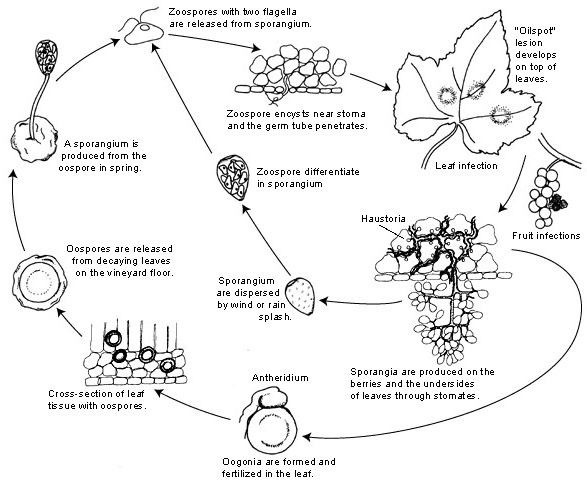
Patogenem mączniaka rzekomego winogron jest Plasmopara viticola. Jest pasożytem obligatoryjnym, co oznacza, że do wzrostu potrzebuje zielonych i świeżych organów winorośli. Ma zarówno bezpłciowe, jak i płciowe stadia reprodukcyjne - zoospory i oospory. W związku z tym istnieją dwa etapy infekcji: infekcja pierwotna i wtórna.
Pierwotna infekcja rozpoczyna się, gdy zimujące oospory kiełkują, tworząc sporangia wiosną, gdy pogoda staje się ciepła. Sporangia są produkowane w nocy, ponieważ światło słoneczne hamuje sporulację. Grubościenne oospory pomagają patogenowi przetrwać trudne warunki zimowe i zainicjować pierwotną infekcję. Sporangia są rozpraszane przez deszcz lub wiatr i uwalniają zoospory w wolnej wodzie. Do skutecznej infekcji niezbędna jest odpowiednio długa wilgotność liści lub opady deszczu.
Wtórna infekcja jest możliwa tylko w obecności dojrzałych plam olejowych i następuje przez zoospory i sporangia. Zoospory i sporangia są bardzo wrażliwe na niską wilgotność i światło, co skraca ich żywotność, co oznacza, że większość infekcji następuje wkrótce po uwolnieniu. Zoospory wnikają do tkanek roślinnych przez rurki zarodnikowe i rozwijają strzępki w celu dalszej infekcji. Strzępki te tworzą oleiste zmiany po okresie inkubacji, który waha się od 5 do 21 dni w zależności od temperatury - im niższa temperatura, tym dłużej to trwa.
Gdy pogoda ponownie staje się zimna, co jest niekorzystne dla patogenu, przestawia się on na produkcję płciową, wytwarzając oospory. Oospory te pozostają uśpione podczas zimy, a cykl się powtarza.
Symptomy

Na górnej powierzchni liści pojawiają się małe żółte zmiany, czasami otoczone brązowawą aureolą. Plamy olejowe rozszerzają się i łączą w miarę dojrzewania, a aureole zanikają. Sporangia wytwarzają później białą, bawełnianą pleśń na spodniej stronie zmian, po czym następuje nekroza. Oleistobrązowe obszary pojawiają się również na pędach, łodygach i jagodach. W ciepłe, wilgotne noce mogą one pokryć się białym puchem w wyniku zarodnikowania. Silna infekcja powoduje przedwczesne opadanie owoców.
Modele FieldClimate
- W FieldClimate dostępne są dwa modele - infekcji pierwotnej i wtórnej.
- Pierwszy wykres przedstawia czas inkubacji po zakończeniu infekcji. Dolne wykresy przedstawiają postęp infekcji dla słabego, umiarkowanego i ciężkiego poziomu nasilenia. Infekcję należy założyć, gdy rosnąca krzywa na wykresie osiągnie 100% - opryskiwanie można rozważyć, jeśli wykazany zostanie poważny poziom infekcji.
Zakażenie pierwotne
Potrzebne czujniki:
- Temperatura powietrza
- Wilgotność względna
- Wilgotność liści
- Opady
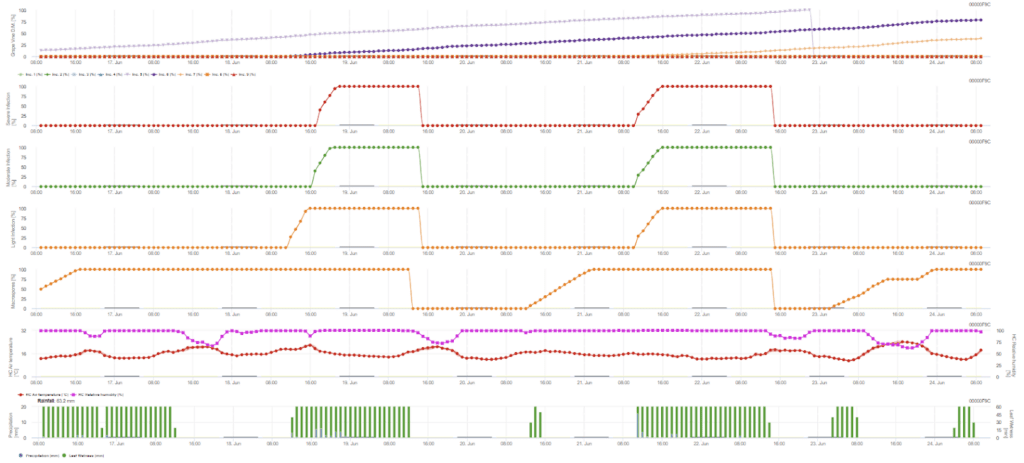
Infekcja pierwotna sprawdza, czy pogoda jest odpowiednia do rozwoju zarodników. Dzieje się tak tak długo, jak liście są mokre lub wilgotność względna po deszczu nie spada poniżej 70%. Sporangia mogą rozwinąć się w ciągu 16 do 24 godzin w zależności od temperatury. Ciągły deszcz o wysokości 5 mm jest interpretowany jako silny opad, który może rozprzestrzeniać zoospory.
Wtórna infekcja
Potrzebne czujniki:
- Temperatura powietrza
- Wilgotność względna
- Wilgotność liści
- Opady
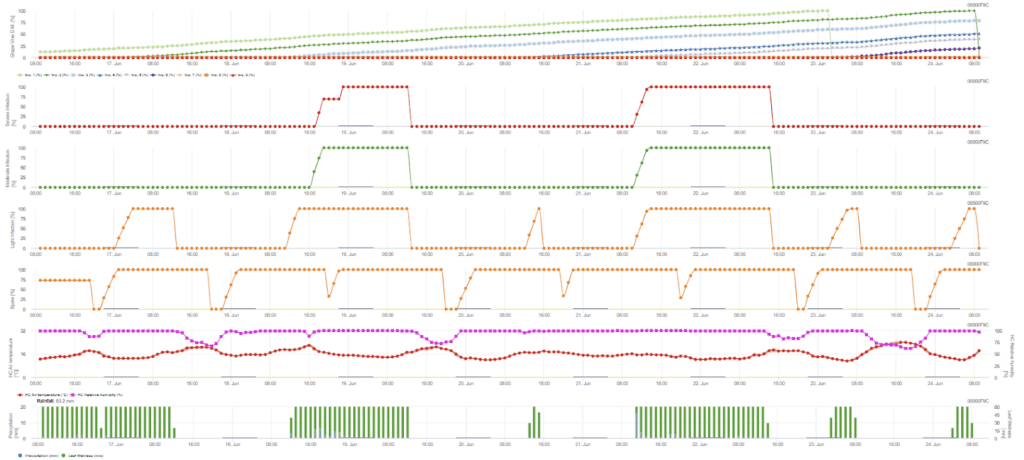
Wtórna infekcja sprawdza się, gdy temperatura jest wyższa niż 12 °C, a wilgotność względna przekracza 95%. Szybkość produkcji sporangiów wzrasta wraz ze wzrostem temperatury do 23 °C. Jeśli warunek ten utrzymuje się przez skumulowaną temperaturę godzinową powyżej 50 °C, zakładamy, że sporulacja została zakończona i w winnicy pojawiły się nowe sporangia. Skumulowana temperatura 50°C odpowiada na przykład 4 godzinom z temperaturą 13°C lub 3 godzinom z temperaturą 17°C. Sporangia giną szybko, gdy robi się cieplej i bardziej sucho - gdy wilgotność względna spada poniżej 50%, resetujemy ją do 0, a gdy temperatura przekracza 29 °C, nie może dojść do sporulacji.
Literatura
- Ash, G. (2000). Mączniak rzekomy winogron. The Plant Health Instructor.
- Gessler, C., Pertot, I., & Perazzolli, M. (2011). Plasmopara viticola: przegląd wiedzy na temat mączniaka rzekomego winorośli i skutecznego zwalczania choroby. Phytopathologia Mediterranea, 50(1), 3-44.
- Kennelly, M. M., Gadoury, D. M., Wilcox, W. F., Magarey, P. A., & Seem, R. C. (2007). Primary infection, lesion productivity, and survival of sporangia in the grapevine downy mildildew pathogen Plasmopara viticola. Phytopathology, 97(4), 512-522.
- Koledenkova, K., Esmaeel, Q., Jacquard, C., Nowak, J., Clément, C., & Ait Barka, E. (2022). Plasmopara viticola - czynnik sprawczy mączniaka rzekomego winorośli: od taksonomii do zarządzania chorobami. Frontiers in Microbiology, 13, 889472.
Mączniak rzekomy
Patogen
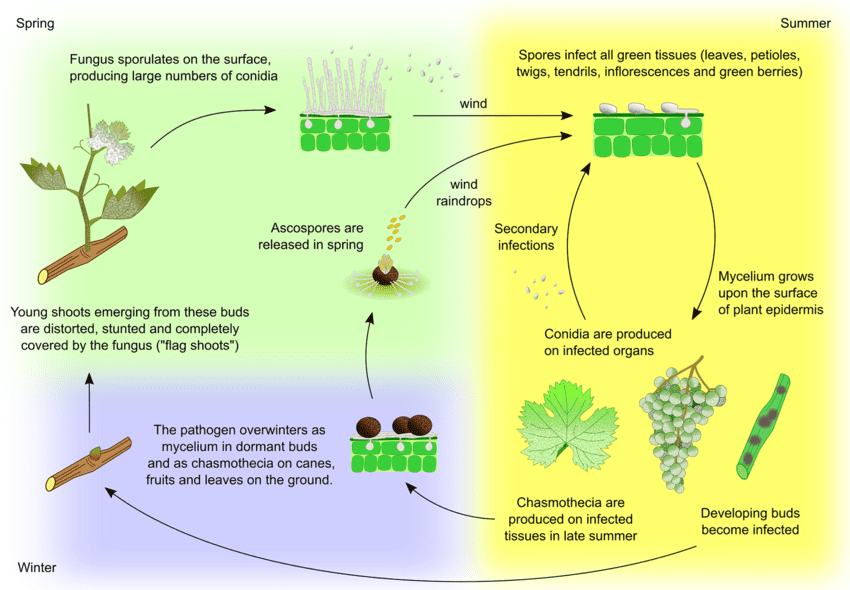
Patogenem mączniaka prawdziwego winogron jest Uncinula necator. Istnieją dwa główne źródła inokulum - zimująca grzybnia i askospory z cleistothecia - które mogą mieć różne znaczenie w zależności od regionu.
Wiosną grzybnia tworzy pędy flagowe. Pędy flagowe to częściowo lub całkowicie pokryte pleśnią pędy powstałe z ukrytych zainfekowanych pąków. Ponieważ wewnątrz tworzą się kolonie, pędy te są dobrze widoczne i często mają zdeformowane liście.
Cleistothecia uwalnia askospory wczesną wiosną. Opady deszczu odgrywają ważną rolę w uwalnianiu askospor. Wraz ze wzrostem temperatury dehiscencja występuje częściej. Askospory kiełkują w ciągu 12 godzin, tworząc rurki zarodnikowe i appressorium na tkankach roślinnych, co prowadzi do tworzenia rozproszonych kolonii.
Wtórna infekcja następuje poprzez konidia wytwarzane w koloniach. Podobnie jak askospory, kiełkują one i rozwijają rurki zarodnikowe oraz appressorium. U. necator nie potrzebuje wolnej wody do infekcji ani wysokiej wilgotności względnej do tworzenia konidiów. Gdy warunki pogodowe stają się mniej korzystne, grzyb tworzy cleistothecia. Zimuje, przeżywając w cleistothecia lub jako wegetatywna grzybnia w uśpionych zainfekowanych pąkach i cykl się powtarza.
Symptomy

Objawy można znaleźć na wszystkich zielonych częściach winorośli. Pędy rozwijają kolonie i pokrywają się biało-szarawą grzybnią, znaną jako "pędy flagowe". Wytwarzają one zniekształcone liście. Kolonie mączniaka występują również na liściach - na dolnej lub obu stronach. Na jagodach pojawiają się popielatoszare plamy, a w ciężkich przypadkach dochodzi do ich pękania. Na pędach pojawiają się ciemnoczerwono-brązowe plamy i mogą one zamierać od końców.
Modele FieldClimate
Zakażenie askosporami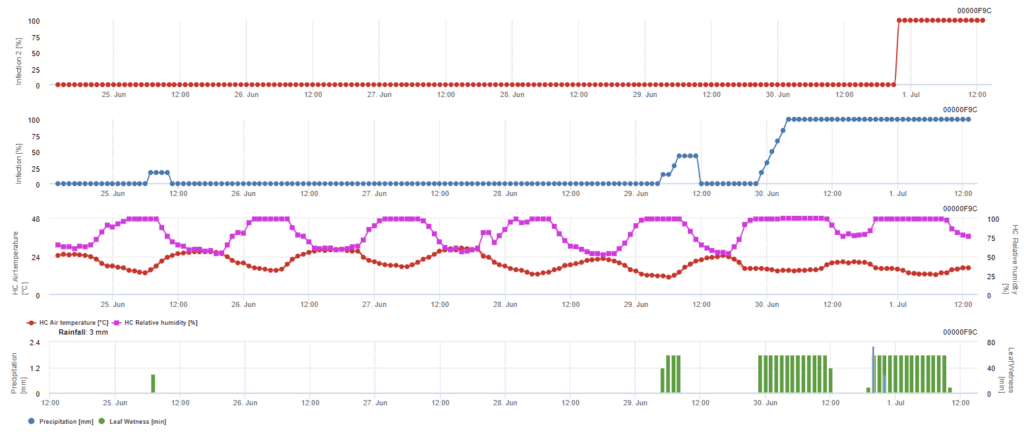
Potrzebne czujniki:
- Temperatura powietrza
- Wilgotność względna
- Wilgotność liści
- Opady
Model ten jest zalecany, gdy askospory powstają podczas mroźnej zimy (a więc nie są infekowane przez grzybnię). Infekcja askosporami przewiduje uwalnianie askosporów i początkową infekcję w oparciu o średnie temperatury podczas wydłużonych okresów wilgotności liści. Do obliczeń wymagane jest około 2,5 mm opadów deszczu, aby uwolnić askospory, a następnie co najmniej 8 do 12 godzin wilgotności liści i temperatury od 10 do 15°C. Po wystąpieniu infekcji model przechodzi do fazy oceny ryzyka choroby (kalifornijski model ryzyka) i opiera się na wpływie temperatury na tempo reprodukcji patogenu.
Kalifornijski model ryzyka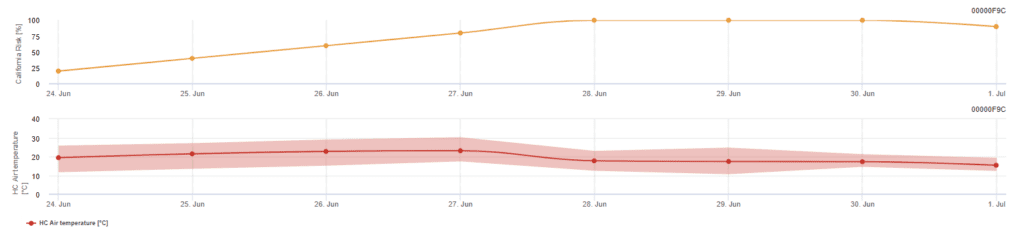
Potrzebne czujniki:
- Temperatura powietrza
Model ten opiera się na badaniach laboratoryjnych przeprowadzonych w Kalifornii. Po uwolnieniu askospor i wykiełkowaniu (model), późniejszy rozwój i rozmnażanie mączniaka prawdziwego zależy od temperatury. Ocenia on temperatury i ryzyko rozwoju mączniaka prawdziwego za pomocą indeksu od 0 do 100 punktów.
Trzy dni z rzędu z co najmniej sześcioma kolejnymi godzinami temperatury między 21 a 30'c są wymagane do zainicjowania wskaźnika oceny ryzyka. Zyskuje on 20 punktów za każdy dzień, w którym występuje 6 lub więcej kolejnych godzin z temperaturą między 21 a 32°C i traci 10 punktów za te, które tego nie robią lub gdy temperatura przekracza 32°C lub spada poniżej 21°C.
Niskie wartości indeksu 0~30 wskazują, że patogen nie rozmnaża się. Indeks 40~50 jest uważany za umiarkowany i oznacza, że mączniak prawdziwy rozmnaża się w ciągu około 15 dni. Wartości indeksu powyżej 60 wskazują, że patogen rozmnaża się szybko (co 5 dni), a ryzyko epidemii choroby jest duże.
Model ryzyka Pessl Instruments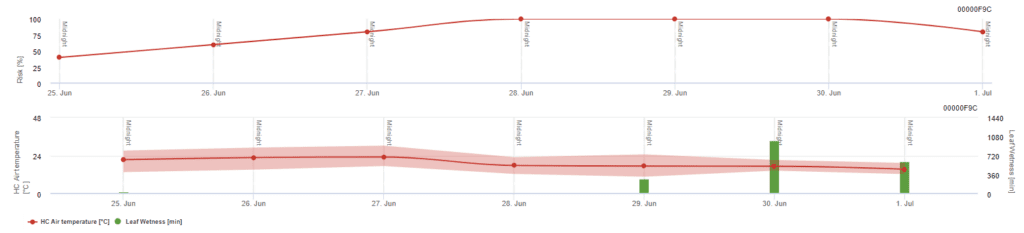
Potrzebne czujniki:
- Temperatura powietrza
- Wilgotność liści
Oprócz temperatury powietrza, wilgotność liści może być czynnikiem przewodnim, ponieważ długie okresy wilgotności liści prowadzą do zasiedlenia antagonistycznego grzyba (Ampelomyces quisqualis), co prowadzi do zmniejszenia liczebności U. necator. Podstawy modelu są równoważne z kalifornijskim modelem ryzyka, ale w tym modelu uwzględniono również wilgotność liści. Wilgotność liści dłuższa niż 8 godzin prowadzi do spadku o 10 punktów.
Niskie wartości indeksu 0~20 wskazują, że patogen nie rozmnaża się. Indeks 20~60 jest uważany za umiarkowany i obowiązuje normalny interwał opryskiwania. Wartości indeksu powyżej 60 wskazują, że patogen rozmnaża się szybko (co 5 dni), a ryzyko epidemii choroby jest duże, dlatego zaleca się skrócenie odstępów między opryskami.
Literatura
- Gadoury, D. M., & Pearson, R. C. (1990). Ascocarp dehiscence and ascospore discharge in Uncinula necator. Phytopathology, 80(4), 393-401.
- Gadoury, D. M., & Pearson, R. C. (1990). Germination of ascospores and infection of Vitis by Uncinula necator. Phytopathology, 80(11), 1198-1203.
- Hall, T. W. (2000). Epidemiologia mączniaka prawdziwego winogron, Uncinula necator, w dolinie Willamette.
- Halleen, F., & Holz, G. (2001). An Overview of the Biology, Epidemiology and Control of Uncinula Necator (Powdery Mildew) on Grapevine, with Ref Ere Nee to South Africa. South african journal of Enology and Viticulture, 22(2), 111-121.
- Rügner, A., Rumbolz, J., Huber, B., Bleyer, G., Gisi, U., Kassemeyer, H. H., & Guggenheim, R. (2002). Tworzenie zimujących struktur Uncinula necator i kolonizacja winorośli w warunkach polowych. Plant pathology, 51(3), 322-330.
Czarna zgnilizna
Patogen
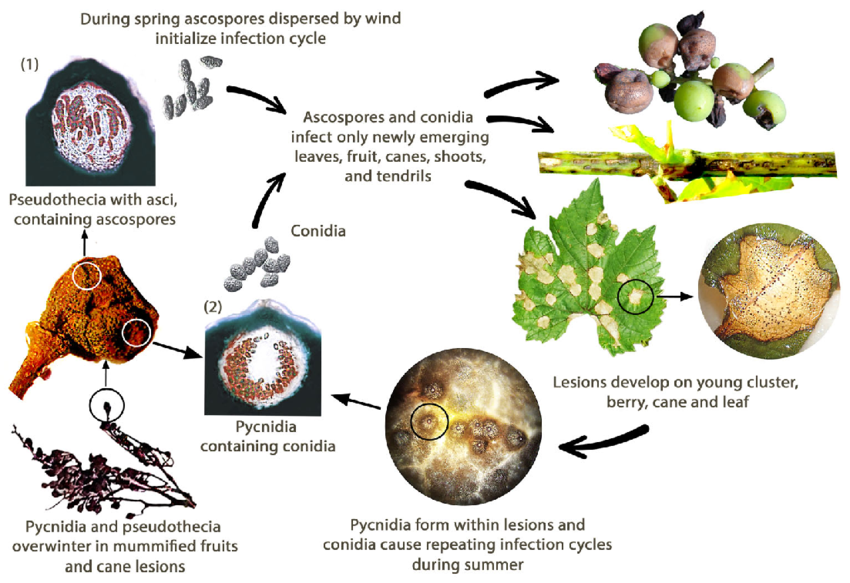
Czarna zgnilizna winorośli jest wywoływana przez grzyba Guignardia bidwellii. Grzyb zimuje w różnych częściach winorośli i może przetrwać ponad dwa lata w zmianach chorobowych zainfekowanych pędów.
Wiosną piknidia wytwarzają konidia (zarodniki bezpłciowe), a pseudothecia generują askospory (zarodniki płciowe). Konidia są zwykle rozprzestrzeniane na krótkie odległości, podczas gdy askospory mogą infekować na większe odległości. Zarodniki te są przenoszone przez wiatr i deszcz i infekują młode tkanki podatnych żywicieli, inicjując infekcje pierwotne. Konidia służą również jako inokulum wtórne, przyczyniając się do szybkiego i wielokrotnego rozprzestrzeniania się choroby.
W sierpniu piknidia przekształcają się w stadium zimujące, które wytwarza pseudothecia, generujące askospory. Askospory te są ważnym źródłem infekcji pierwotnych następnej wiosny.
Symptomy

Pojawiają się czerwonawo-brązowe plamy, które ostatecznie łączą się, często otoczone małymi czarnymi kropkami, które są strukturami grzyba znanymi jako piknidia, które wytwarzają konidia. Młode i szybko rosnące liście są szczególnie podatne na tę infekcję.
Infekcje owoców występują zwykle po opadnięciu kielicha, a większość objawów pojawia się, gdy owoc jest od połowy do prawie pełnego rozmiaru. Początkowo pojawiają się małe plamki otoczone brązowym pierścieniem, które następnie powiększają się i ciemnieją, ostatecznie pokrywając całą jagodę w miarę rozwoju choroby. W ciągu kilku dni zainfekowane jagody mogą ulec mumifikacji, pęknięciu lub przedwczesnemu opadnięciu.
Ponadto porażane są również inne części roślin, takie jak pędy, łodygi i wąsy. Pojawiają się owalne zmiany o barwie od fioletowej do czarnej, a na ich powierzchni rozrzucone są piknidia.
Model FieldClimate
Model czarnej zgnilizny w uprawie winorośli
Potrzebne czujniki:
- Temperatura powietrza
- Wilgotność względna
- Wilgotność liści
- Opady
Model jest pierwotnie oparty na literaturze opublikowanej przez Spottsa, ale z modyfikacjami Daniela Molitora. Wprowadzono trzy klasy nasilenia (lekkie, umiarkowane i ciężkie) podobne do modeli parcha jabłoni. W ciepłych temperaturach okres zwilżenia liści wynoszący 8 godzin jest wystarczający, aby sprzyjać infekcjom i zakłada się, że infekcja jest zakończona, gdy wykres osiągnie 100%.
Nasilenie infekcji zależy od czasu trwania optymalnej temperatury i okresu wilgotności grzyba. Infekcje spełniające kryteria Spotts są oceniane jako lekkie. Infekcje spełniające kryteria Spott przez 150% i 200% są oceniane odpowiednio jako umiarkowane i ciężkie infekcje.
W zależności od presji infekcyjnej, infekcje należy pokryć zapobiegawczo lub zastosować oprysk leczniczy wkrótce po infekcji. W umiarkowanym, półsuchym klimacie Mosel lub większości austriackich obszarów uprawy winorośli, opryskiwanie po stwierdzeniu lekkiej infekcji nie byłoby zalecane.
Literatura
- Wilcox, Wayne F. "Czarna zgnilizna Guignardia bidwellii." Arkusz identyfikacji choroby nr 102GFSG-D4. 2003. Cornell. 24 Oct. 2010
- http://www.nysipm.cornell.edu/factsheets/grapes/diseases/grape_br.pdf
- Ellis, Michael A. "Arkusz informacyjny dotyczący rolnictwa i zasobów naturalnych: Czarna zgnilizna winogron". Departament Patologii Roślin. The University of Ohio State Extension. 2008
- http://ohioline.osu.edu/hyg-fact/3000/pdf/HYG_3004_08.pdf
- Molitor, D. (2009). Untersuchungen zur Biologie und Bekämpfung der Schwarzfäule (Guignardia bidwellii) an Weinreben. Gesellschaft zur Förderung der Forschungsanstalt Geisenheim.
- Ries, S. M. (1999). Raporty o chorobach roślin: Black Rot of Grape. Integrated Pest Management at the Uni. of Illinois. http://ipm. illinois. edu/diseases/series700/rpd703.
- Spotts, R. A. (1977). Effect of leaf wetness duration and temperature on the infectivity of Guignardia bidwellii on grape leaves. Phytopathology, 67(11), 1378-1381.
- Szabó, M., Csikász-Krizsics, A., Dula, T., Farkas, E., Roznik, D., Kozma, P., & Deák, T. (2023). Czarna zgnilizna winogron (Guignardia bidwellii) - kompleksowy przegląd. Horticulturae, 9(2), 130.
- http://extension.cropsciences.illinois.edu/fruitveg/pdfs/771-BlackRotOfGrape.pdf
- https://www.missouribotanicalgarden.org/gardens-gardening/your-garden/help-for-the-home-gardener/advice-tips-resources/insects-pests-and-problems/diseases/fruit-spots/black-rot-of-grapes
mole jagodowe
Patogen

Lobesia botrana Zazwyczaj przechodzi od dwóch do trzech pokoleń rocznie, w zależności od regionu. Pierwsze pokolenie (maj i czerwiec) atakuje tylko kwiaty, więc leczenie jest konieczne tylko wtedy, gdy populacja ćmy jest szczególnie wysoka. Drugie pokolenie (lipiec i sierpień) i trzecie pokolenie powodują największe szkody, przy czym trzecie pokolenie jest szczególnie szkodliwe, ponieważ zbiega się w czasie z dojrzewaniem winogron. Czwarte pokolenie może wystąpić w cieplejszym klimacie, ale leczenie nie jest zwykle wymagane, ponieważ zbiega się ze zbiorem winogron.
Ćma zimuje jako poczwarki w kokonach, a gdy wiosną temperatura wzrasta, pojawiają się osobniki dorosłe pierwszego pokolenia, przy czym samce zwykle pojawiają się przed samicami. Lot pierwszego pokolenia rozpoczyna się w pobliżu pękania pąków i trwa od 4 do 5 tygodni, podczas których dochodzi do godów. Po jednym do dwóch dni po kryciu samice składają od 80 do 160 jaj.
Jaja o średnicy od 0,6 do 0,8 mm są widoczne gołym okiem. Początkowo kremowobiałe, zmieniają kolor na żółty w miarę rozwoju zarodka, z czarnym kolorem głowy larwy. Jaja wylęgają się po 66 stopniach Celsjusza (DDC), około 7 do 11 dni. Larwy oplatają części kwiatu, a ich rozwój trwa od 20 do 30 dni. Następnie następuje przepoczwarczenie, a dorosłe osobniki pojawiają się 6 do 14 dni później.
"Stopniodni" oblicza się, mierząc, jak bardzo średnia dzienna temperatura przekracza pewną podstawową temperaturę progową wymaganą do rozwoju. Wraz ze wzrostem temperatury powyżej wartości bazowej, stopniodni przybywa.
Dorosłe ćmy mają około 6 do 8 mm długości i rozpiętość skrzydeł od 11 do 13 mm. Samice są nieco większe od samców, choć obie mają skrzydła o podobnym mozaikowym wzorze.
Jaja drugiego i trzeciego pokolenia wykluwają się szybciej, w ciągu 3 do 5 dni. Samice składają jaja pojedynczo na zacienionych jagodach, a po wykluciu larwy wchodzą do jagód i wydrążają je. Jesienią noce dłuższe niż 11 godzin wywołują diapauzę, etap spoczynku, który pozwala poczwarkom lepiej tolerować zimno, umożliwiając im zimowanie.
Symptomy
Gąsienice pierwszego pokolenia żerują na kwiatostanach winorośli, wydrążając pąki kwiatowe i zwijając je w celu ochrony, co prowadzi do uszkodzeń w obrębie klastra. W drugim pokoleniu larwy atakują rozwijające się jagody, tworząc punkty wejścia dla patogenów grzybowych, takich jak Botrytis cinerea. To bezpośrednie żerowanie powoduje widoczne uszkodzenia, zwykle oznaczone ciemnymi plamami wokół miejsc żerowania. Trzecie pokolenie powoduje największe szkody, ponieważ larwy penetrują i żerują na dojrzewających jagodach.
Pozostają pomarszczone jagody i odchody larw. Strzępy tkanki naskórka jagód pozostają luźno przymocowane do szypułek, wraz z suchą, wydrążoną "skórką" jagód.
Model FieldClimate
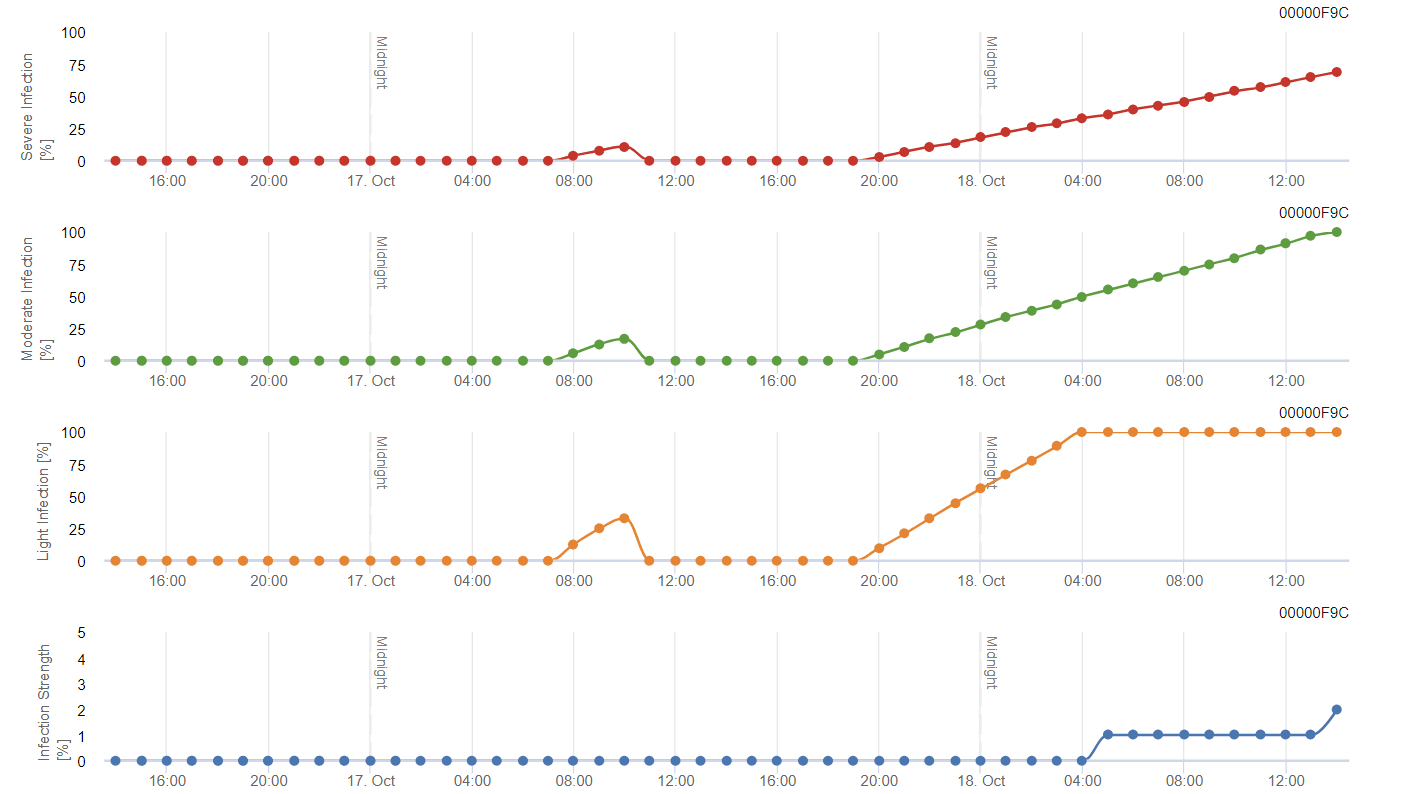
Model ćmy winogronowej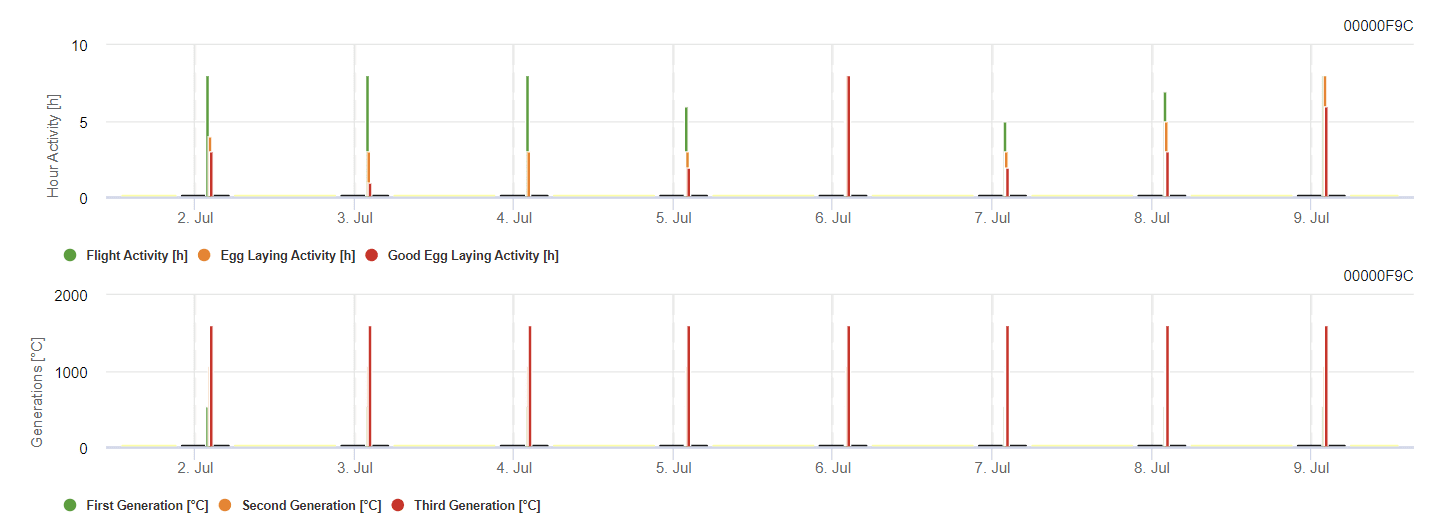
Potrzebny czujnik:
- Temperatura powietrza
Model oblicza ryzyko na podstawie temperatury powietrza. Pierwszy wykres przedstawia okresy aktywności lotnej ze składaniem jaj i dobrą aktywnością składania jaj przez owada. Drugi wykres pokazuje, jakiego pokolenia należy się spodziewać w danym okresie. Na trzecim wykresie wyświetlane są dane klimatyczne, które pokazują akumulację stopniodni (temperatury > 8°C do 24°C na godzinę podzielone przez 24).
Literatura
- Varela, L. G., Smith, R. J., Cooper, M. L., & Hoenisch, R. W. (2010). Europejska ćma winorośli, Lobesia botrana. Napa Valley vineyards. Pract. Winery Vineyard, 2010, 1-5.
- https://ipm.ucanr.edu/invasive-and-exotic-pests/european-grapevine-moth/
- https://www.ages.at/en/plant/plant-health/pests-from-a-to-z/grape-berry-moth
Szara pleśń
Patogen
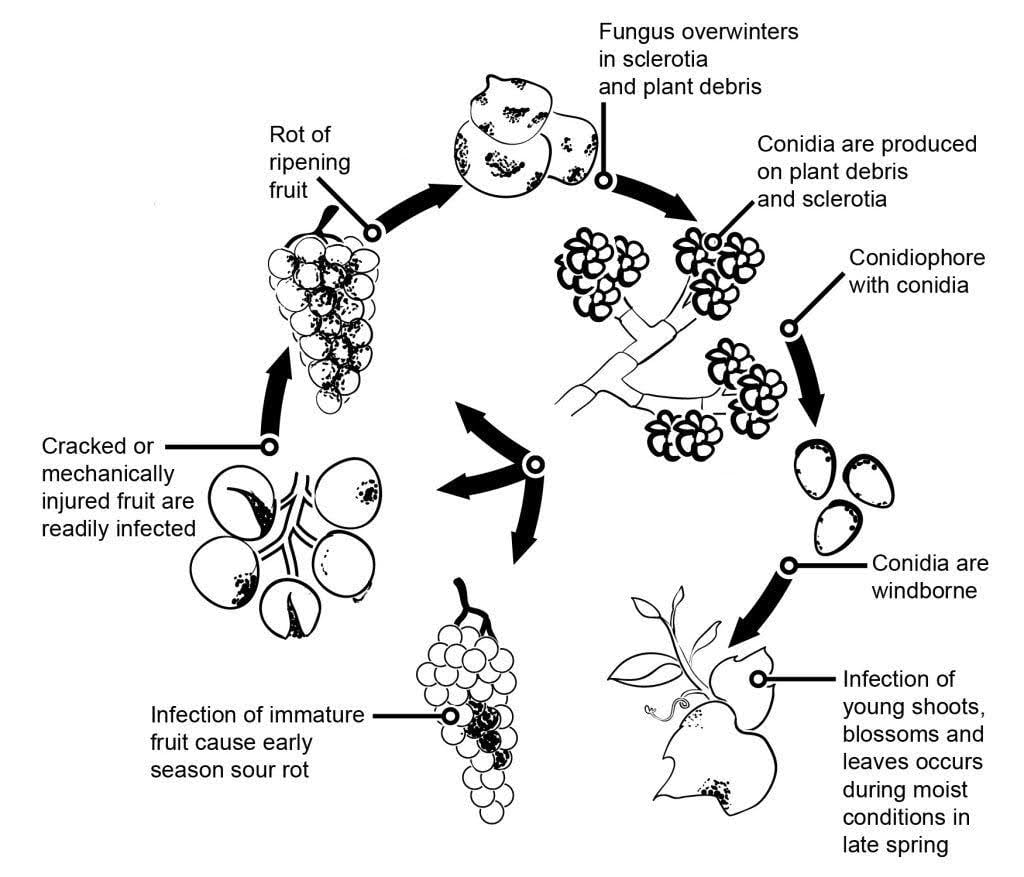
Patogenem szarej pleśni w winorośli jest Botrytis cinerea.
Na epidemiologię szarej pleśni znaczący wpływ mają utajone infekcje zainicjowane przez infekcje kwiatów. Zidentyfikowano różne szlaki od kwiatu do owocu: Grzyb infekuje trzonek kwiatu i dociera do zalążni, gdzie pozostaje utajony ze względu na wcześniej utworzony mechanizm obronny rośliny. Infekcje przez pręciki, płatki i działki są również krytyczne. B. cinerea może infekować pręciki i systematycznie rosnąć w kierunku pojemnika, rozprzestrzeniając się na szypułkę i tkanki naczyniowe w jagodach. Inne ścieżki również obejmują saprofityczny wzrost patogenu.
Zimujące grzybnie lub sklerocja są głównym źródłem infekcji na wiosnę. Konidia (bezpłciowe zarodniki) są wytwarzane i rozpraszane przez wiatr i deszcz. Po wylądowaniu konidia kiełkują, tworząc rurki zarodnikowe i appressoria, które penetrują i infekują roślinę. Grzyb może pozostawać w stanie utajonym do momentu dojrzewania owoców i wzrostu zawartości cukru. Konidia generowane z pierwotnych źródeł inokulum podlegają dobowemu cyklowi inicjacji, produkcji i rozprzestrzeniania.
Podczas gdy stadium płciowe B. cinerea jest rzadko obserwowane, patogen staje się bardziej aktywny w miarę dojrzewania jagód. Zwiększona zawartość cukru w jagodach zwiększa podatność na infekcję. W ten sam sposób, kwiaty są bardzo podatne na infekcję, gdy starzeją się, a obfity pyłek zwiększa nasilenie infekcji.
Symptomy

Szara pleśń infekuje przede wszystkim dojrzałe jagody winogron, które początkowo wydają się miękkie i nasiąknięte wodą. Z czasem jagody stają się czerwonawo-brązowe i wysychają. W sprzyjających warunkach pokrywają się szarymi masami grzybni i konidiów. Zdrowe jagody mogą również zostać zainfekowane poprzez bezpośredni kontakt z chorymi.
Grzyb może również powodować zarazę kwiatów, która może prowadzić do znacznych strat w plonach na początku sezonu. Chociaż infekcje liści są rzadkie, kiedy już wystąpią, zaczynają się jako matowe zielone plamy wzdłuż żył, które ostatecznie przekształcają się w nekrotyczne zmiany.
Model FieldClimate
Ogólny model szarej formy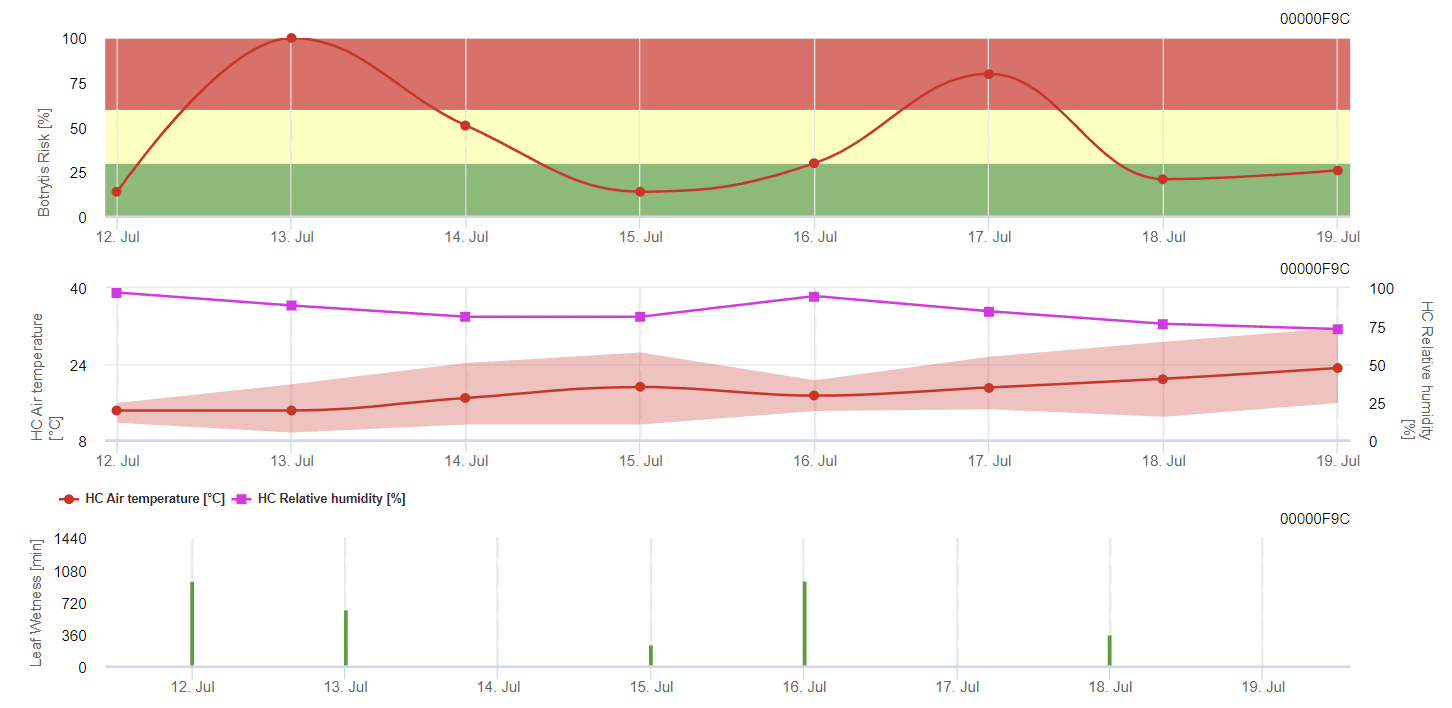
Potrzebne czujniki:
- Temperatura powietrza
- Wilgotność względna
- Wilgotność liści
B. cinerea jest związany z wilgotnym klimatem. Grzyb wymaga wysokiej wilgotności względnej lub obecności wolnej wody do infekcji. Ciepłe okresy z wydłużonym okresem wilgotności liści będą prowadzić do zwiększonego ryzyka wystąpienia B. cinerea, podczas gdy okresy suche będą je zmniejszać. Infekcja ma miejsce na młodych pędach podczas długich okresów wilgotnych lub niszczących burz gradowych.
Model oblicza ryzyko w zakresie od 0 do 100%. Wartość ta wskazuje ciśnienie B. cinerea w tym czasie - jeśli mamy wartość 100%, oznacza to, że kilkakrotnie wystąpił okres wilgotności wystarczająco długi, aby zainfekować podatną tkankę. Obliczamy tak zwane "mokre punkty" między wilgotnością liści a temperaturą z maksimum początkowo 38400 punktów (początek sezonu, który wykazuje ryzyko 30%). Po tym okresie, każdy mokry okres z około 4000 mokrych punktów zwiększa ryzyko o 10%, lub z drugiej strony, każdy suchy okres zmniejsza ryzyko o ⅕ poprzedniej wartości.
Literatura
- Broome, J. C., English, J. T., Marois, J. J., Latorre, B. A., & Aviles, J. C. (1995). Development of an infection model for Botrytis bunch rot of grapes based on wetness duration and temperature. Phytopathology, 85(1), 97-102.
- Elmer, P. A., & Michailides, T. J. (2007). Epidemiologia Botrytis cinerea w uprawach sadowniczych i winorośli. In Botrytis: biologia, patologia i kontrola (pp. 243-272). Dordrecht: Springer Netherlands.
- Williamson, B., Tudzynski, B., Tudzynski, P., & Van Kan, J. A. (2007). Botrytis cinerea: przyczyna choroby szarej pleśni. Molecular plant pathology, 8(5), 561-580.
- Ciliberti, N., Fermaud, M., Roudet, J., & Rossi, V. (2015). Warunki środowiskowe wpływają na infekcję Botrytis cinerea dojrzałych jagód winogron bardziej niż szczep lub genotyp transpozonu. Phytopathology, 105(8), 1090-1096.
Antraknoza
Patogen
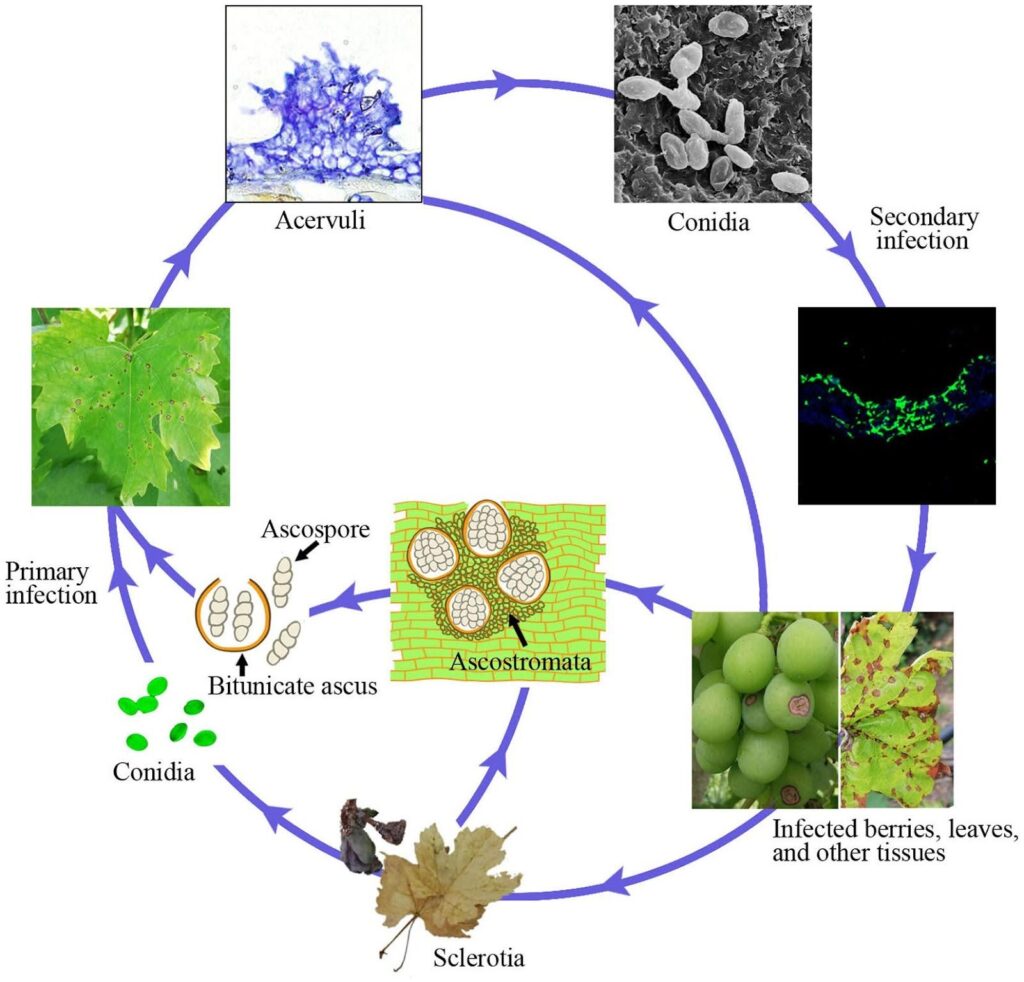
Antraknoza winorośli jest wywoływana przez patogen Elsinoe ampelina.
Zainfekowane pędy są głównym źródłem choroby. Zgnilizna twardzikowa i grzybnia, które przetrwały w zmianach chorobowych i jagodach zimą, stają się aktywne wiosną i wytwarzają askospory (zarodniki płciowe) i konidia (zarodniki bezpłciowe) w wilgotnych warunkach (deszcz lub rosa przez 24 godziny) w zakresie temperatur 2-40°C.
Zarodniki te są rozpraszane do nowych tkanek przez deszcz i wiatr, a po wylądowaniu kiełkują i tworzą rurki zarodkowe i appressoria, inicjując nową infekcję. Mogą infekować nowe liście, pędy, wąsy i młode jagody. Ciepła pogoda zmniejsza wilgotność wymaganą do początkowej infekcji i okresu inkubacji. Optymalne kiełkowanie zarodników następuje w temperaturze 25~30°C, przy czym wymagane są co najmniej 3~4 godziny zwilżenia liści. W przypadku infekcji w temperaturze około 10°C okres inkubacji wynosi około 14 dni.
W miarę postępu kolonizacji pojawiają się acerwulusy i wytwarzane są nowe konidia, które służą jako inokulum wtórnej infekcji. Są one odpowiedzialne za szybką i dalszą infekcję w sezonie.
Symptomy
E. ampelina atakuje nadziemne, soczyste części winorośli, w tym pędy, liście, ogonki liściowe, wąsy czepne, krzywizny i jagody; zmiany na pędach i jagodach są najbardziej powszechne. Winogrona mają ontogeniczną odporność na grzyby, więc młode tkanki są bardziej podatne.
Na początku pojawiają się małe czerwonawo-brązowe plamki, które powiększają się w deszczową pogodę, stając się lekko zapadnięte z szarym środkiem otoczonym ciemnym marginesem. Czasami objawy mogą przypominać obrażenia od gradu. Nekrotyczne centrum na liściach zwykle odpada, tworząc wygląd "dziury po strzale".
W przypadku silnej infekcji rośliny mogą wykazywać wczesną defoliację, zahamowanie wzrostu trzciny, łamanie łodyg, opadanie jagód oraz opóźniony rozwój i dojrzewanie jagód.
Model FieldClimate
Model antraknozy w uprawie winorośli
Potrzebne czujniki:
- Temperatura powietrza
- Wilgotność względna
- Wilgotność liści
- Opady
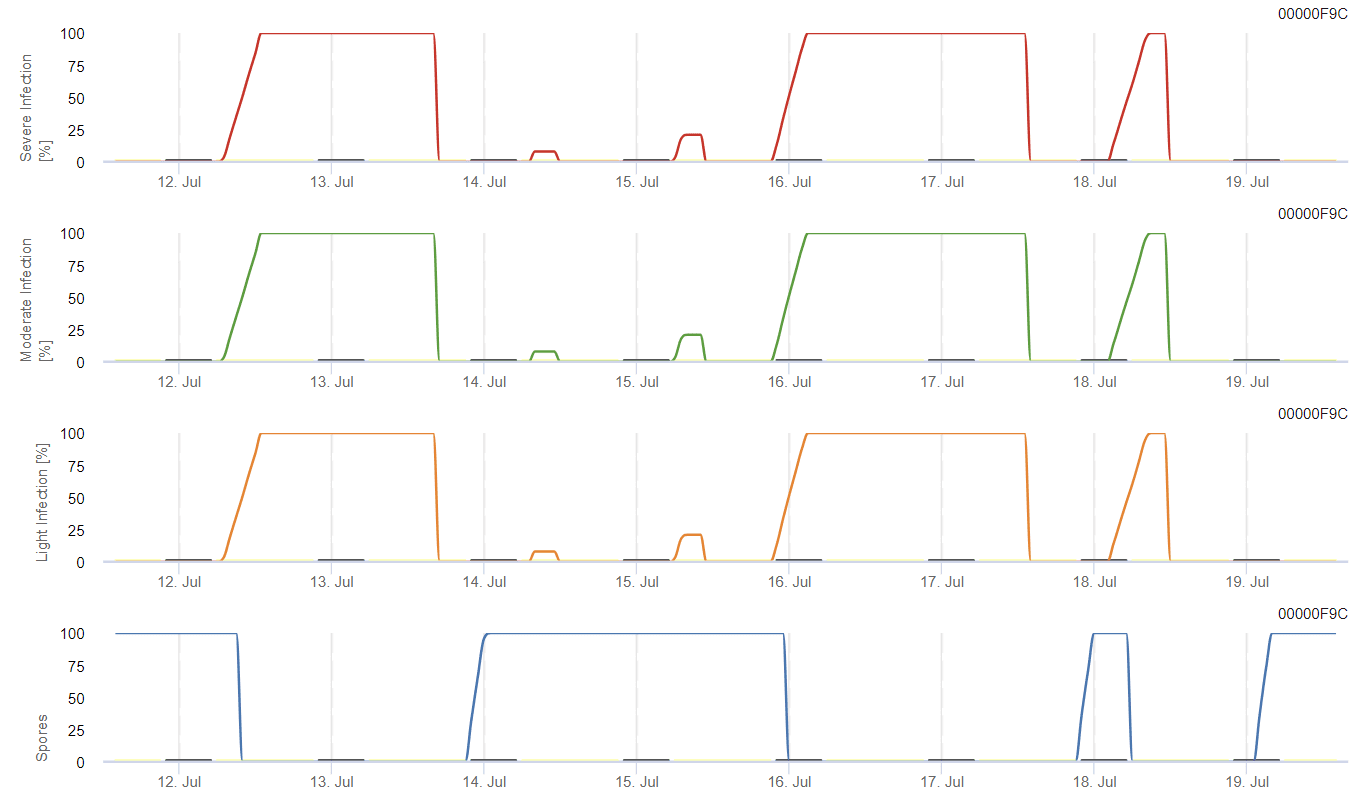
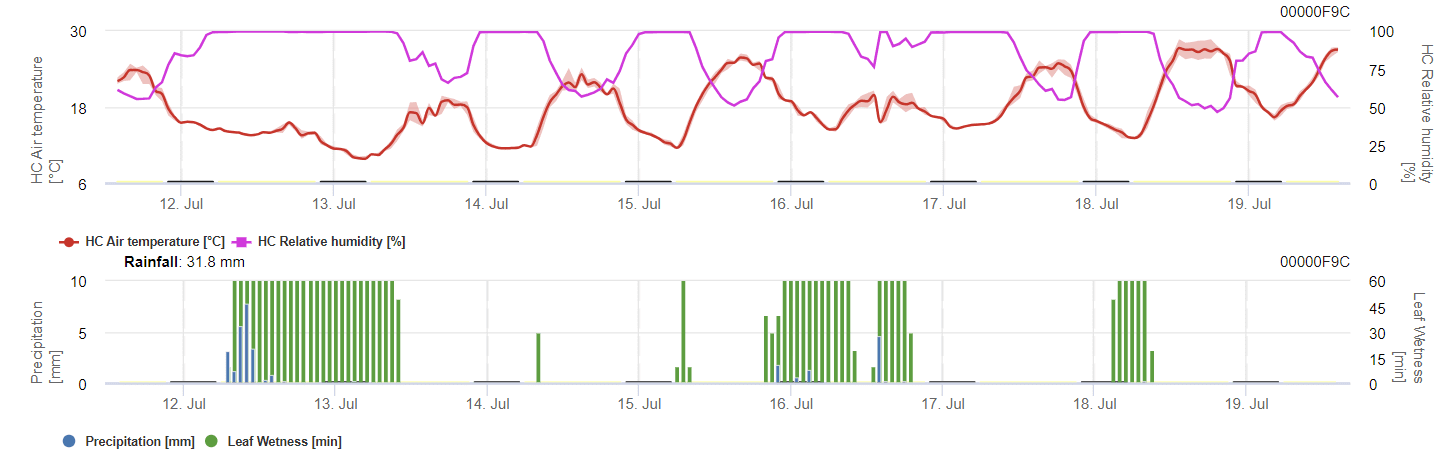
Model oblicza ryzyko wystąpienia antraknozy, biorąc pod uwagę temperaturę powietrza, wilgotność względną, wilgotność liści i opady.
Możliwy rozwój słabej, umiarkowanej i ciężkiej infekcji przedstawiono na osobnych wykresach. Należy przyjąć, że infekcja jest kompletna, gdy rosnąca krzywa osiąga 100%. Ostatni wykres przedstawia sporulację E. ampelina; jeśli wartość tam osiągnie 100%, zakłada się, że zarodniki E. ampelina są obecne.
Aby zarodniki zimujące mogły się rozwinąć, warunki powinny odpowiadać zakresowi temperatur od 2 do 40°C, wilgotności względnej powyżej 90% lub wilgotności liści. Gdy rozwój zarodników osiągnie 100%, infekcja zaczyna być obliczana. Nasilenie infekcji zależy od wilgotnych warunków (opady deszczu). Jeśli jednak wilgotność spadnie poniżej 50%, zarówno rozwój zarodników, jak i infekcja przestają być obliczane.
Literatura
- Li, Z., Dos Santos, R. F., Gao, L., Chang, P., & Wang, X. (2021). Aktualny stan i przyszłe perspektywy antraknozy winorośli wywoływanej przez Elsinoe ampelina: Ważna choroba w wilgotnych regionach uprawy winorośli. Molekularna patologia roślin, 22(8), 899-910
PHOMOPSIS PLAMISTOŚĆ TRZCINY I LIŚCI
Patogen
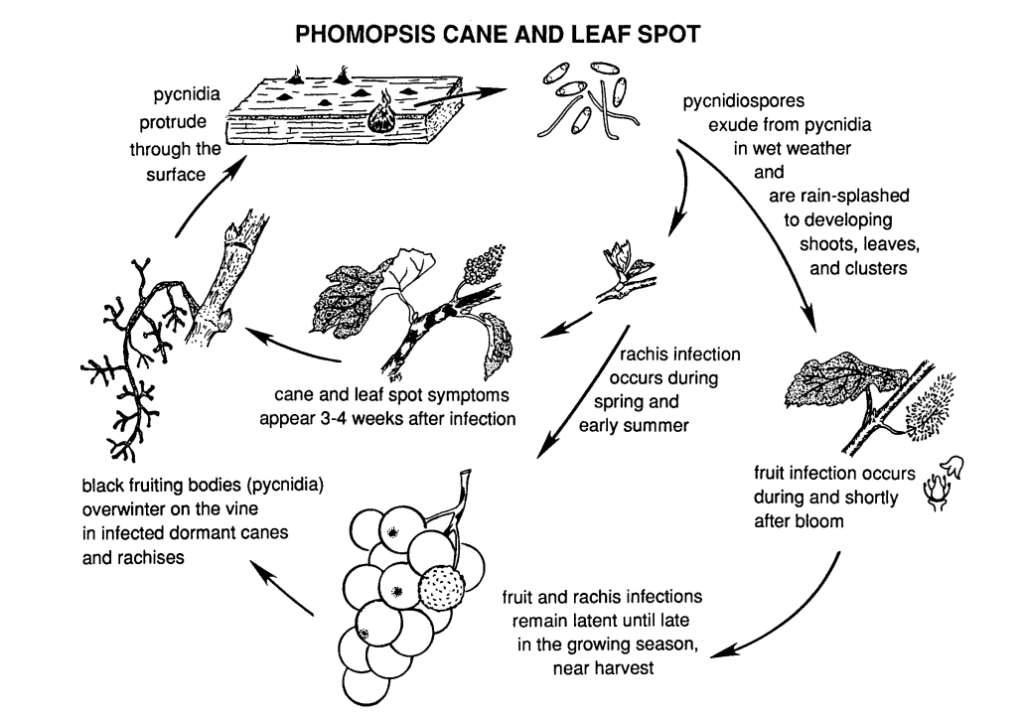
Plamistość liści i trzciny Phomopsis u winorośli jest powodowana przez Phomopsis viticola.
Grzyb zimuje w zdrewniałych częściach winorośli i staje się ponownie aktywny następnej wiosny. Gdy temperatura wzrasta i zaczynają się wiosenne deszcze, z zimujących struktur zwanych piknidiami uwalniane są zarodniki. Gdy zarodniki są rozpraszane przez deszcz i wiatr na nowe tkanki, infekcja rozprzestrzenia się.
Główny okres infekcji zwykle zbiega się z wczesnymi wiosennymi deszczami, rozpoczynając się wkrótce po pęknięciu pąków, gdy pędy wykazują wczesną fazę wzrostu. Młode pędy, wierzchołki pędów, grona owocowe i rachis są podatne na infekcje. Chociaż wierzchołki pędów mogą zostać zainfekowane przez cały sezon wegetacyjny, infekcje są najbardziej powszechne od pęknięcia pąków do kwitnienia. W owocach patogen może pozostawać w stanie uśpienia do momentu dojrzewania owoców. Okres inkubacji trwa zwykle około 3 do 4 tygodni.
Symptomy
Na liściach i ogonkach liściowych pojawiają się małe ciemne plamki z czarnymi środkami otoczonymi żółtymi brzegami, które ostatecznie łączą się. Liście u podstawy mogą stać się zniekształcone i pomarszczone i mogą nie rozwinąć się do pełnego rozmiaru. Gdy ogonki liściowe są silnie zainfekowane, żółkną i odpadają, co prowadzi do opadania liści. Liście tworzą efekt parasola, który ogranicza dalsze infekcje przez zarodniki.
Podobne plamy pojawiają się na pędach, powodując pękanie warstw naskórka w miejscach infekcji. Gdy plamy łączą się, zainfekowane obszary pędów nabierają strupowatej tekstury. W ciężkich przypadkach pędy mogą stać się karłowate, łamać się, a nawet obumierać.
Uszkodzenia na pędach powodują ich zapadanie się i łamliwość. Po okresie uśpienia w lecie, grzyb reaktywuje się wczesną jesienią, prowadząc do gnicia jagód i kiści. Chociaż infekcje owoców nie są na ogół rozległe, na jagodach tworzą się plamy, którym często towarzyszą czarne plamki (piknidia) na skórce jagód. W wilgotnych warunkach żółte masy zarodników mogą wyciekać z piknidiów, prowadząc do przebarwień owoców, szorstkiej tekstury i mumifikacji.
Zainfekowane drewno wykazuje bielszy wygląd w okresie spoczynku. Silnie zainfekowane pędy i ostrogi wykazują ciemne przebarwienia zmieszane z bielonymi obszarami kory. Pycinidia mogą również przebijać się przez powierzchnię. Niskie temperatury, wraz z upośledzoną funkcją łyka i ksylemu, osłabiają i zabijają pędy, ostrogi i pąki.
Model FieldClimate
Model infekcji Phomopsis w uprawie winorośli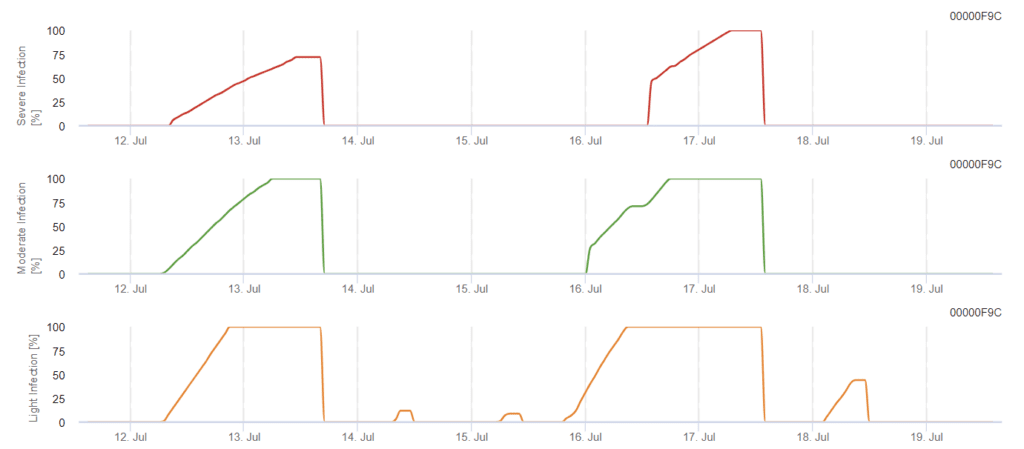
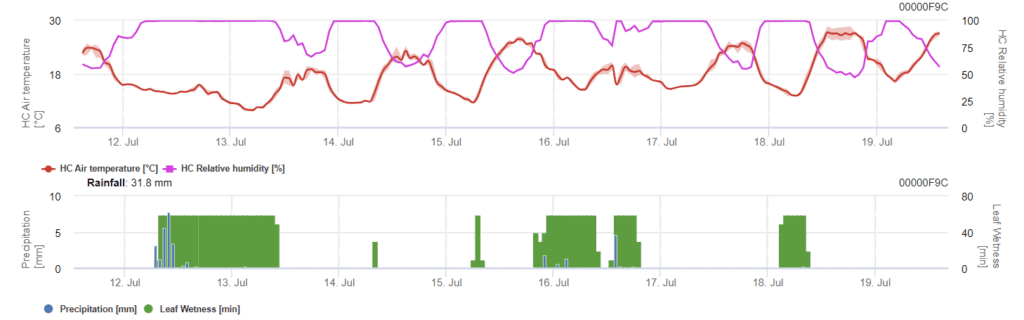
Potrzebne czujniki:
- Temperatura powietrza
- Wilgotność względna
- Wilgotność liści
- Opady
Model określa ryzyko infekcji Phomopsis w zakresie temperatur od 5 do 35°C i wilgotnych warunkach (zwilżenie liści, wysoka wilgotność względna). Nasilenie infekcji zależy od ilości deszczu (ponad 2 mm), ponieważ zarodniki są szybciej rozprzestrzeniane na zdrowy materiał roślinny. Wykazanie infekcji 100% wskazuje, że w terenie zmierzono optymalne warunki do infekcji tkanki roślinnej, a zatem należy wziąć pod uwagę pomiary ochrony roślin.
Literatura
- https://agriculture.vic.gov.au/biosecurity/plant-diseases/grapevine-diseases/phomopsis-cane-and-leaf-spot-of-grapevines
- Bettiga, L. J. (red.). (2013). Grape pest management (Vol. 3343). UCANR Publications.
- Pscheidt, J. W., & Pearson, R. C. (1991). Phomopsis cane & leaf spot.
Zalecane wyposażenie
Sprawdź, jaki zestaw czujników jest potrzebny do monitorowania potencjalnych chorób tej uprawy.
