
Viticultura modelos de doenças
Dourado
Pathogen
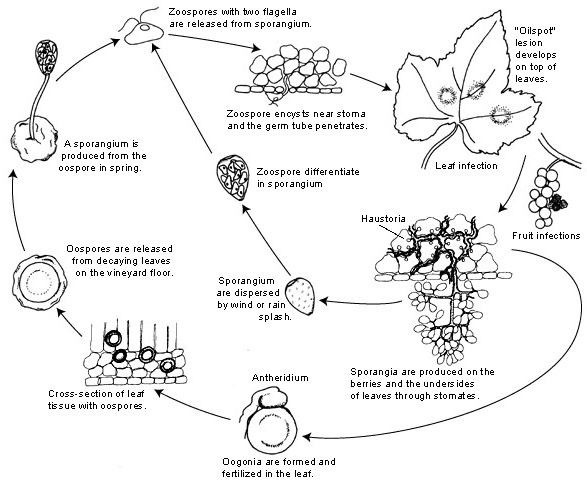
O agente patogénico do míldio da videira é Plasmopara viticola. É um parasita obrigatório, o que significa que os órgãos verdes e frescos da videira são necessários para o seu crescimento. Tem fases de reprodução assexuada e sexual -zoósporos e oósporos. Por conseguinte, existem duas fases de infeção: infeção primária e secundária.
A infeção primária começa com a germinação dos oósporos invernantes, formando esporângios na primavera, quando o tempo fica quente. Os esporângios são produzidos durante a noite, uma vez que a luz solar inibe a esporulação. Os oósporos de paredes espessas ajudam o agente patogénico a sobreviver às condições rigorosas do inverno e a iniciar a infeção primária. Os esporângios são dispersos pela chuva ou pelo vento e libertam zoósporos na água livre. Para que a infeção seja bem sucedida, é necessário um período suficientemente longo de humidade nas folhas ou de precipitação.
A infeção secundária só é possível na presença de manchas oleosas maduras e ocorre através de zoósporos e esporângios. Os zoósporos e os esporângios são muito sensíveis à baixa humidade e à luz, o que reduz a sua viabilidade, o que significa que a maior parte da infeção ocorre pouco depois da libertação. Os zoósporos penetram nos tecidos vegetais através de tubos germinativos e desenvolvem hifas para posterior infeção. Estas hifas formam lesões oleosas após um período de incubação que varia de 5 a 21 dias, dependendo da temperatura - quanto mais baixa a temperatura, mais tempo demora.
Quando o tempo volta a ficar frio, o que é desfavorável para o agente patogénico, este passa à produção sexual, produzindo oósporos. Estes oósporos permanecem dormentes durante o inverno e o ciclo repete-se.
Sintomas

Surgem pequenas lesões amarelas na superfície superior das folhas, por vezes rodeadas por halos acastanhados. As manchas de óleo expandem-se e integram-se à medida que a maturação e os halos desaparecem. Mais tarde, os esporângios produzem um míldio branco-cotonoso na parte inferior das lesões, seguindo-se a necrose. Aparecem também zonas castanhas oleosas nos rebentos, caules e bagas. Em noites quentes e húmidas, podem ficar cobertas de penugem branca devido à esporulação. Uma infeção grave provoca uma queda prematura.
Modelos FieldClimate
- Existem dois modelos no FieldClimate - infeção primária e secundária.
- O primeiro gráfico apresenta o tempo de incubação após a conclusão de uma infeção. Os gráficos inferiores mostram o progresso da infeção para um nível de gravidade fraco, moderado e grave. Presume-se que existe uma infeção quando a curva ascendente do gráfico atinge 100% - a pulverização pode ser considerada se for apresentado um nível grave de infeção.
Infeção primária
Sensores necessários:
- Temperatura do ar
- Humidade relativa
- Humidade das folhas
- Precipitação
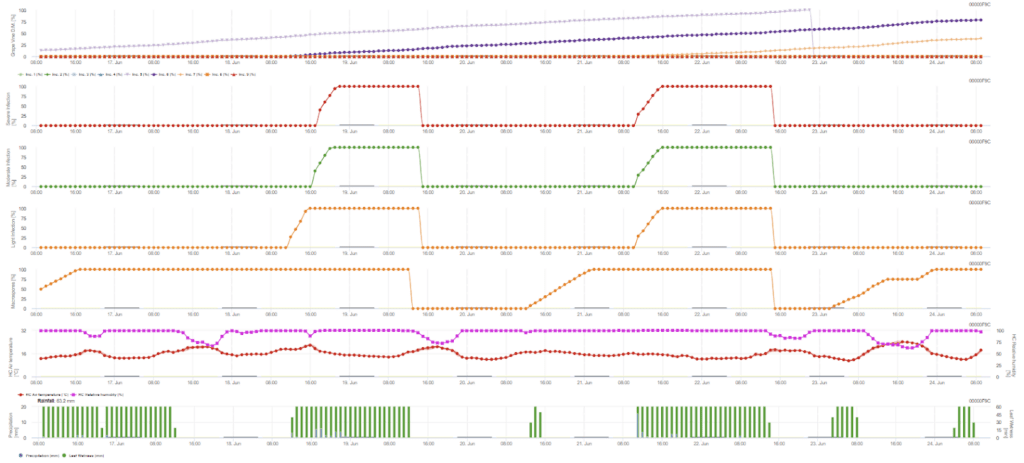
A infeção primária verifica se o clima é adequado para o desenvolvimento de esporângios. Este é o caso desde que as folhas estejam molhadas ou que a humidade relativa após a chuva não desça abaixo de 70%. Os esporângios podem desenvolver-se num período de 16 a 24 horas, dependendo da temperatura. Uma chuva contínua de 5 mm é interpretada como uma chuva forte que pode espalhar zoósporos.
Infeção secundária
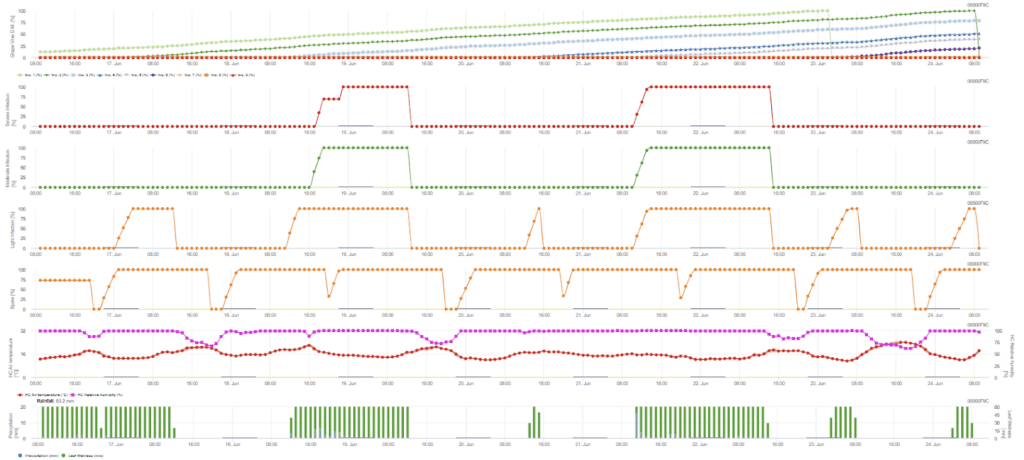
Sensores necessários:
- Temperatura do ar
- Humidade relativa
- Humidade das folhas
- Precipitação
A infeção secundária verifica-se se a temperatura for superior a 12 °C e a humidade relativa for superior a 95%. A taxa de produção de esporângios aumenta com temperaturas até 23 °C. Se esta condição se prolongar por uma temperatura horária acumulada superior a 50 °C, consideramos que a esporulação terminou e que existem novos esporângios na vinha. Os 50 °C acumulados correspondem a 4 horas com 13 °C ou 3 horas com 17 °C, por exemplo. Os esporângios morrem rapidamente quando o tempo fica mais quente e seco - quando a humidade relativa desce abaixo de 50%, o valor é reposto a 0 e quando a temperatura excede os 29 °C, não pode haver esporulação.
Literatura
- Ash, G. (2000). O míldio da uva. The Plant Health Instructor.
- Gessler, C., Pertot, I., & Perazzolli, M. (2011). Plasmopara viticola: uma revisão do conhecimento sobre o míldio da videira e a gestão eficaz da doença. Phytopathologia Mediterranea, 50(1), 3-44.
- Kennelly, M. M., Gadoury, D. M., Wilcox, W. F., Magarey, P. A., & Seem, R. C. (2007). Infeção primária, produtividade da lesão e sobrevivência de esporângios no patógeno do míldio da videira Plasmopara viticola. Phytopathology, 97(4), 512-522.
- Koledenkova, K., Esmaeel, Q., Jacquard, C., Nowak, J., Clément, C., & Ait Barka, E. (2022). Plasmopara viticola, o agente causal do míldio da videira: da sua taxonomia à gestão da doença. Frontiers in Microbiology, 13, 889472.
Oídio em pó
Pathogen
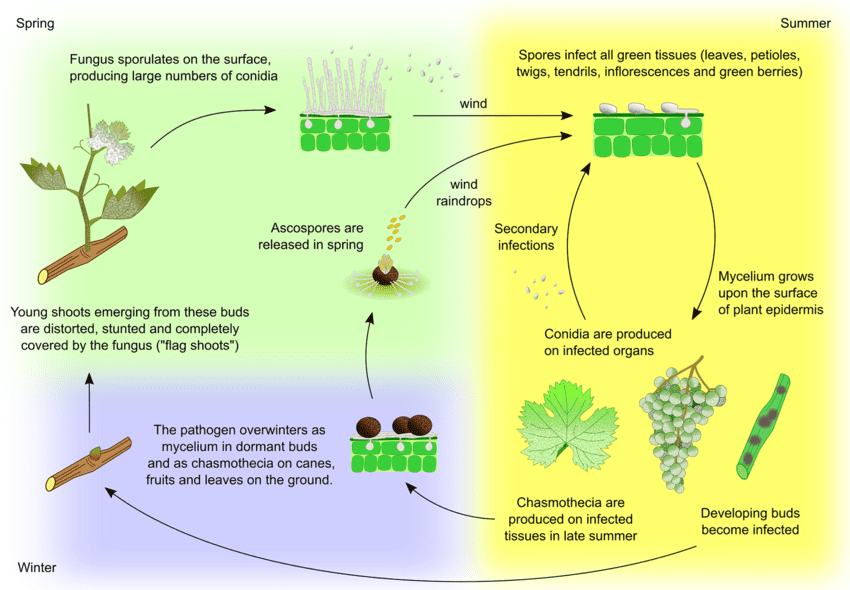
O agente patogénico do oídio da videira é Uncinula necator. Existem duas fontes principais de inóculo - micélio invernal e ascósporos de cleistotecas - que podem variar em importância consoante a região.
O micélio dá origem aos rebentos bandeira na primavera. Os rebentos bandeira são rebentos parcial ou totalmente cobertos de míldio, formados a partir de gomos infectados latentes. Como se formam colónias no interior, estes rebentos são bem visíveis e têm frequentemente folhas deformadas.
A Cleistothecia liberta ascósporos no início da primavera. A precipitação é um fator importante para a libertação dos ascósporos. Com o aumento da temperatura, a deiscência é mais frequente. Os ascósporos germinam em 12 horas, formando tubos germinativos e apressórios nos tecidos das plantas, levando à formação de colónias dispersas.
A infeção secundária ocorre através de conídios produzidos nas colónias. Tal como os ascósporos, germinam e desenvolvem tubos germinativos e apressórios. O U. necator não necessita de água livre para a infeção nem de humidade relativa elevada para a formação de conídios. Quando as condições climatéricas se tornam menos favoráveis, o fungo forma cleistotecas. O fungo sobrevive na cleistoteca ou como micélio vegetativo em gomos infectados e dormentes e o ciclo repete-se.
Sintomas

Os sintomas podem ser encontrados em todas as partes verdes da videira. Os rebentos desenvolvem colónias e ficam cobertos de micélio branco-acinzentado, conhecidos como "rebentos bandeira". As folhas ficam distorcidas. Também se encontram colónias de míldio nas folhas - na parte inferior ou em ambos os lados. Os bagos desenvolvem manchas cinzentas-acinzentadas e, nos casos mais graves, fendem-se. As canas apresentam manchas vermelho-acastanhadas escuras e podem morrer a partir das pontas.
Modelos FieldClimate
Infeção por ascósporos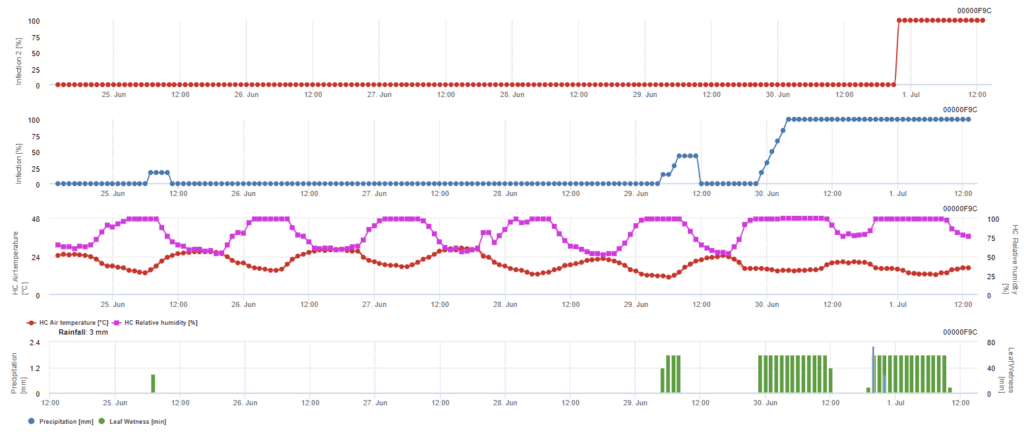
Sensores necessários:
- Temperatura do ar
- Humidade relativa
- Molhagem de Folhas
- Precipitação
Este modelo é recomendado quando os ascósporos são formados durante o inverno frio (portanto, não são infectados pelo micélio). A infeção por ascósporos prevê a libertação de ascósporos e a infeção inicial com base nas temperaturas médias durante períodos prolongados de humidade das folhas. Para o cálculo, são necessários cerca de 2,5 mm de precipitação para libertar ascósporos, seguidos de um mínimo de 8 a 12 horas de humidade nas folhas e temperaturas entre 10 e 15°C. Uma vez ocorrida a infeção, o modelo passa a uma fase de avaliação do risco de doença (modelo de risco californiano) e baseia-se nos efeitos da temperatura sobre a taxa de reprodução do agente patogénico.
Modelo de risco californiano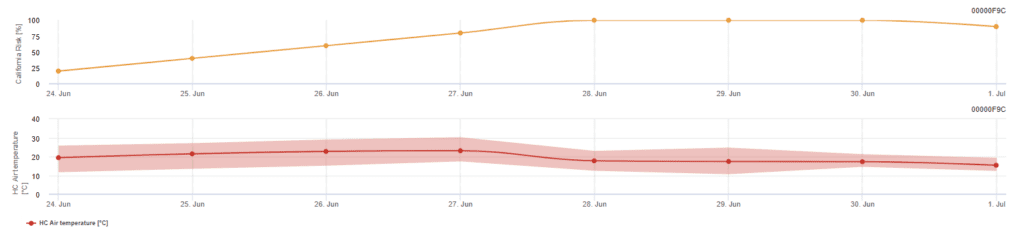
Sensores necessários:
- Temperatura do ar
O modelo baseia-se em estudos laboratoriais efectuados na Califórnia. Após a libertação e germinação dos ascósporos (modelo), o desenvolvimento e a reprodução subsequentes do oídio são influenciados pelas temperaturas. O modelo avalia as temperaturas e avalia o risco de desenvolvimento do oídio através de um índice de 0 a 100 pontos.
São necessários três dias seguidos com um mínimo de seis horas consecutivas de temperatura entre 21 e 30'c para iniciar o índice de avaliação do risco. Ganha-se 20 pontos por cada dia que cumpra 6 ou mais horas consecutivas entre 21 e 32°C e perde-se 10 pontos por aqueles que não o façam ou quando a temperatura ultrapassa os 32°C ou desce abaixo dos 21°C.
Valores baixos de índice de 0~30 indicam que o agente patogénico não se está a reproduzir. Um índice de 40~50 é considerado moderado e implica uma taxa de reprodução do oídio de aproximadamente 15 dias. Valores de índice superiores a 60 indicam que o agente patogénico se está a reproduzir rapidamente (de 5 em 5 dias) e que o risco de uma epidemia da doença é grande.
Modelo de risco Pessl Instruments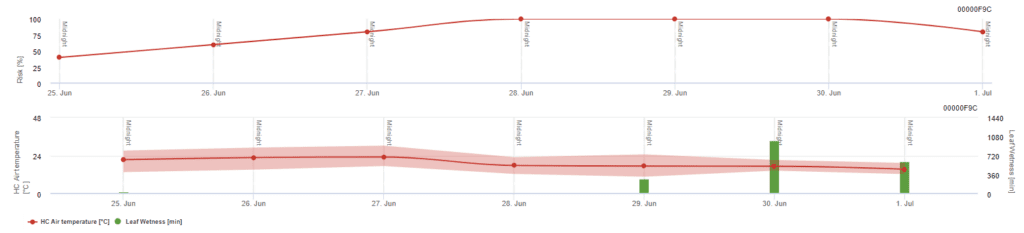
Sensores necessários:
- Temperatura do ar
- Humidade das folhas
Para além da temperatura do ar, a humidade das folhas pode ser um fator orientador, uma vez que longos períodos de humidade das folhas conduzem ao estabelecimento de um fungo antagonista (Ampelomyces quisqualis), que leva a uma diminuição de U. necator. Os fundamentos do modelo são equivalentes aos do modelo de risco californiano, mas a humidade das folhas também é considerada neste modelo. Uma humidade das folhas superior a 8 horas leva a uma diminuição de 10 pontos.
Valores baixos de índice de 0~20 indicam que o agente patogénico não se está a reproduzir. Um índice de 20~60 é considerado moderado e é válido um intervalo de pulverização normal. Valores de índice superiores a 60 indicam que o agente patogénico se está a reproduzir rapidamente (de 5 em 5 dias) e que o risco de uma epidemia da doença é grande, pelo que se recomenda a redução do intervalo de pulverização.
Literatura
- Gadoury, D. M., & Pearson, R. C. (1990). Ascocarp dehiscence and ascospore discharge in Uncinula necator. Phytopathology, 80(4), 393-401.
- Gadoury, D. M., & Pearson, R. C. (1990). Germinação de ascósporos e infeção de Vitis por Uncinula necator. Phytopathology, 80(11), 1198-1203.
- Hall, T. W. (2000). Epidemiologia do oídio da videira, Uncinula necator, em Willamette Valley.
- Halleen, F., & Holz, G. (2001). An Overview of the Biology, Epidemiology and Control of Uncinula Necator (Powdery Mildew) on Grapevine, with Ref Ere Nee to South Africa. South African Journal of Enology and Viticulture, 22(2), 111-121.
- Rügner, A., Rumbolz, J., Huber, B., Bleyer, G., Gisi, U., Kassemeyer, H. H., & Guggenheim, R. (2002). Formação de estruturas de invernada de Uncinula necator e colonização da videira em condições de campo. Plant pathology, 51(3), 322-330.
Podridão negra
Pathogen
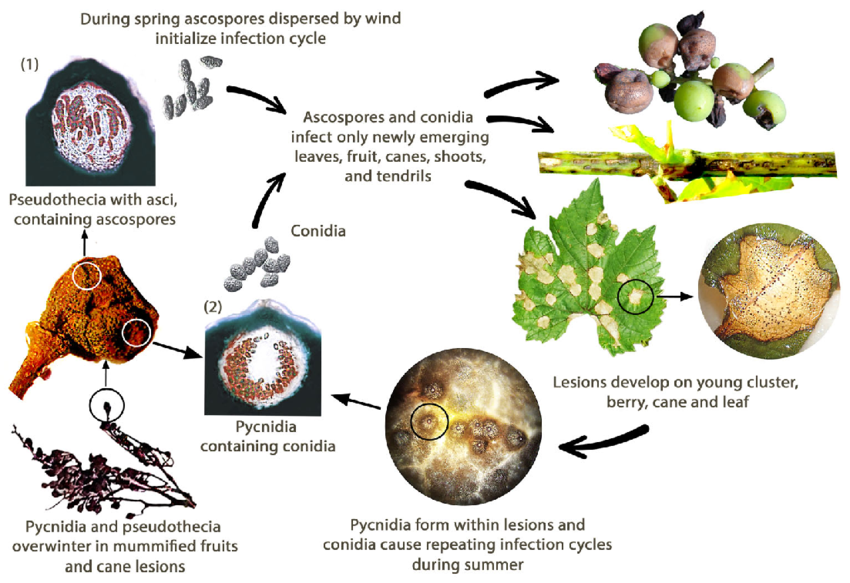
A podridão negra da videira é causada pelo fungo Guignardia bidwellii. O fungo sobrevive em várias partes da videira e pode sobreviver durante mais de dois anos nas lesões dos rebentos infectados.
Na primavera, os picnídios produzem conídios (esporos assexuados) e os pseudotécios geram ascósporos (esporos sexuais). Os conídios são normalmente dispersos a curtas distâncias, enquanto os ascósporos podem infetar a distâncias maiores. Estes esporos são transportados pelo vento e pela chuva para infetar tecidos jovens de hospedeiros susceptíveis, dando início a infecções primárias. Os conídios também servem de inóculo secundário, contribuindo para a propagação rápida e repetida da doença.
Durante o mês de agosto, os picnídios transformam-se numa fase de invernada que produz pseudotecas, que geram ascósporos. Estes ascósporos são fontes importantes de infecções primárias na primavera seguinte.
Sintomas

Desenvolvem-se manchas castanho-avermelhadas que acabam por se fundir, muitas vezes rodeadas por pequenos pontos pretos, que são estruturas fúngicas conhecidas como picnídios que produzem conídios. As folhas jovens e de crescimento rápido são particularmente mais susceptíveis a esta infeção.
As infecções nos frutos ocorrem tipicamente após a queda do cálice, com a maioria dos sintomas a manifestarem-se quando o fruto está com metade do tamanho ou quase cheio. Inicialmente, surgem pequenas manchas, rodeadas por um anel castanho, que depois aumentam e escurecem, acabando por cobrir toda a baga à medida que a doença se desenvolve. Em poucos dias, os bagos infectados podem ficar mumificados, partir-se ou cair prematuramente.
Além disso, outras partes da planta, como rebentos, caules e gavinhas, também são afectadas. Desenvolvem-se lesões de forma ovalada, de cor púrpura a preta, e os picnídios espalham-se pela superfície dessas lesões.
Modelo FieldClimate
Viticultura Modelo de podridão negra
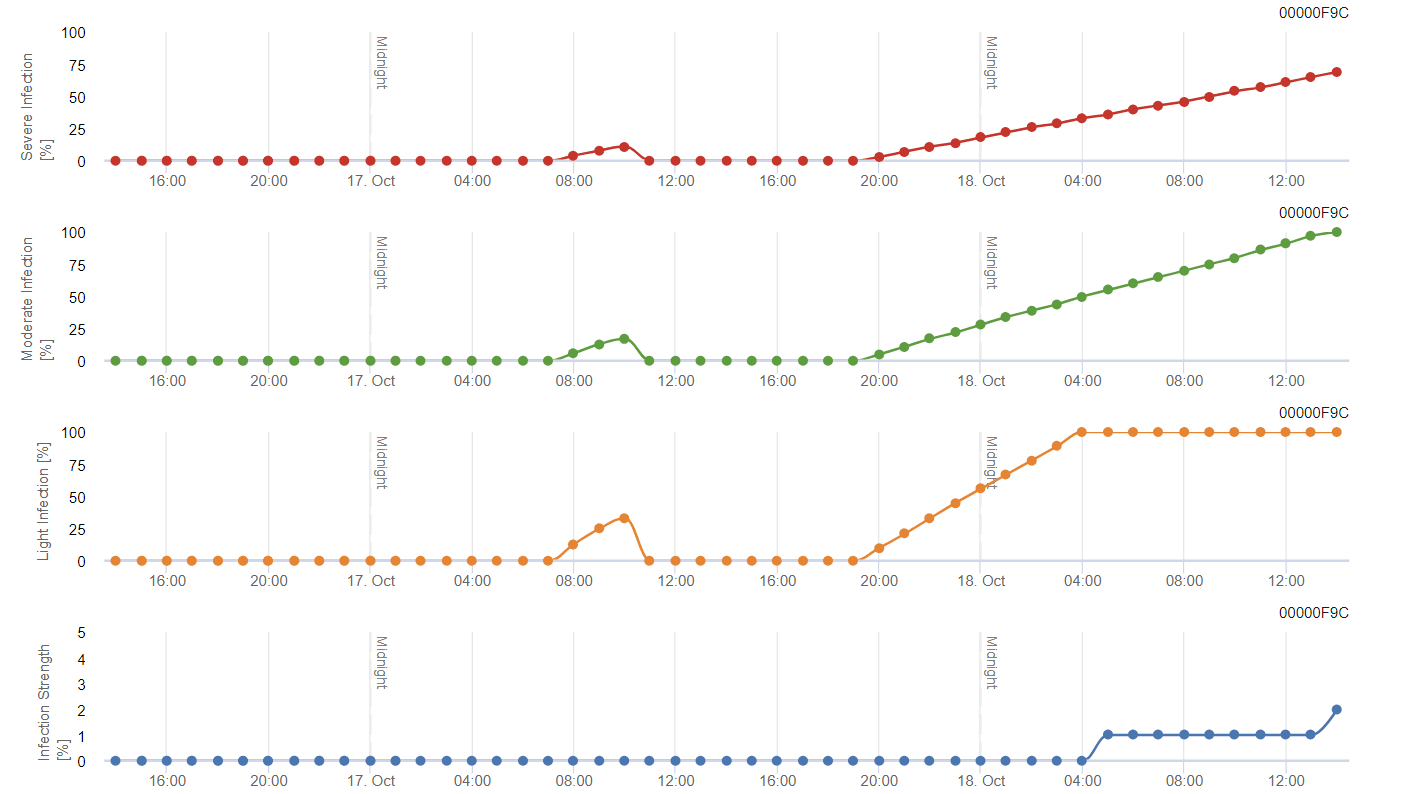
Sensores necessários:
- Temperatura do ar
- Humidade relativa
- Humidade das folhas
- Precipitação
O modelo baseia-se originalmente na literatura publicada por Spotts, mas com a modificação de Daniel Molitor. A revisão introduziu três classes de gravidade (ligeira, moderada e grave) semelhantes à conceção dos modelos da sarna da macieira. A temperaturas quentes, o período de humidade das folhas de 8 horas é suficiente para favorecer as infecções e considera-se que uma infeção está concluída quando um gráfico atinge 100%.
A gravidade da infeção depende do tempo de duração da temperatura óptima e do período de humidade do fungo. As infecções que cumprem os critérios Spotts são classificadas como infecções ligeiras. As infecções que satisfazem os critérios Spott nos 150% e 200% são classificadas como infecções moderadas e graves, respetivamente.
Dependendo da pressão da infeção, as infecções devem ser cobertas de forma preventiva ou deve ser aplicada uma pulverização curativa pouco depois da infeção. No clima semi-árido moderado do Mosel ou da maioria das zonas vitícolas austríacas, não se recomenda a pulverização após a deteção de uma infeção ligeira.
Literatura
- Wilcox, Wayne F. "Podridão negra Guignardia bidwellii". Ficha de identificação de doenças n.º 102GFSG-D4. 2003. Cornell. 24 de outubro de 2010
- http://www.nysipm.cornell.edu/factsheets/grapes/diseases/grape_br.pdf
- Ellis, Michael A. "Fact sheet Agricultural and Natural Resources: Podridão negra da uva". Departamento de Patologia Vegetal. Extensão da Universidade do Estado de Ohio. 2008
- http://ohioline.osu.edu/hyg-fact/3000/pdf/HYG_3004_08.pdf
- Molitor, D. (2009). Untersuchungen zur Biologie und Bekämpfung der Schwarzfäule (Guignardia bidwellii) an Weinreben. Gesellschaft zur Förderung der Forschungsanstalt Geisenheim.
- Ries, S. M. (1999). Relatórios sobre doenças de plantas: Podridão negra da uva. Integrated Pest Management at the Uni. of Illinois. http://ipm. illinois. edu/diseases/series700/rpd703.
- Spotts, R. A. (1977). Efeito da duração da humidade foliar e da temperatura na infecciosidade de Guignardia bidwellii em folhas de videira. Phytopathology, 67(11), 1378-1381.
- Szabó, M., Csikász-Krizsics, A., Dula, T., Farkas, E., Roznik, D., Kozma, P., & Deák, T. (2023). Podridão negra das uvas (Guignardia bidwellii)-Uma visão global. Horticulturae, 9(2), 130.
- http://extension.cropsciences.illinois.edu/fruitveg/pdfs/771-BlackRotOfGrape.pdf
- https://www.missouribotanicalgarden.org/gardens-gardening/your-garden/help-for-the-home-gardener/advice-tips-resources/insects-pests-and-problems/diseases/fruit-spots/black-rot-of-grapes
Traças da baga
Pathogen

Botrana da lobésia A traça-do-tomateiro completa tipicamente duas a três gerações por ano, dependendo da região. A primeira geração (maio e junho) afecta apenas as flores, pelo que o tratamento só é necessário se as populações de traça forem particularmente elevadas. A segunda geração (julho e agosto) e a terceira geração são as que causam mais danos, sendo a terceira especialmente prejudicial, pois coincide com a maturação das uvas. A quarta geração pode ocorrer em climas mais quentes, mas o tratamento geralmente não é necessário, pois coincide com a colheita da uva.
A traça passa o inverno como pupas em casulos e, quando as temperaturas sobem na primavera, os adultos da primeira geração emergem, com os machos a aparecerem normalmente antes das fêmeas. O voo da primeira geração começa perto da abertura dos botões e dura 4 a 5 semanas, durante as quais ocorre o acasalamento. Um a dois dias após o acasalamento, as fêmeas põem entre 80 a 160 ovos.
Os ovos, com 0,6 a 0,8 mm de diâmetro, são visíveis a olho nu. Inicialmente de cor branca cremosa, tornam-se amarelos à medida que o embrião se desenvolve, com a cor preta da cabeça da larva. Os ovos eclodem após 66 graus-dia Celsius (DDC), aproximadamente 7 a 11 dias. As larvas unem as partes da flor, com um desenvolvimento que dura 20 a 30 dias. Segue-se a pupação e os adultos emergem 6 a 14 dias depois.
O "grau-dia" é calculado medindo o quanto a temperatura média diária excede um determinado limiar de temperatura de base necessário para o desenvolvimento. À medida que as temperaturas sobem acima da base, os graus-dia acumulam-se.
As traças adultas têm cerca de 6 a 8 mm de comprimento e uma envergadura de 11 a 13 mm. As fêmeas são ligeiramente maiores do que os machos, embora ambos tenham asas semelhantes com padrão de mosaico.
Os ovos da segunda e terceira gerações eclodem mais rapidamente, num prazo de 3 a 5 dias. As fêmeas põem os ovos individualmente em bagas à sombra e, após a eclosão, as larvas entram nas bagas e esvaziam-nas. No outono, as noites com mais de 11 horas desencadeiam a diapausa, uma fase de repouso que permite que as pupas tolerem melhor o frio, permitindo-lhes passar o inverno.
Sintomas
As lagartas da primeira geração alimentam-se das inflorescências da videira, esvaziando os botões florais e enrolando-os para os proteger, o que provoca danos no interior do cacho. Na segunda geração, as larvas atacam os bagos em desenvolvimento, criando pontos de entrada para agentes patogénicos fúngicos, tais como Botrytis cinerea. Esta alimentação direta causa danos visíveis, normalmente marcados por manchas escuras à volta dos locais de alimentação. A terceira geração causa os danos mais significativos, uma vez que as larvas penetram e se alimentam dos bagos em amadurecimento.
Ficam bagas murchas e excrementos de larvas. Os pedaços de tecido epidérmico dos bagos permanecem soltos nos pedicelos, juntamente com a "pele" seca e oca dos bagos.
Modelo FieldClimate
Traça das bagas da videira Modelo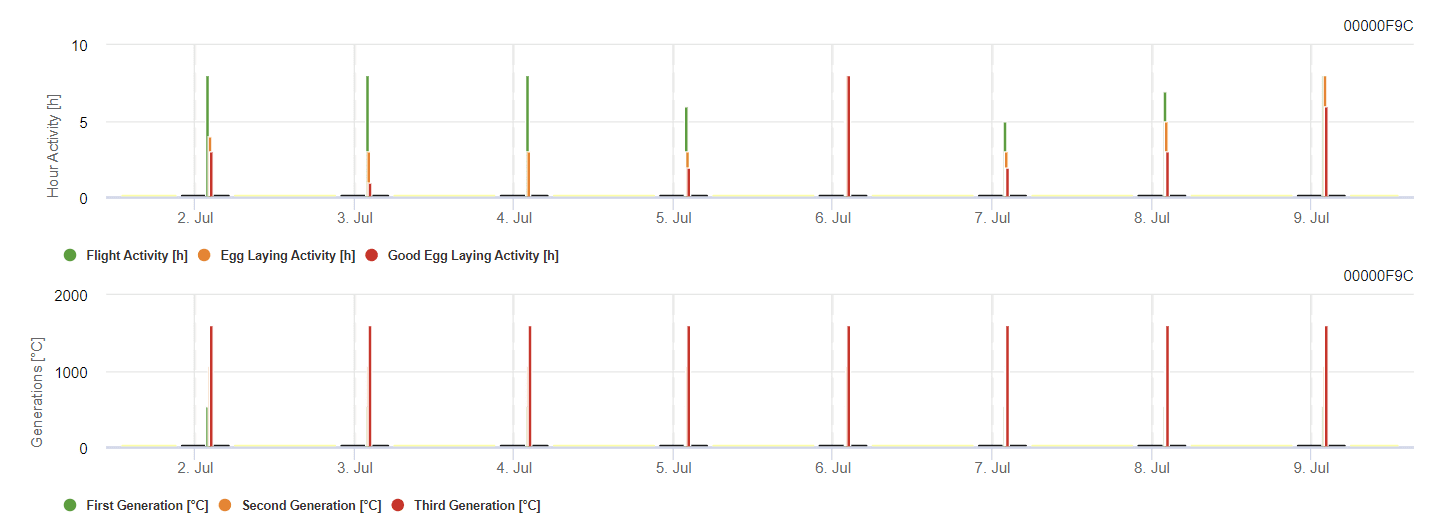
Sensor necessário:
- Temperatura do ar
O modelo calcula o risco em função da temperatura do ar. O primeiro gráfico mostra os períodos de atividade de voo com postura de ovos e boas actividades de postura de ovos para o inseto. O segundo gráfico mostra qual a geração expetável nesse período. No terceiro gráfico, são apresentados os dados climáticos, que mostram a acumulação de graus-dia (temperaturas > 8°C até 24°C por hora dividida por 24).
Literatura
- Varela, L. G., Smith, R. J., Cooper, M. L., & Hoenisch, R. W. (2010). Traça da videira europeia, Lobesia botrana. Vinhas de Napa Valley. Pract. Winery Vineyard, 2010, 1-5.
- https://ipm.ucanr.edu/invasive-and-exotic-pests/european-grapevine-moth/
- https://www.ages.at/en/plant/plant-health/pests-from-a-to-z/grape-berry-moth
Bolor cinzento
Pathogen
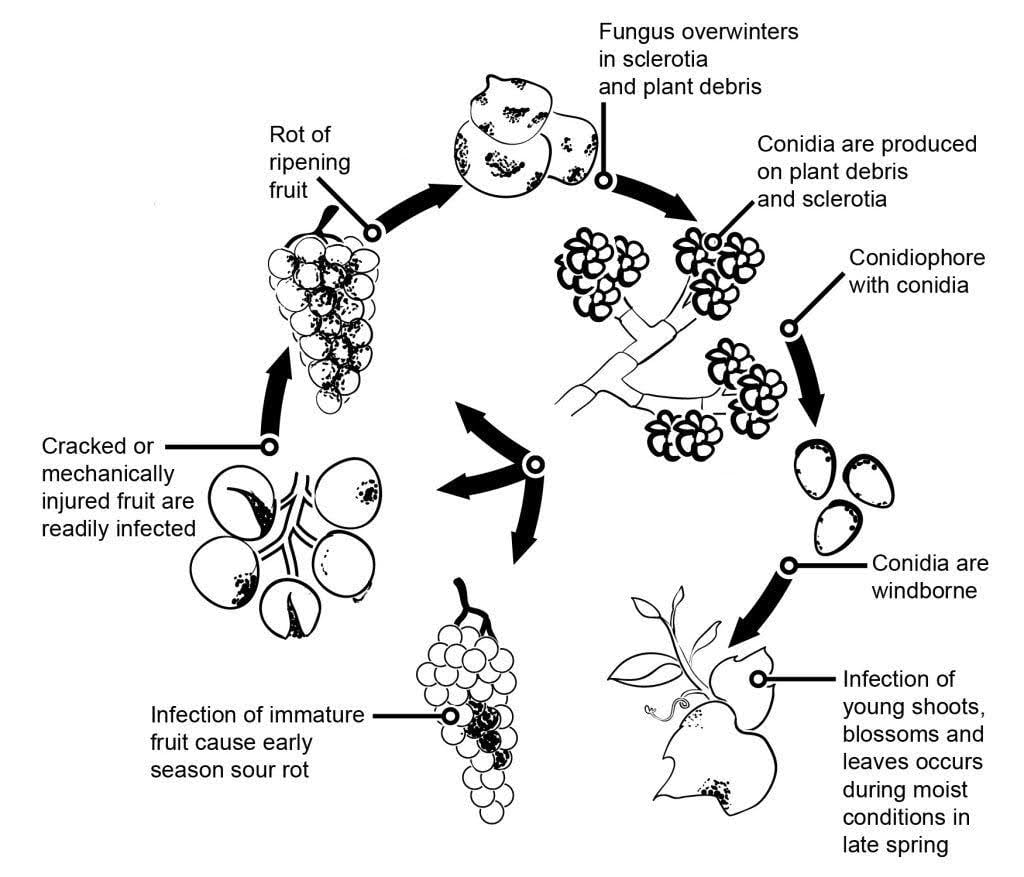
O agente patogénico do bolor cinzento na videira é Botrytis cinerea.
A epidemiologia do mofo cinzento é significativamente influenciada por infecções latentes iniciadas por infecções florais. Foram identificadas várias vias de transmissão da flor para o fruto: O fungo infecta o estilete da flor e atinge o óvulo, onde permanece latente devido ao mecanismo de defesa pré-formado da planta. As infecções através dos estames, pétalas e sépalas também são críticas. A B. cinerea pode infetar os estames e crescer sistematicamente em direção ao recetáculo, espalhando-se para o pedicelo e para os tecidos vasculares dos bagos. Outras vias também envolvem o crescimento saprofítico do agente patogénico.
Os micélios ou esclerócios que passam o inverno são as principais fontes de infeção na primavera. Os conídios (esporos assexuados) são produzidos e dispersos pelo vento e pela chuva. Ao aterrar, os conídios germinam, formando tubos germinativos e apressórios que penetram e infectam a planta. O fungo pode permanecer latente até que o fruto amadureça e o teor de açúcar aumente. Os conídios gerados a partir de fontes de inóculo primário seguem um ciclo diurno de iniciação, produção e disseminação.
Embora a fase sexual de B. cinerea seja raramente observada, o agente patogénico torna-se mais ativo à medida que os bagos amadurecem. O aumento do teor de açúcar nos bagos aumenta a suscetibilidade à infeção. Da mesma forma, as flores são altamente susceptíveis quando entram em senescência, com o pólen abundante a aumentar a gravidade da infeção.
Sintomas

O bolor cinzento infecta principalmente os bagos de uva maduros, que inicialmente parecem moles e encharcados de água. Com o tempo, os bagos tornam-se castanho-avermelhados e murcham. Em condições favoráveis, ficam cobertos de massas cinzentas de micélios e conídios do fungo. As bagas saudáveis também podem ser infectadas através do contacto direto com as bagas doentes.
O fungo pode também causar uma praga na flor, que pode levar a perdas significativas de colheitas no início da época. Embora as infecções foliares sejam raras, quando ocorrem, começam como manchas verdes baças ao longo das nervuras, que acabam por se transformar em lesões necróticas.
Modelo FieldClimate
Modelo de molde cinzento geral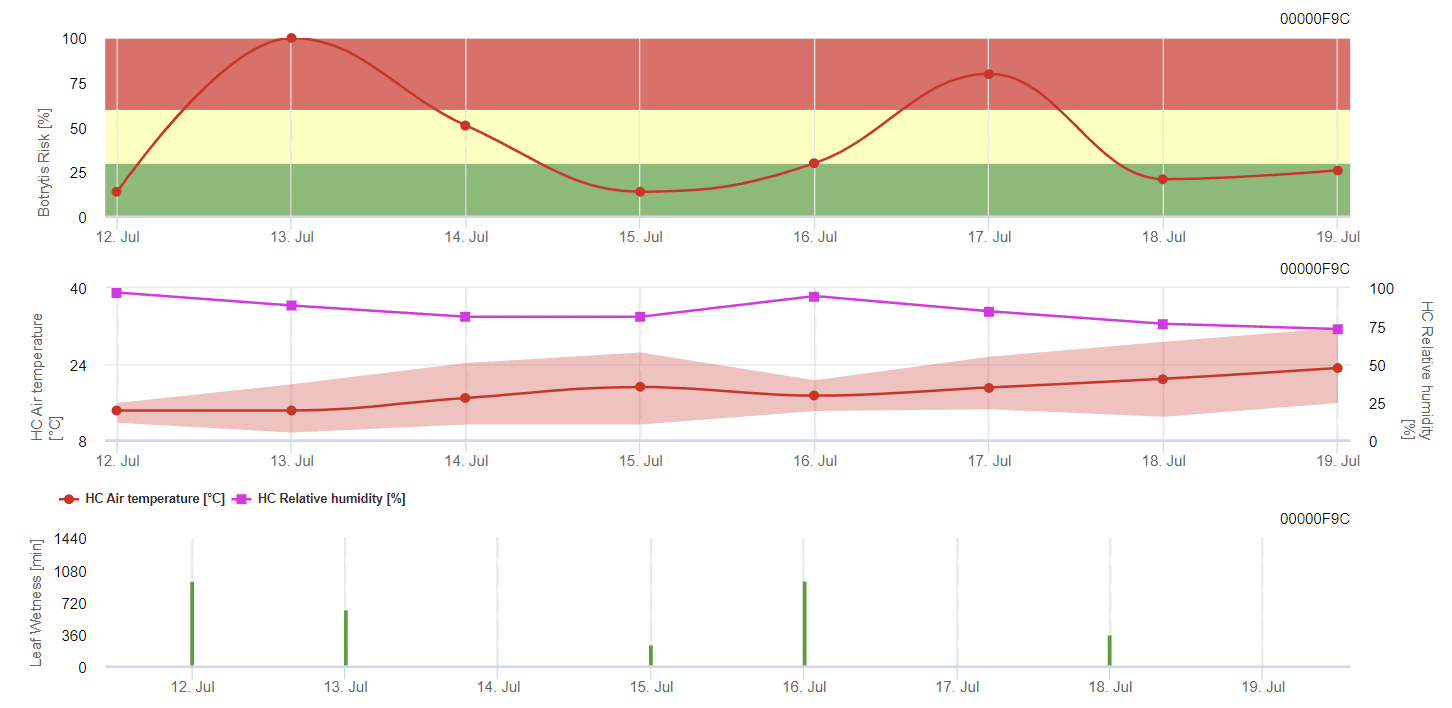
Sensores necessários:
- Temperatura do ar
- Humidade relativa
- Humidade das folhas
B. cinerea está relacionado com o clima húmido. O fungo requer uma humidade relativa elevada ou a presença de água livre para a infeção. Os períodos quentes com um período prolongado de humidade das folhas conduzem a um aumento do risco de B. cinerea, enquanto os períodos secos o reduzem. A infeção ocorre em rebentos jovens durante períodos húmidos prolongados ou tempestades de granizo prejudiciais.
O modelo calcula o risco num valor de 0 a 100%. Este valor indica a pressão de B. cinerea na altura - se tivermos um valor de 100%, isso significa que houve várias vezes um período de humidade suficientemente longo para infetar o tecido suscetível. Calculamos os chamados "pontos húmidos" entre a humidade das folhas e a temperatura com um máximo de 38400 pontos inicialmente (início da estação, que apresenta um risco de 30%). Após este período, cada período húmido com cerca de 4000 pontos húmidos aumenta o risco em 10%, ou, por outro lado, cada período seco reduz o risco em ⅕ do valor anterior.
Literatura
- Broome, J. C., English, J. T., Marois, J. J., Latorre, B. A., & Aviles, J. C. (1995). Desenvolvimento de um modelo de infeção para a podridão cinzenta do cacho da uva baseado na duração da humidade e na temperatura. Phytopathology, 85(1), 97-102.
- Elmer, P. A., & Michailides, T. J. (2007). Epidemiologia de Botrytis cinerea em culturas de pomar e vinha. Em Botrytis: biology, pathology and control (pp. 243-272). Dordrecht: Springer Netherlands.
- Williamson, B., Tudzynski, B., Tudzynski, P., & Van Kan, J. A. (2007). Botrytis cinerea: a causa da doença do bolor cinzento. Molecular plant pathology, 8(5), 561-580.
- Ciliberti, N., Fermaud, M., Roudet, J., & Rossi, V. (2015). As condições ambientais afectam a infeção por Botrytis cinerea em bagos de uva maduros mais do que a estirpe ou o genótipo do transposão. Phytopathology, 105(8), 1090-1096.
Antracnose
Pathogen
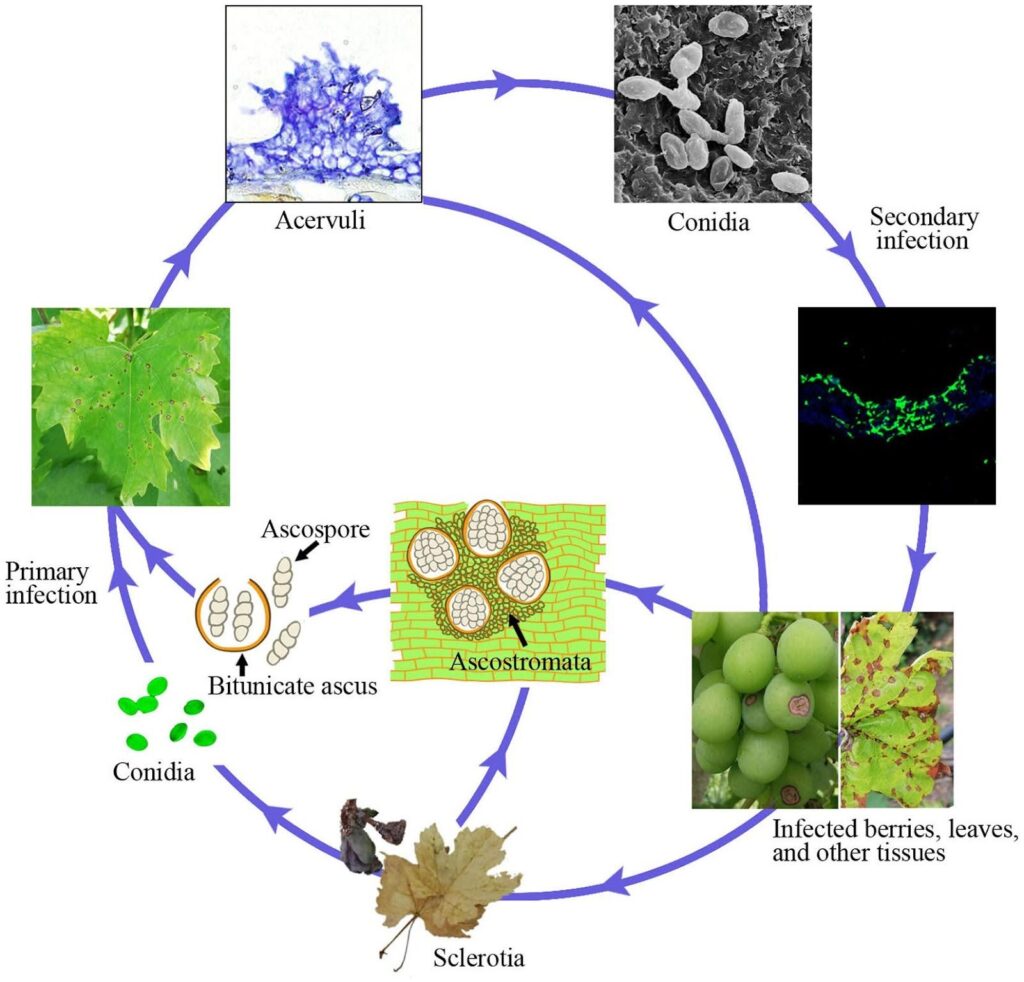
A antracnose da videira é causada pelo agente patogénico Ampelina de Elsinoe.
As canas infectadas são a principal fonte da doença. Os esclerócios e os micélios que sobrevivem nas lesões e nas bagas durante o inverno tornam-se activos na primavera e produzem ascósporos (esporos sexuais) e conídios (esporos assexuais) em condições de humidade (chuva ou orvalho durante 24 horas) dentro da gama de temperaturas de 2~40°C.
Estes esporos são dispersos para novos tecidos por salpicos de chuva e pelo vento e, uma vez pousados, germinam e formam tubos germinativos e apressórios, iniciando uma nova infeção. Podem infetar novas folhas, rebentos, gavinhas e bagas jovens. O tempo quente reduz a duração da humidade necessária para a infeção inicial e o período de incubação. A germinação óptima dos esporos ocorre a 25~30°C, sendo necessário um mínimo de 3~4 horas de humidade nas folhas. Nas infecções a uma temperatura de cerca de 10°C, o período de incubação é de cerca de 14 dias.
À medida que a colonização progride, surgem acérvulos e são produzidos novos conídios, que servem de inóculo de infeção secundária. São responsáveis por uma infeção rápida e posterior na estação.
Sintomas
E. ampelina ataca as partes aéreas e suculentas da videira, incluindo rebentos, folhas, pecíolos, gavinhas, ráquis e bagos; as lesões nos rebentos e nos bagos são as mais comuns. As uvas têm uma resistência ontogénica aos fungos, pelo que os tecidos jovens são mais susceptíveis.
No início aparecem pequenas manchas castanho-avermelhadas que aumentam com o tempo húmido, tornando-se ligeiramente afundadas com um centro cinzento rodeado por uma margem escura. Por vezes, os sintomas podem assemelhar-se a ferimentos causados pelo granizo. O centro necrótico das folhas geralmente cai, criando um aspeto de "buraco de tiro".
Em caso de infeção grave, as plantas podem apresentar desfoliação precoce, atraso no crescimento da cana, quebra do caule, queda dos bagos e atraso no desenvolvimento e amadurecimento dos bagos.
Modelo FieldClimate
Modelo de antracnose na viticultura
Sensores necessários:
- Temperatura do ar
- Humidade relativa
- Humidade das folhas
- Precipitação
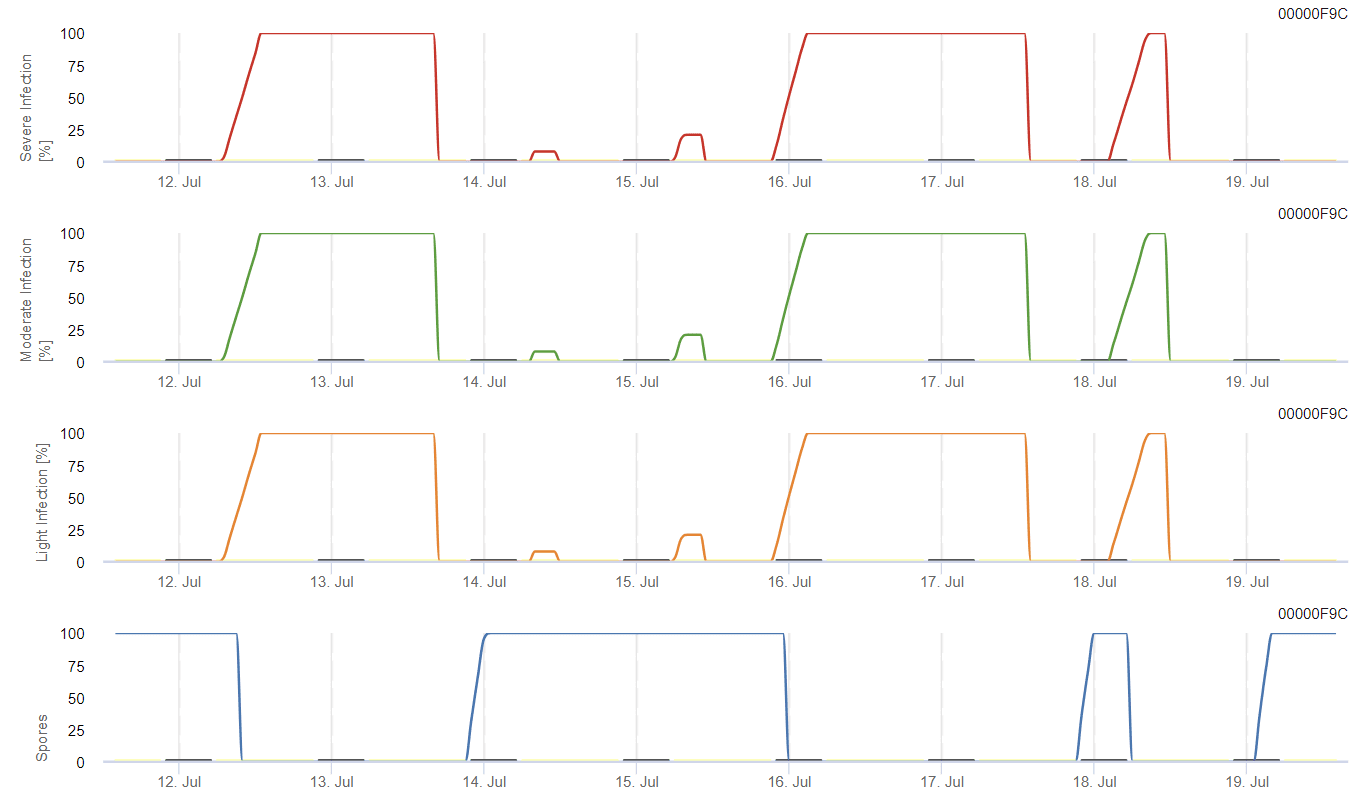
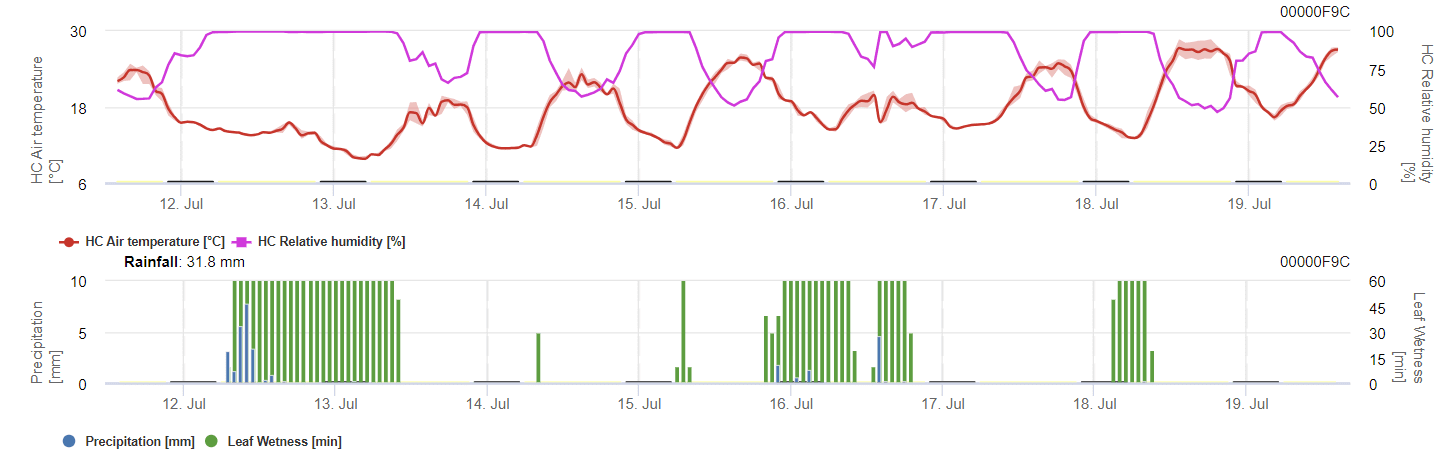
O modelo calcula o risco de antracnose tendo em conta a temperatura do ar, a humidade relativa, a humidade das folhas e a precipitação.
O possível desenvolvimento de uma infeção fraca, moderada e grave é apresentado em gráficos separados. Uma infeção deve ser considerada completa quando a curva crescente atinge 100%. O último gráfico mostra a esporulação de E. ampelinase o valor aí atingir 100%, presume-se que os esporos de E. ampelina estão presentes.
Para que os esporos de inverno se desenvolvam, as condições devem corresponder a um intervalo de temperatura de 2 a 40°C, humidade relativa superior a 90% ou humidade foliar. Quando o desenvolvimento dos esporos atinge 100%, a infeção começa a ser calculada. A gravidade da infeção depende das condições de humidade (eventos de chuva). No entanto, se a humidade descer abaixo de 50%, tanto o desenvolvimento dos esporos como a infeção deixam de ser calculados.
Literatura
- Li, Z., Dos Santos, R. F., Gao, L., Chang, P., & Wang, X. (2021). Situação atual e perspectivas futuras da antracnose da videira causada por Elsinoe ampelina: Uma doença importante em regiões úmidas de cultivo de uvas. Patologia Molecular das Plantas, 22(8), 899-910
PHOMOPSIS MANCHA DA CANA E DA FOLHA
Pathogen
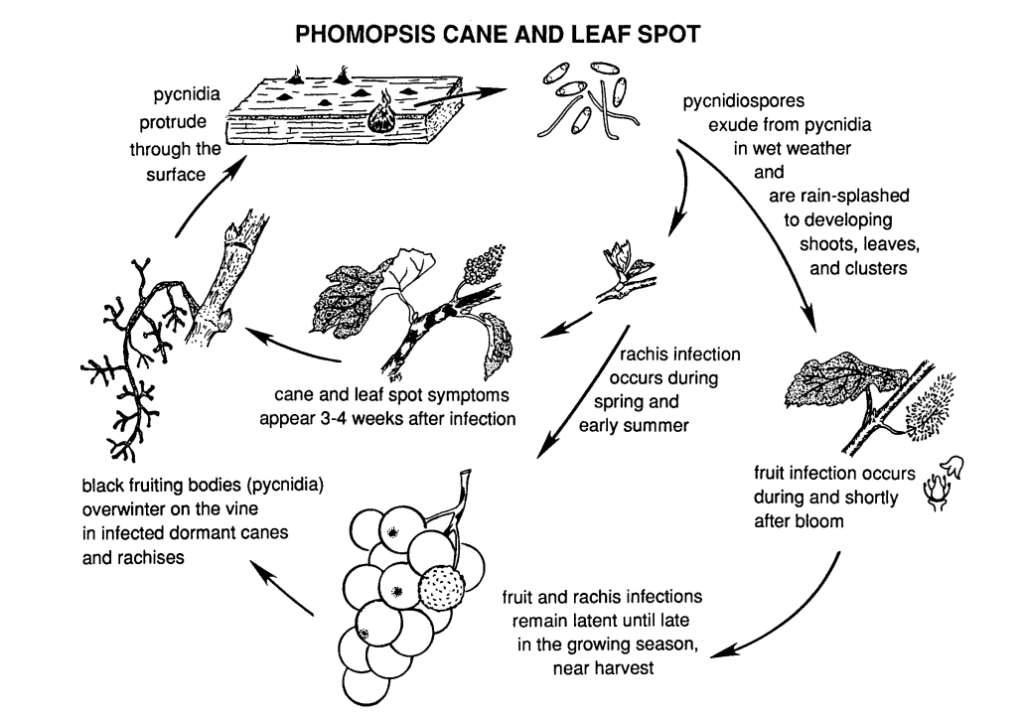
A mancha de Phomopsis da cana e da folha na videira é causada por Phomopsis viticola.
O fungo hiberna nas partes lenhosas da videira e volta a estar ativo na primavera seguinte. Quando as temperaturas sobem e começam as chuvas de primavera, os esporos são libertados das estruturas de invernada chamadas picnídios. À medida que os esporos são dispersos pela chuva e pelo vento para novos tecidos, a infeção propaga-se.
O período de infeção primária coincide tipicamente com as chuvas do início da primavera, começando pouco depois da abertura dos botões, quando os rebentos apresentam uma fase inicial de crescimento. Os rebentos jovens, as pontas dos rebentos, os cachos de frutos e a ráquis são todos vulneráveis à infeção. Embora as pontas dos rebentos possam ser infectadas durante toda a estação de crescimento, as infecções são mais comuns desde a abertura dos botões até à floração. Nos frutos, o agente patogénico pode permanecer adormecido até os frutos amadurecerem. O período de incubação dura geralmente cerca de 3 a 4 semanas.
Sintomas
Nas folhas e pecíolos, surgem pequenas manchas escuras com centros negros rodeados por margens amarelas, que acabam por se fundir. As folhas basais podem ficar distorcidas e enrugadas e podem não atingir o seu tamanho máximo. Quando os pecíolos estão muito infectados, amarelecem e caem, levando à queda das folhas. As folhas criam um efeito de guarda-chuva que reduz outras infecções por esporos.
Aparecem manchas semelhantes nos rebentos, provocando fissuras nas camadas epidérmicas nos locais de infeção. À medida que as manchas se fundem, as áreas infectadas dos rebentos desenvolvem uma textura escabrosa. Em casos graves, os rebentos podem ficar atrofiados, partir-se ou mesmo morrer.
As lesões na ráquis fazem com que esta fique afundada e quebradiça. Após um período de dormência no verão, o fungo reactiva-se no início do outono, provocando a podridão dos bagos e dos cachos. Embora as infecções dos frutos não sejam geralmente extensas, formam-se manchas nos bagos, muitas vezes acompanhadas de manchas pretas (picnídios) na casca do bago. Em condições de humidade, as massas de esporos amarelos podem escorrer dos picnídios, provocando a descoloração dos frutos, a sua textura rugosa e a sua mumificação.
A madeira infetada apresenta um aspeto branqueado no período de dormência. As canas e os esporões gravemente infectados apresentam descolorações escuras misturadas com áreas branqueadas na casca. Os picinídios também podem romper a superfície. As baixas temperaturas, juntamente com a deterioração da função do floema e do xilema, enfraquecem e matam as canas, os esporões e os gomos.
Modelo FieldClimate
Modelo de infeção por Phomopsis na viticultura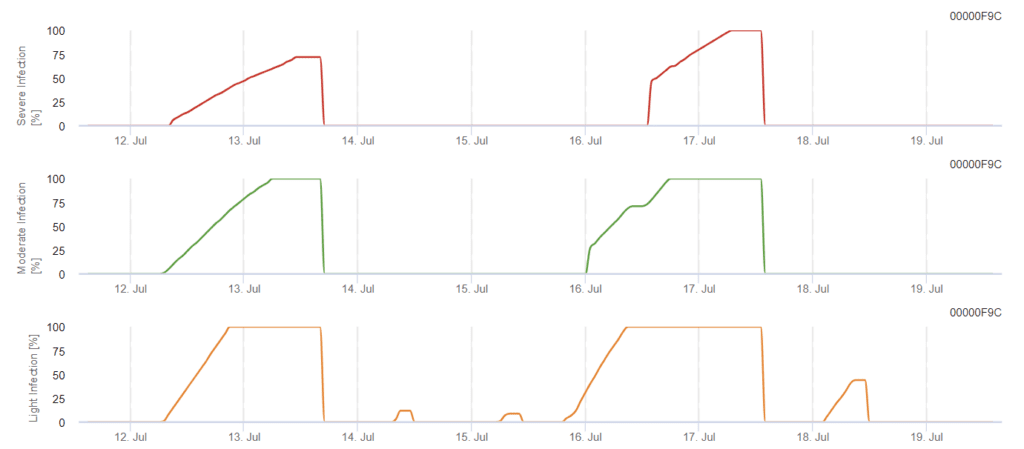
Sensores necessários:
- Temperatura do ar
- Humidade relativa
- Humidade das folhas
- Precipitação
O modelo determina o risco de infeção por Phomopsis na gama de temperaturas de 5 a 35°C e em condições de humidade (humidade nas folhas, humidade relativa elevada). A gravidade da infeção depende da quantidade de chuva (mais de 2 mm), uma vez que os esporos se distribuem mais rapidamente pelo material vegetal saudável. Quando a infeção 100% é mostrada, indica que foram medidas no campo condições óptimas para infetar o tecido vegetal e, portanto, as medidas de proteção das plantas devem ser tidas em conta.
Literatura
- https://agriculture.vic.gov.au/biosecurity/plant-diseases/grapevine-diseases/phomopsis-cane-and-leaf-spot-of-grapevines
- Bettiga, L. J. (Ed.). (2013). Manejo de pragas da uva (Vol. 3343). Publicações UCANR.
- Pscheidt, J. W., & Pearson, R. C. (1991). Phomopsis cane & leaf spot.
Equipamento recomendado
Verificar que conjunto de sensores é necessário para monitorizar as potenciais doenças desta cultura.
