Modele chorób - konopie i len

Konopie i linum modele choroby
Zgnilizna twardzikowa (Sclerotinia)
Zgnilizna twardzikowa dotyka wielu roślin, szczególnie gatunków niezdrewniałych. Zgnilizna twardzikowa jest powodowana przez S. sclerotiorum. Zgnilizna twardzikowa może zaatakować rośliny na każdym etapie produkcji, w tym sadzonki, dojrzałe rośliny i zebrane produkty. Szczególnie podatne na infekcje są rośliny o starzejącej się lub martwej tkance.
Symptomy
Zainfekowany obszar rośliny początkowo przybiera ciemnozielony lub brązowy, nasiąknięty wodą wygląd, a następnie może stać się bledszy. Zwykle rozwija się gęsta, biała, włochata grzybnia, a roślina zaczyna więdnąć i w końcu zamiera. Struktury spoczynkowe lub przetrwalnikowe (sklerocja) są wytwarzane zewnętrznie na zaatakowanych częściach roślin i wewnętrznie w zagłębieniach litych łodyg. Sklerocja są twarde, czarne, o nieregularnym kształcie, najczęściej o wielkości 2-4 mm, a po wniknięciu do gleby są trudne do zauważenia.
Źródła chorób i ich rozprzestrzenianie się
Cykl życia S. sclerotiorum obejmuje zarówno fazę przenoszoną przez glebę, jak i przez powietrze. Sklerotyzmy S. sclerotiorum mogą przetrwać w glebie przez dziesięć lat lub dłużej. Kiełkują, wytwarzając małe, lejkowate owocniki (apothecia) o średnicy około 1 cm. Apothecia wytwarzają zarodniki przenoszone drogą powietrzną, które mogą powodować infekcje, gdy znajdą się na podatnej roślinie żywicielskiej, albo poprzez kwiaty, albo poprzez bezpośrednie kiełkowanie na liściach. Sporadycznie może dojść do zakażenia podstawy łodygi, gdy pasma grzyba (grzybnia) rozwiną się bezpośrednio ze sklerocjów przy powierzchni. Nowe sklerocja rozwijają się w zainfekowanej tkance roślinnej, a po obumarciu rośliny pozostają na powierzchni gleby lub mogą się do niej dostać podczas późniejszej uprawy gleby.
Warunki zakażenia
Po okresie chłodów w zimie, skleroty, zimujące w górnych 5 cm gleby, kiełkują od wiosny, wytwarzając apotecję, kiedy to temperatura gleby wynosi 10°C lub więcej, a gleba jest wilgotna. Sclerotia nie kiełkują w suchej glebie lub gdy temperatura gleby wynosi powyżej 25°C. Mniejsze szanse na kiełkowanie mają sklerocja zakopane poniżej 5 cm w glebie. Gdy apotecja jest już w pełni uformowana, uwolnienie zarodników może nastąpić w świetle lub w ciemności, ale jest zależne od temperaturywięc szczyt rozwoju przypada na godziny południowe. Apothecia może przetrwać około 20 dni w temperaturze 15-20°C, ale wysycha po mniej niż 10 dniach w temperaturze 25°C. Dla kwitnące zioła, zarodniki lądujące na płatkach i pręcikach szybko kiełkują (kiełkowanie w ciągu 3-6 godzin i infekcja w ciągu 24 godzin) w optymalnych warunkach 15-25°C, ciągłe zwilżenie liści i wysoka wilgotność w obrębie rośliny uprawnej. Późniejsze zakażenie liści i łodyg zależy od opadających i przyklejających się do liści płatków. Ryzyko infekcji zwiększa się, gdy liście są wilgotne, ponieważ powoduje to przyklejanie się większej liczby płatków. Zainfekowane, martwe lub starzejące się płatki dostarczają składników odżywczych dla inwazji grzyba do liści i łodyg. Na zioła niekwiatowe, zakażenie następuje głównie przez zarodniki przenoszone drogą powietrzną, które lądują bezpośrednio na liściach. Zarodniki mogą przetrwać na liściach przez kilka tygodni, aż wystąpią warunki sprzyjające infekcji liści. Kiełkowanie zarodników i infekcja zależą od obecności składników odżywczych na liściach, pochodzących z ran roślin lub ze starzejącego się materiału roślinnego. W przypadku kwitnących ziół optymalne warunki do kiełkowania zarodników i infekcji to 15-25°C, przy ciągłej wilgotności liści i wysokiej wilgotności. Po zakażeniu roślin szybkiemu postępowi choroby sprzyjają ciepłe (15-20°C) i wilgotne warunki w gęstych uprawach.
Model infekcji Sclerotinia
Zakażenie roślin przez S. sclerotiorum
Kiełkowanie karpogenów w sklerotach jest stymulowane przez okresy stała wilgotność gleby. Na powierzchni gleby powstają apothecia, z których ascospory uwalniają się do powietrza. Zakażenie większości gatunków roślin uprawnych jest związane głównie z askosporami, ale bezpośrednie zakażenie zdrowej, nienaruszonej tkanki roślinnej przez kiełkujące askospory zwykle nie występuje. Do zakażenia tkanek liści i łodyg zdrowych roślin dochodzi tylko wtedy, gdy kiełkujące askospory kolonizują martwe lub starzejące się tkanki, zwykle części kwiatów, takie jak obumarłe płatki, przed utworzeniem struktur infekcyjnych i penetracją. Kiełkowanie grzybni na powierzchni gleby może również prowadzić do kolonizacji martwej materii organicznej, a następnie do zakażenia sąsiadujących żywych roślin. Jednakże w niektórych uprawach, np. Słonecznik kiełkujące grzybnie skleroty mogą bezpośrednio zainicjować proces infekcji korzeni i łodygi podstawowej skutkujący więdnięciem. Bodziec do kiełkowania i infekcji grzybów w słoneczniku nie jest znany, ale prawdopodobnie zależy od sygnałów odżywczych w ryzosferze pochodzących od roślin żywicielskich.
Proces zakażenia
Zakażenie zdrowej tkanki zależy od tworzenie się appressorium, których struktura może być prosta lub złożona w zależności od powierzchni gospodarza. W większości przypadków penetracja jest bezpośrednio przez kutikulę a nie przez aparaty szparkowe. Apresoria powstają z końcowych, dychotomicznych rozgałęzień strzępek rosnących na powierzchni żywiciela i składają się z poduszeczki szerokich, wieloczłonowych, krótkich strzępek zorientowanych prostopadle do powierzchni żywiciela, do której są przytwierdzone przez śluz. Złożone appressoria są często określane jako poduszki infekcyjne. Chociaż wcześniejsi pracownicy uważali, że penetracja kutikuli jest procesem czysto mechanicznym, istnieją silne dowody z badań ultrastrukturalnych, że enzymatyczne trawienie kutikuli również odgrywa rolę w procesie penetracji. Niewiele wiadomo o. S. sclerotiorum kutynazy, jednak genom koduje co najmniej cztery enzymy podobne do kutynazy (Hegedus niepublikowane). Duża pęcherzyk, utworzony na końcu appressorium przed penetracją, wydaje się być uwalniany do kutikuli gospodarza podczas penetracji. Po przeniknięciu kutikuli tworzy się pęcherzyk podskórny, z którego wyrastają duże rozłogi, przecinające podskórną ścianę epidermy.
Zakażenie poprzez enzymatyczną degratację komórek epidemicznych: Kwas szczawiowy działa w porozumieniu z enzymami degradującymi ścianę komórkową, takimi jak poligalakturonaza (PG), aby doprowadzić do zniszczenia tkanki gospodarza poprzez stworzenie środowiska sprzyjającego atakowi PG na pektyny w środkowej lameli. To z kolei uwalnia niskocząsteczkowe pochodne, które indukują ekspresję dodatkowych genów PG. Rzeczywiście, ogólna aktywność PG jest indukowana przez pektynę lub pochodne pektyny monosacharydy, takie jak kwas galakturonowy, i jest tłumiona przez obecność glukozy. Badanie wzorców ekspresji poszczególnych genów Sspg ujawniło, że wzajemne oddziaływanie pomiędzy PG i gospodarzem podczas różnych etapów infekcji jest precyzyjnie skoordynowane. (Dwayne D. Hegedus *, S. Roger Rimmer: Sclerotinia sclerotiorum: When ''to be or not to be'' a pathogen? FEMS Microbiology Letters 251 (2005) 177-184)
Poszukując warunków klimatycznych do zakażenia S. sclerotiorum należy wziąć pod uwagę tworzenie apotecji, sporulację, bezpośrednie zakażenie przez apotecję (nawet jeśli nie ma ono miejsca zbyt często) oraz zakażenie z ustalonych grzybni poprzez enzymatyczną degradację komórek epidemicznych .
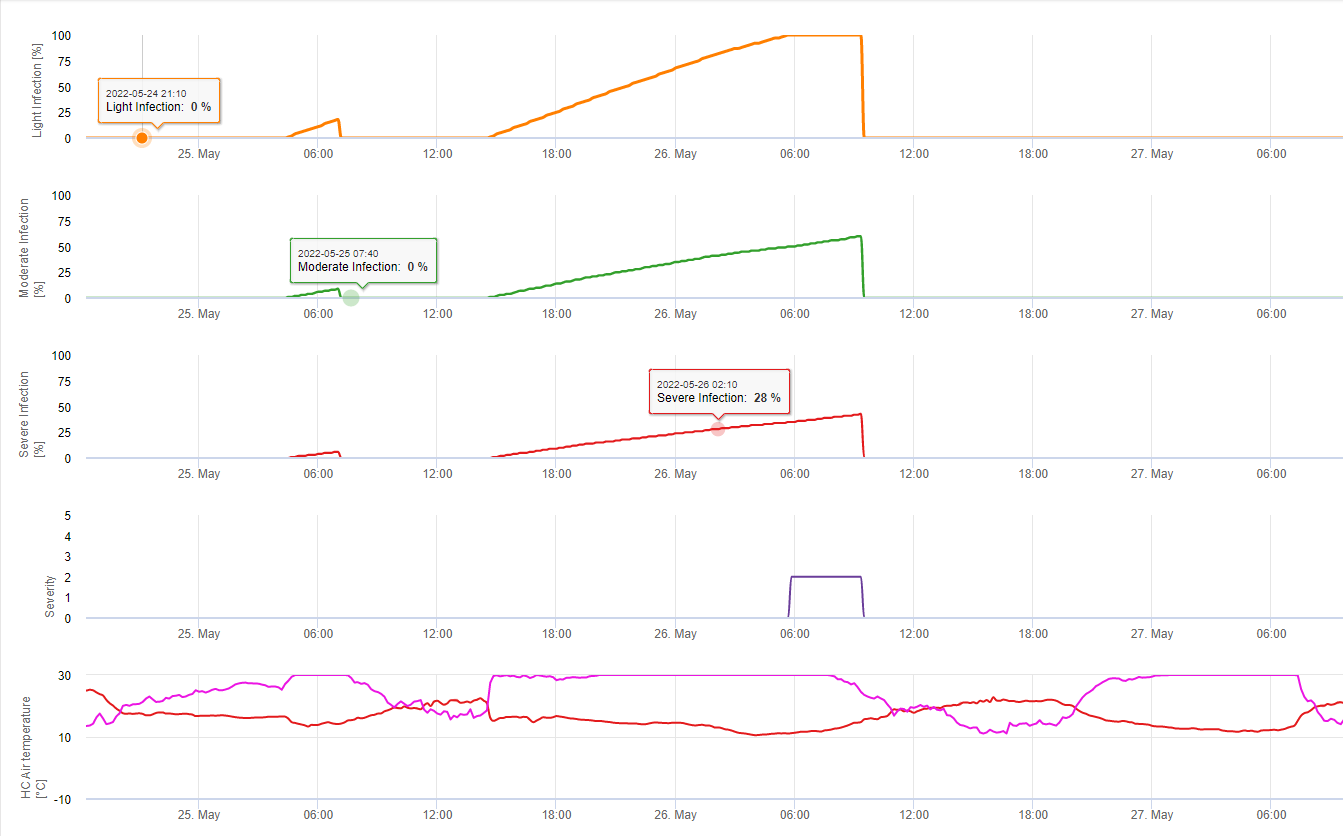
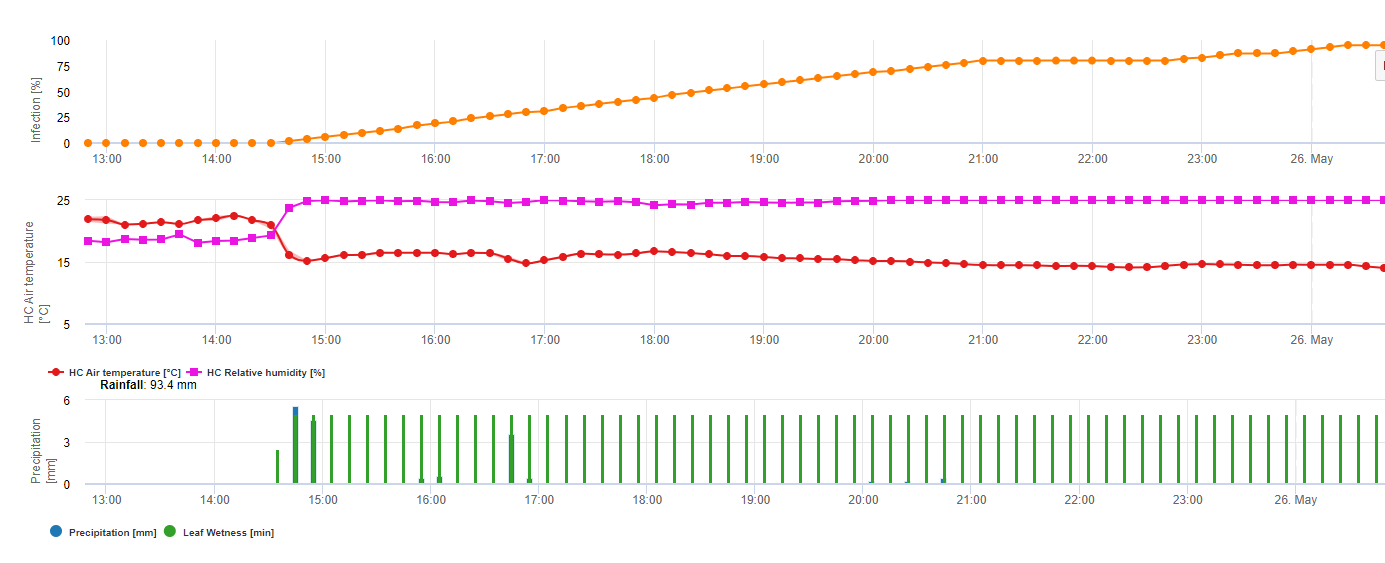
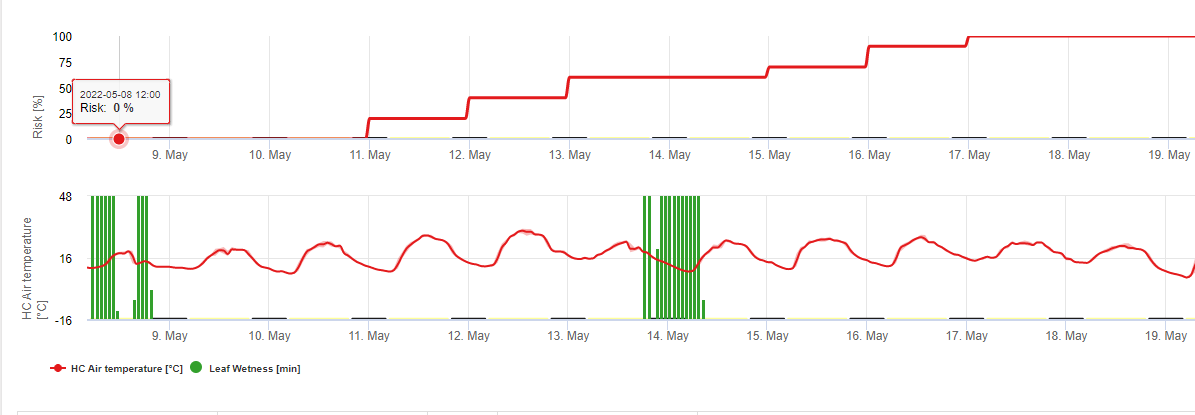
Tworzenie apotecji i sporulacja ma miejsce, jeśli deszcz powyżej 8 mm po czym następuje okres wysoka wilgotność względna utrzymująca się dłużej niż 20 godzin w optymalnej temperaturze od 21°C do 26°C.
Bezpośrednie zakażenie przez Apothecia można się spodziewać po okres zwilżenia liści, po którym następuje 16 godzin wilgotności względnej wyższej niż 90% w optymalnej temperaturze 21°C do 26°C ("zakażenie apresorią"). Natomiast wzrost saprofityczny, po którym następuje encefalopatyczna degratacja komórek epidermy ("infekcja hydrolityczna") może być spodziewany przy nieco niższej względnej wilgotności 80%, trwającej przez okres 24 godzin w optymalnych warunkach 21°C do 26°C.
Literatura:
- Lumsden, R.D. (1976) Pectolytic enzymes of Sclerotinia sclerotiorum and their localization on infected bean. Can. J. Bot. 54,2630-2641.
Tariq, V.N. and Jeffries, P. (1984) Appressorium formation by Sclerotinia sclerotiorum: scanning electron microscopy. Trans. Brit. Mycol. Soc. 82, 645-651. - Boyle, C. (1921) Studia nad fizjologią pasożytnictwa. VI. Zakażenie przez Sclerotinia libertiana. Ann. Bot. 35, 337-347.
Abawi, G.S., Polach, F.J. and Molin, W.T. (1975) Infection of bean by ascospores of Whetzelinia sclerotiorum. Phytopathology 65, 673-678. - Tariq, V.N. and Jeffries, P. (1986) Ultrastruktura penetracji Phaseolus spp. przez Sclerotinia sclerotiorum. Can. J. Bot. 64, 2909- 2915.
- Marciano, P., Di Lenna, P. i Magro, P. (1983) Kwas szczawiowy, enzymy degradujące ścianę komórkową i pH w patogenezie oraz ich znaczenie w wirulencji dwóch izolatów Sclerotinia sclerotiorum na słoneczniku. Physiol. Plant Pathol. 22, 339-345.
- Fraissinet-Tachet, L. and Fevre, M. (1996) Regulacja przez kwas galakturonowy produkcji enzymów ppectinolitycznych przez Sclerotinia sclerotiorum. Curr. Microbiol. 33, 49-53.
Praktyczne wykorzystanie modelu Sclerotinia
Model zakażenia białych nóg pokazuje okresy, w których. tworzenie się apotecji należy się spodziewać. Jeśli te okresy są zbieżne z okresem kwitnienia rzepaku lub canoli, musimy się spodziewać S. sclerotiorum infekcje w okresie wilgotnym. Zarodniki powstałe w apotecjach mogą być dostępne przez jeden do kilku dni. O możliwości infekcji świadczy obliczenie postępu infekcji dla infekcji bezpośrednich lub pośrednich przez apressoria lub enzymatyczną degradację ściany komórkowej. Jeśli linia postępu infekcji osiągnie 100% należy założyć infekcję. Infekcje te powinny być pokryte profilaktycznie lub fungicydem o działaniu leczniczym przeciwko S. sclerotiorum musi być użyta.
Szara pleśń
Biologia szarej pleśni
Grey Mould (Botrytis cinerea) to wyniszczająca choroba o dużych skutkach ekonomicznych w produkcji. B. cinerea infekuje kwiaty i owoce bliskie dojrzałości.
Patogen grzybowy ma bardzo szeroki zakres żywicielski, zakaża ponad 200 różnych gospodarzy. Rozwój grzybów istnieje saprofitycznie i pasożytniczo.
Symptomy
Na słonecznikach patogen powoduje szarą pleśń na główce i łodydze. W tym samym czasie liście zaczynają wysychać. Objawy te występują podczas dojrzewania ziarna na główce. Na tylnej stronie widoczne są brązowe plamy. Plamy te pokryte są grzybnią i zarodnikami grzyba, co daje wygląd pudru. Zarodniki mają możliwość rozprzestrzeniania się podczas wilgotnych warunków atmosferycznych.
Czarne skleroty pozbawione meduli pojawiają się na resztkach pożniwnych po zbiorze lub bezpośrednio na roślinach, jeśli są zbierane zbyt późno.
Grzyb zimuje w czasie zimy na powierzchni gleby lub w glebie w postaci grzybni lub sklerot. Wiosną forma zimująca zaczyna kiełkować i wytwarzać konidia. Konidia te są roznoszone przez wiatr i deszcz i infekują nowe tkanki roślinne.
Kiełkowanie jest możliwe przy wilgotności względnej powyżej 85%. Optymalna temperatura kiełkowania wynosi 18°C. Patogen grzybowy może rozmnażać się wielokrotnie.
Opcje sterowania: Zwalczanie nasion może ochronić rośliny przed zawilgoceniem. Chemiczne zwalczanie jest trudne z powodu odporności patogenu. Dlatego też podejmowane są próby naturalnych strategii kontroli przy użyciu Trichoderma harzianum.
Warunki modelowania zakażenia
B. cinerea infekcje są związane z wolna wilgoć. Dlatego w produkcji polowej wilgotność liści, która jest dobrym wskaźnikiem, jest określona.
Bulger i wsp. (1987) badali korelację okresów zwilżenia liści w czasie kwitnienia z występowaniem szarej pleśni na owocach. Stwierdzili oni, że dla. wyższe ryzyko infekcji w 20°C potrzebny jest okres dłuższy niż 32 godziny zwilżenia liści. W niższych temperaturach okresy zwilżenia liści muszą być dłuższe, aby doszło do infekcji choroby.
FieldClimate wskazuje na ryzyko Botrytis cinerea na podstawie okresy zwilżenia liści i temperatura w tych okresach.
Poniższy wykres przedstawia czas trwania mokrych liści w zależności od rzeczywistej temperatury potrzebnej do Botrytis infekcja. Jeśli ryzyko jest wyższe niż 0 każdy okres zwilżenia liści dłuższy niż 4 godziny zwiększy ryzyko o tę samą relację.
Dzień z okresem zwilżenia liści krótszym niż 4 godziny przyjmuje się za dzień suchy i zmniejsza ryzyko o 20% wartości rzeczywistej.
Praktyczne wykorzystanie modelu szarej formy: Model wskazuje okresy z ryzykiem wystąpienia m.in. Botrytis infekcja. Ten okres ryzyka w czasie kwitnienia truskawek prowadzi do zakażenia owoców. Im dłużej trwa okres ryzyka i im wyższe jest ryzyko, tym większe jest prawdopodobieństwo i liczba zakażonych owoców. Ryzyko, które można wziąć pod uwagę, zależy od rynku. Producenci, którzy sprzedają swoje owoce do supermarketów nie podejmują żadnego ryzyka, wiedząc, że nie mogą sprzedać zakażonych owoców. Natomiast producenci, którzy sprzedają swoje owoce bezpośrednio ludziom, są w stanie podjąć większe ryzyko.
Literatura:
- Bulger M.A., Ellis M. A., Madden L. V. (1987): Influence of temperature and wetness druation on infection of strawberry flowers by Botrytis cinerea and disease incidence of fruit originating from infected flowers. Ecology and Epidemiology; Vol 77 (8): 1225-1230.
- Sosa-Alvarez M., Madden L.V., Ellis M.A. (1995): Wpływ temperatury i czasu trwania wilgotności na sporulację Botrytis cinerea na resztkach liści truskawki. Plant disease 79, 609-615.
Brązowa zaraza
Wczesna zaraza ziemniaka i pomidora
Randall C. Rowe, Sally A. Miller, Richard M. Riedel, Ohio State University Extension Service
Zaraza wczesna jest bardzo powszechną chorobą zarówno ziemniaka, jak i pomidora. Powoduje plamy na liściach i zgorzel bulw ziemniaka oraz plamy na liściach, gnicie owoców i zmiany na łodygach pomidora. Choroba ta może występować w szerokim zakresie warunków klimatycznych i może być bardzo niszcząca, jeśli nie jest kontrolowana, często prowadząc do całkowitego wyniszczenia roślin. W przeciwieństwie do nazwy, rzadko rozwija się wcześnie, ale zwykle pojawia się na dojrzałych liściach.
Symptomy
Na liściach obu roślin pierwsze objawy pojawiają się zwykle na starszych liściach i składają się z małych, nieregularnych, ciemnobrązowych do czarnych, martwych plamek o wielkości od szpilki do 1/2 cala średnicy. W miarę powiększania się plam mogą powstawać koncentryczne pierścienie, będące wynikiem nieregularnego wzrostu organizmu w tkance liścia. Nadaje to zmianie charakterystyczny wygląd "target-spot" lub "bull's eye". Wokół każdej plamki często pojawia się wąska, żółta obwódka, a zmiany są zwykle ograniczone przez żyłki. Gdy plamy są liczne, mogą się zrastać, powodując żółknięcie i zamieranie zainfekowanych liści. Zazwyczaj najpierw zakażane są najstarsze liście, które w miarę postępu choroby zasychają i odpadają od rośliny.
Na pomidorze infekcje łodygi mogą wystąpić w każdym wieku, powodując powstanie małych, ciemnych, lekko zapadniętych obszarów, które powiększają się tworząc okrągłe lub wydłużone plamy z jaśniejszymi środkami. Na zmianach chorobowych na łodygach często pojawiają się koncentryczne oznaczenia, podobne do tych na liściach. Jeśli porażone nasiona zostaną użyte do zapoczątkowania transplantacji pomidora, siewki mogą zwiędnąć wkrótce po wzejściu. Gdy na łodygach transplantów lub siewek przy linii gruntu pojawią się duże zmiany, rośliny mogą zostać opasane, co jest stanem znanym jako "zgnilizna kołnierza". Rośliny takie mogą obumierać po posadzeniu w polu lub, jeśli łodygi są osłabione, mogą się wyłamać na początku sezonu. Niektóre rośliny mogą przetrwać z ograniczonym systemem korzeniowym, jeśli części łodyg znajdujące się powyżej raka wykształcą korzenie w miejscu kontaktu z glebą. Takie rośliny jednak zwykle dają mało owoców lub nie dają ich wcale. Zmiany na łodygach są znacznie mniej powszechne i niszczące na ziemniaku.
Opadanie kwiatów i plamistość pędów owocowych, a także utrata młodych owoców mogą wystąpić, gdy wczesna zaraza zaatakuje pomidory w fazie kwitnienia. Na starszych owocach wczesna zaraza powoduje powstawanie ciemnych, skórzastych, zapadniętych plam, zwykle w miejscu umocowania szypułek. Plamy te mogą się powiększać i obejmować całą górną część owocu, często wykazując koncentryczne oznakowania, jak na liściach. Porażone miejsca mogą być pokryte aksamitnymi, czarnymi masami zarodników. Owoce mogą być również zakażone w fazie zielonej lub dojrzałej poprzez pęknięcia wzrostu i inne rany. Zainfekowane owoce często opadają przed osiągnięciem dojrzałości.
Na bulwach ziemniaka wczesna zaraza powoduje powierzchniowe zmiany, które wydają się nieco ciemniejsze od przylegającej zdrowej skórki. Zmiany są zazwyczaj lekko zapadnięte, okrągłe lub nieregularne i różnią się wielkością do 3/4 cala średnicy. Pomiędzy zdrową i chorą tkanką jest zazwyczaj dobrze zdefiniowany, a czasem lekko podniesiony margines. Wewnętrznie, tkanka wykazuje brązowe do czarnych korków, suchą zgniliznę, zwykle nie więcej niż 1/4 do 3/8 cala głębokości. W starszych zmianach mogą powstawać głębokie pęknięcia. Infekcja bulw jest rzadka w warunkach Ohio.
Patogen
Wczesną zarazę wywołuje grzyb Alternaria solani, który przeżywa w zainfekowanych tkankach liści lub łodyg na lub w glebie. Grzyb ten jest powszechnie obecny na polach, na których uprawiano te rośliny. Może być również przenoszony na nasionach pomidorów i w bulwach ziemniaków. Zarodniki tworzą się na porażonych szczątkach roślinnych na powierzchni gleby lub na aktywnych zmianach w dość szerokim zakresie temperatur, zwłaszcza w warunkach naprzemiennej wilgotności i suchości. Są one łatwo przenoszone przez prądy powietrzne, wiatr, deszcz i wodę do nawadniania. Do zakażenia podatnych tkanek liści lub łodyg dochodzi w czasie ciepłej, wilgotnej pogody z silnymi opadami deszczu lub rosy. Wczesna zaraza może rozwijać się dość szybko w połowie lub pod koniec sezonu i jest bardziej dotkliwa, gdy rośliny są zestresowane przez złe odżywianie, suszę lub inne szkodniki. Zakażenie bulw ziemniaka następuje przez naturalne otwory w skórce lub przez zranienia. Bulwy mogą mieć kontakt z zarodnikami podczas zbiorów, a zmiany chorobowe mogą się rozwijać podczas przechowywania.
TOMCAST (Jim Jasinski, Koordynator TOMCAST dla OHIO, INDIANA i MICHIGAN)
Tło
TOMCAST (TOMato disease foreCASTing) to model komputerowy oparty na danych polowych, który próbuje przewidzieć rozwój chorób grzybowych, a mianowicie Wczesnej Zarazy, Septoria Leaf Spot i Antraknozy na pomidorach. Umieszczone na polu loggery danych rejestrują godzinowe dane dotyczące wilgotności liści i temperatury. Dane te były analizowane przez okres 24 godzin i mogą skutkować tworzenie wartości stopnia ciężkości choroby ; zasadniczo jest to przyrost rozwoju choroby. W miarę gromadzenia się DSV, presja chorobowa na uprawę stale rośnie. Gdy liczba nagromadzonych DSV przekracza okres między opryskami, zaleca się zastosowanie fungicydów w celu zmniejszenia presji chorobowej.
TOMCAST
Termin stosowania fungicydów na wczesną zarazę, Septoria leaf spot i Anthracnose
System prognozowania chorób oparty na danych pogodowych o nazwie TOMCAST, opracowany przez dr Rona Pitblado z Ridgetown College of Agricultural Technology w Ontario w Kanadzie, może być wykorzystany do ustalenia terminu zastosowania fungicydów w przypadku trzech chorób grzybowych: wczesnej zarazy (powodowanej przez Alternaria solani), Septoria leaf spot (powodowanej przez Septoria lycopersici) oraz antraknozy owoców (powodowanej przez Colletotrichum coccodes). Jeśli w twoim okręgu lub okręgach sąsiednich występuje zaraza późna lub istnieją warunki do przemieszczania się zarodników na twój teren, skorzystaj z systemu prognozowania zarazy późnej Simcast w celu ustalenia terminu zastosowania fungicydów.
WAŻNA UWAGA:
TOMCAST nie jest przydatny w gospodarstwach, które mają historię chorób bakteryjnych. Jeśli często występują problemy z bakteryjną plamistością, plamistością lub rakiem pomidorów, nie należy stosować TOMCASTU, ponieważ zalecane odstępy czasu między opryskami nie będą wystarczające do zwalczania chorób bakteryjnych, jeśli miesza się miedź z fungicydami. Informacje o ograniczaniu chorób bakteryjnych można znaleźć tutaj: http://extension.psu.edu/plants/vegetable-fruit/news/2015/farming-like-you-expect-bacterial-diseases
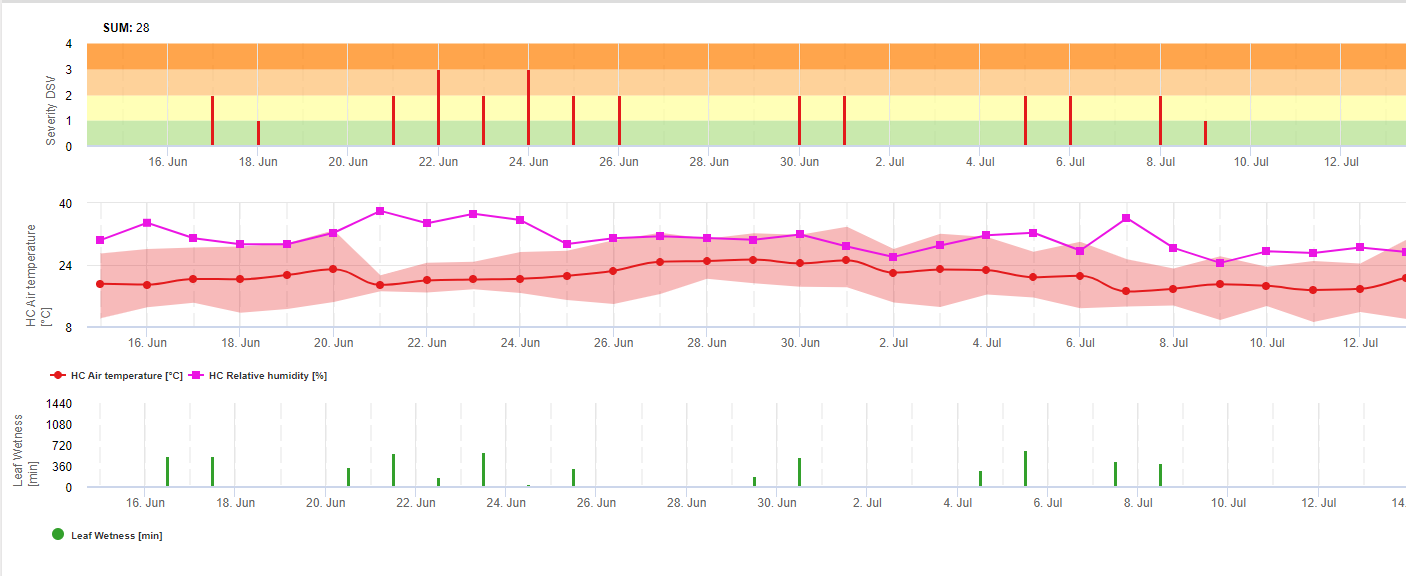
TOMCAST wykorzystuje dane dotyczące wilgotności i temperatury liści do obliczenia wartości nasilenia choroby (DSV), jak pokazano w tabeli 1.
TOMCAST wywodzi się z oryginalnego modelu F.A.S.T. (Forecasting Alternaria solani on Tomatoes) opracowanego przez Dr Madden, Pennypacker i MacNab na Uniwersytecie Stanowym Pensylwanii (PSU). Model PSU F.A.S.T. został zmodyfikowany przez Dr. Pitblado w Ridgetown College w Ontario w model TOMCAST używany przez Ohio State University Extension.
DSV Wartość stopnia nasilenia choroby (DSV) jest jednostką miary nadawaną konkretnemu stopniowi rozwoju choroby (wczesnej zarazy). Innymi słowy, DSV to liczbowa reprezentacja tego, jak szybko lub wolno choroba (wczesna zaraza) gromadzi się na polu pomidorów. DSV jest określane przez dwa czynniki: wilgotność liści i temperaturę podczas godzin "mokrych liści". Wraz ze wzrostem liczby godzin mokrych liści i temperatury, DSV gromadzi się w szybszym tempie. Zobacz poniższy wykres wartości nasilenia choroby.
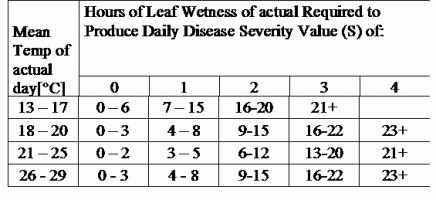
I odwrotnie, gdy jest mniej godzin wilgotności liści, a temperatura jest niższa, DSV gromadzą się powoli, jeśli w ogóle. Gdy całkowita liczba nagromadzonych DSV przekroczy ustalony limit, zwany odstępem między opryskami lub progiem, zaleca się wykonanie oprysku fungicydem w celu ochrony liści i owoców przed rozwojem choroby.

Odstęp między opryskami (określający kiedy należy wykonać oprysk) może wynosić od 15 do 20 DSV. Dokładna wartość DSV, jaką powinien zastosować plantator, jest zazwyczaj dostarczana przez przetwórcę i zależy od jakości owoców. Stosowanie odstępu 15 DSV jest konserwatywnym wykorzystaniem systemu TOMCAST, co oznacza, że opryski będą wykonywane częściej niż w przypadku plantatora, który stosuje odstęp 19 DSV z systemem TOMCAST. Wynikiem tego jest liczba oprysków wykonywanych w sezonie i potencjalne różnice w jakości owoców.
KORZYSTANIE Z TOMCAST
Pomidory uprawiane w promieniu 10 mil od stacji raportującej powinny korzystać z funkcji zarządzania chorobami TOMCAST, aby pomóc w prognozowaniu wczesnej zarazy, Septorii i Antraknozy. Jeśli zdecydujesz się wypróbować TOMCAST w tym sezonie, pamiętaj o trzech bardzo ważnych koncepcjach.
Po pierwsze: Jeśli po raz pierwszy używasz systemu, zaleca się, aby tylko część twojego areału została wprowadzona do programu, aby sprawdzić, jak pasuje do twoich standardów jakości i stylu działania.
Po drugie: Użyj TOMCAST jako przewodnika, aby lepiej zaplanować czas aplikacji fungicydów, zdając sobie sprawę, że w niektórych sezonach możesz zastosować więcej produktu, niż wymaga tego ustalony program.
Trzy: Im dalej pole pomidorów znajduje się od miejsca raportowania, tym bardziej zwiększa się prawdopodobieństwo zniekształcenia kumulacji DSV, tzn. raportowana wartość może być o kilka DSV wyższa lub niższa niż ta, której doświadcza lokalizacja pola. Należy wziąć to pod uwagę, gdy aplikacja fungicydów jest prawdopodobnie w odległości kilku dni. Należy słuchać raportów DSV z pobliskich stacji i triangulować do własnej lokalizacji jako najlepszy sposób na przybliżone oszacowanie akumulacji DSV.
PIERWSZY OPRYSK Z UŻYCIEM TOMCASTU
Przez lata toczyły się dyskusje na temat stosowania pierwszego oprysku przy stosowaniu TOMCASTU. Zasada podana w Przewodniku Produkcji Warzyw z 1997 roku koncentruje się wokół daty sadzenia.
Rośliny pomidora, które weszły na pole przed 20 maja, powinny mieć wykonany pierwszy oprysk, gdy DSV dla tego obszaru przekroczy 25 lub gdy nadejdzie bezpieczny termin 15 czerwca. Termin awaryjny stosuje się tylko wtedy, gdy nie wykonano zabiegu od 20 maja i jest to sposób na wyeliminowanie początkowego inokulum choroby. Po pierwszym oprysku, pomidory te są następnie poddawane zabiegom w momencie przekroczenia wybranego interwału opryskiwania (zakres 15-20 DSV).
Pomidory posadzone po 20 maja są poddawane zabiegom, gdy przekroczą wybrany okres opryskiwania (zakres 15-20 DSV) lub gdy nie zostały poddane zabiegom do dnia 15 czerwca, który jest terminem bezpiecznym. W związku z tym, kluczowe jest porównanie daty sadzenia pomidorów z datą rozpoczęcia raportowania DSV na tym obszarze, aby ukierunkować proces podejmowania decyzji o opryskiwaniu.
Choroba czarnej nogi
Cykl chorobowy
Choroba ma cztery główne etapy na rzepaku ozimym:
Najważniejszym źródłem infekcji dla nowo wschodzących roślin są zarodniki powietrzne wytwarzane na ściernisku po zbiorze rzepaku. Owocniki wytwarzające zarodniki powietrzne potrzebują około 20 dni z deszczem, aby dojrzeć, np. zarodniki były uwalniane wcześnie po mokrym sierpniu w 2005 i 2006 roku, ale późno w 2003 roku, gdy miesiąc ten był suchy.
Zarodniki przenoszone drogą powietrzną, uwalniane głównie w deszczowe dni, infekują liście, tworząc plamistość liści. Symptomy pojawiają się po 5-7 dniach w temperaturze 15-20°C, ale w temperaturze 3°C potrzebują ponad 30 dni.
Nie widać żadnych objawów, a grzyb rozrasta się od plamy na liściu, poprzez ogonek liściowy, aż do łodygi. Tempo wzrostu w dół ogonka liściowego może wynosić do 5 mm/dzień w temperaturze 15-20°C, ale spada do 1 mm/dzień w temperaturze 3-5°C. Fungicydy nie zapewniają kontroli po zainfekowaniu łodygi.
Grzyb rozprzestrzenia się w obrębie łodygi, prowadząc do widocznych objawów raka łodygi po około sześciu miesiącach od zakażenia liści. Wczesna plamistość liści prowadzi do wczesnych raków łodygi, które w największym stopniu ograniczają potencjał plonowania.
Zrozumienie zróżnicowania
Pogoda: Opady deszczu w sierpniu i wrześniu są kluczowym czynnikiem decydującym o wystąpieniu plamistości liści. Ponadprzeciętne opady, szczególnie w sierpniu, wskazują na wczesne zagrożenie.
Biologia
Leptosphaeria maculans lub Phoma lingam przeżywa okres międzyplonów w postaci grzybni i pseudotecjów w resztkach pożniwnych. W Kanadzie tkanka liściowa nie utrzymuje się wystarczająco długo, aby umożliwić rozwój pseudotecjów, ale pseudotecje tworzą się na podstawowej tkance łodygi. Po osiągnięciu dojrzałości pseudociała wytwarzają askospory.
Uwalniane są askospory grzyba po opadach deszczu, gdy temperatura wynosi 8-12ºC/46-54ºF. Zarodniki te mogą być roznoszone przez wiatr na odległość setek metrów. Piknidia mogą i łatwo zimują na ściernisku, ale ponieważ piknidiozy nie są w znacznym stopniu przenoszone drogą powietrzną, mają niewielkie znaczenie w inicjowaniu pierwszego cyklu choroby.
Ascospory kiełkują w obecności wolnej wody od 4-28ºC (40-82ºF). Penetracja odbywa się przez aparaty szparkowe. Patogen może być również przenoszony przez nasiona. Nasiona mogą być zakażone i/lub porażone przez patogen. Zainfekowane nasiona mogą dać początek zainfekowanym siewkom, ale poziom skażenia nasion jest zawsze bardzo niski. Infekcje pierwotne występują zazwyczaj na liścieniach lub podstawowych liściach rozetowych rośliny. Mokra pogoda sprzyja tym pierwotnym infekcjom.
Grzyb wdziera się do przestrzeni międzykomórkowych pomiędzy warstwą palisadową i epidermalną liścia. Po tej bezobjawowej fazie biotroficznej następuje inwazja na mezofil, w wyniku której komórki obumierają i pojawiają się szarozielone zmiany. Hyfusy kontynuują rozgałęzianie się w tkance liścia, aż do momentu dotarcia do żyłki liścia. Następnie grzyb kolonizuje korę i/lub parenchymę ksylemu ogonka liściowego. W miejscu połączenia ogonka liściowego z łodygą, grzyb wnika w korę łodygi, gdzie powoduje rak. To właśnie w tym momencie pojawia się odporność łodygi, która decyduje o możliwości przejścia choroby do szkodliwej fazy raka łodygi. Kłykciny kończące się na łodydze powstają w momencie, gdy roślina się rozkrzewia (wytwarza pionową łodygę z rozety, na której powstają kwiaty). Kłykciny kończyste rozwijają się najszybciej w temperaturze 20-24ºC/68-75ºF i są najgroźniejsze w warunkach stresowych, takich jak uszkodzenia mechaniczne, spowodowane przez owady lub herbicydy.
Uwalniane są piknidiozy (konidia) z pycnidiów w wilgotnych warunkach w śluzie, czyli wodnistym, lepkim roztworze. Zarodniki te są odpowiedzialne za wtórne cykle choroby, ale ważniejszym źródłem inokulum są askospory, ponieważ są bardziej zakaźne i przenoszą się drogą powietrzną.
Pinidiospoory są rozpraszane do nowych miejsc infekcji przez rozbryzg deszczu. Piknidiospoory kiełkują wolniej niż askospory i wymagają ponad 16 godzin ciągłej wilgotności w optymalnym zakresie temperatur 20-25ºC/68-77ºF. Minimalny okres utajenia (czas od zakażenia do wytworzenia nowego inokulum) po zakażeniu przez piknidiozy wynosi 13 dni. Mimo że zdarzają się infekcje wtórne przez piknidiozy, większość strat jest spowodowana pierwotnymi infekcjami liści przez askospory, które prowadzą do powstania korzeni podstawowych łodyg i ostatecznego wylegania roślin.
Model dla pierwszego możliwego zakażenia jesienią
Rozwój epidemii raka łodyg phoma dzieli się na trzy etapy.
1) W. pierwszy etapNa podstawie letnich danych pogodowych przewidziano datę rozpoczęcia epidemii raka liści jesienią. Ponieważ rak łodygi phoma jest chorobą monocykliczną (jeden cykl na sezon wegetacyjny), data jesienna, kiedy zaczyna się rozwijać plamistość liści, jest kluczowym czynnikiem wpływającym na nasilenie epidemii raka łodygi phoma na łodygach następnego lata (West et al. 2001). Datę rozpoczęcia jesiennej fomowej plamistości liści szacuje się na podstawie temperatury i opadów deszczu w okresie międzyplonowym pomiędzy zbiorem poprzedniej uprawy a założeniem nowej uprawy. W przypadku, gdy około 4 mm deszczu spowoduje wystąpienie choroby czarnych nóg o jeden dzień wcześniej, a wpływ temperatury jest większy na początku okresu w połowie lata niż jesienią.
Jeśli zakażenie askosporami jest możliwe dzięki jesiennemu klimatowi, musimy poszukać potrzeb klimatycznych zakażenia askosporami.
2) W tym. drugi etap możemy szukać dojrzałych askospor. Do dojrzewania askospor potrzeba w zależności od temperatury więcej niż 288 godzin powietrza o temperaturze pomiędzy 5 a 25°C i wilgotności względnej wyższej niż 85%. Do rozprowadzenia askospor potrzeba 4 mm lub więcej deszczu. Okres zwilżenia liścia musi zapoczątkować infekcję askoporową, która w optymalnej temperaturze może być zakończona w ciągu 8 godzin.
Późną jesienią i wiosną na dojrzałych zmianach chorobowych choroby czarnych nóg mogą powstawać konidia.
3) W. trzeci etap musimy spodziewać się infekcji konidialnych, które są zapoczątkowane przez okres zwilżenia liści i które są komletowane przez okresy wilgotności względnej wyższej niż 85% przez dłużej niż 8 godzin w temperaturze optymalnej.
Praktyczne wykorzystanie modeli czarnych nóg
Model Czarnej Nogi rozpoczyna się od oceny, czy możliwe jest zakażenie Czarną Nogą w okresie późnego lata i wczesnej jesieni. Ta część modelu może być wykorzystana jako prognoza negatywna. Został on przetestowany dla klimatu Wielkiej Brytanii w celu oszacowania pierwszego wystąpienia P. lingam zakażenia. Model ten jest ważny dla chłodnego i wilgotnego klimatu. Powinien być stosowany z pewną ostrożnością w klimacie kontynentalnym, takim jak Węgry czy Austria. Modele dla dojrzewania askospor, realizacji askospor i infekcji askosporami pokazują możliwe infekcje askosporami w okresie jesiennym. Modele te opierają się na biologii patogenu i najprawdopodobniej pokażą więcej zakażeń askosporami niż można znaleźć w terenie. Dzieje się tak dlatego, że na podstawie danych klimatycznych nie wiemy nic o gęstości inokulum i przedplonach na polach rzepaku. W każdym razie, jeśli jeden lub kilka askospor pasuje do podatnych na infekcje stadiów roślin po pojawieniu się P. lingam, należy spodziewać się infekcji wtórnych z konidiów w ciepłych i wilgotnych okresach jesieni lub wiosny.
Infekcje konidiami są wskazane ze względu na okresy zwilżenia liści potrzebne do zakażenia konidiami.
Choroba Septoria
W pszenicy występują dwie główne choroby Septoria. Są to: plamistość Septoria tritici, wywoływana przez grzyba Septoria tritici (teleomorf: Mycophaerella graminicola), oraz Septoria nodorum plamistość, powodowana przez grzyb Septoria nodorum (teleomorf: Leptosphaeria nodorum). Obie choroby powodują poważne straty w plonie, które według doniesień wynoszą od 31 do 53 procent (Eyal, 1981; Babadoost i Herbert, 1984; Polley i Thomas, 1991). Na całym świecie choroby te dotykają ponad 50 milionów ha pszenicy, rosnącej głównie w rejonach o dużych opadach deszczu. W ciągu ostatnich 25 lat choroby te nasilały się i w niektórych rejonach stały się głównym czynnikiem ograniczającym produkcję pszenicy. W czasie silnych epidemii ziarna podatnych odmian pszenicy są uschnięte i nie nadają się do mielenia. Epidemie Septoria tritici blotch i Septoria nodorum blotch pszenicy są związane z korzystnymi warunkami pogodowymi (częste deszcze i umiarkowane temperatury), specyficznymi praktykami kulturowymi, dostępnością inokulum i obecnością podatnych odmian pszenicy (Eyal et al., 1987).
Septoria spp. Biologia
Po Erick De Wolf, Septoria Tritici Blotch, Kansas State University, kwiecień 2008 r. Septoria tritici plamka znana jako plamistość liści, jest powodowana przez grzyb Septoria tritici. Występuje we wszystkich rejonach uprawy pszenicy na świecie i stanowi poważny problem w wielu regionach. Plamistość Septoria tritici jest najbardziej szkodliwa, gdy choroba atakuje górne liście i główki podatnych odmian późno w sezonie.
Symptomy
Septoria tritici Objawy plamistości pojawiają się po raz pierwszy jesienią. Początkowymi objawami są małe żółte plamki na liściach. Z wiekiem zmiany te stają się często jasnobrązowe, a owocniki grzyba można zobaczyć osadzone w zmianach na pędach. Zmiany mają nieregularny kształt, od eliptycznych do długich i wąskich (rysunek 1). Zmiany zawierają małe, okrągłe, czarne plamki, które są owocnikami grzyba. Czarne owocniki wyglądają jak ziarna czarnego pieprzu i zazwyczaj można je dostrzec bez użycia lupy. Choroba zaczyna się na dolnych liściach i stopniowo postępuje do liścia flagowego. Podatne na atak są także pochewki liściowe. W latach wilgotnych grzyb plamistości liści może przenieść się na główki i spowodować brązowe zmiany na kłosach i szypułkach, znane jako plamistość kłosów. Zmiany te często stają się z wiekiem jasnobrązowe, a owocniki grzyba są często widoczne osadzone w zmianach na pędach.
Faza plamistości liści może powodować znaczne straty w plonie, ale zależność między nasileniem choroby a stratami w plonie nie jest dobrze poznana. Septoria tritici plamistość może być mylona z innymi chorobami liści, które mają bardzo podobne objawy: plamistością żółtą i Stagonspora nodorum na przykład plamistość. Często zdarza się, że rośliny są zakażone przez więcej niż jedną z tych chorób liściowych i dokładne zdiagnozowanie, które choroby są najbardziej rozpowszechnione, może wymagać przeprowadzenia badań laboratoryjnych. Badania laboratoryjne są prawie zawsze wymagane w celu określenia przyczyny plamistości liści. Znajomość gatunku nie jest istotna przy podejmowaniu decyzji o opryskiwaniu, ponieważ wszystkie trzy choroby reagują podobnie na fungicydy. Jednakże wiedza o tym, które choroby są najbardziej rozpowszechnione jest ważnym elementem wyboru odmian, ponieważ różne geny kontrolują odporność na te choroby.
Najbardziej niezawodnym sposobem odróżnienia plamistości Septoria tritici od pozostałych chorób jest obecność czarnych owocników grzyba. Grzyb, który powoduje plamistość opalenizny, nie wytwarza tego typu struktur reprodukcyjnych. Natomiast w wilgotnych warunkach grzyb powodujący plamistość Stagonospora nodorum wytwarza jasnobrązowe owocniki. Oprócz różnicy w kolorze, struktury te są również mniejsze niż te produkowane przez Septoria tritici.
Cykl życia
Septoria tritici przeżywa przez lato na resztkach poprzedniej uprawy pszenicy i rozpoczyna infekcje jesienią. Istnieją pewne dowody, że grzyb jest w stanie przetrwać w połączeniu z innymi żywicielami traw i nasionami pszenicy. Te źródła grzyba są prawdopodobnie najważniejsze, gdy nie ma pozostałości pszenicy. Niezależnie od rotacji lub praktyk zarządzania pozostałościami, zazwyczaj istnieje wystarczająca ilość inokulum, aby zainicjować infekcje jesienne. Septoria tritici plamistości sprzyja chłodna, wilgotna pogoda. Optymalny zakres temperatur to 16-21°C, jednak w miesiącach zimowych infekcje mogą wystąpić w temperaturze nawet 5°C. Infekcja wymaga co najmniej 6 godzin wilgotności liści, a do maksymalnej infekcji potrzeba nawet 48 godzin. Po zakażeniu grzyb potrzebuje od 21 do 28 dni, aby rozwinąć charakterystyczne czarne owocniki i wytworzyć nowe pokolenie zarodników. Wytworzone w tych owocnikach zarodniki są wydalane w lepkich masach i wymagają deszczu, aby rozpryskać je na górne liście i główki.
Zakażenie przez Septoria tritici
Piknidiospores of S. tritici kiełkują w wolnej wodzie z obu końców zarodnika lub z komórek interkalarnych (Weber, 1922). Kiełkowanie zarodników rozpoczyna się dopiero po około 12 godzinach od kontaktu z liściem. Rurki zarodnikowe wyrastają losowo na powierzchni liścia. Weber (1922) zaobserwował jedynie bezpośrednie przenikanie pomiędzy komórkami epidermy, ale inni stwierdzili, że penetracja zarówno przez otwarte, jak i zamknięte aparaty szparkowe jest podstawowym sposobem penetracji gospodarza (Benedict, 1971; Cohen i Eyal, 1993; Hilu i Bever, 1957). Kema i wsp. (1996) obserwowali tylko penetrację przez szparę. Hyfy wyrastające przez szparę ulegają zwężeniu do średnicy ok. 1 μm, a po dotarciu do jamy podstomatalnej stają się szersze.
Hyfusy rosną równolegle do powierzchni liścia pod komórkami epidermy, następnie przez mezofil do komórek niższej epidermy, ale nie w głąb epidermy. Nie powstają haustoria, a wzrost hyfusów jest ograniczony przez komórki sklerenchymy wokół wiązek naczyniowych, z wyjątkiem sytuacji, gdy hyfusy są bardzo gęste. Wiązki naczyniowe nie ulegają inwazji. Hiefy rosną międzykomórkowo wzdłuż ścian komórkowych przez mezofil, rozgałęziając się w przegrodzie lub środku komórki. Przez około 9 dni nie pojawiają się żadne makroskopowe objawy, poza sporadycznymi martwymi komórkami, ale po 11 dniach komórki mezofilu szybko obumierają. Piknidia rozwijają się w komorach substomatalnych. Hyphae rzadko wrastają w komórki gospodarza (Hilu i Bever, 1957; Kema i in., 1996; Weber, 1922).
Do skutecznej infekcji dochodzi dopiero po co najmniej 20 godzinach wysokiej wilgotności. Jeśli liście pozostawały wilgotne przez 5-10 godzin po osadzeniu zarodników (Holmes i Colhoun, 1974) lub do 24 godzin (Kema i in., 1996), powstawały tylko nieliczne brązowe plamki. Relacje gospodarz-pasożyt są takie same na pszenicach odpornych i podatnych. Kiełkowanie zarodników na powierzchni liści jest takie samo niezależnie od podatności. Liczba udanych penetracji jest mniej więcej taka sama, ale wzrost hyfusów jest szybszy u odmian podatnych, co skutkuje większą liczbą zmian chorobowych. Hyfy rozciągają się 44 Sesja 2 - B.M. Cunfer poza obszar nekrotyczny u wszystkich odmian. Toksyna może odgrywać rolę w patogenezie (Cohen i Eyal, 1993; Hilu i Bever, 1957). Natomiast kolonizacja była znacznie ograniczona na linii odpornej (Kema i in., 1996).
Stagonospora (Septoria) i Septoria patogeny zbóż: Proces infekcji
B.M. Cunfer, Department of Plant Pathology, University of Georgia, Griffin, GA
Proces zakażenia najintensywniej badano Stagonospora (Septoria) nodorum i Septoria tritici. Jedno pogłębione badanie dot. Septoria passerinii jest dostępna. Prawie wszystkie podane informacje dotyczą infekcji przez piknidiozy. Jednak proces infekcji dla innych form zarodników jest dość podobny. Przedstawione informacje dotyczą głównie infekcji liści w optymalnych warunkach. Niektóre badania przeprowadzono na nienaruszonych siewkach, inne na oderwanych liściach. Infekcja koleoptyli i siewek pszenicy przez S. nodorum został szczegółowo opisany przez Bakera (1971) i zrecenzowany przez Cunfera (1983). Chociaż nie dokonano dokładnych porównań, wydaje się, że proces infekcji wykazuje wiele podobieństw w każdym układzie gospodarz-pasożyt i jest typowy dla wielu patogenów nekrotroficznych. Informacje na temat czynników wpływających na rozwój symptomów i ekspresję choroby są wykluczone, ale zostały przejrzane przez innych autorów (Eyal i in., 1987; King i in., 1983; Shipton i in., 1971). Zamieszczono zestawienie czynników wpływających na długowieczność zarodników na powierzchni liścia.
Rola Cirrus i przetrwanie zarodników na powierzchni liścia Najbardziej szczegółowe informacje na temat funkcji cirrusu otaczającego wydzielające się z piknidiozy spory są dla S. nodorum. Cyrus jest żelem złożonym ze związków białkowych i sacharydowych. Jego skład i funkcja są podobne jak u innych grzybów z grupy Sphaeropsidales (Fournet, 1969; Fournet i in., 1970; Griffiths i Peverett, 1980). Podstawowe role składników cirrusu to ochrona piknidiospores przed desykacją i zapobieganie przedwczesnemu kiełkowaniu.
Cirrus chroni piknidiospoory tak, że niektóre z nich pozostają żywotne przez co najmniej 28 dni (Fournet, 1969). Po rozcieńczeniu cirrusu wodą, jeśli stężenie roztworu cirrusu wynosiło >20%, kiełkowało mniej niż 10% pycnidiospores. W niższym stężeniu składniki dostarczają substancji odżywczych, które stymulują kiełkowanie zarodników i wydłużanie rurek zarodkowych. Długość rurki zarodnikowej wzrastała do stężenia 15% cirrus, a następnie umiarkowanie spadała przy wyższych stężeniach (Harrower, 1976). Brennan et al. (1986) odnotowali większe kiełkowanie w rozcieńczonym płynie cirrusowym. Składniki cirrusów zmniejszały kiełkowanie przy wilgotności względnej 10-60%. Po rozproszeniu zarodników, stymulujące efekty płynu cirrus są prawdopodobnie pomijalne (Griffiths i Peverett, 1980).
Przy wilgotności względnej 35-45%, zarodniki S. tritici w cirri pozostawały żywotne przez co najmniej 60 dni (Gough i Lee, 1985). Składniki cirri mogą działać jako inhibitor kiełkowania zarodników lub wysoki potencjał osmotyczny cirri może uniemożliwiać kiełkowanie. Piknidiospoory z S. nodorum nie przeżyły przez 24 godziny przy wilgotności względnej powyżej 80% w 20 C. Zarodniki przetrwały dwa tygodnie lub więcej przy wilgotności względnej <10% (Griffiths i Peverett, 1980). Gdy płyn cirrusowy z S. nodorum rozcieńczono wodą, około dwie trzecie piknidiospores straciło żywotność w ciągu 8 godzin, a po 30 godzinach w świetle dziennym kiełkowało tylko 5%. Gdy zarodniki były przechowywane w ciemności, 40% pozostawało żywotne po 30 godzinach (Brennan i in., 1986).
Wysuszone konidia S. nodorum, zacienione i w bezpośrednim świetle słonecznym, przetrwały na zewnątrz co najmniej 56 godzin (Fernandes i Hendrix, 1986a). Kiełkowanie piknidiów S. nodorum było hamowane przez ciągłe promieniowanie UV-B (280-320 nm), natomiast kiełkowanie S. tritici nie było. Wydłużanie rurki zarodkowej w warunkach ciągłego działania UV-B było zahamowane dla obu grzybów, w porównaniu z ciemnością (Rasanayagam i in., 1995).
Zakażenie przez Septoria nodorum
Proces penetracji gospodarza i rozwój S. nodorum Wewnątrz liścia było szczegółowo badane przez kilku badaczy (Baker i Smith, 1978, Bird i Ride 1981, Karjalainen i Lounatmaa, 1986; Keon i Hargreaves, 1984; Straley, 1979; Weber, 1922). Piknidiospoory mają tendencję do osadzania się w zagłębieniach między dwiema komórkami epidermy i wiele prób penetracji liści zaczyna się właśnie tam. Zarodniki kiełkują na powierzchni liści w odpowiedzi na wolną wilgoć (Fernandes i Hendrix, 1986b). Zaczynają one kiełkować 2-3 godziny po osadzeniu, a po 8 godzinach kiełkowanie może osiągnąć 90%. Penetracja liści rozpoczyna się około 10 godzin po osadzeniu zarodników (Bird i Ride, 1981; Brönnimann i in., 1972; Holmes i Colhoun, 1974).
Na początku kiełkowania zarodnik jest otoczony amorficznym materiałem, który przyczepia się do liścia. Rurki zarodnikowe wyrastające z obu końców zarodnika i z komórek międzykomórkowych mają tendencję do wzrostu wzdłuż zagłębień między komórkami i często są zorientowane wzdłuż długiej osi liścia (O'Reilly i Downes, 1986). Hyphae pochodzące z zarodników, które nie znajdują się w zagłębieniach, rosną losowo, sporadycznie się rozgałęziając (Straley, 1979). Tworzy się appressorium z kołkiem infekcyjnym, który penetruje kutykulę i perycykliczne ściany komórek epidermy bezpośrednio do światła komórki, co powoduje szybką śmierć komórki.
Wiele penetracji ma najpierw charakter podskórny lub boczny wzrost hiefy następuje w obrębie ściany komórkowej przed wzrostem do cytoplazmy (Bird i Ride, 1981; O'Reilly i Downes, 1986). Penetracja zarówno przez otwarte, jak i zamknięte aparaty szparkowe również występuje i może być szybsza niż penetracja bezpośrednia (Harrower, 1976; Jenkins, 1978; O'Reilly i Downes, 1986; Straley, 1979). Rurki zarodkowe rozgałęziają się na szparkach i połączeniach komórek epidermy. Penetracja rurki zarodkowej do wnętrza słupka może nastąpić bez tworzenia się appressorium. Penetracja zachodzi czasem przez trichomy (Straley, 1979). Najwyraźniej większość prób penetracji kończy się niepowodzeniem, a w komórkach w miejscu próby penetracji tworzą się gęste brodawki (Karjalainen i Lounatmaa, 1986; Bird i Ride, 1981).
Po wniknięciu do mezofilu komórki epidermy szybko obumierają i stają się zdrewniałe, a hieny wrastają do mezofilu. Komórki mezofilu stają się zniekształcone, a zdrewniały materiał odkłada się na zewnątrz niektórych komórek, które następnie zapadają się. Zdrewnienie następuje przed dotarciem strzępków do komórki. Proces ten jest taki sam u wszystkich odmian, ale u odmian odpornych rozwija się wolniej. Hieny rosną międzykomórkowo wśród komórek epidermy, a następnie w mezofilu. Po wniknięciu do mezofilu w ciągu 6-9 dni rozpoczyna się degradacja chloroplastów (Karjalainen i Lounatmaa, 1986).
Jednakże tempo fotosyntezy zaczyna spadać w ciągu jednego dnia po infekcji, a przed wystąpieniem objawów (Krupinsky i in., 1973). Tkanka sklerenchyma wokół wiązek naczyniowych zapobiega infekcji tkanki naczyniowej. Wiązki naczyniowe blokują rozprzestrzenianie się strzępek przez mezofil, z wyjątkiem sytuacji, gdy tkanka sklerenchymy jest młoda i nie w pełni ukształtowana (Baker i Smith, 1978).
Stagonospora nodorum uwalnia szeroki zakres enzymów degradujących ściany komórkowe, w tym amylazę, metyloesterazę pektynową, poligalakturonazy, ksylanazy i celulazę in vitro oraz podczas infekcji liści pszenicy (Baker, 1969; Lehtinen, 1993; Magro, 1984). Informacje związane z degradacją ściany komórkowej przez enzymy zgadzają się z obserwacjami histologicznymi.enzymy te mogą działać w połączeniu z toksynami. Wrażliwość na enzymy może być związana z odpornością i tempem kolonizacji grzybów (Magro, 1984). Jak wiele nekrotrofów, patogeny Septoria i Stagonospora wytwarzają związki fitotoksyczne in vitro. Degradacja i śmierć komórek, poprzedzająca wzrost hifali do tkanki mezofilu (Bird i Ride, 1981) jest zgodna z produkcją toksyn. Jednakże nie ustalono ostatecznej roli toksyn w procesie infekcji i ich związku z odpornością gospodarza (Bethenod i inni, 1982; Bousquet i inni, 1980; Essad i Bousquet, 1981; King i inni, 1983). Różnice w zasięgu żywiciela pomiędzy przystosowanymi do pszenicy i jęczmienia szczepami S. nodorum może być związana z produkcją toksyny (Bousquet i Kollmann, 1998). Na inicjację kiełkowania zarodników i procent kiełkujących zarodników nie ma wpływu podatność gospodarza (Bird i Ride, 1981; Morgan 1974; Straley, 1979; Straley i Scharen, 1979; Baker i Smith, 1978).
Bird i Ride (1981) podali, że wydłużanie się rurek zarodnikowych na powierzchni liści było wolniejsze na odmianach odpornych niż podatnych. Mechanizm ten, wyrażony co najmniej 48 godzin po osadzeniu zarodników, wskazuje na odporność przed penetracją na wydłużanie rurek zarodnikowych. U odmian odpornych było mniej udanych penetracji, a penetracja przebiegała wolniej na odmianach odpornych (Baker i Smith, 1978; Bird i Ride, 1981). Zaproponowano, że lignifikacja ogranicza infekcję zarówno u odmian odpornych, jak i podatnych, ale inne czynniki spowalniają rozwój grzyba w liniach odpornych. W liniach podatnych szybciej rosnące Hyphae mogą uniknąć lignifikacji komórek gospodarza.Cztery dni po inokulacji jęczmienia biotypem pszenicy izolatem S. nodorum, hyphae wrastały przez kutikulę, a czasem w zewnętrzne warstwy celulozy ścian komórkowych epidermy. Pod penetrującymi hyphae odkładały się grube brodawki, a komórki nie były penetrowane (Keon i Hargreaves, 1984).
Zakażenie przez Septoria passerinii: Green i Dickson (1957) przedstawiają szczegółowy opis procesu infekcji S. passerinii na jęczmieniu. Proces infekcji jest podobny do S. tritici. Podobnie jak w przypadku S. tritici, czas potrzebny do penetracji liści jest znacznie dłuższy niż w przypadku S. nodorum. Rurki zarodkowe rozgałęziają się i wyrastają nad powierzchnią liścia w sposób przypadkowy, ale czasami wzdłuż zagłębień między komórkami epidermy. Penetracja liści odbywa się prawie wyłącznie przez aparaty szparkowe. Hyfusy kiełkujące stają się nabrzmiałe, a jeśli penetracja jest nieudana, hyfusy nadal się wydłużają. Po 48 godzinach od osadzenia zarodników nie dochodzi do penetracji. Po 72 godzinach rurki zarodnikowe zagęszczają się nad aparatem szparkowym, wrastają między komórki wartownicze i na powierzchnie komórek dostępowych oraz do zagłębień podkomorowych. Bezpośrednie wnikanie między komórki epidermy obserwuje się rzadko.
Kiełkowanie zarodników i penetracja żywiciela są takie same na odmianach odpornych i podatnych. Na odmianach odpornych znacznie mniejsza jest rozciągłość strzępek wewnątrz liści, a brodawki obserwowane są na wielu, ale nie wszystkich ścianach komórkowych. Hyphae rosną pod epidermą od jednej stomii do drugiej, ale nie wnikają pomiędzy komórki epidermy. Mezofil jest skolonizowany, ale nie tworzą się haustoria. Po tym jak komórki mezofilu stają się nekrotyczne, komórki epidermy zapadają się. Rozwój grzybni w liściu jest nieliczny i zwykle zablokowany przez wiązki naczyniowe. W młodszych liściach, gdy osłonka naczyniowa jest mniej rozwinięta, strzępki przechodzą pomiędzy wiązkami a epidermą. Piknidia tworzą się w zagłębieniach podkomorowych, najczęściej na górnej powierzchni liścia (Green i Dickson, 1957).
Czynniki wpływające na długość życia zarodników na powierzchni liści Wśród patogenów Stagonospora i Septoria zbóż, ostateczne informacje na temat procesu infekcji odnotowano jedynie dla S. nodorum, S. triticioraz S. passerinii. Podobnie jak wiele innych patogenów nekrotroficznych, żadna z grup patogenów nie wywołuje reakcji nadwrażliwości. Istotną różnicą w procesie infekcji pomiędzy patogenami Septoria i Stagonospora jest to, że kiełkowanie zarodników i penetracja przebiega znacznie szybciej w przypadku S. nodorum niż za S. tritici oraz S. passerinii. Ma to istotny wpływ na epidemiologię chorób.
Patogeny z rodzaju Septoria wnikają do rośliny przede wszystkim przez aparaty szparkowe, natomiast S. nodorum przenika zarówno bezpośrednio, jak i przez stomaty. S. nodorum szybko przenika i zabija komórki naskórka, ale S. tritici i S. passerinii nie zabijają komórek epidermy, dopóki strzępki nie rozgałęzią się w mezofilu liścia i nie rozpocznie się szybka nekroza. Badania histologiczne wzrostu grzyba po wniknięciu do żywiciela odpowiadają danym uzyskanym z badań epidemiologicznych nad odpornością żywiciela. Odporność spowalnia tempo kolonizacji gospodarza, ale nie ma znaczącego wpływu na proces rozwoju zmian chorobowych.
Mechanizmy kontrolujące odpowiedź gospodarza, związane z enzymami i toksynami lub innymi metabolitami uwalnianymi przez patogeny podczas infekcji, są nadal niejasne. Niewiele jest informacji na temat infekcji przez askospory. Proces infekcji jest prawdopodobnie bardzo podobny jak w przypadku piknidiospores. Askospory Phaeosphaeria nodorum kiełkują w szerokim zakresie temperatur, a ich rurki zarodkowe wnikają bezpośrednio do liścia. Jednakże, według Rapilly et al. (1973), askospory, w przeciwieństwie do pycnidiospores, nie kiełkują w wolnej wodzie.
Model zakażenia Septoria spp.
Zakażenia Septorią są możliwe w niskich temperaturach, natomiast temperatura poniżej 7°C może nie doprowadzić do zakażenia w ciągu 2 dni. Optymalna temperatura dla choroby jest osiągana w obszarze od 16 do 21°C. Infekcje są możliwe w okresie wysokiej wilgotności względnej lub wilgotności liści przez 14 lub więcej godzin. Aby sprostać tym warunkom zdecydowaliśmy się na podział na modele dla infekcji słabych, umiarkowanych i ciężkich. Słabe infekcje mogą mieć miejsce, jeśli możliwe jest zainfekowanie przez patogen tkanki gospodarza. Oznacza to, że słabe infekcje mogą mieć miejsce, jeśli temperatury są minimalne, a okresy wilgotności liści mają krytyczny czas trwania. Infekcja umiarkowana będzie miała miejsce w warunkach, w których większość prób infekcyjnych prowadzi do rozsądnych wyników, a infekcje silne mają miejsce w warunkach, w których patogen ma optymalne warunki do infekcji.

Rozpoczyna się zakażenie po deszczu 0,5 mm. Postanowiliśmy nie stosować modelu tworzenia się piknidiów. Jako warunek konieczny do powstania piknidiów przyjęto okres o wilgotności względnej wyższej niż 85%. Przewiduje się, że czas życia pycnidiów wynosi 24 godziny. We wszystkich klimatach, w których Septoria tritici ma szansę na infekcję, znajdziemy 2 godziny spełniające te warunki prawie każdego dnia w okolicach wschodu słońca.
Ocena ciężkości zakażenia: Aby móc ocenić presję infekcyjną Septoria tritici w okresie od fazy 10 (pierwszy liść w koleoptylu) do fazy 32 (węzeł drugi co najmniej 2 cm powyżej węzła pierwszego) oraz w okresie od 32 do 51 (początek kłoszenia) musimy ocenić nasilenie infekcji w oparciu o warunki klimatyczne. Oceny tej dokonuje się w skali od 1 do 5. Ostrość 1 jest przyznawana, jeśli spełnione są warunki dla słabej infekcji i spadło mniej niż 5 mm deszczu. Ostrość 3 jest przyznawana, jeśli spełniony jest warunek umiarkowanej infekcji i spadło mniej niż 5 mm deszczu. Jeżeli podczas umiarkowanej infekcji spadło więcej niż 5 mm deszczu, a podczas ciężkiej infekcji mniej niż 5 mm, przyznaje się ocenę 4.
Silna infekcja z ponad 5 mm deszczu odpowiada wartości ostrości 5.
Septoria tritici ocena nacisku na chorobę: Klimat jest tylko jednym z czynników decydujących o presji chorobowej na polu. Pozostałe dwa czynniki to historia pola i podatność uprawianej odmiany. Jeśli wartości nasilenia choroby od stadium 10 do stadium 32 osiągną wartość 4, możemy spodziewać się słabej presji chorobowej ze strony klimatu. Jeśli wartość ta osiągnie 6 możemy spodziewać się umiarkowanej presji chorobowej, a jeśli osiągnie 10 możemy spodziewać się wysokiej presji chorobowej ze strony klimatu. Znajomość podatności odmiany i historii pola skłoni nas do opryskiwania lub nie przy słabej lub umiarkowanej presji chorobowej w tej sytuacji. Posiadanie wartości skumulowanej 10 może doprowadzić do wykonania oprysku w fazie 32. Decyzja o wykonaniu oprysku w późniejszej fazie zależy w większym stopniu od wiosennego klimatu. Jeśli uda nam się skumulować wartości nasilenia od fazy 10 do wartości 6, możemy spodziewać się słabej presji choroby. Jeśli wartość ta osiągnie 10 możemy spodziewać się umiarkowanej presji choroby, a jeśli wartość ta osiągnie 15 możemy spodziewać się wysokiej presji choroby ze względu na sytuację klimatyczną.
W FieldClimate pokazujemy Septoria tritici Severity wraz z trzema różnymi nasileniami infekcji na jednym wykresie (patrz wyżej). Ze względu na opady deszczu i długie okresy zwilżenia liści warunki do silnej infekcji przez S. tritici miały pełne pole w dniach 14 i 16 maja. Poziomy Severity osiągają 14 maja najwyższą wartość 5, co oznacza, że obecnie występuje wysokie ryzyko infekcji.
Biologia infekcji Stagonospora nodorum różni się w pewnym stopniu od biologii S. tritici, ale ta różnica nie jest wystarczająco duża, aby stworzyć osobny model. Dlatego sugerujemy użycie tego modelu dla całego kompleksu chorób Stagnospora i Septoria w zbożach, w tym S. passerinii. S. tritici oraz S. passerinii potrzebują dłuższych okresów zwilżenia liści niż S. nodorum. Na obszarach o wysokim ciśnieniu S. nodorum infekcje zaklasyfikowane do słabych, dające wartość ciężkości 2, powinny być traktowane poważniej niż w innych obszarach.
Dla Septoria nodorum model ryzyka przedstawiono w FieldClimate (patrz wyżej). Wysokie ryzyko zostało określone w dniach 17 czerwca i 7 lipca (100%). W zależności od stopnia podatności roślin na infekcję należy uwzględnić środki ochrony roślin, jeżeli ryzyko osiągnie 80% (patrz również prognoza pogody, ochrona roślin). Jeżeli zagrożenie wynosiło 100% i infekcja została już stwierdzona, to w celu ochrony rośliny należy zastosować systemowe środki ochrony roślin (aplikacja lecznicza).
Antraknoza
Kilka gatunków patogennych dla roślin grzybów z rodzaju Colletotrichum powodują antraknozę w papryce oraz wielu innych warzywach i owocach. Do końca lat 90. ubiegłego wieku antraknoza papryki i pomidorów była kojarzona tylko z dojrzałymi lub dojrzewającymi owocami. Od tego czasu zadomowiła się bardziej agresywna forma tej choroby. Forma ta atakuje paprykę w każdym stadium rozwoju owoców i może zagrozić opłacalności upraw papryki w rejonach, w których się zadomowiła. Choroba ta może również atakować pomidory, truskawki i ewentualnie inne uprawy owocowo-warzywne.
Symptomy
Okrągłe lub kanciaste, zapadnięte zmiany rozwijają się na niedojrzałych owocach dowolnej wielkości. Często na pojedynczych owocach tworzą się liczne zmiany. Gdy choroba jest poważna, zmiany mogą się łączyć. Często różowe do pomarańczowych masy zarodników grzyba tworzą koncentryczne pierścienie na powierzchni zmian. W starszych zmianach można zaobserwować czarne struktury zwane acervuli. W ręcznym obiektywie wyglądają one jak małe czarne kropki; pod mikroskopem wyglądają jak kępki małych czarnych włosków. Patogen szybko i obficie tworzy zarodniki i może szybko rozprzestrzeniać się w całej uprawie papryki, powodując do 100% utraty plonów. Zmiany mogą pojawiać się również na łodygach i liściach w postaci brązowych plam o nieregularnym kształcie i ciemnobrązowych brzegach.
Patogen
Ta forma antraknozy papryki jest powodowana przez grzyb Colletotrichum acutatum. Patogen przeżywa na resztkach roślinnych z porażonych upraw oraz na innych podatnych gatunkach roślin. Przy braku porażonych resztek roślinnych grzyb nie jest przez dłuższy czas przenoszony przez glebę. Grzyb może być również wprowadzony do uprawy na porażonych nasionach. Podczas ciepłe i wilgotne okresy, zarodniki są rozpryskiwane przez deszcz lub wodę do nawadniania z owoców chorych do zdrowych. Chore owoce stanowią źródło inokulum, co umożliwia rozprzestrzenianie się choroby z rośliny na roślinę w obrębie pola. Grzyb przeżywa w nasionach i na nich. Antraknoza jest wprowadzana na pole z zainfekowanych sadzonek lub może przetrwać między sezonami w resztkach roślinnych lub na chwastach. Alternatywnymi żywicielami są chwasty i inne rośliny z rodziny psiankowatych (pomidor, ziemniak, bakłażan), chociaż infekcje tych żywicieli są niezwykle rzadkie na Florydzie. Owoce są infekowane, gdy zarodniki grzyba lub porażone szczątki są rozpryskiwane przez deszcz na rośliny papryki. Nowe zarodniki wytwarzane są w zainfekowanej tkance, a następnie rozprzestrzeniają się na inne owoce. Pracownicy mogą również przenosić zarodniki za pomocą sprzętu lub podczas przenoszenia zakażonych roślin. Do zakażenia dochodzi zazwyczaj podczas ciepłej, wilgotnej pogody. Temperatury około 80° F (27° C) to optymalne temperatury. dla rozwoju choroby, chociaż infekcje występują zarówno w wyższych, jak i niższych temperaturach. Poważne straty występują w czasie deszczowej pogody, ponieważ zarodniki są wymywane lub rozpryskiwane na inne owoce, co prowadzi do większej liczby infekcji. Choroba częściej rozwija się na dojrzałych owocach, które są obecne przez dłuższy czas na roślinie, chociaż może wystąpić zarówno na niedojrzałych, jak i dojrzałych owocach. Antraknoza może infekować w temperaturze od 15°C do 30°C. Ale a mokrość długich liści jest potrzebna do wypełnienia potrzeb związanych z infekcją. W optymalnej temperaturze od 20°C do 25°C jeszcze 12 godzin zwilżenia liści są potrzebne. Wyższe lub chłodniejsze temperatury wymagają jeszcze dłuższych okresów zwilżenia liści (do obliczeń nie jest potrzebna funkcja liniowa/ macierz). FieldClimate oblicza możliwe zdarzenia infekcyjne na podstawie wilgotności liści i temperatur podczas tego zdarzenia.
Mączniak rzekomy
Biologia Plasmopara viticola (Downy Mildew)
P. viticola jest obowiązkowym pasożytem. Co oznacza, że do rozwoju potrzebne są zielone, świeże organy winorośli. W okresie wolnym od wegetacji utrzymuje się tworząc owocniki, tzw. oospory. Oospory oomycetes mogą przetrwać bardzo długi okres w glebie. Dlatego też możemy spotkać mączniaka w miejscach, gdzie infekcje nie są możliwe w każdym roku. Wiosną, gdy wierzchnia warstwa gleby jest wystarczająco wilgotna i ciepła, oospory utworzą tzw. makrosporangia, które mogą uwolnić do wolnej wody do 200 zoospor. Zoospory przenoszą się na liście i skupiska przez wiatr w kropelkach wody. Posiadają one dwie flagi i poruszają się w warstwie wody na spodniej stronie liści lub na klastrach i młodych jagodach, aby znaleźć stomię, przez którą dostaną się do tkanki roślinnej. Wchodzą i kiełkują do stomii, w której przenoszą całą swoją plazmę w ciągu mniej niż jednej godziny. W badaniach mikroskopowych znalezienie stomii, encystacja i kiełkowanie do stomii kończyło się w ciągu 90 minut.
P. viticola rośnie w przestrzeni międzykomórkowej i odżywia się haustoriami wnikającymi w komórki epidermy i miąższu. W zależności od temperatury i wilgotności względnej rozwija się wystarczająco dużo wzrostu międzykomórkowego z wystarczającą ilością haustorii, aby utworzyć ciało podkomórkowe, które wypełnia cały obszar podkomórkowy i które podnosi tkankę naskórkową z tkanki miąższowej. Prowadzi to do widocznego objawu w postaci plamy olejowej.
Oomycetes to. sporulujące przy braku światła, gdy wilgotność względna jest bardzo wysoka. Na stronie P. viticola nie dochodzi do sporulacji, jeśli temperatura jest poniżej 12°C, a wilgotność względna poniżej 95%. Sporangiaphores są tworzone przez pęcherzyki substomatelowe i będą one wychodziły ze stomii. Świeżo uformowane sporangia są lepkie i można je usunąć ze sporangiów tylko za pomocą wody. Podczas spadku wilgotności względnej powietrza sporangia stają się lepkie i mogą być usunięte przez wiatr.
Sporangia uwalniają do 20 zarodników do wolnej wody. Te zarodniki muszą być rozprowadzone przez wiatr w kropelkach wody, aby dotarły do świeżych liści, lub sporangia mogą być rozprowadzone przez deszcz lub sam wiatr. Proces infekcji pierwotnej i wtórnej jest taki sam.
Ze względu na duże znaczenie fazy płciowej dla hibernacji patogenu możemy przyjąć typy kojarzenia pasujące do wszystkich winnic, w których występuje mączniak rzekomy winorośli. Tworzenie zoospor ma miejsce na starszych liściach w okresie letnim i wczesną jesienią.
Zakażenie pierwotne w szczegółach
Infekcje pochodzące z oospor nazywane są infekcjami pierwotnymi. Termin ten jest mylący, ponieważ na początku lata może wystąpić kilka infekcji pierwotnych. W zdarzeniach epidemiologicznych infekcja pierwotna nie odgrywa istotnej roli, jeśli w winnicach jest wystarczająca ilość plam olejowych, a potencjał infekcyjny zarodników letnich (sporangiów) przewyższa oospory.
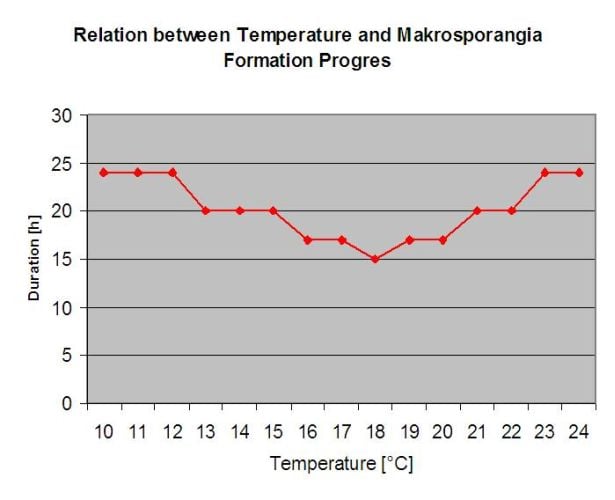
Zimujące oospory rozwijają się do tzw. makrosporangiów, gdy tylko przez około 24 godziny jest wystarczająca wilgotność względna. Makrosporangia uwalniają swoje zarodniki do wolnej wody i silnego deszczu (np. podczas burzy). Zarodniki przenoszone są na liście i/lub zielone pędy winorośli. Infekcje pierwotne, a więc, potrzebują dłuższego deszczu okresy lub kilka następujących po sobie burz. Pierwszy deszcz powoduje nasycenie opadłych liści wodą, a silne opady w kolejnych dniach powodują uwalnianie przez makrosporangia swoich zoospor, które docierają do liści lub pędów winorośli. Do skutecznej infekcji niezbędny jest odpowiednio długi okres zwilżenia liści, aby zoospory mogły dotrzeć do stomii liści lub pędów i je zainfekować (Ilustracja powyżej przedstawia cykl rozwojowy mączniaka rzekomego winorośli (Plasmopara viticola).
Model infekcji pierwotnej mączniaka sprawdza najpierw, czy pogoda jest odpowiednia do rozwoju makrosporangiów. Tak jest, jeśli liście są wilgotne lub wilgotność względna po deszczu nie spada poniżej 70%. W zależności od temperatury, makrosporangia mogą się rozwinąć w ciągu 16-24 godzin. Jeśli dojrzałe makrosporangia są dostępne, zostanie to pokazane graficznie na wyświetlaczu infekcji pierwotnej Downy Mildew. Jeśli makrosporangia są obecne, silny opad deszczu może spowodować rozprzestrzenienie się ich zarodników. Ciągły deszcz o wielkości 5 mm jest interpretowany jako silny deszcz i zarodniki są rozprzestrzeniane, a infekcja pierwotna jest możliwa, jeśli zwilżenie liści trwa wystarczająco długo.
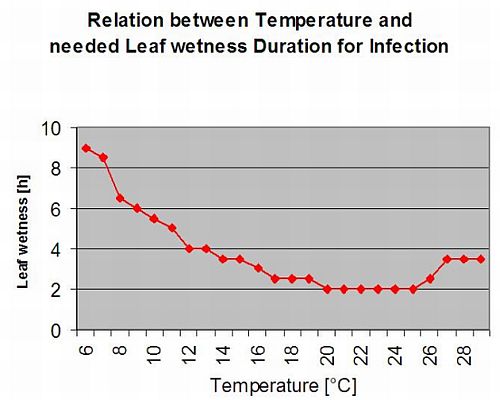
Zakażenia wtórne
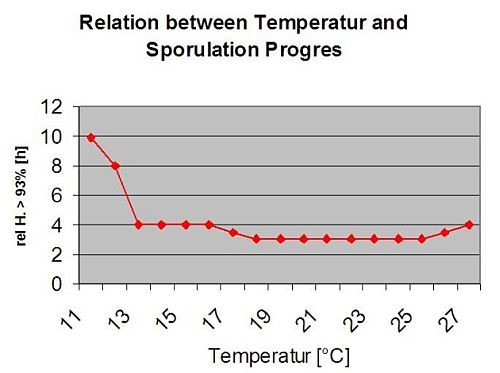
Wtórne zakażenia Plasmopara viticola są możliwe tylko wtedy, gdy w Twojej winnicy lub w jej pobliżu istnieją już dojrzałe plamy olejowe. Plamy olejowe są dojrzałe, gdy są w stanie sporulować (wytwarzać sporangia). Sporangia są wytwarzane tylko przez noc. Światło słoneczne hamuje sporulację. Sporangia powstają, jeśli jest cieplejsze niż 12°C i wilgotność względna jest bardzo wysoka. Tempo wytwarzania sporangiów wzrasta wraz z temperaturą do 24°C. Optymalna temperatura dla sporulacji na europejskich odmianach winogron (Vitis vinifera) wynosi około 24°C. Jeśli temperatura przekracza 29°C, nie może dojść do sporulacji. W naszym modelu sprawdzamy, czy wilgotność powyżej 95% występuje w nocy. Jeśli ten stan utrzymuje się przez skumulowaną temperaturę godzinową powyżej 50°C, sporulacja zostaje zakończona i pojawiają się nowe sporangia Plasmopara istnieją w winnicy. Na przykład godziny z 50°C odpowiadają 4 godzinom z 13°C lub 3 godzinom z 17°C.
Poniższy wykres przedstawia zależność pomiędzy temperaturą a warunkami wilgotnymi (wilgotność względna, wilgotność liści, opady), które są wykorzystywane do modelowania zdarzeń infekcyjnych w fieldclimate.com.
Sporangia z Plasmopara viticola mają ograniczoną żywotność. Im jest cieplej i im bardziej suche powietrze, tym szybciej giną (w fieldclimate.com resetujemy do 0, gdy r.h. jest poniżej 50%). Na pewno giną w następnym okresie rosy lub zwilżenia liści, który jest zbyt krótki dla infekcji. Fitness starszych sporangiów jest więc dość ograniczony. Nasz model zakłada, że czas życia sporangiów jest ograniczony do jednego dnia.
Aby wywołać nowe infekcje, sporangia muszą zostać rozprowadzone. Istnieją dwa sposoby rozprowadzania zarodników: Jeśli bezpośrednio po uformowaniu się sporangiów pada deszcz, rozprzestrzeniają się one wraz z rozpryskami deszczu. Jeśli liście winorośli pozostaną wystarczająco długo mokre, wysoki poziom Plasmopara viticola dochodzi do infekcji. Jeśli kolejny poranek zaczyna się bez deszczu i ze zmniejszającą się wilgotnością, zaschnięte sporangia odrywają się od rozgałęzień. Nawet niewielki ruch powietrza przeniesie je na zdrowe liście. Jeśli wkrótce nie spadnie deszcz, zginą.
Mączniak prawdziwy Infekcja pierwotna
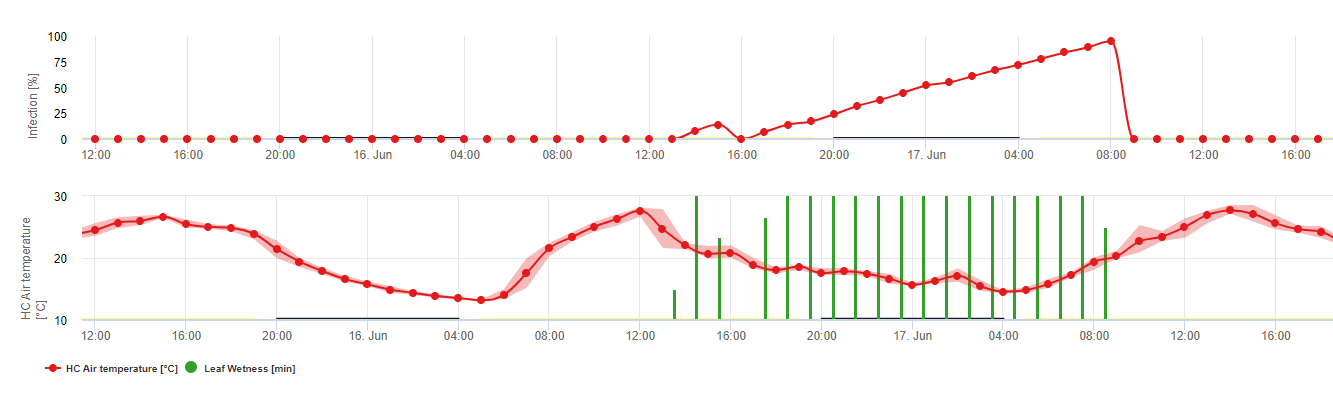
Infekcje są przedstawione po rozwinięciu makrospor (kolor pomarańczowy, piąty wykres) w trzech różnych klasach ciężkości (słaba: pomarańczowa, umiarkowana: zielona, ciężka: czerwona) w zależności od ilości deszczu, a tym samym dystrybucji zarodników w winnicy. W przypadku stwierdzenia infekcji 100% zapewniono optymalne warunki do wniknięcia w tkankę roślinną (środek ochrony roślin) i krzywa inkubacji (pierwszy wykres) zaczyna się zwiększać. W przypadku zakończenia inkubacji (100%) i braku ochrony roślin należało sprawdzić na polu objawy (plamy olejowe).
1. Krzywa postępu infekcji, a po pełnej infekcji wynikający z niej okres inkubacji (czas pomiędzy infekcją a widocznymi objawami w terenie).
2. Krzywa postępu infekcji jest wyznaczana, gdy obecne są makrosporangia lub sporangia i liście są wilgotne. Wzrasta ona wraz z postępującą wilgotnością liści i temperaturą. Jeśli krzywa postępu infekcji osiągnie 100%, można uznać, że infekcja została zakończona. Krzywa postępu inkubacji, która należy do konkretnej infekcji, zaczyna być obliczana wraz z rozpoczęciem infekcji. Jeśli infekcja nie może być zakończona, krzywa postępu inkubacji również zostanie zatrzymana.
3. Warunki pogodowe są wyświetlane na tej samej stronie co wyniki modelu choroby. Dlatego jednym spojrzeniem można sprawdzić temperaturę, wilgotność względną, deszcz i zwilżenie liści podczas infekcji.
4. Model wskazuje terminy infekcji dla pierwotnych i wtórnych infekcji mączniaka prawdziwego winorośli. Jest to najbardziej krytyczna informacja. Infekcje, które nie zostały jeszcze zwalczone przez fungicydy zapobiegawcze lub lecznicze, mogą być katastrofalne dla plonu/jakości. Dalsze informacje dotyczące nasilenia infekcji (słabe/umiarkowane/ciężkie) mogą być pomocne w podjęciu decyzji o strategii ochrony roślin w zależności od historii winnicy (ilość inokulum), odmiany i doświadczeń z poprzednich lat.
Strategie ochrony roślin
- Do zwalczania mączniaka prawdziwego powszechnie stosuje się fungicydy profilaktyczne i systemiczne lub lecznicze. Profilaktyczne środki chemiczne stosuje się przed, ale jak najbliżej zdarzenia infekcyjnego w okresie największej podatności gospodarza, pomiędzy długością pędów 10 cm a wielkością jagód grochu.
- Profilaktyczne środki chemiczne można stosować również poprzez opryskiwanie jak najbliżej przed prognozowanym zdarzeniem pogodowym o deszczu większym niż 2 mm (dla kręgu podstawowego).
- Fungicyd leczniczy powinien być zastosowany jak najszybciej po wystąpieniu infekcji (infekcja 100%) i przed pojawieniem się plam olejowych. Należy pamiętać o zapobieganiu powstawania odporności na fungicydy.
- Monitorowanie winnicy pod kątem obecności mączniaka prawdziwego (plamki olejowe) powinno odbywać się regularnie, z uwzględnieniem co najmniej 200 winorośli. Za zagrożenie uznaje się, jeśli zaobserwuje się więcej niż dwie plamy olejowe na 50 winorośli.
Model opiera się na publikacjach MUELLER-THURGAU, ARENS, MUELLER i SLEUMER, BLAESER, HERZOG, GEHMANN i wielu innych pracowników związanych z siecią badawczą epidemiologii mączniaka rzekomego winorośli od początku XIX wieku.
Mączniak rzekomy
Mączniak rzekomy pomidora może być wywoływany na świecie przez trzy patogeny.
Leveillula taurica (Oidiopsis taurica) jest patogenem szerokiej gamy gatunków żywicieli w ciepłym, suchym lub półsuchym klimacie w Azji, regionie śródziemnomorskim, Afryce, a ostatnio w południowo-zachodnich Stanach Zjednoczonych.
Erysiphe orontii (E. cichoracearum oraz E. polyphaga) to kolejny gatunek wspólny dla wielu roślin żywicielskich zarówno w strefie umiarkowanej, jak i tropikalnej.
I jako trzeci gatunek Odium lycopersicum.
Czynniki rozwoju choroby
- wilgotność względna > 50% (optymalna wilgotność względna > 90%)
- wolna woda na powierzchniach liści nie jest konieczna
- zakres temperatur: 10-35 °C (najlepiej poniżej 30 °C)
Mączniak rzekomy jest chorobą napędzaną przez inokulum. Dlatego też można określić tylko okresy ryzyka, głównym czynnikiem powodującym szkody, np. epidemię jest początkowe inokulum (które jest aktywne w szerokim zakresie temperatur). Tak więc dla strategii kontroli: połącz modelowanie okresu ryzyka z monitorowaniem inokulum grzyba (choroby) na polu!
Pomidor polny
Rdza szparagowa
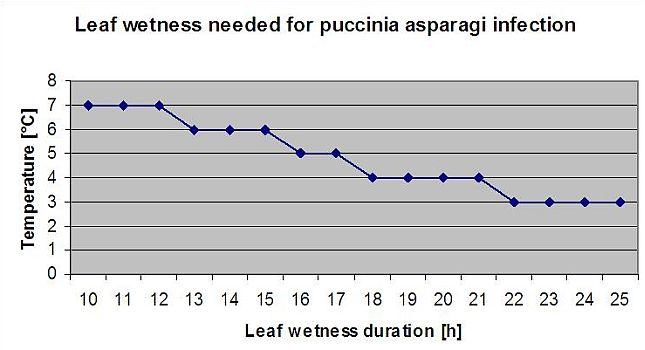
Rdza szparagowa Puccinia asparagi sprzyja wilgotny i ciepły klimat. Niewielkie ilości deszczu i wiatru powodują rozprzestrzenianie się zarodników, natomiast ulewne deszcze mogą je zmyć do gleby. Z tego powodu okresy zwilżenia liści przez ponad 10 mm deszczu nie są brane pod uwagę jako okresy infekcji. Okresy zwilżenia liści przez lekkie deszcze i rosy trwające od 3 do 8 godzin, przy temperaturze od 25°C do 10°C mogą być okresami infekcji dla zarodników w lecie i pod koniec lata.
Zaraza liści Stemphylium
Stemphylium Zaraza liści jest powodowana przez grzyb Stemphylium vesicarium. Na liściach powstają małe, jasnożółte do brązowych i nasiąknięte wodą zmiany. Te małe zmiany rozrastają się w wydłużone plamy, które często ulegają koalescencji, co prowadzi do porażenia liści. Zmiany zwykle zmieniają kolor na jasnobrązowy do brązowego w centrum, a później na ciemnooliwkowo-brązowy do czarnego, gdy rozwijają się zarodniki tego patogenu. S. vesicarium zwykle wkracza do martwych i obumierających tkanek cebuli, takich jak końcówki liści, zmiany w postaci purpurowej plamistości i mączniaka prawdziwego, tkanki zranione i starcze. Infekcja zwykle ogranicza się do liści i nie rozszerza się na łuski cebuli. Zmiany chorobowe pojawiają się zazwyczaj po stronie liścia zwróconej w kierunku dominującego wiatru. Długie okresy ciepłych i wilgotnych warunków sprzyjają rozwojowi choroby.
Stemphylium versicarium model oparty jest na pracy SUHERI i PRICE w przypadku cebuli oraz LLorent, VILARDELL, BUGIANI, GHERARDI i MONTESINO w przypadku gruszki. Oblicza się krzywe infekcji dla słabych, umiarkowanych i ciężkich infekcji. Od historii choroby danego miejsca zależy, czy zabieg musi być uwzględniony przy słabej, umiarkowanej czy ciężkiej infekcji.
Przy takim podziale na sytuacje korzystne, umiarkowanie korzystne i bardzo korzystne to hodowca decyduje o tym, jak duża będzie presja chorobowa na danym polu i czy musi pokryć konkretną infekcję.
Temperatura: 11-30°C
Wilgotność liści > 0 (początek infekcji) lub wilgotność względna > 90% (tylko jeśli przed obliczeniem była już infekcja i nadal się utrzymuje)
Lekka infekcja (11-30°C), umiarkowana infekcja (13-30°C), silna infekcja (16-30°C), macierz z czasem trwania wilgotności liści (patrz wyżej)
Reset: jeśli wilgotność względna jest niższa niż 70%.
S. versicarium infekcje występują często razem z Alternaria porri infekcje. Dlatego też model TomCast (Alternaria) jest dość często stosowany w obu przypadkach.
Cercospora leaf spot
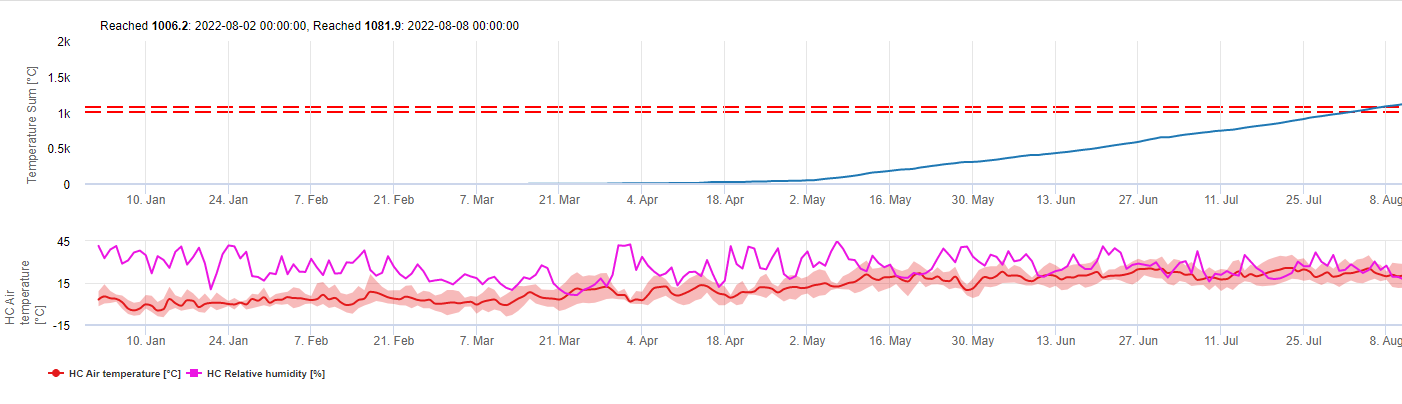
Model ten szacuje datę pierwszego wystąpienia C. beticola na podstawie skumulowanych średnich temperatur dobowych od pierwszego stycznia powyżej 5°C. W okresach o wilgotności względnej wyższej niż 60% przyjmuje próg 1006.2°C, a gdybyśmy nie mieli wilgotności względnej, obowiązuje próg 1081.9°C.
Model ten został opracowany dla Włoch i jest stosowany we Włoszech i w Niemczech.
W roku 2010 w Styrii CercoPrim wskazuje 19 czerwca jako datę pierwszego oprysku. Jest to mniej więcej ten sam termin, który model Pessl Instruments Risk lub model DIV wskazałby dla odmian podatnych na przędzenie.
Purpurowa plamistość
Patogen
Fioletowa plamistość na pędach szparagów i paprociach jest powodowana przez grzyb Stemphylium vesicarium. Grzyb przeżywa zimę w postaci zarodników płciowych (askospores) w woreczku (ascus) wytwarzanym w strukturach zimujących (pseudothecia), które pojawiają się jako małe czarne kropki na resztkach szparagów z poprzedniego sezonu. Strona askospory są uwalniane z ascusa przez deszcz i mogą być przenoszone przez wiatr na nowo wschodzące rośliny szparagów, gdzie powodują pierwotną infekcję w sezonie wegetacyjnym. W wyniku tych nowych infekcji powstają zarodniki (konidia) produkowane w procesie bezpłciowym, które z kolei mogą powodować infekcje wtórne, proces ten powtarza się tak długo, jak długo temperatury i opady są korzystne.
Choroba
Pojawienie się purpurowej plamistości jako istotnego problemu w produkcji szparagów w Michigan może wynikać z przyjęcia systemu uprawy bez uprawy, w którym wysuszone paprocie z poprzedniego sezonu są ścinane w kwietniu i pozostawiane na powierzchni gleby. Pozostałość ta utrzymuje się przez sezon zbiorów (połowa czerwca) i jest widoczna przez okres wzrostu paproci (od końca czerwca do września) i jest źródłem askospor, które rozpoczynają infekcje we wczesnym okresie wegetacji. Objawami choroby są: Choroba objawia się jako liczne, lekko zapadnięte, fioletowe plamy z brązowym środkiem występujące na zebranych włóczniach i paprociach. Zmiany na włóczniach często występują po stronie nawietrznej, ponieważ nawiewany piasek powoduje rany, które sprzyjają infekcji. W latach epidemicznych plamistość może występować na 60-90% włóczni i może prowadzić do odrzucenia uprawy, zwłaszcza w przypadku sprzedaży na świeżym rynku. Plamy występują również na paprociach szparagowych, dotykając głównego pnia, drugorzędnych gałęzi i igieł (kladofili). Silne porażenie paproci może skutkować przedwczesną defoliacją rośliny. Wzrost nasilenia choroby purpurowej plamistości wiąże się z dłuższymi okresami opadów, mgły lub rosy.
Opracowanie tekstu: Mary K. Hausbeck, profesor i specjalista ds. rozwoju, Michigan State University, Wydział Patologii Roślin, E. Lansing
TomCast dla szparagów
Wprowadzenie: TOMCAST (TOMato disease foreCASTing) to model komputerowy oparty na danych terenowych, który próbuje przewidzieć rozwój chorób grzybowych, tj. Wczesna zaraza, Septoria Leaf Spot i Anthracnose na pomidorach. Umieszczone w terenie rejestratory danych zapisują co godzinę dane dotyczące wilgotności liści i temperatury. Dane te są analizowane w ciągu 24 godzin i mogą prowadzić do powstania wartości DSV (Disease Severity Value); zasadniczo jest to przyrost rozwoju choroby. W miarę gromadzenia się DSV, presja choroby na uprawę stale rośnie. Gdy liczba skumulowanych DSV przekracza okres między opryskami, zalecane jest zastosowanie fungicydu w celu zmniejszenia presji choroby.
TOMCAST wywodzi się z oryginalnego modelu F.A.S.T. (Forecasting Alternaria solani on Tomatoes) opracowanego przez dr Madden, Pennypacker i MacNab z Pennsylvania State University (PSU). Model PSU F.A.S.T. został zmodyfikowany przez Dr. Pitblado w Ridgetown College w Ontario do postaci modelu TOMCAST używanego przez Ohio State University Extension.
DSV są: Disease Severity Value (DSV) to jednostka miary nadawana określonemu przyrostowi rozwoju choroby (wczesnej zarazy).
Innymi słowy, DSV to liczbowa reprezentacja tego, jak szybko lub wolno choroba (wczesna zaraza) gromadzi się na polu pomidora. DSV zależy od dwóch czynników: wilgotności liści i temperatury w godzinach "mokrych". Wraz ze wzrostem liczby godzin mokrych liści i temperatury, DSV gromadzi się w szybszym tempie. Zobacz poniższy wykres wartości nasilenia choroby.
I odwrotnie, gdy jest mniej godzin wilgotności liści, a temperatura jest niższa, DSV gromadzą się powoli, jeśli w ogóle. Gdy całkowita liczba nagromadzonych DSV przekroczy ustalony limit, zwany odstępem między opryskami lub progiem, zaleca się wykonanie oprysku fungicydem w celu ochrony liści i owoców przed rozwojem choroby.
Odstęp między opryskami (określający kiedy należy wykonać oprysk) może wynosić od 15 do 20 DSV. Dokładna wartość DSV, jaką powinien zastosować plantator, jest zazwyczaj dostarczana przez przetwórcę i zależy od jakości owoców. Stosowanie odstępu 15 DSV jest konserwatywnym wykorzystaniem systemu TOMCAST, co oznacza, że opryski będą wykonywane częściej niż w przypadku plantatora, który stosuje odstęp 19 DSV z systemem TOMCAST. Wynikiem tego jest liczba oprysków wykonywanych w sezonie i potencjalne różnice w jakości owoców.
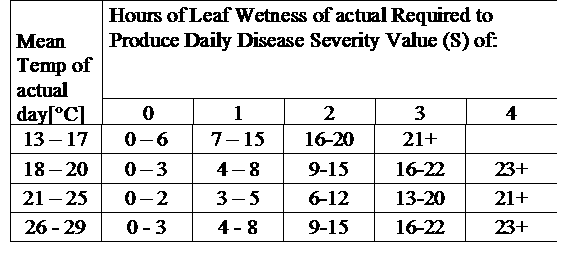 TomCast ze szparagami
TomCast ze szparagami
Badania wykazały, że urządzenie Tom-Cast do przewidywania chorób jest obiecującą alternatywą dla opartych na kalendarzu oprysków paproci na komercyjnych polach szparagów. Tom-Cast ostrzega hodowców, gdy warunki środowiskowe są korzystne dla rozwoju choroby purpurowej plamistości (przedłużone okresy rosy lub deszczu, którym towarzyszą ciepłe temperatury). Skuteczne fungicydy stosowane zgodnie z prognozą chorobową Tom-Cast pozwalają plantatorom opanować fioletową plamistość szparagów, jednocześnie oszczędzając pieniądze i chroniąc środowisko.
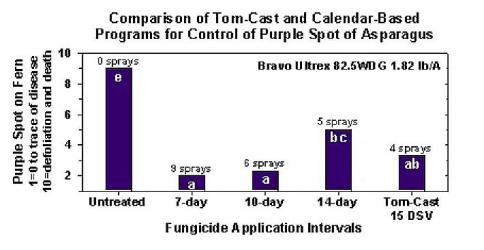
Kredyt na tekst: Jim Jasinski, Koordynator TOMCAST dla OHIO, INDIANA i MICHIGAN
Model zakażenia purpurową plamką
Na stronie Stemphylium versicarium Model infekcji oparty jest na pracy SUHERI i PRICE w cebuli oraz LLorent, VILARDELL, BUGIANI, GHERARDI i MONTESINO w gruszce.
Obliczono krzywe infekcji dla lekkich, umiarkowanych i ciężkich infekcji.
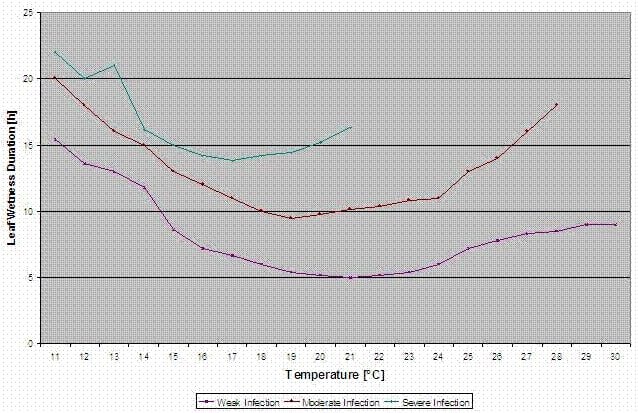
Przy takim podziale na sytuacje korzystne, umiarkowanie korzystne i bardzo korzystne to hodowca decyduje o tym, jak duża będzie presja chorobowa na danym polu i czy musi pokryć konkretną infekcję.
Warunki:
Temperatura: 11-30°C
Wilgotność liści > 0 (początek infekcji) lub wilgotność względna > 90% (tylko jeśli przed obliczeniem była już infekcja i nadal się utrzymuje)
Lekka infekcja (11-30°C), umiarkowana infekcja (13-30°C), silna infekcja (16-30°C), macierz z czasem trwania wilgotności liści (patrz wyżej)
Reset: jeśli wilgotność względna jest niższa niż 70%.