
Fraise modèles de maladies
Anthracnose
Agent pathogène
L'anthracnose des fraises, causée par Colletotrichum acutatumCette maladie se manifeste par des lésions noires et enfoncées sur les tiges, les stolons et les fruits. Cette maladie fongique affecte toutes les parties de la plante, y compris la couronne, les racines, les pétioles et les stolons.
La maladie peut se développer rapidement dans des conditions favorables et jusqu'à 90% des fruits peuvent être infectés en l'espace d'une semaine ou moins. Les fruits immatures et matures sont tous deux susceptibles d'être infectés, mais la maladie est plus fréquente dans les fruits en cours de maturation ou complètement matures. Les plantes infectées ou les débris végétaux peuvent servir de sources d'inoculum pour l'hiver. Au printemps, les spores sont produites et dispersées par la pluie et le vent sur des distances relativement courtes.
Le pathogène pénètre dans la plante par un appressorium qui traverse la cuticule et envahit les cellules épidermiques. Au départ, C. acutatum existe dans une phase biotrophe et passe à une phase nécrotrophe, dans laquelle le champignon prolifère à l'intérieur des cellules mortes. Au fur et à mesure que la maladie progresse, le champignon forme des acervules sous les parois cellulaires de l'épiderme. Ces acervules mûrissent et libèrent des conidies, qui propagent la maladie plus rapidement, notamment sous l'effet des éclaboussures de pluie. Les conidies secondaires constituent également une source importante d'inoculum.
Symptômes
Les symptômes se manifestent d'abord par un flétrissement des feuilles les plus jeunes, qui peuvent se rétablir temporairement mais meurent rapidement. Des taches noires irrégulières apparaissent sur les feuilles, surtout à l'extrémité des folioles.
Le tissu de la couronne présente alors une décoloration rougeâtre qui finit par devenir brun foncé ou noir au fur et à mesure que la plante se détériore. Les couronnes infectées sont souvent partiellement endommagées, ce qui entraîne un retard de croissance, mais pas la mort complète de la plante. Généralement, seul un côté de la couronne est infecté, plutôt que la couronne entière.
Des lésions foncées et allongées se forment sur les pétioles et les tiges des stolons. Les pétioles et les tiges affectés peuvent être ceinturés par les lésions, ce qui entraîne le flétrissement et la mort des feuilles ou des plantes filles entières.
Les fruits peuvent être infectés à n'importe quel stade de leur développement, en durcissant et en devenant bruns. Des lésions sombres et enfoncées se développent sur les fruits matures, entraînant une momification au lieu d'un mûrissement. Les fruits peuvent également sembler couverts de masses de conidies roses ou saumonées.
FieldClimate Modèle
Modèle général d'anthracnose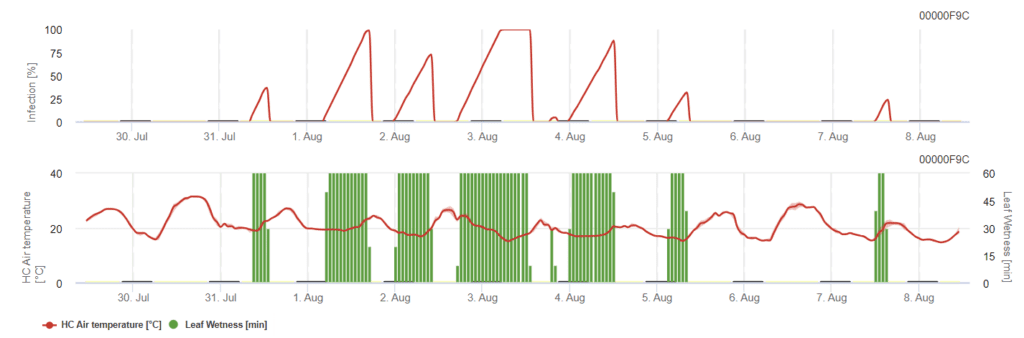
Capteurs nécessaires :
- Température de l'air
- Humidité des feuilles
C. acutatum infecte les plantes à des températures comprises entre 15°C et 30°C, mais une période d'humectation des feuilles de longue durée est nécessaire. Aux températures optimales de 20°C à 25°C, une période d'humectation des feuilles de 12 heures est nécessaire. Lorsque le graphique d'infection atteint 100%, les conditions optimales pour une infection sont réunies dans le champ.
Littérature
- Aljawasim, B. D., Samtani, J. B. et Rahman, M. (2023). New Insights in the detection and management of anthracnose diseases in strawberries. Plants, 12(21), 3704.
- Ellis, M. A., et Erincik, O. (2008). Anthracnose du fraisier. The Ohio State University Extension.
- Smith, B. J. (2008). Epidémiologie et pathologie de l'anthracnose du fraisier : une perspective nord-américaine. HortScience, 43(1), 69-73.
Oïdium
Agent pathogène
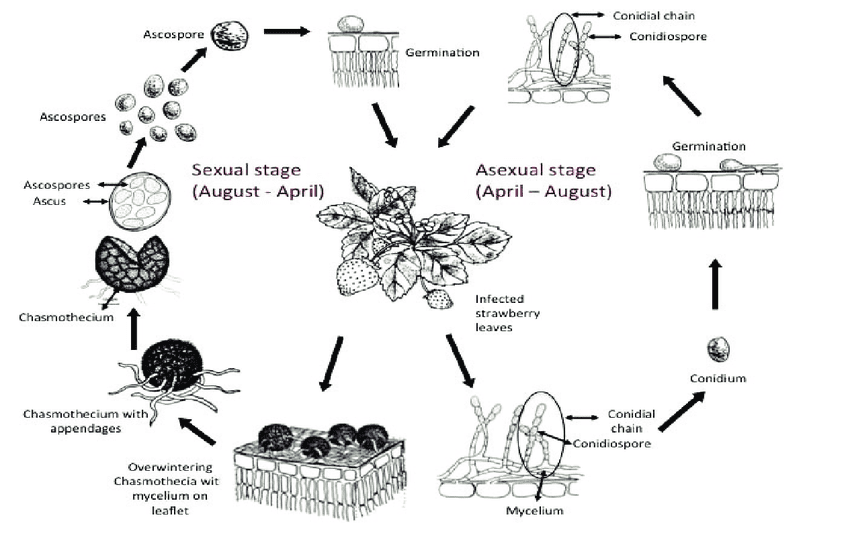
L'agent pathogène de l'oïdium des fraises est le suivant Podosphaera aphanis. Elle hiverne sous deux formes : le mycélium et les cleistothèces.
Le mycélium hivernant devient actif au printemps, produisant des conidiophores qui libèrent des conidies (spores reproductrices asexuées) à maturité. Les conidies se posent sur un nouveau tissu, germent et forment des appressoria, des structures d'infection spécialisées qui pénètrent dans les cellules végétales. Ce processus aboutit à la formation de nouvelles colonies.
Le Cleistothecia libère des ascospores (spores reproductrices sexuelles) de mars à mai. Les ascospores se posent également sur de nouveaux tissus, germent et forment de nouvelles colonies.
Le mycélium et les conidies servent tous deux d'inoculum primaire. Les infections secondaires se produisent principalement par l'intermédiaire des conidies, qui sont dispersées par le vent et se propagent rapidement.
Lorsque les conditions environnementales deviennent moins favorables, le champignon passe à la reproduction sexuée - formation de cleistothèces - et le cycle se répète lorsque les inoculums passent l'hiver.
Symptômes
Des taches poudreuses blanches de mycéliums et de conidies apparaissent sur toutes les parties aériennes et se regroupent pour couvrir toute la surface. Les organes jeunes sont plus sensibles que les organes plus âgés. En ce qui concerne les feuilles, la face supérieure présente un oïdium plus important que la face inférieure. Une infection sévère entraîne une réduction de la photosynthèse, une défoliation et une déformation des fruits. Au fur et à mesure que la maladie se développe, la feuille s'enroule vers le haut et des taches pourpres à rougeâtres se forment à la surface des feuilles.
Modèles FieldClimate
Modèle Gubler modifié par Broome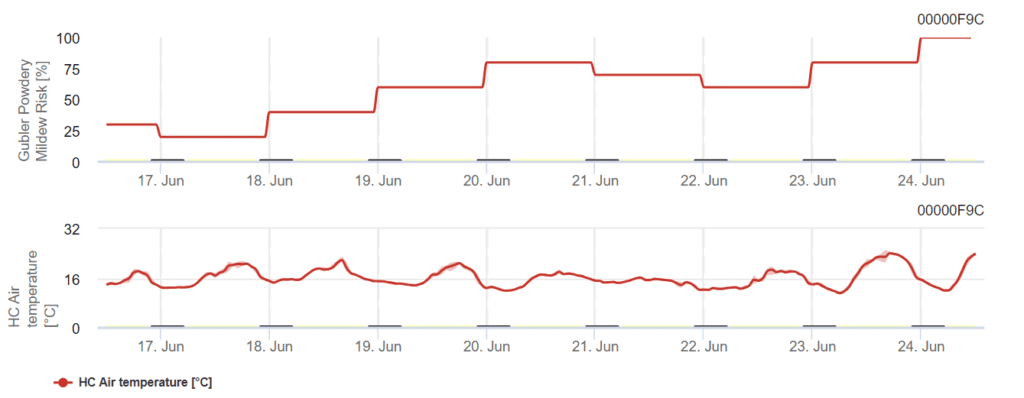
Capteurs nécessaires :
- Température de l'air
Le modèle est basé sur le cadre de Gubler avec des modifications des seuils de haute température introduites par Broome. Il calcule le risque en fonction de la température de l'air et l'indice de risque varie de 0 à 100. Pour déclencher l'indice, il faut trois jours consécutifs avec plus de 6 heures de températures entre 21°C et 30°C.
L'indice augmente de 20 points pour chaque jour qui remplit ces conditions (un minimum de 6 heures entre 21°C et 30°C). À l'inverse, si une journée connaît moins de 6 heures dans cette fourchette de température ou si la température dépasse 35°C, l'indice diminue de 10 points.
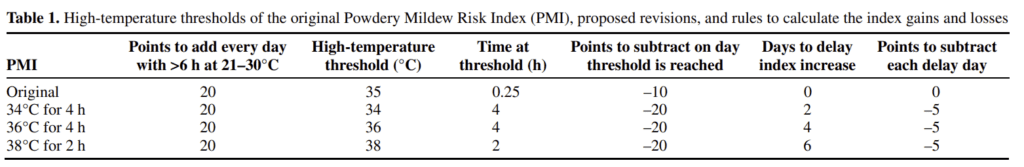
Le modèle original de Gubler établissait un seuil de 35°C pendant 0,35 heure, mais Broome a introduit plusieurs seuils détaillés de températures élevées. Lorsque des températures spécifiques (34°C, 36°C et 38°C) sont atteintes pendant une durée suffisante, des points sont soustraits. En outre, le modèle tient compte du retard dans la croissance fongique ; tout gain d'indice le jour suivant est retardé de plusieurs jours et cinq points supplémentaires sont déduits pour chaque jour de retard.
Un indice inférieur à 30 indique un taux de reproduction de 15 jours ou moins, tandis qu'un indice de 40~50 est considéré comme normal, impliquant un taux de reproduction de 8 à 11 jours. Un indice supérieur à 60 indique que le pathogène se reproduit tous les 5 jours et qu'il est recommandé de réduire l'intervalle de pulvérisation.
Modèle d'oïdium du fraisier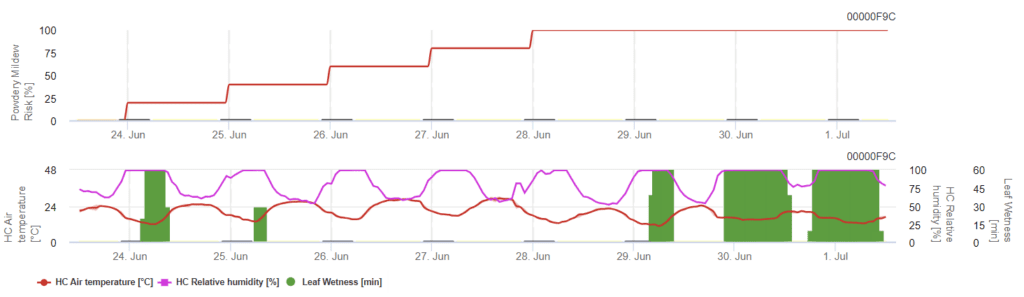
Capteurs nécessaires :
- Température de l'air
- Humidité relative
- Humidité des feuilles
Ce modèle inclut l'humidité des feuilles et l'humidité relative dans un autre modèle. Les températures de l'air supérieures à 21°C et l'humidité relative supérieure à 66% augmentent le risque, tandis que les températures plus basses, l'humidité relative et l'humidité des feuilles diminuent le risque.
L'indice de risque inférieur à 60 indique que les mesures de protection des plantes sont faibles, tandis que le risque supérieur à 60 indique un risque de maladie accru et qu'une pulvérisation est recommandée. Un risque de maladie de 100 pour une période plus longue nécessite une augmentation de la densité d'application.
Littérature
- Broome, J. C., Hand, E. K., Backup, P., Janousek, C. N. et Gubler, W. D. (2010, juin). Revising the high temperature threshold for the Gubler-Thomas grape powdery mildew risk index. In PHYTOPATHOLOGY (Vol. 100, No. 6, pp. S17-S18). 3340 PILOT KNOB ROAD, ST PAUL, MN 55121 USA : AMER PHYTOPATHOLOGICAL SOC.
- Gadoury, D. M., Asalf, B., Heidenreich, M. C., Herrero, M. L., Welser, M. J., Seem, R. C., ... & Stensvand, A. (2010). Initiation, développement et survie des cleistothèces de Podosphaera aphanis et leur rôle dans l'épidémiologie de l'oïdium du fraisier. Phytopathology, 100(3), 246-251.
- Jin XiaoLei, J. X., Fitt, B. D. L., Hall, A. M., & Huang YongJu, H. Y. (2013). Le rôle des chasmothécies dans l'initiation des épidémies d'oïdium (Podospheara aphanis) et le rôle du silicium dans le contrôle des épidémies sur fraise.
- Palmer, S. A. (2007). Strawberry powdery mildew : epidemiology and the effect of host nutrition on disease (Doctoral dissertation).
- Aldrighetti, A., & Pertot, I. (2023). Epidémiologie et lutte contre l'oïdium du fraisier : une revue. Phytopathologia Mediterranea, 62(3), 427-453.
Équipement recommandé
Vérifiez quel jeu de capteurs est nécessaire pour surveiller les maladies potentielles de cette culture.
