Chanvre et lin modèles de maladies
Pourriture sclérotique
La pourriture sclérotique affecte un large éventail de plantes, en particulier les espèces non ligneuses. La pourriture sclérotique est causée par S. sclerotiorum. La pourriture sclérotique peut affecter les plantes à tous les stades de la production, y compris les semis, les plantes matures et les produits récoltés. Les plantes dont les tissus sont sénescents ou morts sont particulièrement sensibles à l'infection.
Symptômes
La zone infectée d'une plante prend d'abord un aspect vert foncé ou brun imbibé d'eau, puis peut devenir plus pâle. Un mycélium blanc dense et cotonneux se développe généralement et la plante commence à flétrir et finit par mourir. Des structures de repos ou de survie (sclérotes) sont produites à l'extérieur sur les parties de la plante affectées et à l'intérieur dans les cavités de la moelle de la tige. Les sclérotes sont durs, noirs, de forme irrégulière, d'une taille de 2 à 4 mm pour la plupart, et difficiles à voir une fois incorporés dans le sol.
Sources et propagation des maladies
Le cycle de vie de S. sclerotiorum comprend à la fois une phase transmise par le sol et une phase transmise par l'air. Les sclérotes de S. sclerotiorum peuvent survivre dans le sol pendant dix ans ou plus. Ils germent pour produire de petits corps fructifères en forme d'entonnoir (apothécies) d'environ 1 cm de diamètre. Les apothécies produisent des spores en suspension dans l'air, qui peuvent provoquer une infection lorsqu'elles atterrissent sur une plante hôte sensible, soit par l'intermédiaire des fleurs, soit par germination directe sur les feuilles. Parfois, l'infection de la base des tiges peut se produire lorsque des brins de champignons (mycélium) se développent directement à partir des sclérotes près de la surface. De nouveaux sclérotes se développent dans les tissus végétaux infectés et, lorsque la plante meurt, ils restent à la surface du sol ou peuvent être incorporés lors d'un travail ultérieur du sol.
Conditions d'infection
Après une période de froid en hiver, les sclérotes, qui ont passé l'hiver dans les 5 premiers centimètres du sol, germent à partir du printemps pour produire des apothécies, qui sont ensuite utilisées pour la culture de la vigne. les températures du sol sont supérieures ou égales à 10°C et le sol est humide. Les sclérotes ne germent pas dans un sol sec ou lorsque la température du sol est supérieure à 25°C. Les sclérotes enfouis à moins de 5 cm dans le sol ont moins de chances de germer. Une fois que les apothécies sont complètement formées, la libération des spores peut se produire à la lumière ou à l'obscurité, mais dépend de la températureLes apothécies peuvent durer une vingtaine de jours à une température comprise entre 15 et 25°C. Elles se flétrissent après moins de 10 jours à 25°C. Les apothécies peuvent durer environ 20 jours à une température de 15 à 20°C, mais se flétrissent après moins de 10 jours à 25°C. Pour les les herbes à fleurs, les spores atterrissant sur les pétales et les étamines germent rapidement (germination dans les 3 à 6 heures et infection dans les 24 heures) dans des conditions optimales de 15 à 25°C, en continu. l'humidité des feuilles et l'humidité élevée à l'intérieur de la culture. L'infection ultérieure des feuilles et des tiges dépend de la chute et de l'adhérence des pétales sur les feuilles. Le risque d'infection augmente si les feuilles sont humides, car les pétales collent davantage. Les pétales morts ou sénescents infectés fournissent des nutriments pour l'invasion du champignon dans les feuilles et les tiges. Pour les pour les herbes non fleuries, l'infection est principalement due à des spores transportées par l'air et atterrissant directement sur les feuilles. Les spores peuvent survivre sur les feuilles pendant plusieurs semaines jusqu'à ce que les conditions favorables à l'infection des feuilles soient réunies. La germination et l'infection des spores dépendent de la présence de nutriments sur les feuilles, provenant soit de blessures de la plante, soit de matériel végétal en voie de sénescence. En ce qui concerne les herbes à fleurs, les conditions optimales de germination et d'infection des spores se situent entre 15 et 25°C, avec une humidification continue des feuilles et une humidité élevée. Une fois que la plante est infectée, la progression rapide de la maladie est favorisée par des conditions chaudes (15-20°C) et humides dans les cultures denses.
Modèle d'infection par Sclerotinia
Infection des plantes par S. sclerotiorum
La germination carpogène des sclérotes est stimulée par des périodes de humidité continue du sol. Des apothécies se forment à la surface du sol, à partir desquelles les ascospores sont libérées dans l'air. L'infection de la plupart des espèces cultivées est principalement associée aux ascospores, mais l'infection directe de tissus végétaux sains et intacts par des ascospores en germination ne se produit généralement pas. L'infection des tissus des feuilles et des tiges de plantes saines ne se produit que lorsque les ascospores en germination colonisent les tissus morts ou sénescents, généralement les parties des fleurs telles que les pétales abscents, avant la formation des structures d'infection et la pénétration. La germination mycéliogène des sclérotes à la surface du sol peut également entraîner la colonisation de la matière organique morte et l'infection ultérieure des plantes vivantes adjacentes. Cependant, dans certaines cultures, par exemple Tournesol La germination mycéliogène des sclérotes peut directement initier le processus d'infection des racines et de la tige basale, ce qui entraîne un flétrissement. Le stimulus de la germination et de l'infection mycéliogène chez le tournesol n'est pas connu mais dépend probablement de signaux nutritionnels dans la rhizosphère dérivés des plantes hôtes.
Le processus d'infection
L'infection des tissus sains dépend de la formation d'un appressoriumqui peuvent avoir une structure simple ou complexe en fonction de la surface de l'hôte. Dans la plupart des cas, la pénétration est directement à travers la cuticule et non par les stomates. Les appressoria se développent à partir des ramifications dichotomiques terminales des hyphes poussant sur la surface de l'hôte et consistent en un coussinet d'hyphes larges, multi-septés et courts, orientés perpendiculairement à la surface de l'hôte à laquelle ils sont attachés par du mucilage. Les appressoria complexes sont souvent appelés coussins d'infection. Bien que les premiers chercheurs aient considéré que la pénétration de la cuticule était un processus purement mécanique, des études ultra-structurelles montrent clairement que la pénétration de la cuticule est un processus purement mécanique. la digestion enzymatique de la cuticule joue également un rôle dans le processus de pénétration. On sait peu de choses sur les S. sclerotiorum Cependant, le génome code pour au moins quatre enzymes de type cutinase (Hegedus, non publié). Une grande vésicule, formée à l'extrémité de l'appressorium avant la pénétration, semble être libérée dans la cuticule de l'hôte pendant la pénétration. Après la pénétration de la cuticule, une vésicule subcuticulaire se forme, à partir de laquelle de grandes hyphes se développent en éventail, recouvrant et dissolvant la paroi subcuticulaire de l'épiderme.
Infection par dégradation enzymatique des cellules épidémiques : L'acide oxalique agit en relation avec les enzymes de dégradation de la paroi cellulaire, comme la polygalacturonase (PG), pour provoquer la destruction du tissu hôte en créant un environnement propice à l'attaque par la PG de la pectine dans la lamelle moyenne. Cette attaque libère à son tour des dérivés de faible poids moléculaire qui induisent l'expression d'autres gènes de PG. En effet, l'activité PG globale est induite par la pectine ou les monosaccharides dérivés de la pectine, comme l'acide galacturonique, et est réprimée par la présence de glucose. L'examen des modèles d'expression des gènes Sspg individuels a révélé que l'interaction entre les PG et avec l'hôte au cours des différentes étapes de l'infection est finement coordonnée. (Dwayne D. Hegedus *, S. Roger Rimmer : Sclerotinia sclerotiorum : Quand ''être ou ne pas être'' un pathogène ? FEMS Microbiology Letters 251 (2005) 177-184)
La recherche de conditions climatiques propices à l'infection de S. sclerotiorum doit tenir compte de la formation des apothécies, de la sporulation, de l'infection directe par les apothécies (même si elle n'est pas très fréquente) et de l'infection à partir des mycéliums établis par dégradation enzymatique des cellules épidémiques.
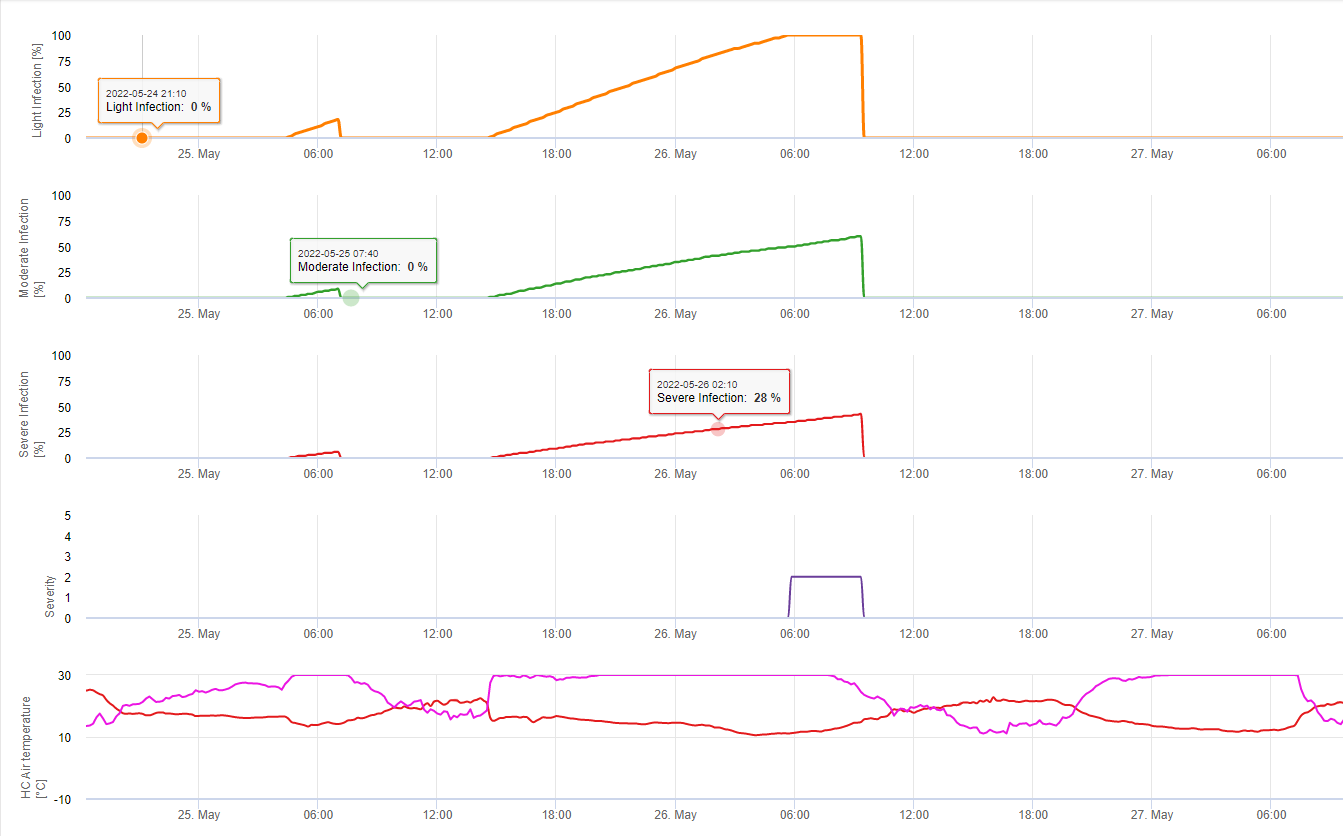
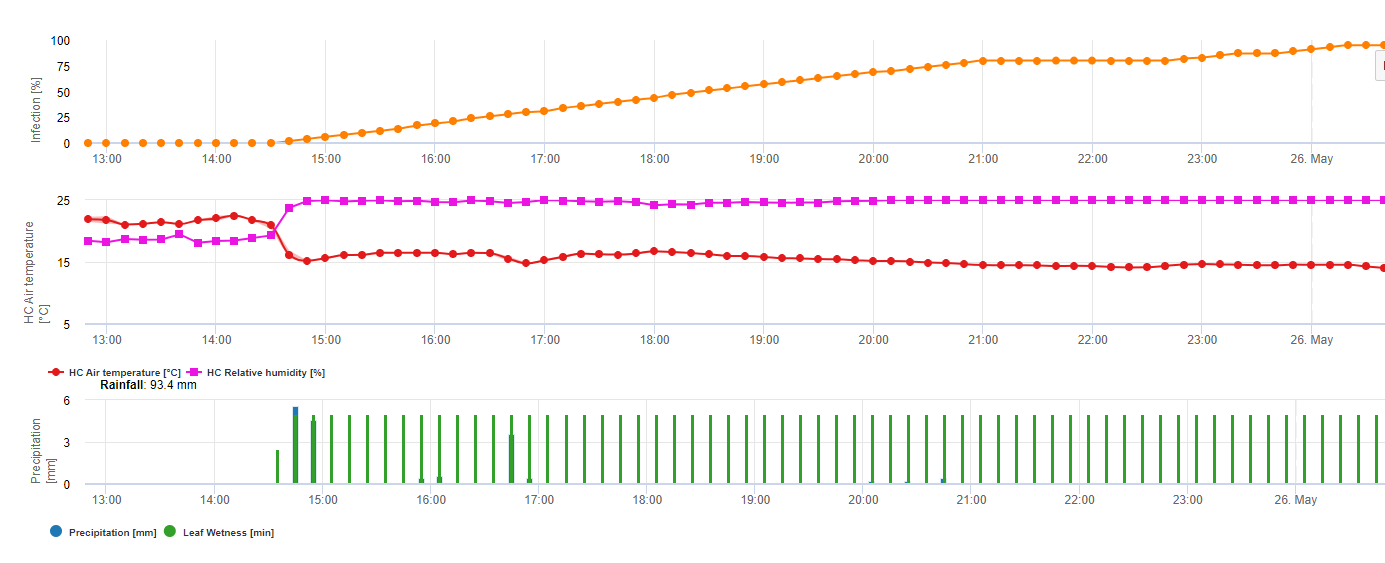
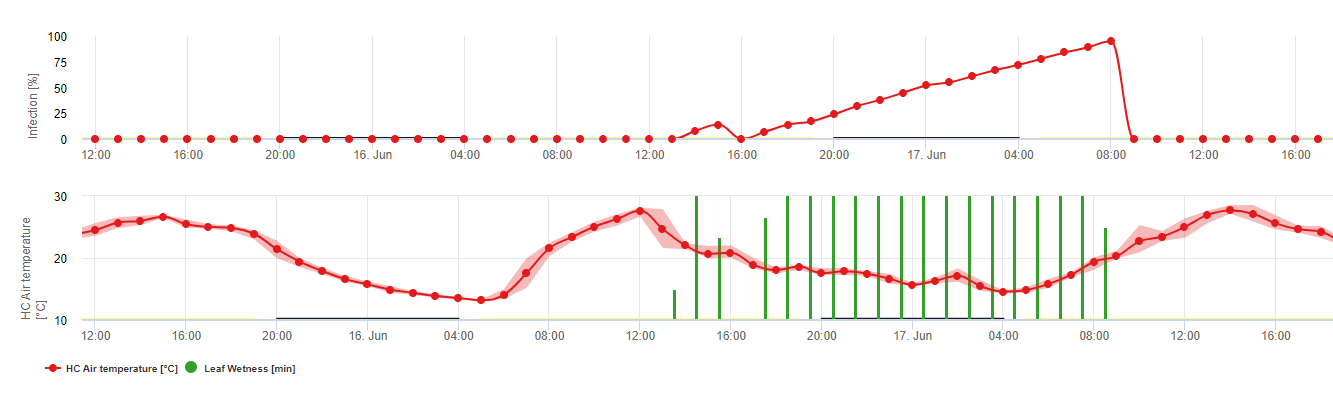
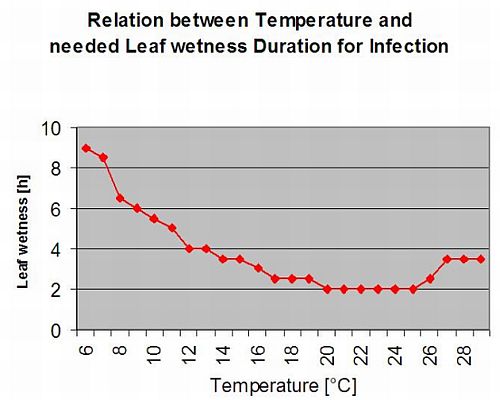
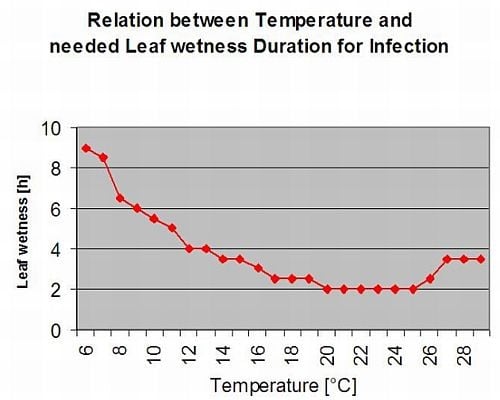
Formation des apothécies et sporulation a lieu si un pluie de plus de 8 mm est suivie d'une période de une humidité relative élevée durant plus de 20 heures à une température optimale de 21°C à 26°C.
Infection directe par les apothécies peut être attendue après une période d'humidité des feuilles suivie de 16 heures d'humidité relative plus élevée que celle de 90% à une température optimale de 21°C à 26°C ("infection par appressoria"). En revanche, une croissance saprophyte suivie d'une dégradation enkystée des cellules épidermiques ("infection hydrolytique") peut être attendue sous une humidité relative légèrement inférieure à 80% pendant une période de 24 heures dans des conditions optimales de 21°C à 26°C.
La littérature :
- Lumsden, R.D. (1976) Enzymes pectolytiques de Sclerotinia sclerotiorum et leur localisation sur le haricot infecté. Can. J. Bot. 54,2630-2641.
Tariq, V.N. et Jeffries, P. (1984) Appressorium formation by Sclerotinia sclerotiorum : scanning electron microscopy. Trans. Brit. Mycol. Soc. 82, 645-651. - Boyle, C. (1921) Études sur la physiologie du parasitisme. VI. Infection par Sclerotinia libertiana. Ann. Bot. 35, 337-347.
Abawi, G.S., Polach, F.J. et Molin, W.T. (1975) Infection du haricot par les ascospores de Whetzelinia sclerotiorum. Phytopathologie 65, 673-678. - Tariq, V.N. et Jeffries, P. (1986) Ultrastructure de la pénétration de Phaseolus spp. par Sclerotinia sclerotiorum. Can. J. Bot. 64, 2909- 2915.
- Marciano, P., Di Lenna, P. et Magro, P. (1983) Oxalic acid, cell wall degrading enzymes and pH in pathogenesis and their significance in the virulence of two Sclerotinia sclerotiorum isolates on sunflower. Physiol. Plant Pathol. 22, 339-345.
- Fraissinet-Tachet, L. et Fevre, M. (1996) Regulation by galacturonic acid of ppectinolytic enzyme production by Sclerotinia sclerotiorum. Curr. Microbiol. 33, 49-53.
Utilisation pratique du modèle Sclerotinia
Le modèle de l'infection de la jambe blanche montre les périodes pendant lesquelles le formation d'apothécies sont attendues. Si ces périodes coïncident avec la période de floraison du colza ou du canola, il faut s'attendre à ce que S. sclerotiorum infections pendant une période humide. Les spores formées dans les apothécies peuvent être disponibles pendant un à plusieurs jours. L'opportunité des infections est indiquée par le calcul de la progression de l'infection pour les infections directes ou indirectes par les appressoria ou la dégradation enzymatique de la paroi cellulaire. Si la ligne de progression de l'infection atteint 100%, une infection doit être supposée. Ces infections doivent être couvertes par un traitement préventif ou un fongicide à action curative contre S. sclerotiorum doit être utilisé.
Moisissure grise
Biologie des moisissures grises
Moule gris (Botrytis cinerea) est une maladie dévastatrice ayant un impact économique élevé en production. B. cinerea infecte les fleurs et les fruits proches de la maturité.
Ce champignon pathogène a une très large gamme d'hôtes, infectant plus de 200 hôtes différents. La croissance fongique existe de manière saprophyte et parasitaire.
Symptômes
Sur les tournesols, le pathogène provoque une moisissure grise sur la tête et la tige. Pendant ce temps, les feuilles commencent à se dessécher. Ces symptômes apparaissent pendant la maturation des grains sur la tête. On observe des taches brunes sur la face arrière. Ces taches sont recouvertes par le mycélium et les spores du champignon, donnant l'aspect d'une poudreuse. Les spores peuvent être disséminées lors de conditions météorologiques humides.
Les sclérotes noirs dépourvus de médulle apparaissent sur les débris de la culture après la récolte ou directement sur les plantes si elles sont récoltées trop tard.
Le champignon passe l'hiver à la surface du sol ou dans le sol sous forme de mycélium ou de sclérotes. Au printemps, la forme hivernante commence à germer et à produire des conidies. Ces conidies sont propagées par le vent et la pluie et infectent les nouveaux tissus végétaux.
La germination est possible à une humidité relative supérieure à 85%. La température optimale de germination est de 18°C. Le champignon pathogène peut se reproduire plusieurs fois.
Options de contrôle : Le contrôle des semences peut protéger les plantes de la fonte des semis. La lutte chimique est difficile en raison de la résistance de l'agent pathogène. C'est pourquoi on tente de mettre en place des stratégies de lutte naturelle avec Trichoderma harzianum.
Conditions de modélisation de l'infection
B. cinerea Les infections sont liées à humidité libre. Par conséquent, dans la production en plein champ humidité des feuillesqui est un bon indicateur, est déterminé.
Bulger et al. (1987) ont étudié la corrélation entre les périodes d'humidité des feuilles pendant la floraison et l'apparition de la pourriture grise sur les fruits. Ils ont constaté que pour une Risques d'infection plus élevés à 20°C : une période de plus de 32 heures d'humidité des feuilles est nécessaire.. À des températures plus basses, les périodes d'humidité des feuilles doivent être plus longues pour permettre l'infection de la maladie.
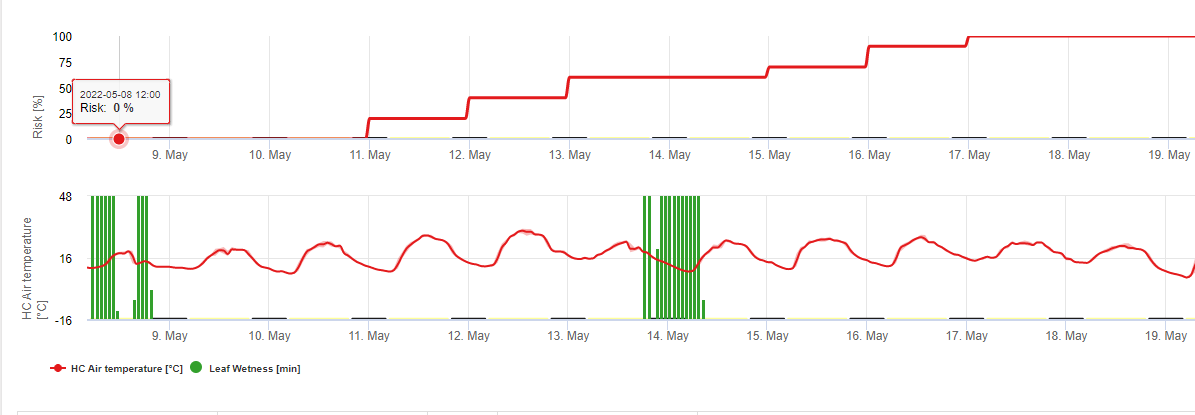
FieldClimate indique un risque de Botrytis cinerea à la base de la les périodes d'humidité des feuilles et la température pendant ces périodes.
Le graphique ci-dessous montre la durée des feuilles mouillées en fonction de la température réelle nécessaire pour une Botrytis l'infection. Si le risque est supérieur à 0, toute période de mouillage des feuilles supérieure à 4 heures augmentera le risque dans les mêmes proportions.
Un jour où la période d'humidité des feuilles est inférieure à 4 heures est considéré comme un jour sec et réduit le risque de 20% par rapport à la valeur réelle.
Utilisation pratique du modèle du moule gris : Le modèle indique les périodes présentant un risque de Botrytis l'infection. Cette période de risque pendant la floraison des fraises conduira à des fruits infectés. Plus la période de risque est longue et plus le risque est élevé, plus la probabilité et le nombre de fruits infectés sont élevés. Le risque, qui peut être pris en considération, dépend du marché. Les producteurs qui vendent leurs fruits aux supermarchés ne prendront aucun risque, sachant qu'ils ne sont pas en mesure de vendre des fruits infectés. En revanche, les producteurs qui vendent leurs fruits directement à la population peuvent prendre un risque plus élevé.
La littérature :
- Bulger M.A., Ellis M. A., Madden L. V. (1987) : Influence de la température et de l'humidité sur l'infection des fleurs de fraisiers par Botrytis cinerea et l'incidence de la maladie sur les fruits provenant de fleurs infectées. Ecology and Epidemiology ; Vol 77 (8) : 1225-1230.
- Sosa-Alvarez M., Madden L.V., Ellis M.A. (1995) : Effects of temperature and wetness duration on sporulation of Botrytis cinerea on strawberry leaf residues. Plant disease 79, 609-615.
Brûlure brune
Brûlure précoce de la pomme de terre et de la tomate
Randall C. Rowe, Sally A. Miller, Richard M. Riedel, Service de vulgarisation de l'Université d'État de l'Ohio
Le mildiou est une maladie très courante de la pomme de terre et de la tomate. Elle provoque des taches sur les feuilles et la brûlure des tubercules sur la pomme de terre, et des taches sur les feuilles, la pourriture des fruits et des lésions de la tige sur la tomate. La maladie peut se manifester dans un large éventail de conditions climatiques et peut être très destructrice si elle n'est pas contrôlée, entraînant souvent la défoliation complète des plantes. Contrairement à son nom, elle se développe rarement tôt, mais apparaît généralement sur le feuillage mature.
Symptômes
Sur les feuilles des deux cultures, les premiers symptômes apparaissent généralement sur les feuilles plus anciennes et consistent en de petites taches mortes irrégulières, de couleur brun foncé à noir, dont la taille varie d'un point à un demi-pouce de diamètre. Au fur et à mesure que les taches s'agrandissent, des anneaux concentriques peuvent se former en raison de la croissance irrégulière de l'organisme dans le tissu foliaire. Cela donne à la lésion un aspect caractéristique de " point cible " ou d'" œil de bœuf ". Il y a souvent un halo étroit et jaune autour de chaque tache et les lésions sont généralement bordées par les nervures. Lorsque les taches sont nombreuses, elles peuvent se développer ensemble, entraînant le jaunissement et la mort des feuilles infectées. En général, les feuilles les plus anciennes sont infectées en premier et elles se dessèchent et tombent de la plante à mesure que la maladie progresse le long de la tige principale.
Sur la tomate, les infections de la tige peuvent survenir à tout âge et se traduire par de petites zones sombres, légèrement enfoncées, qui s'agrandissent pour former des taches circulaires ou allongées avec des centres plus clairs. Des marques concentriques, semblables à celles des feuilles, se développent souvent sur les lésions de la tige. Si des semences infestées sont utilisées pour démarrer des transplants de tomates, les semis peuvent se dessécher peu après l'émergence. Lorsque de grandes lésions se développent au niveau du sol sur les tiges des transplants ou des semis, les plantes peuvent s'anneler, une condition connue sous le nom de "pourriture du collet". Ces plantes peuvent mourir lorsqu'elles sont mises en place dans le champ ou, si les tiges sont affaiblies, elles peuvent se briser tôt dans la saison. Certaines plantes peuvent survivre avec un système racinaire réduit si des parties de tiges situées au-dessus du chancre développent des racines là où elles entrent en contact avec le sol. Cependant, ces plantes produisent généralement peu ou pas de fruits. Les lésions des tiges sont beaucoup moins courantes et moins destructrices sur la pomme de terre.
La chute des fleurs et la formation de taches sur les tiges des fruits, ainsi que la perte des jeunes fruits, peuvent se produire lorsque la brûlure précoce attaque les tomates au stade de la floraison. Sur les fruits plus âgés, la brûlure précoce provoque des taches sombres, coriaces et enfoncées, généralement au point d'attache de la tige. Ces taches peuvent s'agrandir et toucher toute la partie supérieure du fruit, présentant souvent des marques concentriques comme celles des feuilles. Les zones affectées peuvent être recouvertes de masses de spores noires veloutées. Les fruits peuvent également être infectés au stade vert ou mûr par les fissures de croissance et autres blessures. Les fruits infectés tombent souvent avant d'atteindre la maturité.
Sur les tubercules de pomme de terre, le mildiou se traduit par des lésions superficielles qui semblent un peu plus foncées que la peau saine adjacente. Les lésions sont généralement légèrement enfoncées, circulaires ou irrégulières, et leur taille varie jusqu'à 3/4 de pouce de diamètre. Il y a généralement une marge bien définie et parfois légèrement surélevée entre le tissu sain et le tissu malade. À l'intérieur, le tissu présente une pourriture sèche, liégeuse, brune à noire, dont la profondeur ne dépasse généralement pas 1/4 à 3/8 de pouce. Des fissures profondes peuvent se former dans les lésions plus anciennes. L'infection des tubercules est rare dans les conditions de l'Ohio.
Agent pathogène
Le mildiou est causé par le champignon Alternaria solani, qui survit dans les tissus infectés des feuilles ou des tiges sur ou dans le sol. Ce champignon est universellement présent dans les champs où ces cultures ont été pratiquées. Il peut également être transporté sur les semences de tomates et dans les tubercules de pommes de terre. Les spores se forment sur les débris végétaux infestés à la surface du sol ou sur les lésions actives dans une gamme de températures assez large, surtout en cas d'alternance de conditions humides et sèches. Elles sont facilement transportées par les courants d'air, le sol balayé par le vent, les éclaboussures de pluie et l'eau d'irrigation. L'infection des tissus sensibles des feuilles ou des tiges se produit par temps chaud et humide accompagné de fortes rosées ou pluies. Le mildiou peut se développer assez rapidement au milieu ou à la fin de la saison et est plus grave lorsque les plantes sont stressées par une mauvaise nutrition, la sécheresse ou d'autres parasites. L'infection des tubercules de pomme de terre se produit par des ouvertures naturelles sur la peau ou par des blessures. Les tubercules peuvent entrer en contact avec les spores pendant la récolte et les lésions peuvent continuer à se développer pendant le stockage.
TOMCAST (Jim Jasinski, coordinateur TOMCAST pour l'OHIO, l'INDIANA et le MICHIGAN)
Contexte
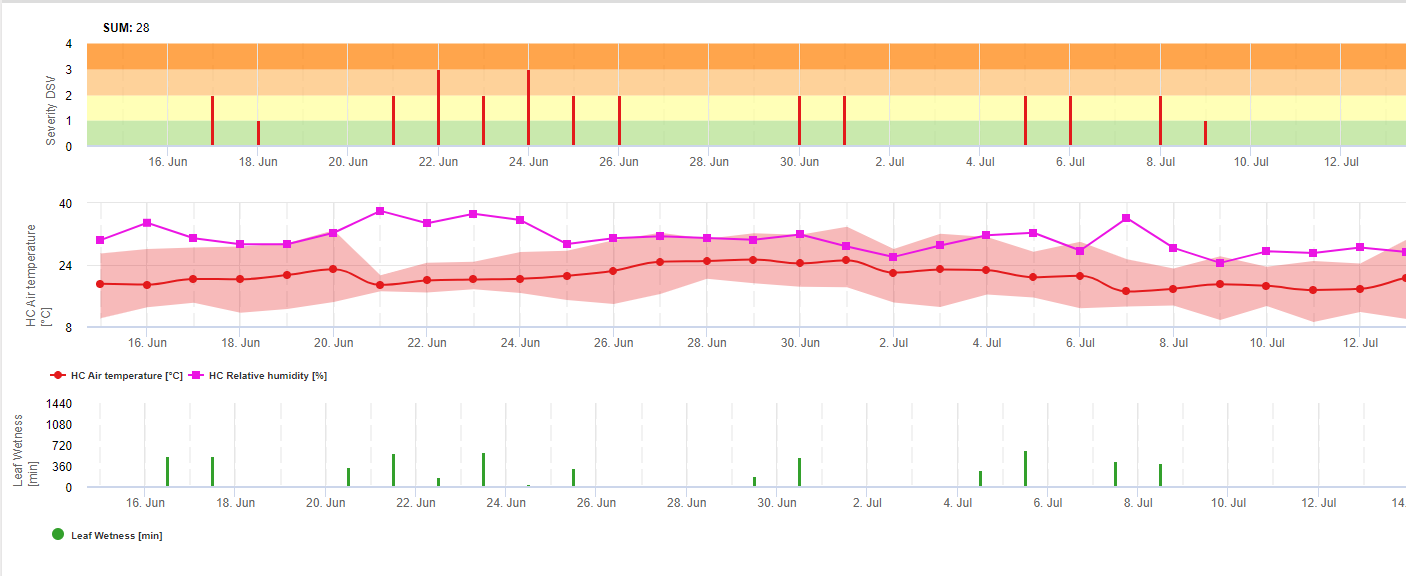
TOMCAST (TOMato disease foreCASTing) est un modèle informatique basé sur des données de terrain qui tente de prévoir le développement de maladies fongiques, à savoir le mildiou, la tache septorienne et l'anthracnose sur les tomates. Les enregistreurs de données placés sur le terrain enregistrent données horaires sur l'humidité et la température des feuilles. Ces données ont été analysées sur une période de 24 heures et peuvent donner lieu à l'établissement d'une liste de contrôle. formation d'une valeur de gravité de la maladie (DSV) ; il s'agit essentiellement d'une augmentation du développement de la maladie. Au fur et à mesure que les DSV s'accumulent, la pression de la maladie continue de s'exercer sur la culture. Lorsque le nombre de DSV accumulés dépasse l'intervalle de pulvérisation, une application de fongicide est recommandée pour soulager la pression de la maladie.
TOMCAST
Calendrier des applications de fongicides pour le mildiou, la tache septorienne et l'anthracnose.
Un système de prévision des maladies basé sur les conditions météorologiques appelé TOMCAST, mis au point par le Dr Ron Pitblado du Ridgetown College of Agricultural Technology en Ontario, au Canada, peut être utilisé pour programmer les applications de fongicides contre trois maladies fongiques : le mildiou (causé par Alternaria solani), la tache septorienne (causée par Septoria lycopersici) et l'anthracnose des fruits (causée par Colletotrichum coccodes). Si le mildiou est présent dans votre comté ou dans les comtés adjacents, ou si les conditions sont réunies pour un déplacement des spores dans votre région, utilisez le système de prévision du mildiou Simcast pour planifier les applications de fongicides.
NOTE D'AVERTISSEMENT IMPORTANTE :
TOMCAST n'est pas utile dans les exploitations qui ont des antécédents de maladies bactériennes. Si vous avez souvent des problèmes de taches, de mouchetures ou de chancres bactériens dans vos tomates, vous ne devriez pas utiliser TOMCAST parce que les intervalles de pulvérisation recommandés ne seront pas suffisants pour lutter contre les maladies bactériennes si vous mélangez du cuivre en réservoir avec vos applications de fongicides. Vous trouverez des informations sur la réduction des maladies bactériennes ici : http://extension.psu.edu/plants/vegetable-fruit/news/2015/farming-like-you-expect-bacterial-diseases
TOMCAST utilise les données d'humidité et de température des feuilles pour calculer les valeurs de gravité de la maladie (DSV), comme indiqué dans le tableau 1.
TOMCAST est dérivé du modèle original F.A.S.T. (Forecasting Alternaria solani on Tomatoes) développé par les docteurs Madden, Pennypacker et MacNab ? à l'Université d'État de Pennsylvanie (PSU). Le modèle F.A.S.T. de la PSU a été modifié par le Dr Pitblado au Ridgetown College en Ontario pour devenir le modèle TOMCAST utilisé par Ohio State University Extension.
DSV Une valeur de gravité de la maladie (VSD) est l'unité de mesure donnée à une augmentation spécifique du développement de la maladie (mildiou). En d'autres termes, une valeur de gravité de la maladie est une représentation numérique de la rapidité ou de la lenteur avec laquelle la maladie (mildiou) s'accumule dans un champ de tomates. Le DSV est déterminé par deux facteurs : l'humidité des feuilles et la température pendant les heures d'humidité des feuilles. Plus le nombre d'heures de mouillage des feuilles et la température augmentent, plus la DSV s'accumule rapidement. Voir le tableau des valeurs de gravité des maladies ci-dessous.
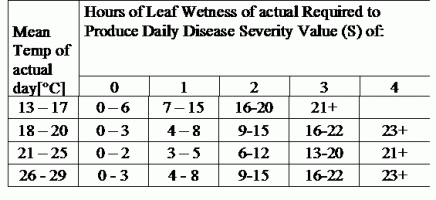
À l'inverse, lorsqu'il y a moins d'heures de mouillage des feuilles et que la température est plus basse, les DSV s'accumulent lentement, voire pas du tout. Lorsque le nombre total de DSV accumulés dépasse une limite prédéfinie, appelée intervalle ou seuil de pulvérisation, une pulvérisation de fongicide est recommandée pour protéger le feuillage et les fruits du développement de la maladie.

L'intervalle de pulvérisation (qui détermine quand vous devez pulvériser) peut varier entre 15 et 20 DSV. Le DSV exact qu'un producteur doit utiliser est généralement fourni par le transformateur et dépend de la qualité du fruit. Suivre un intervalle de pulvérisation de 15 DSV est une utilisation conservatrice du système TOMCAST, ce qui signifie que vous pulvériserez plus souvent qu'un producteur qui utilise un intervalle de pulvérisation de 19 DSV avec le système TOMCAST. Le compromis se situe au niveau du nombre de pulvérisations appliquées pendant la saison et de la différence potentielle de qualité des fruits.
UTILISATION DE TOMCAST
Les tomates cultivées dans un rayon de 15 km d'une station de déclaration devraient bénéficier de la fonction de gestion des maladies de TOMCAST pour aider à prévoir le mildiou, la septoriose et l'anthracnose. Si vous décidez d'essayer TOMCAST cette saison, gardez à l'esprit trois concepts très importants.
Un : Si vous utilisez le système pour la première fois, il est recommandé de ne mettre qu'une partie de votre superficie dans le programme pour voir comment il s'adapte à vos normes de qualité et à votre style d'exploitation.
Deuxièmement, utilisez TOMCAST comme guide pour mieux planifier les applications de fongicides, en sachant que dans certaines saisons, vous pouvez appliquer plus de produit que ce qu'exige un programme fixe.
Troisièmement : Plus un champ de tomates est éloigné d'un site de déclaration, plus la probabilité de distorsion dans l'accumulation des DSV augmente, c'est-à-dire que la valeur déclarée peut être supérieure ou inférieure de quelques DSV à celle enregistrée par le site du champ. Cela doit être pris en considération lorsque l'application de fongicides est susceptible de se faire dans quelques jours. La meilleure façon d'estimer approximativement votre accumulation de DSV est d'écouter les rapports de DSV des stations voisines et de trianguler avec votre propre emplacement.
PREMIÈRE PULVÉRISATION À L'AIDE DE TOMCAST
Il y a eu quelques discussions au cours des années concernant l'application de la première pulvérisation lorsque l'on suit TOMCAST. La règle énoncée dans le Guide de la production maraîchère de 1997 est centrée sur la date de plantation.
Les plants de tomates qui entrent dans le champ avant le 20 mai doivent faire l'objet d'une première pulvérisation lorsque la DSV pour cette zone dépasse 25 ou lorsqu'une date de sécurité intégrée arrive le 15 juin. La date limite n'est utilisée que si vous n'avez pas traité depuis le 20 mai, et c'est un moyen d'éliminer l'inoculum initial de la maladie. Après la première pulvérisation, ces tomates sont ensuite traitées lorsque l'intervalle de pulvérisation choisi (fourchette 15-20 DSV) est dépassé.
Les tomates plantées après le 20 mai sont traitées lorsqu'elles dépassent l'intervalle de pulvérisation choisi (entre 15 et 20 DSV) ou lorsqu'elles n'ont pas été traitées à la date limite du 15 juin. Par conséquent, il est essentiel de comparer la date de plantation des tomates à la date à laquelle les rapports sur le DSV ont commencé dans cette région pour guider le processus de décision concernant la pulvérisation.
Maladie de la jambe noire
Cycle de la maladie
La maladie a quatre étapes principales sur le colza d'hiver :
1. Les sources d'infection les plus importantes pour les plantes nouvellement émergées sont les spores aériennes produites sur les chaumes de colza après la récolte. Les corps fructifères qui produisent des spores aéroportées ont besoin d'environ 20 jours de pluie pour arriver à maturité ; par exemple, les spores ont été libérées tôt après le mois d'août humide en 2005 et en 2006, mais tardivement en 2003 lorsque ce mois était sec.
2. Les spores transportées par l'air, libérées principalement les jours de pluie, infectent les feuilles pour produire le stade de la tache foliaire. Les symptômes apparaissent après 5-7 jours à 15-20°C mais prennent plus de 30 jours pour se développer à 3°C.
3. Aucun symptôme n'est visible pendant que le champignon se développe à partir de la tache foliaire, le long du pétiole, jusqu'à la tige. La vitesse de croissance le long du pétiole peut atteindre 5 mm/jour à 15-20°C mais ralentit à 1 mm/jour à 3-5°C. Les fongicides ne permettent pas de lutter contre le champignon une fois que la tige est infectée.
4. Le champignon se propage à l'intérieur de la tige, entraînant des symptômes visibles de chancre de la tige environ six mois après l'infection des feuilles. Les taches foliaires précoces entraînent des chancres précoces de la tige, qui sont les plus susceptibles de réduire le potentiel de rendement.
Comprendre les variations
Les conditions météorologiques : Les précipitations d'août et de septembre sont le facteur clé qui détermine l'apparition des taches foliaires. Des précipitations supérieures à la moyenne, en particulier en août, indiquent un risque précoce.
Biologie
Leptosphaeria maculans ou Phoma lingam survit à la période interculturelle sous forme de mycélium et de pseudothèces dans les résidus de culture. Au Canada, les tissus foliaires ne persistent pas assez longtemps pour permettre aux pseudothèces de se développer, mais des pseudothèces se forment sur les tissus des tiges basales. A maturité, les pseudothèces produisent des ascospores.
Les ascospores du champignon sont libérées après une pluie, lorsque les températures sont comprises entre 8 et 12ºC/46-54ºF. Ces spores peuvent être dispersées par le vent sur des centaines de mètres. Les pycnides peuvent facilement passer l'hiver dans les chaumes, mais comme les pycnidiospores ne sont pas transportées dans l'air de manière significative, elles n'ont qu'une importance mineure dans le déclenchement du premier cycle de la maladie.
Les ascospores germent en présence d'eau libre entre 4 et 28 ºC (40-82 ºF). La pénétration se fait par les stomates. Le pathogène peut également être transmis par les semences. Les semences peuvent être infectées et/ou infestées par le pathogène. Les semences infectées peuvent donner naissance à des plantules infectées, mais les niveaux de contamination des semences sont toujours très faibles. Les infections primaires se produisent généralement sur les cotylédons ou les feuilles de la rosette basale de la plante. Le temps humide favorise ces infections primaires.
Le champignon envahit les espaces intercellulaires entre les couches palissadiques et épidermiques de la feuille. Cette phase biotrophe sans symptôme est suivie d'une invasion du mésophylle avec la mort des cellules et l'apparition de lésions gris-vert. Les hyphes continuent à se ramifier dans le tissu foliaire jusqu'à ce qu'ils atteignent une veine de la feuille. Le champignon colonise alors le cortex et/ou le parenchyme du xylème du pétiole. À la jonction du pétiole et de la tige, le champignon envahit le cortex de la tige où il provoque un chancre. C'est à ce stade que la résistance de la tige s'exprime et détermine la capacité de la maladie à passer à la phase dommageable du chancre de la tige. Les chancres de la tige se forment lorsque les plantes débourrent (produisent une tige droite à partir de la rosette sur laquelle se forment les fleurs). Les chancres de la tige se développent plus rapidement à 20-24ºC/68-75ºF et sont plus sévères dans des conditions de stress telles que des blessures mécaniques, d'insectes ou d'herbicides.
Les pycnidiospores (conidies) sont libérées. des pycnides dans des conditions humides dans un mucilage, une solution aqueuse et collante. Ces spores sont responsables des cycles secondaires de la maladie, mais les ascospores sont la source d'inoculum la plus importante car elles sont plus infectieuses et se propagent dans l'air.
Les pynidiospores sont dispersées vers de nouveaux sites d'infection par les éclaboussures de pluie. Les pycnidiospores germent plus lentement que les ascospores et nécessitent plus de 16 heures d'humidité continue à la température optimale de 20-25ºC/68-77ºF. La période de latence minimale (temps écoulé entre l'infection et la production d'un nouvel inoculum) après une infection par des pycnidiospores est de 13 jours. Bien que des infections secondaires par des pycnidiospores se produisent, la plupart des pertes sont dues à des infections primaires des feuilles par des ascospores qui conduisent à des chancres basaux de la tige et finalement à la verse des plantes.
Modèle pour la première infection possible à l'automne
Le développement d'une épidémie de chancre de la tige du phoma est séparé en trois étapes.
1) Dans le première étapeLa date à laquelle les épidémies de taches foliaires du phoma commencent en automne a été prédite à partir des données météorologiques de l'été. Le chancre de la tige du phoma étant une maladie monocyclique (un cycle par saison de croissance), la date à laquelle les taches foliaires commencent à se développer en automne est un facteur crucial qui affecte la sévérité des épidémies de chancre de la tige du phoma sur les tiges l'été suivant (West et al. 2001). La date à laquelle les taches foliaires du phoma commencent à se développer en automne est estimée à partir de la température et de la pluviométrie pendant la période intercalaire entre la récolte de la culture précédente et l'établissement de la nouvelle culture. Lorsqu'il pleut environ 4 mm, la maladie des pattes noires apparaît un jour plus tôt et l'impact de la température est plus important au début de la période, au milieu de l'été, qu'à l'automne.
Si l'infection par les ascospores est possible grâce au climat automnal, nous devons rechercher les besoins climatiques de l'infection par les ascospores.
2) Dans ce deuxième étape nous pouvons rechercher des ascospores matures. Pour que les ascospores mûrissent, il faut, en fonction de la température, plus de 288 heures de température de l'air comprise entre 5 et 25°C et une humidité relative supérieure à 85%. Il faut maintenant 4 mm de pluie ou plus pour distribuer les ascospores. Une période d'humectation des feuilles doit déclencher l'infection des ascopores et peut être achevée en 8 heures à une température optimale.
Vers la fin de l'automne et au printemps, des conidies peuvent se former sur les lésions matures de la maladie des jambes noires.
3) Dans le troisième étape il faut s'attendre à des infections de conidies, qui sont déclenchées par une période d'humidité des feuilles et qui sont complétées par des périodes d'humidité relative supérieure à 85% pendant plus de 8 heures à la température optimale.
Utilisation pratique des modèles de jambe noire
Le modèle de la jambe noire commence par l'évaluation de la possibilité d'une infection de la jambe noire à la fin de l'été et au début de l'automne. Cette partie du modèle peut être utilisée comme un pronostic négatif. Il a été testé pour le climat britannique afin d'estimer la première apparition de la maladie de la jambe noire. P. lingam des infections. Ce modèle est valable pour les climats frais et humides. Il doit être utilisé avec prudence dans les climats continentaux comme la Hongrie ou l'Autriche. Les modèles de maturation des ascospores, de réalisation des ascospores et d'infection par les ascospores montrent des infections possibles par les ascospores pendant l'automne. Ces modèles sont basés sur la biologie du pathogène et montreront très probablement plus d'infections d'ascospores que ce que l'on peut trouver sur le terrain. Ceci est dû au fait que sur base des données climatiques, nous ne savons rien de la densité de l'inoculum et des précroissances des champs de colza. Quoi qu'il en soit, si un ou plusieurs infecitons d'ascospores sont introduits dans les stades sensibles de la plante après l'émergence, des infections par P. lingam se produiront et des infections secondaires par conidies sont à prévoir pendant les périodes chaudes et humides de l'automne ou du printemps.
Les infections par conidies sont indiquées en raison des périodes d'humidité des feuilles nécessaires à l'infection par conidies.
Maladie de la septoriose
Il existe deux principales maladies du blé dues à la septoriose. Il s'agit de la tache Septoria tritici, provoquée par le champignon Septoria tritici (téléomorphe : Mycophaerella graminicola) et Septoria nodorum blotch, causée par le champignon Septoria nodorum (téléomorphe : Leptosphaeria nodorum). Ces deux maladies entraînent de graves pertes de rendement allant de 31 à 53 pour cent (Eyal, 1981 ; Babadoost et Herbert, 1984 ; Polley et Thomas, 1991). Dans le monde entier, plus de 50 millions d'hectares de blé, poussant principalement dans les régions à forte pluviométrie, sont touchés. Au cours des 25 dernières années, ces maladies ont augmenté et sont devenues un facteur limitant majeur de la production de blé dans certaines régions. En cas d'épidémies graves, les grains des cultivars de blé sensibles sont ratatinés et impropres à la mouture. Les épidémies de Septoria tritici et de Septoria nodorum sont associées à des conditions climatiques favorables (pluies fréquentes et températures modérées), à des pratiques culturales spécifiques, à la disponibilité d'inoculum et à la présence de cultivars de blé sensibles (Eyal et al., 1987).
Septoria spp. Biologie
Suite à Erick De Wolf, Septoria Tritici Blotch, Kansas State University, avril 2008 Septoria tritici est causée par un champignon, l'acarien, qui est à l'origine de la tache des feuilles. Septoria tritici. Elle est présente dans toutes les zones de culture du blé du monde et constitue un problème sérieux dans de nombreuses régions. La tache Septoria tritici est la plus dommageable lorsque la maladie attaque les feuilles supérieures et les épis des variétés sensibles en fin de saison.
Symptômes
Septoria tritici Les symptômes de la tache noire apparaissent pour la première fois à l'automne. Les premiers symptômes sont de petites taches jaunes sur les feuilles. Ces lésions deviennent souvent légèrement bronzées en vieillissant, et les fructifications fongiques peuvent être observées dans les lésions sur les tiges. Les lésions sont de forme irrégulière et varient d'elliptiques à longues et étroites (figure 1). Les lésions contiennent de petites taches rondes et noires qui sont les fructifications du champignon. Les fructifications noires ressemblent à des grains de poivre noir et peuvent généralement être vues sans l'aide d'une loupe. La maladie commence sur les feuilles inférieures et progresse progressivement jusqu'à la feuille étendard. Les gaines des feuilles sont également susceptibles d'être attaquées. Les années humides, le champignon de la tache mouchetée peut se déplacer sur les têtes et provoquer des lésions brunes sur les glumes et les aulnes, connues sous le nom de tache des glumes. Ces lésions deviennent souvent légèrement bronzées en vieillissant et les fructifications fongiques sont souvent visibles dans les lésions sur les aulnes.
La phase de la tache des glumes peut entraîner une perte de rendement importante, mais la relation entre la gravité de la maladie et la perte de rendement n'est pas bien comprise. Septoria tritici peut être confondue avec d'autres maladies foliaires qui présentent des symptômes très similaires : la tache bronzée et la tache de l'épinette. Stagonspora nodorum par exemple. Il est fréquent que les plantes soient infectées par plusieurs de ces maladies foliaires, et il peut être nécessaire de procéder à des examens de laboratoire pour diagnostiquer avec précision les maladies les plus répandues. Un examen en laboratoire est presque toujours nécessaire pour déterminer la cause de la tache des glumes. La connaissance de l'espèce n'est pas importante pour les décisions de pulvérisation, car les trois maladies réagissent de la même manière aux fongicides. Cependant, le fait de savoir quelles sont les maladies les plus répandues est un élément important de la sélection des variétés, car différents gènes contrôlent la résistance aux maladies.
La manière la plus fiable de distinguer la tache septoriale des autres maladies est la présence de fructifications noires. Le champignon responsable de la tache bronzée ne produit pas ce type de structure reproductive. En revanche, dans des conditions humides, le champignon responsable de la tache Stagonospora nodorum produit des fructifications brun clair. Outre la différence de couleur, ces structures sont également plus petites que celles produites par Septoria tritici.
Cycle de vie
Septoria tritici survit pendant l'été sur les résidus d'une culture de blé précédente et commence les infections à l'automne. Il existe des preuves que le champignon est capable de survivre en association avec d'autres graminées hôtes et des semences de blé. Ces sources du champignon sont probablement les plus importantes lorsque les résidus de blé sont absents. Indépendamment des pratiques de rotation ou de gestion des résidus, il y a généralement suffisamment d'inoculum pour déclencher des infections à l'automne. Septoria tritici est favorisée par un temps frais et humide. La température optimale se situe entre 16 et 21 °C ; cependant, des infections peuvent se produire pendant les mois d'hiver à des températures aussi basses que 5 °C. L'infection nécessite au moins 6 heures d'humidité des feuilles, et jusqu'à 48 heures d'humidité pour une infection maximale. Une fois que l'infection a eu lieu, le champignon met 21 à 28 jours pour développer les fructifications noires caractéristiques et produire une nouvelle génération de spores. Les spores produites dans ces corps fructifères sont exsudées en masses collantes et il faut de la pluie pour les projeter sur les feuilles supérieures et les têtes.
Infection par Septoria tritici
Pycnidiospores de S. tritici germent dans l'eau libre à partir des deux extrémités de la spore ou des cellules intercalaires (Weber, 1922). La germination des spores ne commence qu'environ 12 heures après le contact avec la feuille. Les tubes germinatifs se développent au hasard sur la surface de la feuille. Weber (1922) n'a observé qu'une pénétration directe entre les cellules épidermiques, mais d'autres ont conclu que la pénétration à travers les stomates ouverts et fermés est le principal moyen de pénétration de l'hôte (Benedict, 1971 ; Cohen et Eyal, 1993 ; Hilu et Bever, 1957). Kema et al. (1996) n'ont observé que la pénétration stomatique. Les hyphes qui se développent à travers les stomates se resserrent jusqu'à un diamètre d'environ 1 μm, puis s'élargissent après avoir atteint la cavité sous-matale.
Les hyphes se développent parallèlement à la surface de la feuille sous les cellules épidermiques, puis à travers le mésophylle jusqu'aux cellules de l'épiderme inférieur, mais pas dans l'épiderme. Il n'y a pas de formation d'haustoria et la croissance des hyphes est limitée par les cellules du sclérenchyme autour des faisceaux vasculaires, sauf lorsque les hyphes sont très denses. Les faisceaux vasculaires ne sont pas envahis. Les hyphes se développent de manière intercellulaire le long des parois cellulaires à travers le mésophylle, se ramifiant au niveau d'un septum ou du milieu d'une cellule. Aucun symptôme macroscopique n'apparaît pendant environ 9 jours, à l'exception d'une cellule morte occasionnelle, mais les cellules du mésophylle meurent rapidement après 11 jours. Les pycnides se développent dans des chambres sous-matricielles. Les hyphes se développent rarement dans les cellules de l'hôte (Hilu et Bever, 1957 ; Kema et al, 1996 ; Weber, 1922).
L'infection ne réussit qu'après au moins 20 heures d'humidité élevée. Seules quelques mouchetures brunes se développent si les feuilles restent humides pendant 5-10 heures après le dépôt des spores (Holmes et Colhoun, 1974) ou jusqu'à 24 heures (Kema et al., 1996). Les relations hôte-parasite sont les mêmes sur les blés résistants ou sensibles. La germination des spores à la surface des feuilles est la même quelle que soit la sensibilité. Le nombre de pénétrations réussies est à peu près le même, mais la croissance des hyphes est plus rapide chez les cultivars sensibles, ce qui entraîne un plus grand nombre de lésions. Les hyphes s'étendent au-delà de la zone nécrosée chez tous les cultivars. Une toxine peut jouer un rôle dans la pathogenèse (Cohen et Eyal, 1993 ; Hilu et Bever, 1957). En revanche, la colonisation a été fortement réduite sur une lignée résistante (Kema et al., 1996).
Stagonospora (Septoria) et Septoria pathogènes des céréales : Le processus d'infection
B.M. Cunfer, Département de pathologie végétale, Université de Géorgie, Griffin, GA
Le processus d'infection a fait l'objet des études les plus approfondies pour Stagonospora (Septoria) nodorum et Septoria tritici. Une étude approfondie sur Septoria passerinii est disponible. Presque toutes les informations rapportées concernent l'infection par les pycnidiospores. Cependant, le processus d'infection pour d'autres formes de spores est assez similaire. Les informations présentées concernent principalement l'infection des feuilles dans des conditions optimales. Certaines études ont été réalisées avec des plants intacts, tandis que d'autres ont été réalisées avec des feuilles détachées. Infection du coléoptile et de la plantule de blé par des S. nodorum a été décrite en détail par Baker (1971) et analysée par Cunfer (1983). Bien qu'aucune comparaison précise n'ait été faite, il semble que le processus d'infection présente de nombreuses similitudes dans chaque système hôte-parasite et soit typique de nombreux pathogènes nécrotrophes. Les informations sur les facteurs influençant le développement des symptômes et l'expression de la maladie sont exclues mais ont été examinées par d'autres auteurs (Eyal et al., 1987 ; King et al., 1983 ; Shipton et al., 1971). Un résumé des facteurs affectant la longévité des spores à la surface des feuilles est inclus.
Rôle des cirrus et survie des spores sur la surface de la feuille Les informations les plus détaillées sur la fonction du cirrus enveloppant les pycnidiospores exsudées par le pycnidium sont pour S. nodorum. Le cirrus est un gel composé d'éléments protéiques et saccharidiques. Sa composition et sa fonction sont similaires à celles d'autres champignons des Sphaeropsidales (Fournet, 1969 ; Fournet et al., 1970 ; Griffiths et Peverett, 1980). Les rôles principaux des composants du cirrus sont la protection des pycnidiospores contre la dessiccation et la prévention de la germination prématurée.
Le cirrus protège les pycnidiospores de telle sorte que certaines restent viables pendant au moins 28 jours (Fournet, 1969). Lorsque le cirrus est dilué avec de l'eau, si la concentration de la solution de cirrus est >20%, moins de 10% de pycnidiospores germent. À une concentration plus faible, les composants fournissent des nutriments qui stimulent la germination des spores et l'allongement des tubes germinatifs. La longueur des tubes germinatifs augmente jusqu'à une concentration de 15% cirrus, puis diminue modérément à des concentrations plus élevées (Harrower, 1976). Brennan et al. (1986) ont rapporté une germination plus importante dans un cirrus dilué. Les composants du cirrus réduisent la germination à 10-60% d'humidité relative. Une fois que les spores sont dispersées, les effets stimulants du liquide de cirrus sont probablement négligeables (Griffiths et Peverett, 1980).
À une humidité relative de 35-45%, les spores de S. tritici dans les cirres sont restées viables pendant au moins 60 jours (Gough et Lee, 1985). Les composants du cirrus peuvent agir comme un inhibiteur de la germination des spores, ou le potentiel osmotique élevé du cirrus peut empêcher la germination. Les pycnidiospores de S. nodorum n'ont pas survécu pendant 24 heures à une humidité relative supérieure à 80% à 20 C. Les spores ont survécu deux semaines ou plus à une humidité relative <10% (Griffiths et Peverett, 1980). Lorsque le fluide de cirrus de S. nodorum diluées dans l'eau, environ deux tiers des pycnidiospores ont perdu leur viabilité en 8 heures, et après 30 heures à la lumière du jour, seules 5% ont germé. Lorsque les spores sont conservées dans l'obscurité, 40% restent viables après 30 heures (Brennan et al., 1986).
Conidies sèches de S. nodorumLes pycnidiospores de S. nodorum, à l'ombre et en plein soleil, ont survécu à l'extérieur pendant au moins 56 heures (Fernandes et Hendrix, 1986a). La germination des pycnidiospores de S. nodorum a été inhibée par des UV-B continus (280-320 nm), alors que la germination des pycnidiospores de S. nodorum a été inhibée par des UV-B continus (280-320 nm). S. tritici ne l'était pas. L'extension des tubes germinatifs sous UV-B continu a été inhibée pour les deux champignons, par rapport à l'obscurité (Rasanayagam et al., 1995).
Infection par Septoria nodorum
Le processus de pénétration de l'hôte et le développement des S. nodorum La pénétration des pycnidiospores dans la feuille a été examinée en détail par plusieurs chercheurs (Baker et Smith, 1978, Bird et Ride, 1981, Karjalainen et Lounatmaa, 1986 ; Keon et Hargreaves, 1984 ; Straley, 1979 ; Weber, 1922). Les pycnidiospores ont tendance à se loger dans les dépressions entre deux cellules épidermiques, et de nombreuses tentatives de pénétration des feuilles commencent par là. Les spores germent à la surface des feuilles en réponse à l'humidité libre (Fernandes et Hendrix, 1986b). Elles commencent à germer 2-3 heures après le dépôt, et après 8 heures la germination peut atteindre 90%. La pénétration des feuilles commence environ 10 heures après le dépôt des spores (Bird et Ride, 1981 ; Brönnimann et al., 1972 ; Holmes et Colhoun, 1974).
Au début de la germination, le tube germinatif est entouré d'une matière amorphe qui s'attache à la feuille. Les tubes germinatifs qui poussent à partir des deux extrémités d'une spore et des cellules intercalaires ont tendance à se développer le long des dépressions entre les cellules et sont souvent orientés le long de l'axe long de la feuille (O'Reilly et Downes, 1986). Les hyphes provenant de spores qui ne sont pas dans des dépressions poussent de manière aléatoire avec des ramifications occasionnelles (Straley, 1979). Un appressorium se forme avec une tige d'infection qui pénètre la cuticule et les parois périclinales des cellules épidermiques directement dans le lumen cellulaire, ce qui entraîne la mort rapide des cellules.
De nombreuses pénétrations sont d'abord subcuticulaires ou la croissance latérale d'un hyphe se produit à l'intérieur de la paroi cellulaire avant la croissance dans le cytoplasme (Bird et Ride, 1981 ; O'Reilly et Downes, 1986). La pénétration à travers les stomates ouverts ou fermés se produit également et peut être plus rapide que la pénétration directe (Harrower, 1976 ; Jenkins, 1978 ; O'Reilly et Downes, 1986 ; Straley, 1979). Les tubes germinatifs se ramifient au niveau des stomates et des jonctions de cellules épidermiques. La pénétration d'un tube germinatif dans un stomate peut se produire sans formation d'un appressorium. La pénétration se fait parfois à travers les trichomes (Straley, 1979). Apparemment, la plupart des tentatives de pénétration échouent, des papilles denses se formant dans les cellules au site de la tentative de pénétration (Karjalainen et Lounatmaa, 1986 ; Bird et Ride, 1981).
Après la pénétration, les cellules épidermiques meurent rapidement et se lignifient, et les hyphes se développent dans le mésophylle. Les cellules du mésophylle se déforment et du matériel lignifié se dépose à l'extérieur de certaines cellules, qui s'effondrent alors. La lignification se produit avant que les hyphes n'atteignent la cellule. Le processus est le même dans tous les cultivars mais se développe plus lentement dans les cultivars résistants. Les hyphes se développent de manière intercellulaire entre les cellules épidermiques, puis dans le mésophylle. Lorsque le mésophylle est pénétré, la détérioration des chloroplastes commence en 6-9 jours (Karjalainen et Lounatmaa, 1986).
Cependant, le taux de photosynthèse commence à diminuer un jour après l'infection et avant que les symptômes ne soient visibles (Krupinsky et al, 1973). Le sclérenchyme entourant les faisceaux vasculaires empêche l'infection des tissus vasculaires. Les faisceaux vasculaires bloquent la dissémination des hyphes à travers le mésophylle, sauf lorsque le tissu sclérenchyme est jeune et pas complètement formé (Baker et Smith, 1978).
Stagonospora nodorum libère une large gamme d'enzymes dégradant les parois cellulaires, y compris l'amylase, la pectine méthyl estérase, les polygalacturonases, les xylanases et la cellulase in vitro et pendant l'infection des feuilles de blé (Baker, 1969 ; Lehtinen, 1993 ; Magro, 1984). Les informations relatives à la dégradation des parois cellulaires par les enzymes sont en accord avec les observations histologiques. Ces enzymes peuvent agir en conjonction avec les toxines. La sensibilité aux enzymes peut être liée à la résistance et au taux de colonisation fongique (Magro, 1984). Comme de nombreux nécrotrophes, les pathogènes Septoria et Stagonospora produisent des composés phytotoxiques in vitro. La détérioration et la mort des cellules avant la croissance des hyphes dans le tissu mésophylle (Bird et Ride, 1981) sont compatibles avec la production de toxines. Cependant, le rôle définitif des toxines dans le processus d'infection et leur relation avec la résistance de l'hôte n'ont pas été établis (Bethenod et al, 1982 ; Bousquet et al, 1980 ; Essad et Bousquet, 1981 ; King et al, 1983). Les différences de gamme de plantes-hôtes entre les souches de S. nodorum peut être liée à la production de toxines (Bousquet et Kollmann, 1998). L'initiation de la germination des spores et le pourcentage de spores germées ne sont pas influencés par la sensibilité de l'hôte (Bird et Ride, 1981 ; Morgan 1974 ; Straley, 1979 ; Straley et Scharen, 1979 ; Baker et Smith, 1978).
Bird et Ride (1981) signalent que l'extension des tubes germinatifs à la surface des feuilles est plus lente sur les cultivars résistants que sur les cultivars sensibles. Ce mécanisme, qui s'exprime au moins 48 heures après le dépôt des spores, indique une résistance à l'élongation des tubes germinatifs avant la pénétration. Il y a eu moins de pénétrations réussies chez les cultivars résistants, et la pénétration s'est déroulée plus lentement sur les cultivars résistants (Baker et Smith, 1978 ; Bird et Ride, 1981). La lignification a été proposée pour limiter l'infection dans les cultivars résistants et sensibles, mais d'autres facteurs ont ralenti le développement du champignon dans les lignées résistantes. Dans les lignées sensibles, les hyphes à croissance plus rapide peuvent échapper à la lignification des cellules hôtes. Quatre jours après l'inoculation de l'orge avec un isolat de S. nodorumLes hyphes de pénétration se développent à travers la cuticule et parfois dans les couches externes de cellulose des parois cellulaires épidermiques. Des papilles épaisses se sont déposées sous les hyphes de pénétration et les cellules n'ont pas été pénétrées (Keon et Hargreaves, 1984).
Infection par Septoria passerinii : Green et Dickson (1957) présentent une description détaillée du processus d'infection du S. passerinii sur l'orge. Le processus d'infection est similaire à celui de la S. tritici. Comme pour S. tritici, le temps nécessaire à la pénétration des feuilles est considérablement plus long que pour S. tritici. S. nodorum. Les tubes germinatifs se ramifient et se développent sur la surface de la feuille au hasard, mais parfois le long des dépressions entre les cellules épidermiques. La pénétration des feuilles se fait presque exclusivement par les stomates. Les hyphes de germination se gonflent et, si la pénétration échoue, les hyphes continuent à s'allonger. Il n'y a pas de pénétration 48 heures après le dépôt des spores. Après 72 heures, les tubes germinatifs s'épaississent au-dessus des stomates, se développent entre les cellules de garde et sur les faces des cellules accessoires et dans les cavités sous-matales. La pénétration directe entre les cellules épidermiques n'est que rarement observée.
La germination des spores et la pénétration de l'hôte sont les mêmes sur les cultivars résistants et sensibles. L'extension des hyphes à l'intérieur des feuilles est beaucoup moins importante sur les cultivars résistants et des papilles sont observées sur de nombreuses parois cellulaires, mais pas sur toutes. Les hyphes se développent sous l'épiderme d'un stomate à l'autre, mais ne pénètrent pas entre les cellules épidermiques. Le mésophylle est colonisé, mais aucun haustoria ne se forme. Après la nécrose des cellules du mésophylle, les cellules de l'épiderme s'effondrent. Le développement mycélien dans la feuille est peu abondant et généralement bloqué par les faisceaux vasculaires. Dans les feuilles plus jeunes, si la gaine vasculaire est moins développée, les hyphes passent entre le faisceau et l'épiderme. Les pycnides se forment dans les cavités sous-matales, principalement sur la face supérieure des feuilles (Green et Dickson, 1957).
Facteurs affectant la longévité des spores Parmi les pathogènes Stagonospora et Septoria des céréales, des informations définitives sur le processus d'infection n'ont été rapportées que pour le Stagonospora et le Septoria. S. nodorum, S. triticiet S. passerinii. Comme beaucoup d'autres pathogènes nécrotrophes, aucun de ces deux groupes de pathogènes ne provoque de réaction hypersensible. Une différence significative dans le processus d'infection entre les pathogènes Septoria et Stagonospora est que la germination et la pénétration des spores se déroulent beaucoup plus rapidement pour les Septoria et les Stagonospora. S. nodorum que pour S. tritici et S. passerinii. Cela a une influence significative sur l'épidémiologie des maladies.
Les agents pathogènes de la septoriose pénètrent dans la plante principalement par les stomates, tandis que les agents pathogènes de la S. nodorum pénètre à la fois directement et à travers les stomates. S. nodorum pénètre et tue rapidement les cellules de l'épiderme, mais S. tritici et S. passerinii ne tuent pas les cellules épidermiques avant que les hyphes ne se soient ramifiées à travers le mésophylle de la feuille et qu'une nécrose rapide ne commence. Les études histologiques de la croissance fongique après la pénétration de l'hôte correspondent aux données générées par les études épidémiologiques de la résistance de l'hôte. La résistance ralentit le taux de colonisation de l'hôte mais n'a pas d'effet appréciable sur le processus de développement des lésions.
Les mécanismes contrôlant la réponse de l'hôte, qu'ils soient liés aux enzymes et aux toxines ou à d'autres métabolites libérés par les pathogènes au cours de l'infection, ne sont pas encore clairs. Il existe peu d'informations sur l'infection par les ascospores. Le processus d'infection est probablement très similaire à celui des pycnidiospores. Les ascospores de Phaeosphaeria nodorum germent dans une large gamme de températures, et leurs tubes germinatifs pénètrent directement dans la feuille. Cependant, selon Rapilly et al. (1973), les ascospores, contrairement aux pycnidiospores, ne germent pas dans l'eau libre.
Modèle d'infection par Septoria spp.
Les infections par la septoriose sont possibles à des températures basses, alors que les températures inférieures à 7°C peuvent ne pas conduire à une infection dans les 2 jours. La température optimale de la maladie est atteinte dans une zone de 16 à 21°C. Les infections sont possibles pendant une période d'humidité relative élevée ou d'humidification des feuilles de 14 heures ou plus. Pour répondre à ces conditions, nous avons décidé de séparer les modèles pour les infections faibles, modérées et sévères. Les infections faibles peuvent être données s'il est possible pour le pathogène d'infecter le tissu de l'hôte. Cela signifie que les infections faibles peuvent avoir lieu si les températures sont minimales et si les périodes d'humidité des feuilles sont d'une durée critique. Une infection modérée a lieu dans des conditions où la plupart des essais d'infection donnent des résultats raisonnables et les infections sévères ont lieu dans des conditions où le pathogène a des conditions optimales pour l'infection.

Début de l'infection après une pluie de 0,5 mm. Nous avons décidé de ne pas utiliser de modèle pour la formation des pycnides. Les conditions nécessaires à la formation des pycnides sont supposées être une période où l'humidité relative est supérieure à 85%. La durée de vie des pycnides est estimée à 24 heures. Dans tous les climats où Septoria tritici a une chance d'infecter, nous trouverons 2 heures remplissant ces conditions presque tous les jours autour du lever du soleil.
Évaluation de la gravité de l'infection : Pour pouvoir évaluer la pression d'infection de Septoria tritici entre le stade 10 (première feuille à travers le coléoptile) et le stade 32 (nœud deux au moins 2 cm au-dessus du nœud 1) et entre 32 et 51 (début de l'épiaison), nous devons évaluer la sévérité des infections en fonction des conditions climatiques. Cette évaluation se fait sur une échelle de 1 à 5. Une sévérité de 1 est donnée si la condition pour une faible infection est remplie et qu'il a plu moins de 5 mm, sinon la valeur de sévérité correspondante sera 2. Une gravité de 3 est attribuée si une infection modérée est remplie et qu'il a plu moins de 5 mm. S'il a plu plus de 5 mm au cours d'une infection modérée ou moins de 5 mm au cours d'une infection sévère, la gravité est de 4.
Une infection sévère avec plus de 5 mm de pluie correspond à une valeur de sévérité de 5.
Septoria tritici l'évaluation de la pression de la maladie : Le climat n'est qu'un des facteurs qui déterminent la pression de la maladie dans le champ. Les deux autres facteurs sont l'historique du champ et la sensibilité de la variété cultivée. Si nous pouvons accumuler les valeurs de sévérité de la maladie du stade 10 au stade 32 jusqu'à une valeur de 4, nous pouvons nous attendre à une faible pression de la maladie par le climat. Si cette valeur atteint 6, on peut s'attendre à une pression modérée de la maladie et si elle atteint 10, on peut s'attendre à une forte pression de la maladie de la part du climat. La connaissance de la sensibilité de la variété et de l'historique du champ nous amènera à pulvériser ou non en cas de pression faible ou modérée de la maladie dans cette situation. Une valeur cumulée de 10 peut de toute façon conduire à une pulvérisation au stade 32. La décision de pulvériser à un stade plus avancé dépend davantage du climat printanier. Si nous pouvons accumuler les valeurs de sévérité depuis le stade 10 jusqu'à une valeur de 6, nous pouvons nous attendre à une faible pression de la maladie. Si cette valeur atteint 10, on peut s'attendre à une pression modérée de la maladie et si cette valeur atteint 15, on peut s'attendre à une forte pression de la maladie en raison de la situation climatique.
Dans FieldClimate, nous montrons le Septoria tritici Sévérité avec les trois différentes sévérités d'infection dans un graphique (voir ci-dessus). En raison des précipitations et des longues périodes d'humectation des feuilles, les conditions d'une infection sévère par le S. tritici ont été en plein champ les 14 et 16 mai. Les niveaux de gravité atteignent la valeur maximale de 5 le 14 mai, ce qui signifie que le risque d'infection est désormais élevé.
La biologie de l'infection de Stagonospora nodorum diffère dans une certaine mesure de celle de S. tritici, mais cette différence n'est pas suffisamment importante pour justifier un modèle distinct. C'est pourquoi nous suggérons d'utiliser ce modèle pour l'ensemble des maladies de Stagnospora et de Septoria dans les céréales, y compris S. passerinii. S. tritici et S. passerinii ont tendance à avoir besoin de périodes d'humectation plus longues que les S. nodorum. Dans les régions où l'anticyclone de S. nodorum Les infections classées comme faibles, avec une valeur de gravité de 2, doivent être traitées plus sérieusement que dans d'autres domaines.
Pour Septoria nodorum Un modèle de risque est présenté dans le document FieldClimate (voir ci-dessus). Un risque élevé a été déterminé le 17 juin et le 7 juillet (100%). En fonction du stade de la plante sensible à l'infection, des mesures de protection des plantes doivent être prises en compte si le risque atteint 80% (voir également les prévisions météorologiques, la protection des plantes). Si le risque est de 100% et qu'une infection a déjà été détectée, des mesures phytosanitaires systémiques (application curative) doivent être prises pour protéger la plante.
Anthracnose
Plusieurs espèces de champignons phytopathogènes du genre Colletotrichum provoquent l'anthracnose des poivrons et de nombreux autres légumes et fruits. Jusqu'à la fin des années 1990, l'anthracnose des poivrons et des tomates n'était associée qu'aux fruits mûrs ou en cours de maturation. Depuis cette époque, une forme plus agressive de la maladie s'est établie. Cette forme attaque les poivrons à n'importe quel stade du développement du fruit et peut menacer la rentabilité des cultures de poivrons dans les zones où elle s'établit. Cette maladie peut également affecter les tomates, les fraises, et éventuellement d'autres cultures de fruits et légumes.
Symptômes
Des lésions circulaires ou angulaires en creux se développent sur les fruits immatures de toutes tailles. Souvent, plusieurs lésions se forment sur un même fruit. Lorsque la maladie est grave, les lésions peuvent coalescer. Des masses de spores fongiques de couleur rose à orange se forment souvent en anneaux concentriques à la surface des lésions. Dans les lésions plus anciennes, on peut observer des structures noires appelées acervules. Avec une loupe, elles ressemblent à de petits points noirs ; au microscope, elles ressemblent à des touffes de petits poils noirs. Le pathogène forme des spores rapidement et abondamment et peut se propager rapidement dans une culture de poivrons, entraînant une perte de rendement pouvant atteindre 100%. Les lésions peuvent également apparaître sur les tiges et les feuilles sous forme de taches brunes de forme irrégulière avec des bords brun foncé.
Agent pathogène
Cette forme d'anthracnose du poivron est causée par le champignon Colletotrichum acutatum. Le pathogène survit sur les débris végétaux des cultures infectées et sur d'autres espèces végétales sensibles. Le champignon n'est pas transmis par le sol pendant de longues périodes en l'absence de débris végétaux infestés. Le champignon peut également être introduit dans une culture par des semences infestées. Au cours de l'épidémie, le champignon se propage dans le sol. pendant les périodes chaudes et humides, les spores sont projetées par la pluie ou l'eau d'irrigation des fruits malades aux fruits sains. Les fruits malades constituent une source d'inoculum, ce qui permet à la maladie de se propager d'une plante à l'autre dans le champ. Le champignon survit dans et sur les graines. L'anthracnose est introduite dans le champ par des transplants infectés ou peut survivre entre les saisons dans des débris végétaux ou sur des plantes hôtes. Les plantes adventices et les autres plantes de la famille des Solanacées (tomate, pomme de terre, aubergine) sont des hôtes alternatifs, bien que les infections de ces hôtes soient extrêmement rares en Floride. Les fruits sont infectés lorsque des spores du champignon ou des débris infestés sont projetés en pluie sur les plants de poivrons. De nouvelles spores sont produites dans les tissus infectés et sont ensuite dispersées dans d'autres fruits. Les travailleurs peuvent également déplacer les spores avec l'équipement ou lors de la manipulation de plantes infectées. L'infection se produit généralement par temps chaud et humide. Les températures autour de 80° F (27° C) sont les températures optimales. pour le développement de la maladie, bien que l'infection se produise aussi bien à des températures plus élevées qu'à des températures plus basses. Des pertes sévères se produisent par temps de pluie car les spores sont lavées ou éclaboussées sur d'autres fruits, ce qui augmente le nombre d'infections. La maladie est plus susceptible de se développer sur des fruits mûrs qui sont présents pendant une longue période sur la plante, bien qu'elle puisse se produire à la fois sur des fruits immatures et sur des fruits mûrs. L'anthracnose peut infecter des températures comprises entre 15 °C et 30 °C. Mais une humidité de la feuille longue est nécessaire pour répondre aux besoins d'une infection. À une température optimale de 20°C à 25°C toujours 12 heures d'humidité des feuilles sont nécessaires. Des températures plus élevées ou plus fraîches nécessiteront des périodes d'humectation des feuilles encore plus longues (pas de fonction linéaire/réseau nécessaire pour le calcul). FieldClimate calcule les événements d'infection possibles sur la base de l'humidité des feuilles et des températures pendant cet événement.
Mildiou
Biologie de Plasmopara viticola (Mildiou)
P. viticola est un parasite obligatoire. Cela signifie que les organes verts et frais de la vigne sont nécessaires à sa croissance. Pendant la période sans végétation, il persiste en formant des corps fructifères, appelés oospores. Les oospores des oomycètes peuvent survivre très longtemps dans le sol. C'est pourquoi on peut trouver le mildiou dans des endroits où les infections ne sont pas possibles chaque année. Au printemps, lorsque le sol est suffisamment humide et chaud, les oospores forment des macrosporanges qui peuvent libérer jusqu'à 200 zoospores dans l'eau libre. Les zoospores se déplacent vers les feuilles et les grappes sous l'effet du vent dans les gouttelettes d'eau. Elles possèdent deux flagelles et se déplacent dans un film d'eau sur la face inférieure des feuilles ou des grappes et des jeunes baies pour trouver un stoma qui leur permettra de pénétrer dans les tissus végétaux. Elles pénètrent et germent dans le stomate, dans lequel elles transfèrent tout leur plasma en moins d'une heure. Dans les études microscopiques, la découverte des stomates, l'enkystement et la germination dans les stomates sont terminés en 90 minutes.
P. viticola se développe dans l'espace intercellulaire et se nourrit d'haustorias pénétrant dans les cellules épidermiques et parenchymateuses. En fonction de la température et de l'humidité relative, il développe suffisamment de croissance intercellulaire avec suffisamment d'haustorias pour former un corps sous-matellaire qui remplit toute la zone sous-matellaire et qui soulève le tissu épidermique du tissu parenchymateux. Cela conduit au symptôme visible de la tache d'huile.
Les oomycètes sont sporulant en l'absence de lumière lorsque l'humidité relative est très élevé. Dans le cadre de P. viticola il n'y a pas de sporulation si les températures sont inférieures à 12°C et l'humidité relative inférieure à 95%. Les sporangiaphores sont formés par les vésicules de substomatelle et sortent du stomate. Les sporanges fraîchement formés sont collants et ne peuvent être retirés des sporangiaphores qu'avec de l'eau. Lors de la diminution de l'humidité relative, les sporanges deviennent secs et peuvent être enlevés par le vent.
Les sporanges libèrent jusqu'à 20 zoospores dans l'eau libre. Ces zoospores doivent être distribués par le vent dans des gouttelettes d'eau pour atteindre les feuilles fraîches, ou les sporanges peuvent être distribués par la pluie ou le vent lui-même. Le processus d'infection primaire et secondaire est le même.
En raison de la grande importance du stade sexuel pour l'hibernation du pathogène, nous pouvons supposer que les types d'accouplement conviennent à tous les vignobles où le mildiou de la vigne est présent. La formation des zoospores a lieu sur les feuilles plus âgées pendant l'été et au début de l'automne.
La primo-infection en détail
Les infections provenant des oospores sont appelées infections primaires. Ce terme est trompeur car plusieurs infections primaires peuvent se produire au début de l'été. Dans les événements épidémiologiques, l'infection primaire ne joue pas un rôle important s'il y a suffisamment de taches d'huile dans les vignobles et si le potentiel d'infection des spores d'été (sporanges) dépasse celui des oospores.
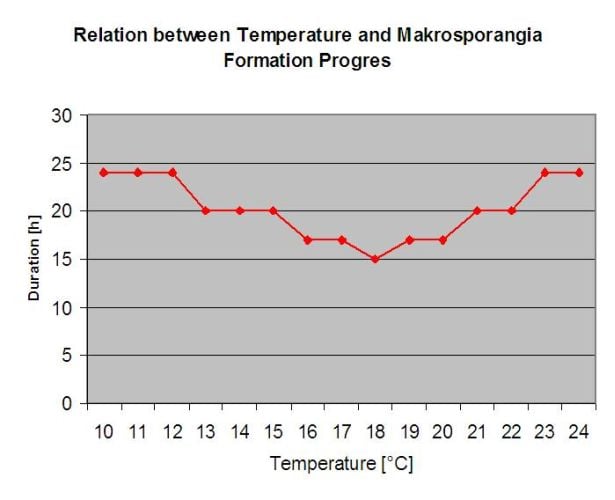
Les oospores hivernantes se transforment en macrosporanges lorsque l'humidité relative est suffisante pendant environ 24 heures. Les macrosporanges libèrent leurs zoospores dans l'eau libre et les fortes pluies (comme lors d'un orage). Les spores sont transportées vers les feuilles de la vigne et/ou les pousses vertes. Il s'agit donc d'infections primaires, ont besoin d'une pluie plus longue La première pluie provoque la saturation en eau des feuilles tombées au sol et les fortes pluies des jours suivants provoquent la libération des zoospores. La première pluie provoque la saturation en eau des feuilles tombées au sol et les fortes pluies des jours suivants provoquent la libération par les macrosporanges de leurs zoospores, qui atteignent les feuilles ou les sarments de la vigne. Pour que l'infection réussisse, une période d'humidité des feuilles suffisamment longue est nécessaire pour permettre aux zoospores d'atteindre les stomates des feuilles ou des pousses et de les infecter (l'illustration ci-dessus montre le cycle de développement du mildiou de la vigne (Plasmopara viticola).
Le modèle de l'infection primaire du mildiou vérifie d'abord si le temps est propice au développement des macrosporanges. C'est le cas tant que les feuilles sont humides ou que l'humidité relative après la pluie ne tombe pas en dessous de 70%. En fonction de la température, les macrosporanges peuvent se développer en 16 à 24 heures. Si des macrosporanges matures sont disponibles, cela sera indiqué graphiquement dans l'affichage de l'infection primaire du mildiou. Si des macrosporanges sont présents, une forte pluie peut disséminer leurs zoospores. Une pluie continue de 5 mm est interprétée comme une forte pluie et les zoospores sont disséminées, une infection primaire est alors possible si l'humidité des feuilles a duré suffisamment longtemps.
Infections secondaires
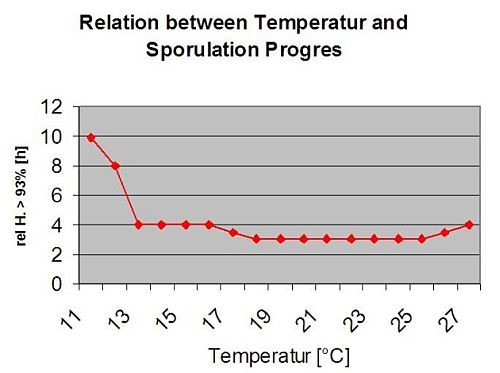
Infections secondaires de Plasmopara viticola ne sont possibles que si des taches d'huile déjà mûres existent dans votre vignoble ou à proximité. Les taches d'huile sont matures lorsqu'elles sont capables de sporuler (produire des sporanges). Les sporanges ne sont produits que par nuit. La lumière du soleil inhibe la sporulation. Les sporanges sont produits s'il y a plus chaud que 12°C et le humidité relative est très élevé. Le taux de production de sporanges augmente avec la température jusqu'à 24°C. La température optimale pour la sporulation sur les cépages européens (Vitis vinifera) est d'environ 24°C. Si les températures dépassent 29°C, aucune sporulation ne peut avoir lieu. Dans notre modèle, nous vérifions si humidité supérieure à 95% se produit pendant la nuit. Si cette condition dure pendant une température horaire cumulée de plus de 50°C, la sporulation est terminée et de nouveaux sporanges de Plasmopara existent dans le vignoble. Par exemple, les heures à 50°C correspondent à 4 heures à 13°C ou à 3 heures à 17°C.
Le graphique suivant montre la relation entre la température et les conditions humides (humidité relative, humidité des feuilles, précipitations) qui sont utilisées pour modéliser les événements d'infection dans les pays de l'UE. fieldclimate.com.
Sporanges de Plasmopara viticola ont une durée de vie limitée. Plus il fait chaud et plus l'air est sec, plus ils meurent rapidement (dans ng.fieldclimate.com, nous remettons à 0 lorsque l'humidité relative est inférieure à 50%). Ils meurent définitivement au cours de la prochaine période de rosée ou d'humidité des feuilles, qui est trop courte pour l'infection. L'aptitude des sporanges plus anciens est donc très limitée. Notre modèle suppose que la durée de vie des sporanges est limitée à un jour.
Pour provoquer de nouvelles infections, les sporanges doivent être disséminés. Il y a deux façons de distribuer les spores : S'il pleut immédiatement après la formation des sporanges, ceux-ci se répandent avec les éclaboussures de la pluie. Si les feuilles de la vigne restent humides assez longtemps, un niveau élevé de spores se propage. Plasmopara viticola Les infections ont lieu. Si le lendemain matin commence sans pluie et avec une humidité décroissante, les sporanges desséchés se détachent de leurs branches. Le moindre mouvement d'air les transporte vers les feuilles saines. S'il ne pleut pas rapidement, elles mourront.
Mildiou Infection primaire
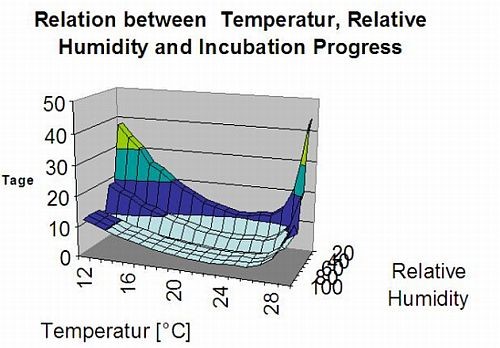
Les infections sont représentées après le développement des macrospores (orange, cinquième graphique) dans trois classes de gravité différentes (faible : orange, modérée : verte, sévère : rouge) en fonction de la quantité de pluie et donc de la distribution des spores dans le vignoble. Si l'infection par 100% est déterminée, les conditions optimales ont été réunies pour pénétrer dans le tissu végétal (protection curative de la plante) et la courbe d'incubation (premier graphique) commence à augmenter. Si l'incubation se termine (100%) et qu'aucune protection phytosanitaire n'a été prise en compte, les symptômes (taches d'huile) auraient dû être vérifiés sur le terrain.
1. La courbe de progression de l'infection et, après une infection complète, la période d'incubation qui en découle (temps écoulé entre l'infection et les symptômes visibles sur le terrain).
2. Une courbe de progression de l'infection est déterminée lorsque des macrosporanges ou des sporanges sont présents et que les feuilles sont humides. Elle augmente en fonction de l'humidité des feuilles et de la température. Si la courbe de progression de l'infection atteint 100%, on peut considérer que l'infection est terminée. La courbe de progression de l'incubation correspondant à l'infection spécifique commence à être calculée au début de l'infection. Si une infection ne peut pas être achevée, la courbe d'incubation sera également arrêtée.
3. Les conditions météorologiques sont affichées sur la même page que les résultats du modèle de maladie. Vous pouvez donc vérifier d'un seul coup d'œil la température, l'humidité relative, la pluie et l'humidité des feuilles pendant l'infection.
4. Le modèle indique les dates d'infection pour les infections primaires et secondaires du mildiou de la vigne. Il s'agit là de l'information la plus importante. Les infections qui n'ont pas encore été couvertes par des fongicides préventifs ou curatifs peuvent être désastreuses pour le rendement/la qualité. Des informations supplémentaires sur la gravité de l'infection (faible/moyenne/sévère) pourraient être utiles pour décider de la stratégie de protection des plantes en fonction de l'historique du vignoble (quantité d'inoculum), de la variété et de l'expérience des années précédentes.
Stratégies de protection des plantes
- Les fongicides prophylactiques et systémiques ou curatifs sont largement utilisés pour lutter contre le mildiou. Les produits chimiques prophylactiques sont appliqués avant, mais aussi près que possible d'un épisode d'infection dans la période de plus grande sensibilité de l'hôte, entre une longueur de pousse de 10 cm et des baies de la taille d'un pois.
- Les produits chimiques prophylactiques peuvent également être utilisés en pulvérisant le plus tôt possible avant un événement météorologique prévu de plus de 2 mm de pluie (pour le cercle primaire).
- Un fongicide curatif doit être appliqué dès que possible après un épisode d'infection (infection par 100%) et avant l'apparition de taches d'huile. Veillez à prévenir le développement de la résistance aux fongicides.
- La surveillance de la présence du mildiou (taches d'huile) dans le vignoble doit être effectuée régulièrement et prendre en compte au moins 200 pieds de vigne. On considère qu'il y a un risque si l'on observe plus de deux taches d'huile pour 50 pieds de vigne.
Le modèle se base sur les publications de MUELLER-THURGAU, ARENS, MUELLER et SLEUMER, BLAESER, HERZOG, GEHMANN et de nombreux autres travailleurs liés au réseau de recherche sur l'épidémiologie du mildiou et de l'oïdium de la vigne depuis le début du dix-neuvième siècle.
Oïdium
L'oïdium de la tomate peut être causé par trois agents pathogènes dans le monde.
Leveillula taurica (Oidiopsis taurica) est un agent pathogène d'un large éventail d'espèces hôtes dans les climats chauds arides à semi-arides d'Asie, de la Méditerranée, d'Afrique et, plus récemment, du sud-ouest des États-Unis.
Erysiphe orontii (E. cichoracearum et E. polyphaga) est une autre espèce commune à de nombreuses plantes hôtes dans les régions tempérées et tropicales.
Et comme troisième espèce Odium lycopersicum.
Facteurs de développement de la maladie
- niveaux d'humidité relative > 50% (RH optimale > 90%)
- l'eau libre sur les surfaces des feuilles n'est pas nécessaire
- plage de température : 10-35 °C (meilleure température en dessous de 30 °C)
L'oïdium est une maladie qui dépend de l'inoculum. Par conséquent, les périodes à risque peuvent être déterminées, mais le facteur principal des dommages, par exemple l'épidémie, est l'inoculum initial (qui est actif dans une large gamme de températures). Pour les stratégies de lutte, il faut donc combiner la modélisation de la période à risque avec la surveillance de l'inoculum fongique (maladie) sur le terrain !
Tomate de plein champ
Rouille de l'asperge
Rouille de l'asperge Puccinia asparagi est favorisée par un climat humide et chaud. De petites quantités de pluie et de vent distribuent les urédiaspores, tandis que de fortes pluies peuvent les faire tomber dans le sol. C'est pourquoi une période d'humidité foliaire avec plus de 10 mm de pluie n'est pas considérée comme une période d'infection. Les périodes d'humidité foliaire provenant de pluies légères et de rosées de 3 à 8 heures avec des températures de 25°C à 10°C peuvent être des périodes d'infection pour les urédiaspores en été et à la fin de l'été.
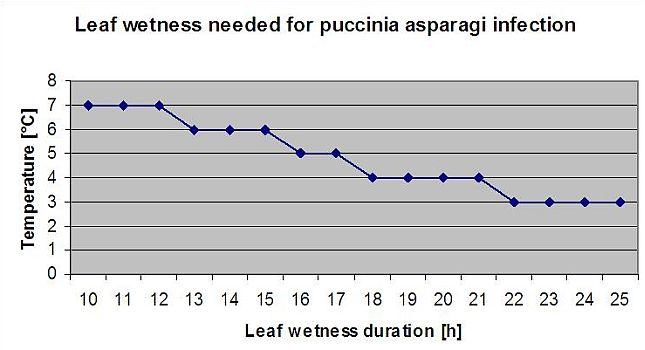
Stemphylium leaf blight
Stemphylium La brûlure des feuilles est causée par le champignon Stemphylium vesicarium. De petites lésions jaune clair à brunes et imbibées d'eau se développent sur les feuilles. Ces petites lésions se transforment en taches allongées qui coalescent souvent, ce qui entraîne la formation de feuilles flétries. Les lésions deviennent généralement brun clair à beige au centre, puis brun olive foncé à noir à mesure que les spores de ce pathogène se développent. S. vesicarium envahit normalement les tissus morts et mourants de l'oignon, tels que les extrémités des feuilles, les lésions de la tache pourpre et du mildiou, les tissus blessés et les tissus sénescents. L'infection reste généralement limitée aux feuilles et ne s'étend pas aux écailles du bulbe. Les lésions se produisent généralement sur la face de la feuille exposée au vent dominant. Les longues périodes de chaleur et d'humidité favorisent le développement de la maladie.
Stemphylium versicarium est basé sur les travaux de SUHERI et PRICE pour les oignons et de LLorent, VILARDELL, BUGIANI, GHERARDI et MONTESINO pour les poires. Les courbes d'infection pour les infections faibles, modérées et sévères sont calculées. Le fait qu'un traitement doive être pris en considération pour une infection faible, modérée ou grave dépend de l'historique de la maladie de l'endroit.
Avec cette séparation en situations favorables, moyennement favorables et très favorables, c'est au producteur de décider de l'ampleur de la pression de la maladie dans un champ spécifique et s'il doit couvrir une infection spécifique.
Température : 11-30°C
Humidité des feuilles : > 0 (début de l'infection) ou humidité relative > 90% (seulement s'il y avait déjà une infection avant le calcul et qu'elle persiste)
infection légère (11-30°C), infection modérée (13-30°C), infection sévère (16-30°C), tableau avec la durée d'humidité des feuilles (voir ci-dessus)
Réinitialisation : si l'humidité relative est inférieure à 70%.
S. versicarium Les infections existent souvent en même temps que les Alternaria porri infections. C'est pourquoi le modèle TomCast (Alternaria) est fréquemment utilisé dans les deux cas.
Cercospora leaf spot
Ce modèle permet d'estimer la date de la première apparition de la C. beticola sur la base des températures moyennes journalières cumulées depuis le premier janvier supérieures à 5°C. Il prend le seuil de 1006,2°C dans les périodes où l'humidité relative est supérieure à 60% et si nous n'avons pas d'humidité relative, le seuil de 1081,9°C est valable.
Ce modèle a été développé pour l'Italie et est utilisé en Italie et en Allemagne.
Pour l'année 2010 en Styrie, CercoPrim indique le 19 juin pour la première pulvérisation. C'est à peu près la même date que le modèle de risque Pessl Instruments ou le modèle DIV aurait indiqué pour arroser les variétés sensibles.
Maladie des taches pourpres
L'agent pathogène
La maladie des taches pourpres sur les asperges et la fougère est causée par le champignon Stemphylium vesicarium. Le champignon survit à l'hiver sous forme de spores sexuelles (ascospores) dans un sac (ascus) produit dans des structures d'hivernage (pseudothécies) qui apparaissent comme de petits points noirs sur les débris d'asperges de la saison précédente. Les les ascospores sont libérées de l'asque par la pluie et peuvent être transportées par le vent jusqu'aux plants d'asperges nouvellement émergés, où elles provoquent l'infection primaire de la saison de croissance. Ces nouvelles infections donnent lieu à des spores (conidies) produites par un processus asexué, qui peuvent à leur tour provoquer des infections secondaires, un processus qui se répète tant que les températures et les précipitations sont favorables.
La maladie
L'émergence de la tache pourpre en tant que problème important dans la production d'asperges dans le Michigan peut être due à l'adoption d'un système de culture sans labour, dans lequel la fougère séchée de la saison précédente est coupée en avril et laissée à la surface du sol. Ce résidu persiste pendant la saison de récolte (mi-juin) et est visible pendant la période de croissance de la fougère (de fin juin à septembre) ; il est la source des ascospores qui déclenchent les infections au début de la saison de croissance. Les symptômes de la maladie sont les suivants : La maladie se manifeste par de nombreuses taches violacées, légèrement enfoncées, avec un centre brun, sur les lances et la fougère récoltées. Les lésions sur les lances se trouvent souvent du côté exposé au vent, car le sable soufflé provoque des blessures qui favorisent l'infection. Pendant les années d'épidémie, des taches peuvent apparaître sur 60-90% des lances et peuvent entraîner le rejet de la récolte, en particulier pour les ventes sur les marchés frais. Des taches apparaissent également sur les fougères asperges, affectant la tige principale, les branches secondaires et les aiguilles (cladophylles). Une infection sévère de la fougère peut entraîner une défoliation prématurée de la plante. L'augmentation de la gravité de la maladie des taches pourpres est associée à des périodes prolongées de pluie, de brouillard ou de rosée.
Crédit texte : Mary K. Hausbeck, professeur et spécialiste de la vulgarisation, Michigan State University, Department of Plant Pathology, E. Lansing
TomCast pour les asperges
Contexte : TOMCAST (TOMato disease foreCASTing) est un modèle informatique basé sur des données de terrain qui tente de prédire le développement de maladies fongiques, à savoir Brûlure précoce, tache septorienne et anthracnose sur les tomates. Des enregistreurs de données placés sur le terrain enregistrent toutes les heures les données relatives à l'humidité des feuilles et à la température. Ces données sont analysées sur une période de 24 heures et peuvent donner lieu à la formation d'une valeur de gravité de la maladie (DSV), c'est-à-dire une augmentation du développement de la maladie. Au fur et à mesure que les DSV s'accumulent, la pression de la maladie continue de s'exercer sur la culture. Lorsque le nombre de DSV accumulées dépasse l'intervalle de pulvérisation, une application de fongicide est recommandée pour soulager la pression de la maladie.
TOMCAST est dérivé du modèle original F.A.S.T. (Forecasting Alternaria solani on Tomatoes) développé par Dr. Madden, Pennypacker, et MacNab à Pennsylvania State University (PSU). Le modèle F.A.S.T. de la PSU a été modifié par le Dr Pitblado au Ridgetown College en Ontario pour devenir le modèle Tomcast utilisé par l'Ohio State University Extension.
DSV sont : La valeur de sévérité de la maladie (DSV) est l'unité de mesure donnée à un degré spécifique de développement de la maladie (mildiou).
En d'autres termes, le DSV est une représentation numérique de la rapidité ou de la lenteur de l'accumulation de la maladie (mildiou précoce) dans un champ de tomates. Le DSV est déterminé par deux facteurs : l'humidité des feuilles et la température pendant les heures d'humidité des feuilles. Plus le nombre d'heures d'humectation des feuilles et la température augmentent, plus le DSV s'accumule rapidement. Voir le tableau des valeurs de gravité des maladies ci-dessous.
À l'inverse, lorsqu'il y a moins d'heures de mouillage des feuilles et que la température est plus basse, les DSV s'accumulent lentement, voire pas du tout. Lorsque le nombre total de DSV accumulés dépasse une limite prédéfinie, appelée intervalle ou seuil de pulvérisation, une pulvérisation de fongicide est recommandée pour protéger le feuillage et les fruits du développement de la maladie.
L'intervalle de pulvérisation (qui détermine quand vous devez pulvériser) peut varier entre 15 et 20 DSV. Le DSV exact qu'un producteur doit utiliser est généralement fourni par le transformateur et dépend de la qualité du fruit. Suivre un intervalle de pulvérisation de 15 DSV est une utilisation conservatrice du système TOMCAST, ce qui signifie que vous pulvériserez plus souvent qu'un producteur qui utilise un intervalle de pulvérisation de 19 DSV avec le système TOMCAST. Le compromis se situe au niveau du nombre de pulvérisations appliquées pendant la saison et de la différence potentielle de qualité des fruits.
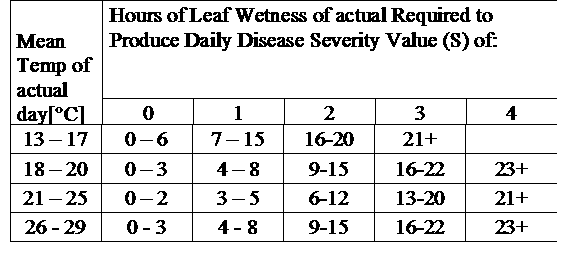 TomCast aux asperges
TomCast aux asperges
La recherche a déterminé que le Tom-Cast est une alternative prometteuse à la pulvérisation de la fougère dans les champs d'asperges commerciaux. Tom-Cast alerte les producteurs lorsque la les conditions environnementales sont favorables au développement de la maladie des taches pourpres (périodes prolongées de rosée ou de pluie accompagnées de températures chaudes). Des fongicides efficaces appliqués selon le prévisionniste Tom-Cast permettent aux producteurs de lutter contre la maladie des taches pourpres de l'asperge, tout en économisant de l'argent et en préservant l'environnement.
Crédit texte : Jim Jasinski, coordinateur de TOMCAST pour l'OHIO, l'INDIANA et le MICHIGAN
Modèle d'infection de la tache pourpre
Le site Stemphylium versicarium Le modèle d'infection est basé sur les travaux de SUHERI et PRICE pour les oignons et de LLorent, VILARDELL, BUGIANI, GHERARDI et MONTESINO pour les poires.
Les courbes d'infection pour les infections légères, modérées et sévères sont calculées.
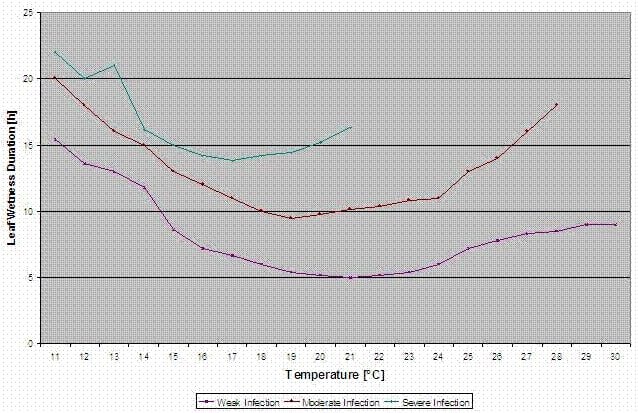
Avec cette séparation en situations favorables, moyennement favorables et très favorables, c'est au producteur de décider de l'ampleur de la pression de la maladie dans un champ spécifique et s'il doit couvrir une infection spécifique.
Conditions :
Température : 11-30°C
Humidité des feuilles > 0 (début de l'infection) ou humidité relative > 90% (seulement si une infection a déjà eu lieu avant le calcul et qu'elle persiste).
infection légère (11-30°C), infection modérée (13-30°C), infection sévère (16-30°C), un tableau avec la durée d'humidité des feuilles (voir ci-dessus)
Réinitialisation : si l'humidité relative est inférieure à 70%.
Équipement recommandé
Vérifiez quel jeu de capteurs est nécessaire pour surveiller les maladies potentielles de cette culture.