
Grapevine modèles de maladies
Mildiou
Agent pathogène
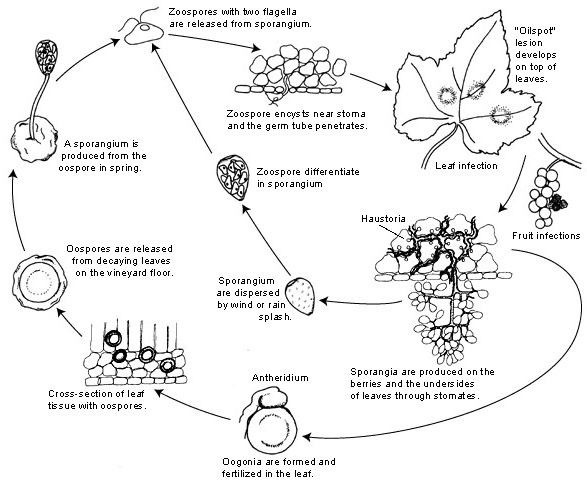
L'agent pathogène du mildiou de la vigne est le suivant Plasmopara viticola. Il s'agit d'un parasite obligatoire, ce qui signifie que les organes verts et frais de la vigne sont nécessaires à sa croissance. Il possède des stades de reproduction asexués et sexués - les zoospores et les oospores. Il existe donc deux stades d'infection : l'infection primaire et l'infection secondaire.
L'infection primaire commence par la germination des oospores qui ont passé l'hiver et qui forment des sporanges au printemps, lorsque le temps devient chaud. Les sporanges sont produits la nuit car la lumière du soleil inhibe la sporulation. Les oospores à paroi épaisse aident l'agent pathogène à survivre aux conditions hivernales difficiles et à déclencher l'infection primaire. Les sporanges sont dispersés par la pluie ou le vent et libèrent des zoospores dans l'eau libre. Pour que l'infection réussisse, il faut que les feuilles soient mouillées suffisamment longtemps ou qu'il pleuve.
L'infection secondaire n'est possible qu'en présence de taches d'huile matures et se produit par l'intermédiaire de zoospores et de sporanges. Les zoospores et les sporanges sont très sensibles à une faible humidité et à la lumière, ce qui réduit leur viabilité, ce qui signifie que la plupart des infections se produisent peu de temps après leur libération. Les zoospores pénètrent dans les tissus végétaux par les tubes germinatifs et développent des hyphes pour poursuivre l'infection. Ces hyphes forment des lésions huileuses après la période d'incubation qui varie de 5 à 21 jours en fonction de la température - plus la température est basse, plus cela prend de temps.
Lorsque le temps redevient froid, ce qui est défavorable au pathogène, il passe à la production sexuelle, produisant des oospores. Ces oospores restent dormantes pendant l'hiver et le cycle se répète.
Symptômes

De petites lésions jaunes apparaissent sur la face supérieure des feuilles, parfois entourées d'auréoles brunâtres. Les taches d'huile s'étendent et s'intègrent au fur et à mesure de la maturation et les halos s'estompent. Les sporanges produisent ensuite un mildiou blanc-cottonique sur la face inférieure des lésions et une nécrose s'ensuit. Des zones brunes et huileuses apparaissent également sur les pousses, les tiges et les baies. Lors de nuits chaudes et humides, elles peuvent se couvrir d'un duvet blanc dû à la sporulation. Une infection sévère provoque une chute prématurée.
Modèles FieldClimate
- Il existe deux modèles dans FieldClimate - l'infection primaire et l'infection secondaire.
- Le premier graphique montre le temps d'incubation après la fin de l'infection. Les graphiques inférieurs illustrent la progression de l'infection pour un niveau de gravité faible, modéré et grave. On peut considérer qu'il y a infection lorsque la courbe croissante du graphique atteint 100% - la pulvérisation peut être envisagée si le niveau d'infection est grave.
Primo-infection
Capteurs nécessaires :
- Température de l'air
- Humidité relative
- Humidité des feuilles
- Précipitations
L'infection primaire vérifie si le temps est propice au développement des sporanges. C'est le cas tant que les feuilles sont humides ou que l'humidité relative après la pluie ne tombe pas en dessous de 70%. Les sporanges peuvent se développer dans les 16 à 24 heures en fonction de la température. Une pluie continue de 5 mm est considérée comme une forte pluie qui peut disséminer les zoospores.
Infection secondaire
Capteurs nécessaires :
- Température de l'air
- Humidité relative
- Humidité des feuilles
- Précipitations
L'infection secondaire se produit si la température est supérieure à 12 °C et si l'humidité relative est supérieure à 95%. Le taux de production de sporanges augmente avec les températures jusqu'à 23 °C. Si cette condition dure pendant une température horaire cumulée de plus de 50 °C, nous supposons que la sporulation est terminée et que de nouveaux sporanges existent dans le vignoble. Les 50 °C cumulés correspondent à 4 heures avec 13 °C ou 3 heures avec 17 °C, par exemple. Les sporanges meurent rapidement lorsqu'il fait plus chaud et plus sec - lorsque l'humidité relative tombe en dessous de 50%, nous la remettons à 0 et lorsque la température dépasse 29 °C, aucune sporulation ne peut avoir lieu.
Littérature
- Ash, G. (2000). Le mildiou de la vigne. The Plant Health Instructor.
- Gessler, C., Pertot, I., & Perazzolli, M. (2011). Plasmopara viticola : une revue des connaissances sur le mildiou de la vigne et une gestion efficace de la maladie. Phytopathologia Mediterranea, 50(1), 3-44.
- Kennelly, M. M., Gadoury, D. M., Wilcox, W. F., Magarey, P. A. et Seem, R. C. (2007). Primary infection, lesion productivity, and survival of sporangia in the grapevine downy mildew pathogen Plasmopara viticola. Phytopathology, 97(4), 512-522.
- Koledenkova, K., Esmaeel, Q., Jacquard, C., Nowak, J., Clément, C., & Ait Barka, E. (2022). Plasmopara viticola the causal agent of downy mildew of grapevine : from its taxonomy to disease management. Frontiers in Microbiology, 13, 889472.
Oïdium
Agent pathogène
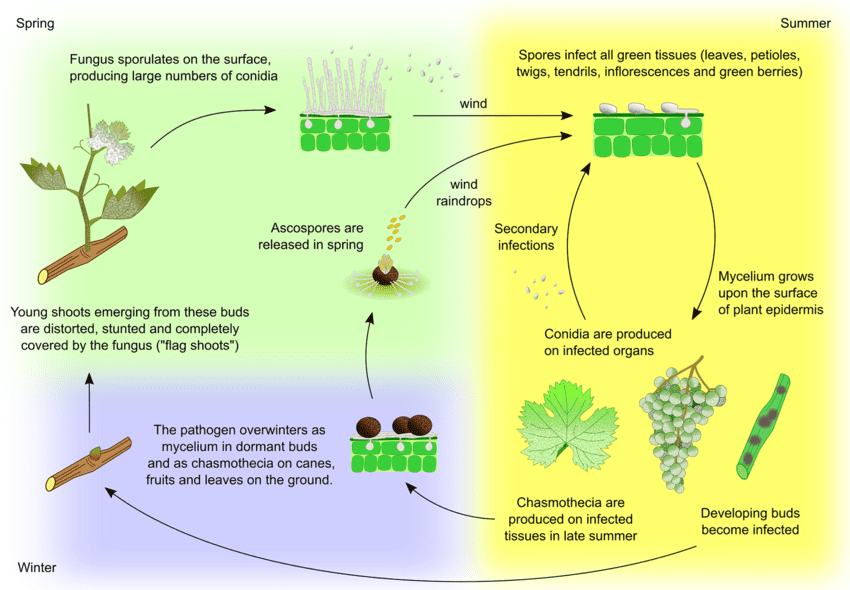
L'agent pathogène de l'oïdium de la vigne est Uncinula necator. Il existe deux sources principales d'inoculum - le mycélium hivernant et les ascospores des cleistothèces - dont l'importance peut varier en fonction de la région.
Le mycélium provoque des pousses en drapeau au printemps. Les pousses en drapeau sont des pousses partiellement ou totalement couvertes de mildiou et formées à partir de bourgeons infectés latents. Comme des colonies se forment à l'intérieur, ces pousses sont bien visibles et ont souvent des feuilles déformées.
Les cleistothécies libèrent des ascospores au début du printemps. Les précipitations jouent un rôle important dans la libération des ascospores. Avec l'augmentation de la température, la déhiscence est plus fréquente. Les ascospores germent dans les 12 heures, formant des tubes germinatifs et des appressoriums sur les tissus végétaux, conduisant à la formation de colonies dispersées.
L'infection secondaire se produit par l'intermédiaire des conidies produites dans les colonies. Tout comme les ascospores, elles germent et développent des tubes germinatifs et un appressorium. U. necator n'a pas besoin d'eau libre pour l'infection ni d'une humidité relative élevée pour la formation des conidies. Lorsque les conditions climatiques deviennent moins favorables, le champignon forme des cleistothèces. Il passe l'hiver en survivant dans les cleistothèces ou sous forme de mycélium végétatif dans les bourgeons infectés dormants et le cycle se répète.
Symptômes

Les symptômes sont présents sur toutes les parties vertes de la vigne. Les pousses développent des colonies et se couvrent d'un mycélium blanc-grisâtre, connu sous le nom de "pousses-drapeaux". Ils produisent des feuilles déformées. On trouve également des colonies de mildiou sur les feuilles, soit sur la partie inférieure, soit sur les deux faces. Les baies présentent des taches gris cendré et se fendent dans les cas les plus graves. Les tiges présentent des taches rouge-brun foncé et peuvent dépérir à partir de l'extrémité.
Modèles FieldClimate
Infection par les ascospores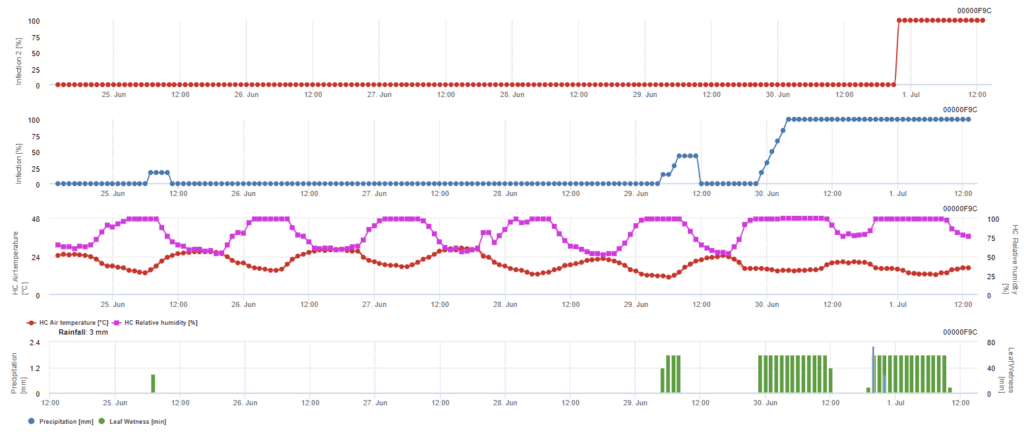
Capteurs nécessaires :
- Température de l'air
- Humidité relative
- Humidité des feuilles
- Précipitations
Ce modèle est recommandé lorsque les ascospores sont formées pendant les périodes froides de l'hiver (donc pas d'infection par le mycélium). L'infection par les ascospores prédit la libération des ascospores et l'infection initiale sur la base des températures moyennes pendant les périodes d'humidité prolongée des feuilles. Pour le calcul, environ 2,5 mm de pluie sont nécessaires pour libérer les ascospores, suivis d'un minimum de 8 à 12 heures d'humidité des feuilles et de températures comprises entre 10 et 15°C. Une fois que l'infection a eu lieu, le modèle passe à une phase d'évaluation du risque de maladie (modèle de risque californien) et se base sur les effets de la température sur le taux de reproduction de l'agent pathogène.
Modèle de risque californien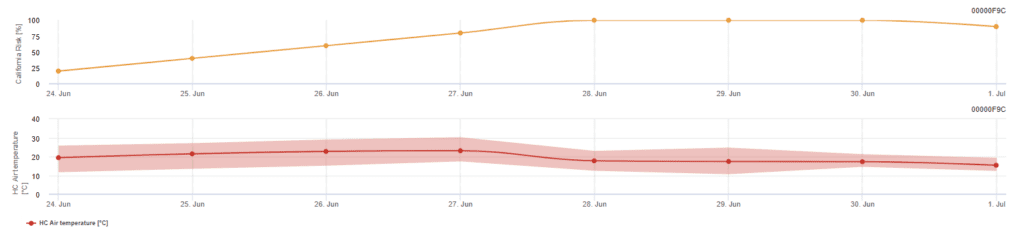
Capteurs nécessaires :
- Température de l'air
Le modèle est basé sur des études en laboratoire en Californie. Après la libération et la germination des ascospores (modèle), le développement et la reproduction de l'oïdium sont influencés par les températures. Le modèle évalue les températures et le risque de développement de l'oïdium à l'aide d'un indice de 0 à 100 points.
Trois jours consécutifs avec un minimum de six heures consécutives de température entre 21 et 30°C sont nécessaires pour déclencher l'indice d'évaluation du risque. Il gagne 20 points pour chaque jour qui atteint 6 heures consécutives ou plus entre 21 et 32°C et perd 10 points pour ceux qui ne le font pas ou lorsque la température dépasse 32°C ou descend en dessous de 21°C.
Des valeurs d'indice faibles de 0~30 indiquent que le pathogène ne se reproduit pas. Un indice de 40~50 est considéré comme modéré et implique un taux de reproduction de l'oïdium d'environ 15 jours. Des valeurs d'indice supérieures à 60 indiquent que le pathogène se reproduit rapidement (tous les 5 jours) et que le risque d'épidémie est important.
Modèle de risque Pessl Instruments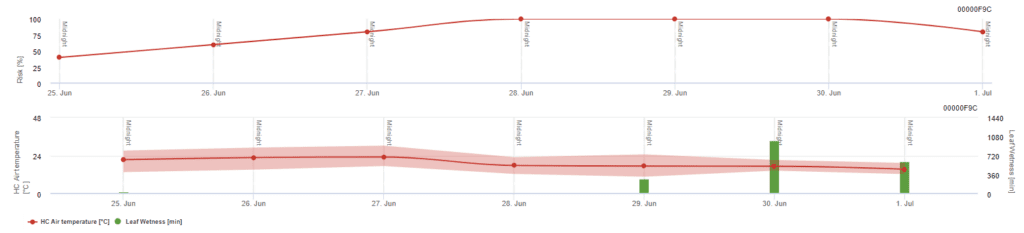
Capteurs nécessaires :
- Température de l'air
- Humidité des feuilles
Outre la température de l'air, l'humidité des feuilles peut être un facteur déterminant, car de longues périodes d'humidité des feuilles conduisent à l'établissement d'un champignon antagoniste (Ampelomyces quisqualis), qui entraîne une diminution d'U. necator. Les fondements du modèle sont équivalents à ceux du modèle californien de risque, mais l'humidité des feuilles est également prise en compte dans ce modèle. Une humidité des feuilles supérieure à 8 heures entraîne une diminution de 10 points.
Un indice faible de 0~20 indique que le pathogène ne se reproduit pas. Un indice de 20~60 est considéré comme modéré et un intervalle de pulvérisation normal est valable. Les valeurs d'indice supérieures à 60 indiquent que le pathogène se reproduit rapidement (tous les 5 jours) et que le risque d'épidémie est important, de sorte qu'il est recommandé de réduire l'intervalle de pulvérisation.
Littérature
- Gadoury, D. M., & Pearson, R. C. (1990). Déhiscence de l'ascocarpe et décharge des ascospores chez Uncinula necator. Phytopathology, 80(4), 393-401.
- Gadoury, D. M. et Pearson, R. C. (1990). Germination des ascospores et infection de Vitis par Uncinula necator. Phytopathology, 80(11), 1198-1203.
- Hall, T. W. (2000). Epidémiologie de l'oïdium du raisin, Uncinula necator, dans la vallée de la Willamette.
- Halleen, F., & Holz, G. (2001). Aperçu de la biologie, de l'épidémiologie et de la lutte contre Uncinula Necator (oïdium) sur la vigne, avec référence à l'Afrique du Sud. South african journal of Enology and Viticulture, 22(2), 111-121.
- Rügner, A., Rumbolz, J., Huber, B., Bleyer, G., Gisi, U., Kassemeyer, H. H., & Guggenheim, R. (2002). Formation de structures d'hivernage d'Uncinula necator et colonisation de la vigne en conditions de terrain. Plant pathology, 51(3), 322-330.
Pourriture noire
Agent pathogène
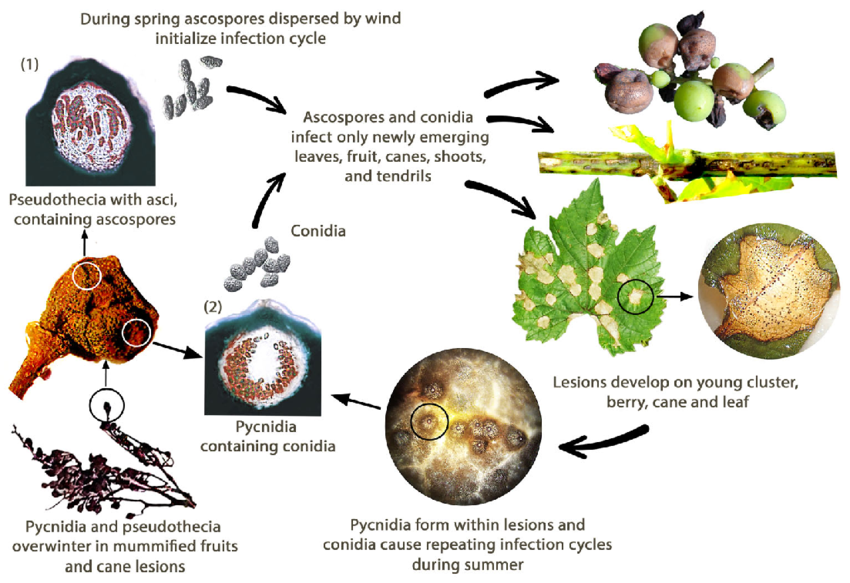
La pourriture noire de la vigne est causée par le champignon Guignardia bidwellii. Le champignon passe l'hiver dans différentes parties de la vigne et peut survivre pendant plus de deux ans dans les lésions des pousses infectées.
Au printemps, les pycnides produisent des conidies (spores asexuées) et les pseudothèces des ascospores (spores sexuées). Les conidies sont généralement dispersées sur de courtes distances, tandis que les ascospores peuvent infecter sur de plus longues distances. Ces spores sont transportées par le vent et la pluie pour infecter les jeunes tissus des hôtes sensibles, déclenchant ainsi des infections primaires. Les conidies servent également d'inoculum secondaire, contribuant à la propagation rapide et répétée de la maladie.
Au mois d'août, les pycnides se transforment en un stade d'hivernage qui produit des pseudothèces, lesquels génèrent des ascospores. Ces ascospores sont des sources importantes pour les infections primaires au printemps suivant.
Symptômes

Des taches brun-rouge se développent et finissent par fusionner, souvent entourées de petits points noirs, qui sont des structures fongiques connues sous le nom de pycnides qui produisent des conidies. Les feuilles jeunes et à croissance rapide sont particulièrement sensibles à cette infection.
Les infections des fruits se produisent généralement après la chute du calice, la plupart des symptômes se manifestant lorsque le fruit a atteint la moitié ou la quasi-totalité de sa taille. Au début, de petites taches apparaissent, entourées d'un anneau brun, qui s'agrandissent et s'assombrissent, recouvrant finalement la totalité de la baie au fur et à mesure que la maladie se développe. En quelques jours, les baies infectées peuvent se momifier, se briser ou tomber prématurément.
En outre, d'autres parties de la plante, telles que les pousses, les tiges et les vrilles, sont également touchées. Des lésions ovales de couleur pourpre à noire se développent et des pycnides se dispersent à la surface de ces lésions.
FieldClimate Modèle
Viticulture Modèle pourriture noire
Capteurs nécessaires :
- Température de l'air
- Humidité relative
- Humidité des feuilles
- Précipitations
Le modèle est basé à l'origine sur la littérature publiée par Spotts, mais a été modifié par Daniel Molitor. La révision a introduit trois classes de sévérité (légère, modérée et sévère) similaires à la conception des modèles de tavelure du pommier. À des températures chaudes, la période d'humidité des feuilles de 8 heures est suffisante pour favoriser les infections et on considère qu'une infection est terminée lorsqu'un graphique atteint 100%.
La gravité de l'infection dépend de la durée de la température optimale et de la période d'humidité du champignon. Les infections répondant aux critères de Spotts sont considérées comme des infections légères. Les infections répondant aux critères de Spotts par 150% et 200% sont considérées comme des infections modérées et sévères, respectivement.
En fonction de la pression d'infection, les infections doivent être couvertes de manière préventive ou une pulvérisation curative doit être appliquée peu de temps après l'infection. Dans le climat semi-aride modéré de la Moselle ou de la plupart des régions viticoles autrichiennes, il n'est pas recommandé de pulvériser après avoir constaté une infection légère.
Littérature
- Wilcox, Wayne F. "Pourriture noire Guignardia bidwellii". Fiche d'identification de la maladie n° 102GFSG-D4. 2003. Cornell. 24 Oct. 2010
- http://www.nysipm.cornell.edu/factsheets/grapes/diseases/grape_br.pdf
- Ellis, Michael A. "Fiche d'information sur les ressources agricoles et naturelles : Grape Black Rot". Département de pathologie végétale. Université de l'Ohio State Extension. 2008
- http://ohioline.osu.edu/hyg-fact/3000/pdf/HYG_3004_08.pdf
- Molitor, D. (2009). Untersuchungen zur Biologie und Bekämpfung der Schwarzfäule (Guignardia bidwellii) an Weinreben. Gesellschaft zur Förderung der Forschungsanstalt Geisenheim.
- Ries, S. M. (1999). Rapports sur les maladies des plantes : Black Rot of Grape. Integrated Pest Management at the Uni. of Illinois. http://ipm. illinois. edu/diseases/series700/rpd703.
- Spotts, R. A. (1977). Effet de la durée d'humectation des feuilles et de la température sur l'infectivité de Guignardia bidwellii sur les feuilles de vigne. Phytopathology, 67(11), 1378-1381.
- Szabó, M., Csikász-Krizsics, A., Dula, T., Farkas, E., Roznik, D., Kozma, P., & Deák, T. (2023). Pourriture noire du raisin (Guignardia bidwellii)-Une vue d'ensemble. Horticulturae, 9(2), 130.
- http://extension.cropsciences.illinois.edu/fruitveg/pdfs/771-BlackRotOfGrape.pdf
- https://www.missouribotanicalgarden.org/gardens-gardening/your-garden/help-for-the-home-gardener/advice-tips-resources/insects-pests-and-problems/diseases/fruit-spots/black-rot-of-grapes
Les papillons de nuit
Agent pathogène

Lobesia botrana effectue généralement deux à trois générations par an, selon la région. La première génération (mai et juin) n'affecte que les fleurs, de sorte qu'un traitement n'est nécessaire que si les populations de papillons sont particulièrement élevées. La deuxième génération (juillet et août) et la troisième génération causent les dégâts les plus importants, la troisième génération étant particulièrement nuisible car elle coïncide avec la maturation des raisins. Une quatrième génération peut apparaître dans les climats plus chauds, mais le traitement n'est généralement pas nécessaire car il coïncide avec la récolte du raisin.
Le papillon passe l'hiver sous forme de chrysalide dans un cocon et, lorsque les températures augmentent au printemps, les adultes de la première génération émergent, les mâles apparaissant généralement avant les femelles. Le vol de la première génération commence au moment du débourrement et dure 4 à 5 semaines, au cours desquelles l'accouplement a lieu. Un à deux jours après l'accouplement, les femelles pondent entre 80 et 160 œufs.
Les œufs, d'un diamètre de 0,6 à 0,8 mm, sont visibles à l'œil nu. D'abord blanc crème, ils deviennent jaunes au fur et à mesure que l'embryon se développe, avec la couleur noire de la tête de la larve. Les œufs éclosent après 66 degrés-jours Celsius (DDC), soit environ 7 à 11 jours. Les larves tissent des liens entre les parties de la fleur, et leur développement dure de 20 à 30 jours. La nymphose suit et les adultes émergent 6 à 14 jours plus tard.
Le "degré-jour" est calculé en mesurant le degré de dépassement de la température moyenne journalière par rapport à une certaine température de base nécessaire au développement. Les degrés-jours s'accumulent au fur et à mesure que les températures dépassent le seuil de base.
Les papillons adultes mesurent environ 6 à 8 mm de long pour une envergure de 11 à 13 mm. Les femelles sont légèrement plus grandes que les mâles, bien que les deux aient des ailes similaires en mosaïque.
Les œufs des deuxième et troisième générations éclosent plus rapidement, en 3 à 5 jours. Les femelles pondent leurs œufs individuellement sur des baies ombragées et, à l'éclosion, les larves pénètrent dans les baies et les creusent. À l'automne, les nuits de plus de 11 heures déclenchent la diapause, un stade de repos qui permet aux chrysalides de mieux tolérer le froid, ce qui leur permet d'hiverner.
Symptômes
Les chenilles de la première génération se nourrissent des inflorescences de la vigne, creusent les boutons floraux et les enroulent pour les protéger, ce qui provoque des dégâts à l'intérieur de la grappe. Dans la deuxième génération, les larves ciblent les baies en développement, créant ainsi des points d'entrée pour les pathogènes fongiques tels que le Botrytis cinerea. Cette alimentation directe provoque des dégâts visibles, généralement marqués par des taches sombres autour des sites d'alimentation. C'est la troisième génération qui cause les dégâts les plus importants, car les larves pénètrent dans les baies en cours de maturation et s'en nourrissent.
Il reste des baies ratatinées et des excréments de larves. Des lambeaux de tissu épidermique des baies restent attachés de manière lâche aux pédicelles, ainsi qu'une "peau" sèche et creusée des baies.
FieldClimate Modèle
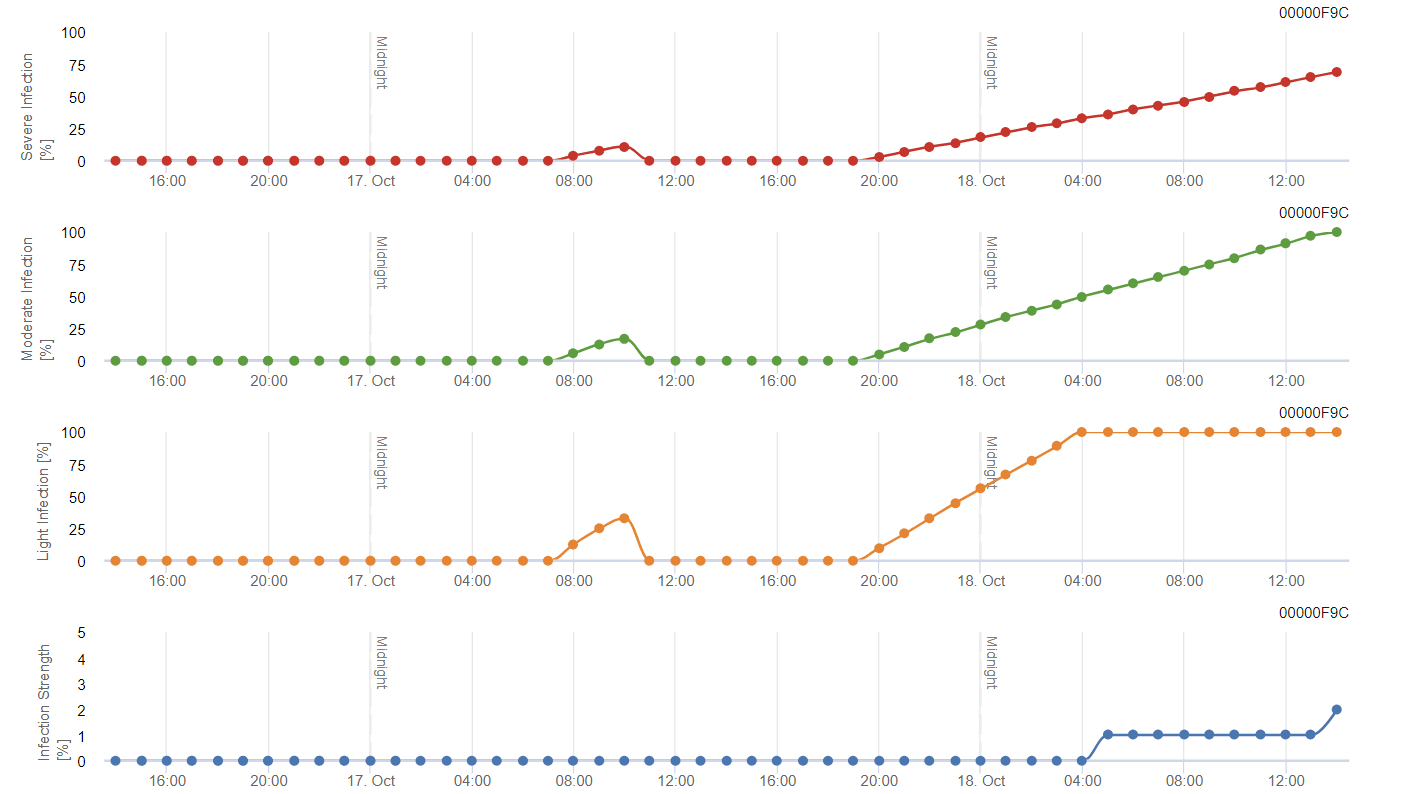
Modèle de pyrale de la vigne
Capteur nécessaire :
- Température de l'air
Le modèle calcule le risque en fonction de la température de l'air. Le premier graphique montre les périodes d'activité de vol avec ponte et les bonnes activités de ponte pour l'insecte. Le deuxième graphique indique la génération à laquelle il faut s'attendre au cours de la période. Dans le troisième graphique, les données climatiques sont affichées et montrent l'accumulation des degrés-jours (températures > 8°C jusqu'à 24°C par heure divisée par 24).
Littérature
- Varela, L. G., Smith, R. J., Cooper, M. L. et Hoenisch, R. W. (2010). Pyrale de la vigne, Lobesia botrana. Napa Valley vineyards. Pract. Winery Vineyard, 2010, 1-5.
- https://ipm.ucanr.edu/invasive-and-exotic-pests/european-grapevine-moth/
- https://www.ages.at/en/plant/plant-health/pests-from-a-to-z/grape-berry-moth
Moisissure grise
Agent pathogène
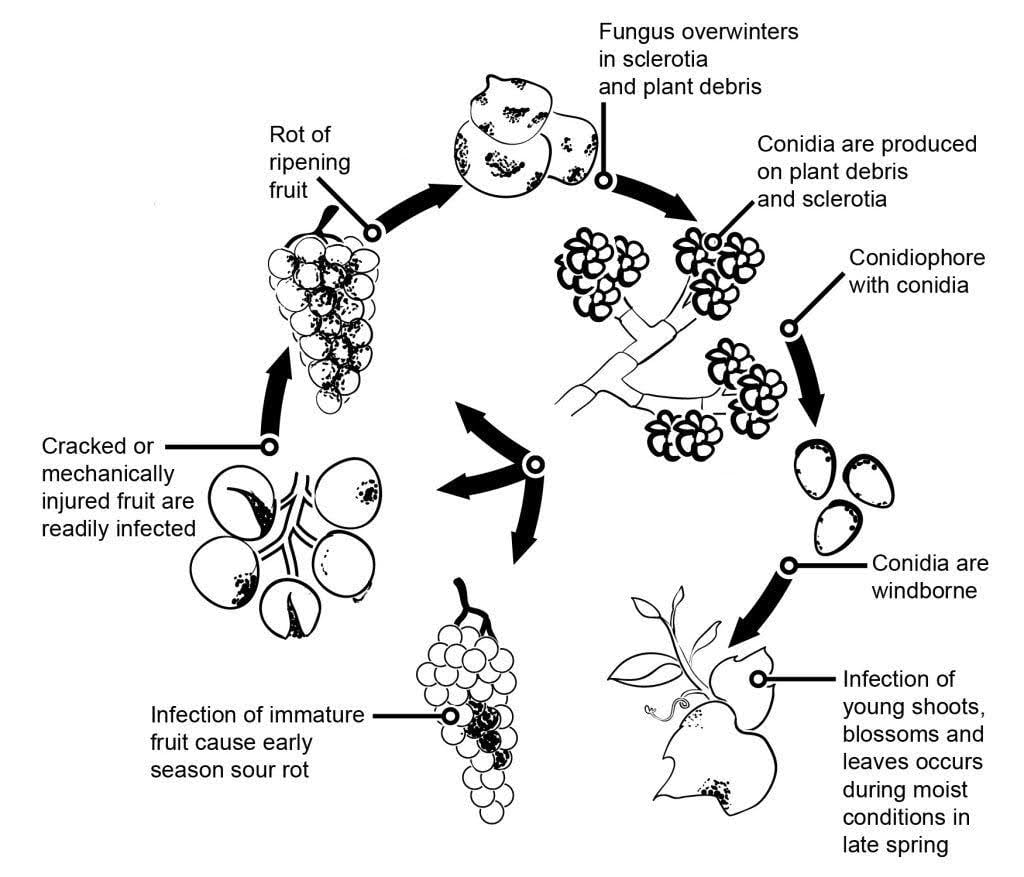
L'agent pathogène de la pourriture grise de la vigne est Botrytis cinerea.
L'épidémiologie de la pourriture grise est fortement influencée par les infections latentes initiées par les infections des fleurs. Différentes voies de transmission de la fleur au fruit ont été identifiées : Le champignon infecte le stylet de la fleur et atteint l'ovule, où il reste latent grâce au mécanisme de défense préformé de la plante. Les infections par les étamines, les pétales et les sépales sont également critiques. B. cinerea peut infecter les étamines et se développer systématiquement vers le réceptacle, se propageant au pédicelle et aux tissus vasculaires des baies. D'autres voies impliquent également la croissance saprophyte du pathogène.
Les mycéliums ou sclérotes hivernants sont les principales sources d'infection au printemps. Les conidies (spores asexuées) sont produites et dispersées par le vent et la pluie. Lorsqu'elles atterrissent, les conidies germent, formant des tubes germinatifs et des appressoria qui pénètrent et infectent la plante. Le champignon peut rester latent jusqu'à ce que le fruit mûrisse et que la teneur en sucre augmente. Les conidies générées par les sources primaires d'inoculum suivent un cycle diurne d'initiation, de production et de dissémination.
Bien que le stade sexuel de B. cinerea soit rarement observé, le pathogène devient plus actif lorsque les baies mûrissent. L'augmentation de la teneur en sucre des baies accroît la sensibilité à l'infection. De la même manière, les fleurs sont très sensibles lorsqu'elles sont sénescentes, l'abondance de pollen augmentant la gravité de l'infection.
Symptômes

La pourriture grise infecte principalement les baies de raisin mûres, qui apparaissent d'abord molles et gorgées d'eau. Avec le temps, les baies deviennent brun rougeâtre et se ratatinent. Dans des conditions favorables, elles se couvrent de masses grises de mycéliums et de conidies fongiques. Les baies saines peuvent également être infectées par contact direct avec des baies malades.
Le champignon peut également provoquer une brûlure de la fleur, ce qui peut entraîner des pertes de récoltes importantes en début de saison. Bien que les infections foliaires soient rares, lorsqu'elles se produisent, elles commencent par des taches vertes ternes le long des nervures, qui finissent par se transformer en lésions nécrotiques.
FieldClimate Modèle
Modèle général de moule gris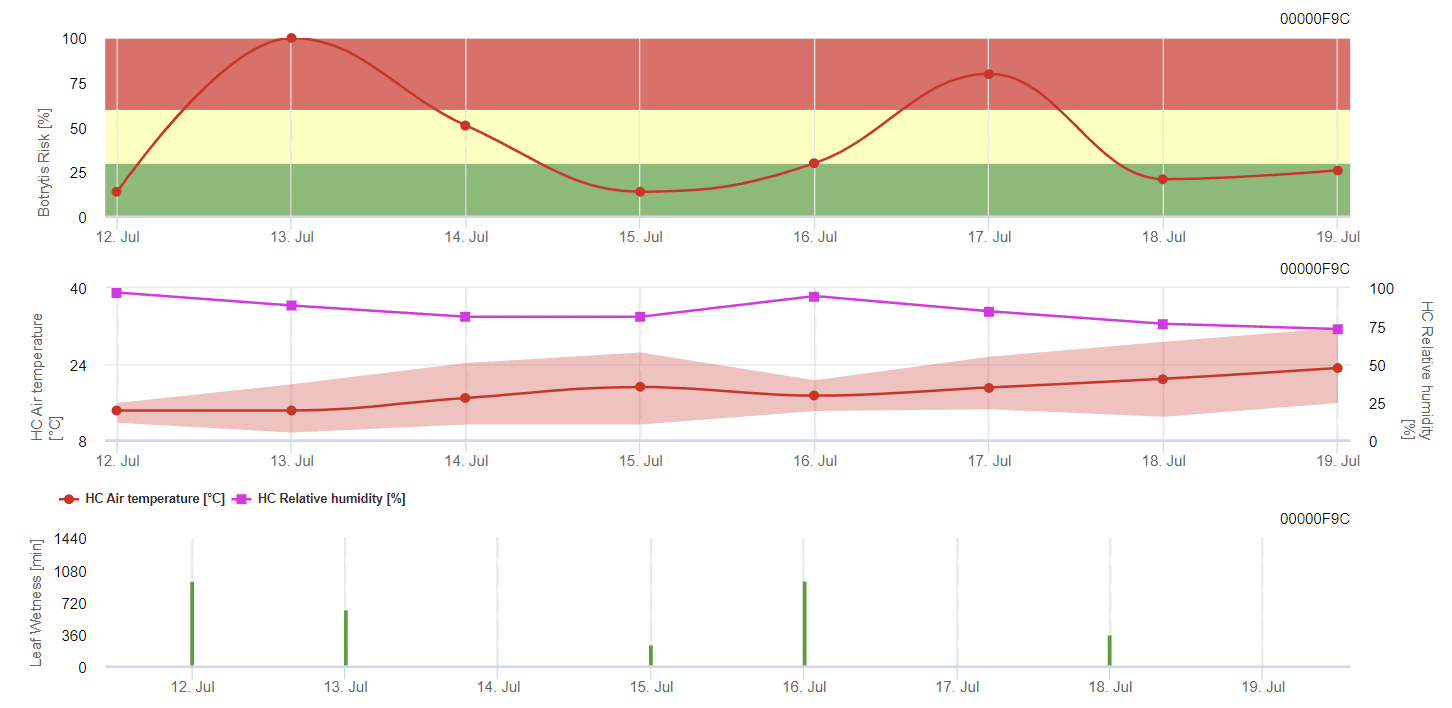
Capteurs nécessaires :
- Température de l'air
- Humidité relative
- Humidité des feuilles
B. cinerea est liée à un climat humide. Le champignon a besoin d'une humidité relative élevée ou de la présence d'eau libre pour s'infecter. Les périodes chaudes avec une longue période d'humidité des feuilles augmentent le risque de B. cinerea, tandis que les périodes sèches le réduisent. L'infection a lieu sur les jeunes pousses pendant les longues périodes humides ou les tempêtes de grêle dommageables.
Le modèle calcule le risque dans une valeur de 0 à 100%. Cette valeur indique la pression de B. cinerea à ce moment-là - si nous avons une valeur de 100%, cela signifie qu'il y a eu plusieurs fois une période d'humidité suffisamment longue pour infecter les tissus sensibles. Nous calculons ce que l'on appelle les "points humides" entre l'humidité des feuilles et la température, avec un maximum initial de 38 400 points (début de la saison, qui affiche un risque de 30%). Après cette période, chaque période humide avec environ 4000 points humides augmente le risque de 10%, ou au contraire, chaque période sèche réduit le risque de ⅕ de la valeur précédente.
Littérature
- Broome, J. C., English, J. T., Marois, J. J., Latorre, B. A., & Aviles, J. C. (1995). Development of an infection model for Botrytis bunch rot of grapes based on wetness duration and temperature. Phytopathology, 85(1), 97-102.
- Elmer, P. A. et Michailides, T. J. (2007). Épidémiologie de Botrytis cinerea dans les cultures de vergers et de vignes. In Botrytis : biology, pathology and control (pp. 243-272). Dordrecht : Springer Netherlands.
- Williamson, B., Tudzynski, B., Tudzynski, P. et Van Kan, J. A. (2007). Botrytis cinerea : la cause de la pourriture grise. Molecular plant pathology, 8(5), 561-580.
- Ciliberti, N., Fermaud, M., Roudet, J. et Rossi, V. (2015). Les conditions environnementales affectent l'infection par Botrytis cinerea des baies de raisin matures plus que la souche ou le génotype du transposon. Phytopathology, 105(8), 1090-1096.
Anthracnose
Agent pathogène
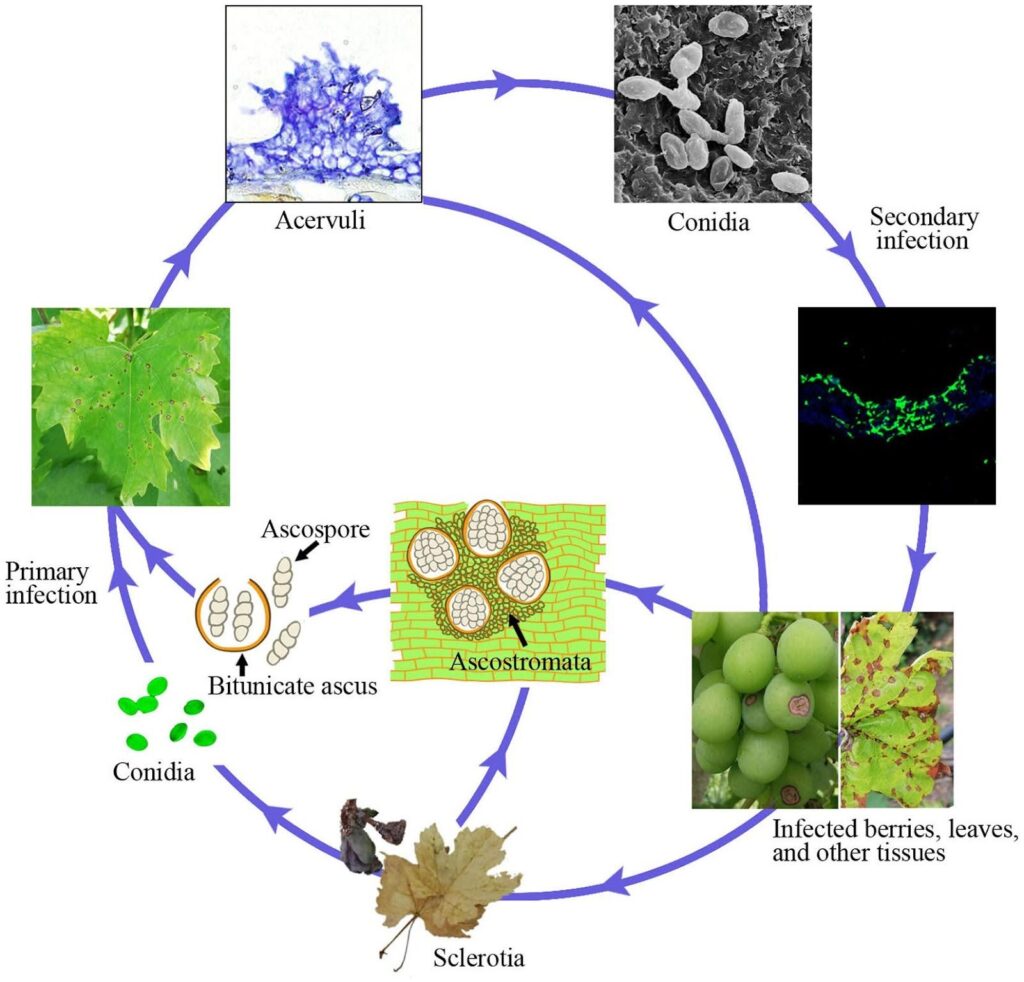
L'anthracnose de la vigne est causée par le pathogène Elsinoe ampelina.
Les cannes infectées sont la principale source de la maladie. Les sclérotes et les mycéliums qui survivent dans les lésions et les baies pendant l'hiver deviennent actifs au printemps et produisent des ascospores (spores sexuelles) et des conidies (spores asexuées) dans des conditions humides (pluie ou rosée pendant 24 heures) à une température comprise entre 2 et 40°C.
Ces spores sont dispersées dans les nouveaux tissus par les éclaboussures de pluie et le vent et, une fois qu'elles ont atterri, elles germent et forment des tubes germinatifs et des appressoria, déclenchant ainsi une nouvelle infection. Elles peuvent infecter les nouvelles feuilles, les pousses, les vrilles et les jeunes baies. Le temps chaud réduit la durée d'humidité nécessaire à l'infection initiale et à la période d'incubation. La germination optimale des spores se produit à 25~30°C, avec un minimum de 3~4 heures d'humidité des feuilles. Lors d'infections à une température d'environ 10°C, la période d'incubation est d'environ 14 jours.
Au fur et à mesure que la colonisation progresse, des acervules émergent et de nouvelles conidies sont produites, qui servent d'inoculum d'infection secondaire. Elles sont responsables d'une infection rapide et ultérieure au cours de la saison.
Symptômes
E. ampelina attaque les parties aériennes et succulentes de la vigne, y compris les sarments, les feuilles, les pétioles, les vrilles, les rachis et les baies ; les lésions sur les sarments et les baies sont les plus courantes. Les raisins présentent une résistance ontogénique aux champignons, de sorte que les jeunes tissus sont plus sensibles.
De petites taches brun-rouge apparaissent d'abord et s'agrandissent par temps humide, devenant légèrement enfoncées avec un centre gris entouré d'une marge foncée. Parfois, les symptômes peuvent ressembler à des blessures causées par la grêle. Le centre nécrosé des feuilles tombe généralement, donnant l'impression d'un "trou de tir".
En cas d'infection grave, les plantes peuvent présenter une défoliation précoce, un ralentissement de la croissance des cannes, une cassure des tiges, une chute des baies et un retard dans le développement et la maturation des baies.
FieldClimate Modèle
Modèle d'anthracnose en viticulture
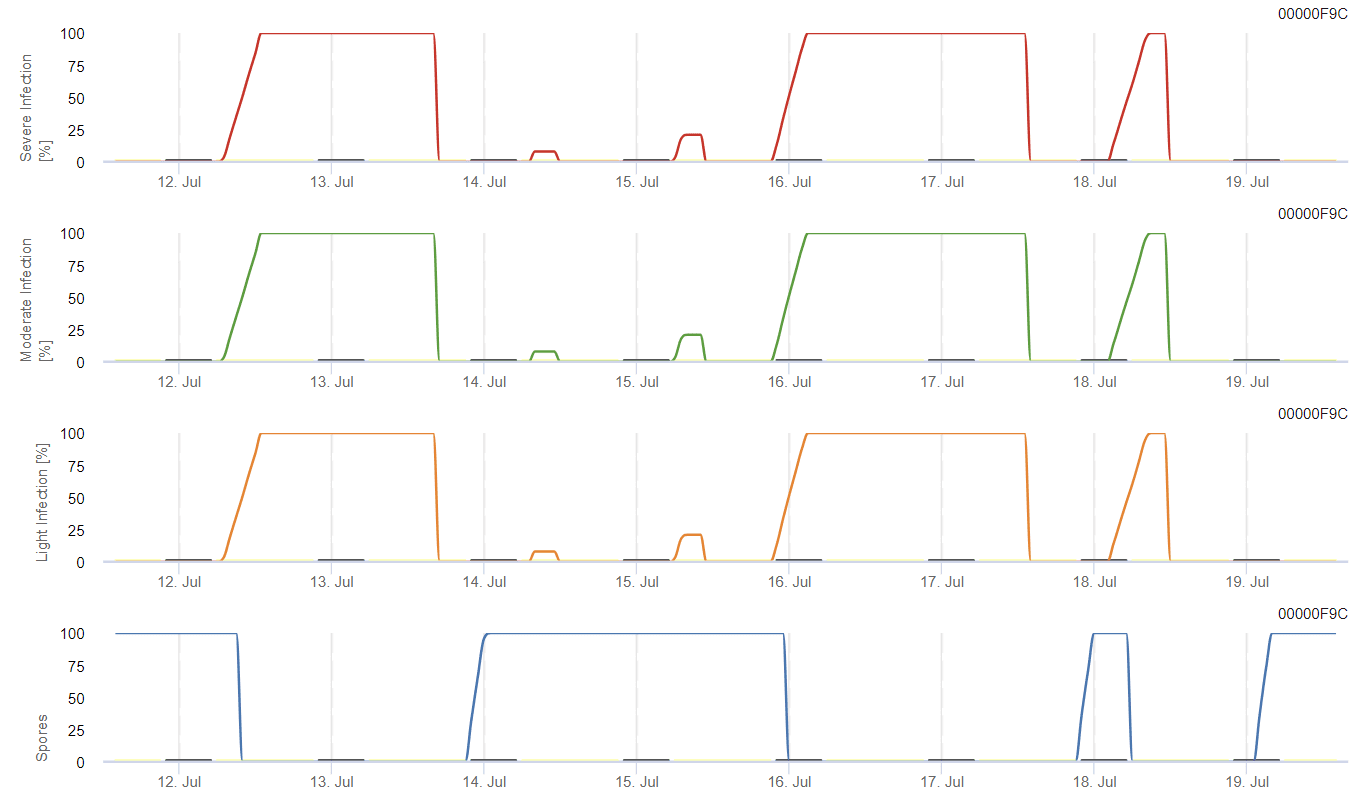
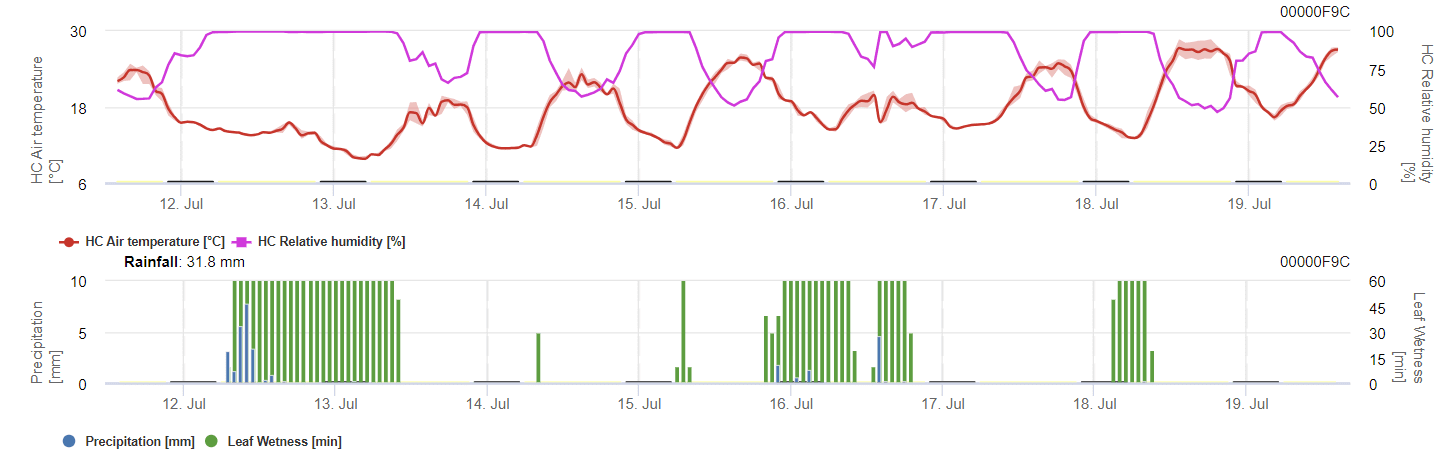
Capteurs nécessaires :
- Température de l'air
- Humidité relative
- Humidité des feuilles
- Précipitations
Le modèle calcule le risque d'anthracnose en tenant compte de la température de l'air, de l'humidité relative, de l'humidité des feuilles et des précipitations.
Le développement possible d'une infection faible, modérée et sévère est représenté dans des graphiques distincts. On considère qu'une infection est terminée lorsque la courbe croissante atteint 100%. Le dernier graphique montre la sporulation de E. ampelina; si la valeur atteint 100%, on suppose que des spores de E. ampelina sont présents.
Pour que les spores hivernantes se développent, les conditions doivent correspondre à une plage de température de 2 à 40°C, à une humidité relative supérieure à 90%, ou à l'humidité des feuilles. Lorsque le développement des spores atteint 100%, l'infection commence à être calculée. La gravité de l'infection dépend des conditions humides (événements pluvieux). Cependant, si l'humidité tombe en dessous de 50%, le développement des spores et l'infection cessent d'être calculés.
Littérature
- Li, Z., Dos Santos, R. F., Gao, L., Chang, P. et Wang, X. (2021). Situation actuelle et perspectives d'avenir de l'anthracnose de la vigne causée par Elsinoe ampelina : Une maladie importante dans les régions viticoles humides. Molecular Plant Pathology, 22(8), 899-910.
PHOMOPSIS TACHE DE LA CANNE ET DE LA FEUILLE
Agent pathogène
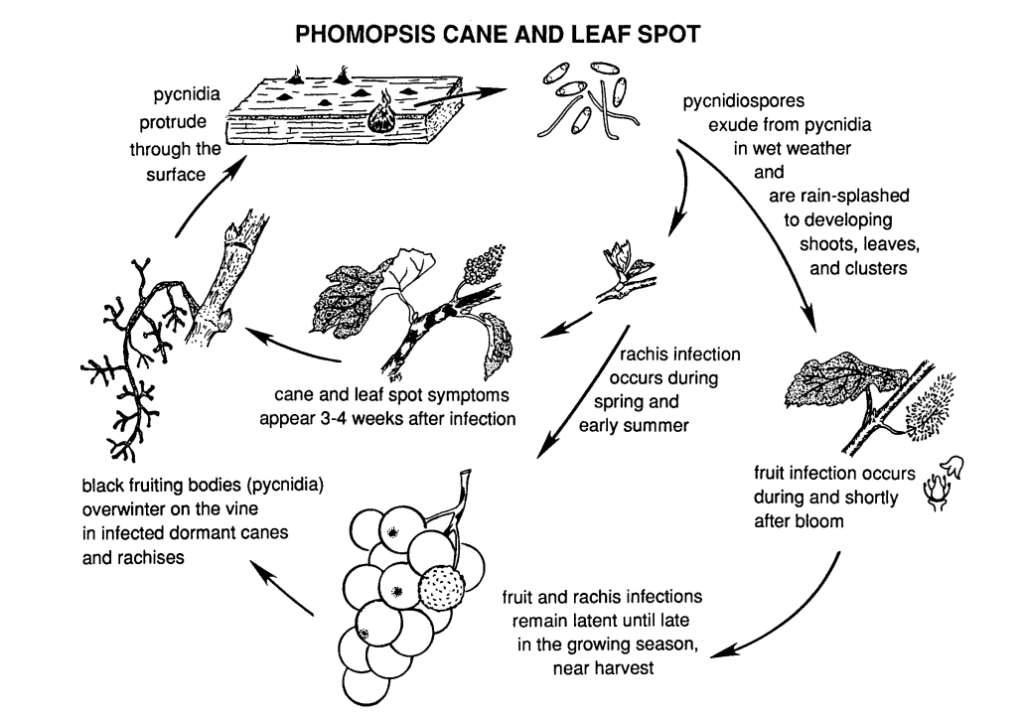
La tache de la canne et de la feuille de Phomopsis sur la vigne est causée par Phomopsis viticola.
Le champignon passe l'hiver dans les parties ligneuses de la vigne et redevient actif au printemps suivant. Lorsque les températures augmentent et que les pluies de printemps commencent, les spores sont libérées des structures d'hivernage appelées pycnides. Les spores sont dispersées par la pluie et le vent sur de nouveaux tissus et l'infection se propage.
La période d'infection primaire coïncide généralement avec les pluies du début du printemps et commence peu après le débourrement, lorsque les pousses présentent un stade de croissance précoce. Les jeunes pousses, les extrémités des pousses, les grappes de fruits et le rachis sont tous vulnérables à l'infection. Bien que les extrémités des pousses puissent être infectées tout au long de la saison de croissance, les infections sont plus fréquentes entre le débourrement et la floraison. Dans les fruits, le pathogène peut rester dormant jusqu'à ce que les fruits mûrissent. La période d'incubation dure généralement de 3 à 4 semaines.
Symptômes
Sur les feuilles et les pétioles, de petites taches sombres avec un centre noir entouré d'un bord jaune apparaissent et finissent par fusionner. Les feuilles basales peuvent se déformer, se froisser et ne pas atteindre leur taille maximale. Lorsque les pétioles sont fortement infectés, ils jaunissent et tombent, entraînant la chute des feuilles. Les feuilles créent un effet de parapluie qui réduit les infections ultérieures par les spores.
Des taches similaires apparaissent sur les pousses, provoquant la fissuration des couches épidermiques au niveau des sites d'infection. Au fur et à mesure que les taches fusionnent, les zones infectées des pousses acquièrent une texture galeuse. Dans les cas les plus graves, les pousses peuvent être rabougries, se casser ou même mourir.
Les lésions du rachis provoquent un affaissement et une fragilisation de celui-ci. Après une période de dormance en été, le champignon se réactive au début de l'automne, entraînant la pourriture des baies et des grappes. Bien que les infections des fruits ne soient pas étendues en général, des taches se forment sur les baies, souvent accompagnées de points noirs (pycnides) sur la peau des baies. En conditions humides, des masses de spores jaunes peuvent suinter des pycnides, entraînant une décoloration des fruits, une texture rugueuse et une momification.
Le bois infecté présente un aspect blanchi pendant la saison de dormance. Les cannes et les éperons gravement infectés présentent des décolorations sombres mélangées à des zones blanchies dans l'écorce. Des pycinides peuvent également percer la surface. Les basses températures, ainsi que l'altération des fonctions du phloème et du xylème, affaiblissent et tuent les tiges, les rameaux et les bourgeons.
FieldClimate Modèle
Modèle d'infection par Phomopsis en viticulture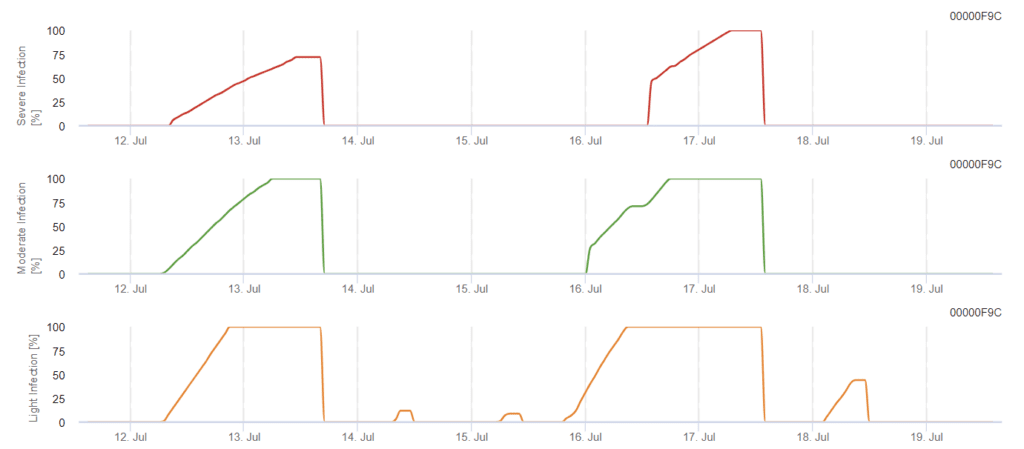
Capteurs nécessaires :
- Température de l'air
- Humidité relative
- Humidité des feuilles
- Précipitations
Le modèle détermine le risque d'infection par Phomopsis à des températures comprises entre 5 et 35°C et dans des conditions humides (mouillure des feuilles, humidité relative élevée). La gravité de l'infection dépend de la quantité de pluie (plus de 2 mm), car les spores sont distribuées plus rapidement sur le matériel végétal sain. Lorsque l'infection par 100% est montrée, cela indique que les conditions optimales ont été mesurées sur le terrain pour infecter les tissus végétaux et qu'il faut donc prendre en compte les mesures de protection des plantes.
Littérature
- https://agriculture.vic.gov.au/biosecurity/plant-diseases/grapevine-diseases/phomopsis-cane-and-leaf-spot-of-grapevines
- Bettiga, L. J. (Ed.). (2013). Grape pest management (Vol. 3343). Publications de l'UCANR.
- Pscheidt, J. W. et Pearson, R. C. (1991). Phomopsis cane & leaf spot.
Équipement recommandé
Vérifiez quel jeu de capteurs est nécessaire pour surveiller les maladies potentielles de cette culture.
