Banane modèles de maladies
La banane est l'un des fruits les plus importants au monde. Sous sa forme sucrée, la banane Dollar, ou sous sa forme non sucrée, elle fait partie intégrante du régime alimentaire des habitants des pays tropicaux. Depuis la fin du XIXe siècle, la banane commence à devenir le fruit le plus important du commerce mondial. Les bananes produites en Amérique centrale et dans les Caraïbes ont commencé à être exportées vers les États-Unis et l'Europe. Aujourd'hui, la banane est un élément important de la base fruitière des pays industrialisés. Avec l'augmentation des revenus en Chine et en Europe de l'Est, de nouveaux marchés créent de nouvelles demandes pour les bananes.
Il y a deux points importants maladies des taches foliaires dans les bananes : Sigatoka jaune et Sigatoka noir. La sigatoka jaune, causée par le champignon Mycosphaerella musicola, s'est répandue dans toutes les zones de culture de la banane, tandis que la sigatoka noire, causée par le champignon M. fijiensis var. difformis a été trouvée aux Fidji. Le Sigatoka noir est beaucoup plus virulent que le Sigatoka jaune et c'est pour cette raison qu'il est devenu la maladie la plus importante du bananier dans la plupart des pays producteurs de bananes.
Maladie du sigatoka noir
Le travail est basé sur les deux articles suivants :
- Maladie des taches noires ; Pests and Diseases of American Samoa Number 10, American Samoa Community College Community & Natural Resources Cooperative Research & Extension. 2004
- Le sigatoka noir, un fil conducteur de plus en plus important pour la culture des bananes ; Douglas H. Marín, Del Monte Fresh Produce ; Ronald A. Romero, Chiquita Brands ; Mauricio Guzmán, National Banana Corporation of Costa Rica ; Turner B. Sutton, North Carolina State University, Raleigh
La striure noire des feuilles (BLS), ou "Sigatoka noir", est la maladie foliaire la plus dommageable pour les bananiers dans le monde entier. La plupart des régions tropicales et subtropicales sont touchées, avec des pertes signalées de 30 à 50%. Le premier cas de BLS dans le Pacifique a été signalé il y a 40 ans dans la vallée de Sigatoka, à Fidji. La plupart des fongicides utilisés dans la production de bananes servent à lutter contre le BLS. La banane 'Williams' de type Cavendish, cultivée par la plupart des producteurs commerciaux, est très sensible à cette maladie fongique. Les plantes infectées ont moins de feuilles, ce qui se traduit par des fruits moins nombreux et plus petits, une récolte retardée, un mûrissement prématuré et des fruits de moindre qualité.
Impact potentiel
Le sigatoka noir provoque la destruction des tissus des feuilles de bananier, ce qui affecte les capacités photosynthétiques de la plante et peut réduire les rendements jusqu'à 50%. Le sigatoka noir est l'un des principaux facteurs responsables du déclin des exportations de bananes dans les pays du Pacifique Sud. Les plantations commerciales produisant des bananes pour l'exportation doivent maintenir un programme coûteux de pulvérisation de fongicides pour lutter contre le sigatoka noir, et ont été critiquées pour des raisons environnementales et de santé humaine. Cependant, s'ils ne sont pas contrôlés, les fruits produits sur des plantes malades peuvent mûrir prématurément pendant le transport et causer des pertes supplémentaires. Les ravages de la maladie ont été contrôlés par des pulvérisations chimiques les années suivantes (15-17 applications de fongicides), mais cela a considérablement augmenté le coût de production.
Plantes affectées
Les symptômes définitifs du sigatoka noir n'ont été observés que sur Musa (Bananes), Musa paradisiaca (Plantains), Musa acuminata (banane sauvage) et Musa acuminata (subsp. bantesii et subsp. zebrina). Les cultivars diffèrent dans leur réaction au pathogène. L'immunité n'est pas connue et il est possible que d'autres espèces et sous-espèces sauvages de Musa sont infectés, mais la maladie ne se développe pas de manière significative. Mycosphaerella fijiensis peut également s'attaquer aux jeunes plants de bananes sauvages.
Saison d'apparition
Les spores du sigatoka noir se forment facilement pendant les étés tropicaux et subtropicaux ou dans des conditions d'humidité élevée. humidité et précipitations élevéessurtout s'il y a une pellicule d'eau libre sur les feuilles. Le principal moyen de dissémination est la pluie ou les éclaboussures de spores, mais plus tard dans le développement de la maladie, les spores sont également rejetées de force dans les courants d'air. L'infection se produit sur les feuilles les plus jeunes de la plante pendant et immédiatement après le déploiement, mais les feuilles plus âgées sont plus propices au développement de la maladie. Les symptômes visuels évidents apparaissent environ 15-20 jours après l'infection initiale.
Symptômes
Les premiers symptômes apparents de l'infection des feuilles sont de courtes lignes brun-rouge d'environ 2 mm de long. Ces lignes se transforment en stries brunes de 20 à 30 mm de long qui s'élargissent en taches elliptiques, brunes sur la face inférieure de la feuille, noires sur la face supérieure. Les taches sont légèrement enfoncées et entourées d'un halo jaunâtre. Ensuite, le centre de la grande tache devient gris, bordé d'une ligne noire et d'un halo jaune. Enfin, les taches fusionnent, tuant la feuille.
Épidémiologie
Les conidies et les ascospores jouent toutes deux un rôle dans la propagation de la maladie. Les conidies se forment dans des conditions d'humidité élevéesurtout s'il y a une pellicule d'eau libre sur les feuilles. Elles se forment pendant le développement des premiers stades de la maladie (en particulier pendant les stades 2, 3 et 4). Les principaux moyens de dispersion sont la pluie et les éclaboussures ; les conidies ne sont pas détachées par le vent. Les conidies sont associées principalement à la dissémination locale de la maladie et sont importantes pendant les périodes de forte humidité, de fortes rosées fréquentes et d'averses intermittentes.
Parce que M. fijiensis produit relativement peu de conidies, les ascospores sont considérées comme plus importantes dans la dissémination du Sigatoka noir (4,20). Cependant, Jacome et al. (10) affirment que les conidies sont capables de provoquer des quantités significatives de maladie, et que les symptômes de la maladie sont identiques à ceux provoqués par l'infection par les ascospores. Il a indiqué que les conidies deviennent plus importantes pendant les périodes sèches lorsque le développement de la maladie est retardé en raison de la présence de conditions climatiques moins favorables (10). Les ascospores sont le principal moyen de la dispersion sur de plus longues distances à l'intérieur des plantations et dans de nouvelles zones, et constituent le mode de propagation habituel pendant les périodes prolongées de temps humide (3,4,6,10, 11,15).
Les ascospores sont produites dans des pseudothèces dans des lésions matures, qui sont communes sur les feuilles plus âgées de la plante ou sur des feuilles mortes gisant sur le sol. Meredith et Lawrence (14) signalent que les pseudothèces sont produits sur les deux faces de la feuille, mais qu'ils sont plus nombreux sur la face adaxiale. A l'inverse, Gauhl et al. (6) ont trouvé que plus de pseudothèces et d'ascospores étaient produits sur la surface abaxiale de la feuille. Bien que Burt et al. (2) aient trouvé qu'environ 4,5 ascospores sont libérées par pseudothèce, ce nombre semble très faible si l'on considère la forte concentration d'inoculum présente dans l'air après la pluie (4).
Libération d'ascospores
Nécessite la présence de une pellicule d'eau provenant de la pluie ou de la rosée qui imprègne les pseudothèces et entraîne l'éjection forcée des ascospores à travers la couche limite de la feuille, où elles sont disséminées par les courants d'air (15,20). La maturation des pseudothèces nécessite une saturation des tissus foliaires morts pendant environ 48 h (3,4,7,10,11,15). Dans les conditions hawaïennes, les concentrations d'ascospores augmentent pendant la nuit, atteignent leur maximum vers 0600 h et diminuent de manière significative pendant la journée. Les jours de pluie, les concentrations maximales se produisaient peu après le début de la pluie. Les augmentations saisonnières des concentrations moyennes journalières d'ascospores sont associées à une augmentation des précipitations et de l'humidité relative (15). Gauhl (4), travaillant sur des bananiers, a rapporté des résultats similaires dans les conditions du Costa Rica. Alors que Meredith et al. (15) n'ont pas trouvé de preuves que la production ou la libération d'ascospores était affectée par les températures minimales, Gauhl (4) a déterminé qu'il y avait une réduction de la production d'inoculum pendant les mois les plus secs (ou les moins pluvieux) de l'année dans la zone caraïbe du Costa Rica, qui est aussi la saison où les températures sont les plus basses. Les ascospores sont dispersées par le vent ; cependant, la dispersion sur de longues distances est limitée à quelques centaines de kilomètres en raison de leur sensibilité aux rayons ultraviolets (17). Il n'a pas été démontré de relation cohérente entre la libération des ascospores et le développement de la maladie, ce qui limite l'utilité du piégeage des spores pour la prévision de la maladie (5,11). Les ascospores se déposent principalement sur la surface inférieure de la feuille pendant le déploiement d'une nouvelle feuille, produisant une bande d'infections sur le côté qui est exposé en premier, ce qui reflète le dépôt accru de spores sur la feuille cylindrique de la candela pendant son déploiement par rapport à l'ensemble de la lamelle ouverte de la feuille. Par conséquent, la plupart des infections se produisent sur la surface abaxiale des feuilles (3,7).
Infection
Les tubes germinatifs mettent environ 48 à 72 heures pour pénétrer les stomates (1,20), bien que le champignon puisse se développer de manière épiphyte à la surface des feuilles pendant 6 jours avant de pénétrer réellement dans les feuilles (1). Infection réussie est encouragée par des les périodes de forte humidité et la présence d'eau libre sur les feuilles (3,7,13). La germination est maximale en présence d'eau libre. Les conidies germent dans une gamme plus large d'humidité relative (92 à 100%) que les ascospores (98 à 100%). L'effet de l'humidité température sur la germination peut être caractérisée par une fonction de réponse quadratique, avec un optimum estimé à 26,5°C (10). Stover (21) a observé une croissance maximale des tubes germinatifs d'ascospores à 26 à 28°C après 24 heures d'incubation. Jacome et Schuh (8,9) ont signalé que les feuilles plus âgées étaient plus sensibles ; cependant, E. Bureau (communication personnelle) et Romero (18) ont observé que les feuilles plus jeunes sont plus sensibles (de la première à la troisième) que les feuilles plus âgées.
Période d'incubation
Le délai entre l'infection et l'apparition des symptômes varie en fonction des conditions climatiques et de la sensibilité de la plante (68). Chez le bananier, on estime que le moment de l'infection des feuilles coïncide avec l'émergence d'une nouvelle feuille à partir de l'apex du pseudo-tronc (20). Dans des conditions très favorables au Costa Rica, et avec un hôte sensible, le période d'incubation peut être aussi courte que 13 à 14 jours, alors que pendant les périodes de climat défavorable, la durée de la période d'incubation peut s'étendre jusqu'à 35 jours. Des rapports similaires existent au Nigéria sur les bananes plantains (16). Pendant la saison des pluies, la période d'incubation était de 14 jours, mais pendant la saison sèche, elle était de 24 jours. La durée de la période d'incubation varie également en fonction de la sensibilité du cultivar à M. fijiensis. La période d'incubation était respectivement de 26,2 et 25,1 jours chez les cultivars FHIA 1 et FHIA 2, deux hybrides synthétiques tétraploïdes développés par la FHIA, contre 22,4 jours chez le cultivar sensible Grande Naine (19).
Après avoir pénétré dans la feuille, les hyphes de l'espèce <M. fijiensis colonisent les cellules adjacentes pendant environ 7 jours sans qu'il n'y ait de signe de perturbation des cellules. Les hyphes végétatifs peuvent émerger des stomates et se développer à la surface de la feuille et pénétrer dans les stomates adjacents ou produire des conidiophores et des conidies. Cette croissance épiphyte permet au champignon de coloniser les tissus foliaires adjacents, ce qui entraîne un développement rapide des symptômes (4,20). M. fijiensis a une plus grande capacité à pénétrer plusieurs stomates que le M. musicolace qui se traduit par des taches plus importantes qu'avec le premier pathogène (20).
Période de latence
Bien que des conidies puissent être produites dans des lésions présentant des symptômes précoces du M. fijiensis Pour que les champignons puissent se développer et contribuer à l'épidémie, la période de latence est définie par le moment où le champignon commence à produire des lésions avec des pseudothèces et des ascospores matures, qui sont la principale source d'inoculum. Comme la période d'incubation, la période de latence varie également en fonction des conditions météorologiques, de la sensibilité de l'hôte et de l'intensité des infections. La période de latence varie de 25 jours pendant la saison des pluies (juin à décembre) à 70 jours pendant la saison sèche à Guapiles, au Costa Rica. Lorsque les conditions météorologiques sont très favorables à la décharge des ascospores et à l'infection, de nombreuses infections se produisent sur les feuilles. Lorsque les infections sont denses, elles fusionnent rapidement à un stade de développement très précoce, accélérant l'apparition de taches matures caractérisées par la présence de pseudothèces et d'ascospores (22). Dans ces conditions, les feuilles sont rapidement et sévèrement endommagées. La période de latence varie également en fonction du niveau de résistance. Par exemple, le temps écoulé entre l'émergence des feuilles et le premier symptôme de tache mature dans les mêmes conditions naturelles pour le cultivar Curraré, une banane à cuire appartenant au sous-groupe plantain, était de 44 jours contre 34 jours pour le cultivar Valery, une banane appartenant au sous-groupe Cavendish (4). Le terme "temps de développement de la maladie" est largement utilisé dans la littérature sur la banane sous les tropiques pour désigner la période de latence, et il est défini comme le temps écoulé entre l'infection et la formation de taches matures. Un autre terme couramment utilisé dans la littérature sur la banane est "le temps d'évolution des symptômes" ou "la période de transition", qui correspond au temps écoulé entre les premiers symptômes et l'apparition des taches matures (6). Le temps d'évolution des symptômes donne une bonne indication de la vitesse à laquelle la maladie progresse sur les feuilles.
La littérature :
- Beveraggi, A. 1992. Etude des interactions hôte-parasite chez des bananiers sensibles et résistants inoculés par Cercospora fijiensis responsable de la maladie des raies noires. Thèse de 3ème cycle. Université de Montpellier, Montpellier, France.
- Burt, J. P. A., Rosenberg, L. J., Rutter, J., Ramírez, F., et González, O. H. 1999. Prévision de la dissémination aérienne de Mycosphaerella fijiensis, cause de la maladie du Sigatoka noir sur bananier : Estimations du nombre de périthèces et d'ascospores. Ann. Appl. Biol. 135:369-377.
- Fullerton, R. A. 1994. Sigatoka Leaf Diseases, pages 12-14 dans : Compendium of Tropical Fruit Diseases. R. C. Ploetz, G. A. Zentmyer, W. T. Nishijinia, K. G. Rohrbach, et H. D. Ohr, eds. American Phytopathological Society, St. Paul, MN.
- Gauhl, F. 1994. Epidémiologie et écologie du Sigatoka noir (Mycosphaerella fijiensis Morelet) sur plantain et bananier (Musa spp.) au Costa Rica, Amérique Centrale. INIBAP, Montpellier, France.
- Gauhl, F. 2002. Les pièges à spores sont-ils un outil utile pour prédire le développement de la maladie de Sigatoka dans les bananeraies commerciales ? Page 22 in : Int. Workshop Mycosphaerella Leaf Spot Dis. Bananas, 2nd - Programme and Abstracts. (Abstr.)
- Gauhl, F., Pasberg-Gauhl, C., et Jones, D. R. 2000. Disease cycle and epidemiology. Pages 56-62 in : Diseases of Banana, Abacá and Enset. D. R. Jones, ed. CAB International, Wallingford, UK.
- González, M. 1987. Enfermedades del cultivo del banano. Oficina de Publicaciones de la Universidad de Costa Rica, San José.
- Jacome, L. H., et Schuh, W. 1992. Effets de la durée d'humectation des feuilles et de la température sur le développement de la maladie de Sigatoka noir sur les bananiers infectés par Mycosphaerella fijiensis var. difformis. Phytopathology 82:515-520.
- Jacome, L. H., et Schuh, W. 1993. Effet de la température sur la croissance et la production de conidies in vitro, et comparaison de l'infection et de l'agressivité in vivo parmi les isolats de Mycosphaerella fijiensis var. difformis. Trop. Agric. 70:51-59.
- Jacome, L. H., Schuh, W., et Stevenson, R. E. 1991. Effet de la température et de l'humidité relative sur la germination et le développement des tubes germinatifs de Mycosphaerella fijiensis var. difformis. Phytopathology 81:1480-1485.
- Jeger, M. J., Eden-Green, S., Thresh, J. M., Johanson, J. M., Waller, J. M., et Brown, A. E. 1995. Banana diseases. Pages 317-381 in : Bananas and Plantains. S. Gowen, ed. Chapman & Hall, Londres.
- Marín, D. H., et Romero, R. A. 1992. El combate de la Sigatoka negra. Boletín No. 4, Departamento de Investigaciones, Corporación Bananera Nacional, Costa Rica.
- Mayorga, M. H. 1990. La Raya negra (Mycosphaerella fijiensis Morelet) del plátano y del banano. I. Ciclo de vida del patógeno bajo las condiciones del Urabá. Revista ICA 25:69-77.
- Meredith, D. S., et Lawrence, J. S. 1969. Maladie de la strie noire du bananier (Mycosphaerella fijiensis) : Symptômes de la maladie à Hawaii, et notes sur l'état conidien du champignon responsable. Trans. Br. Mycol. Soc. 52:459-476.
- Meredith, D. S., Lawrence, J. S., et Firman,I. D. 1973. Ascospore release and dispersal on black leaf streak disease of bananas (Mycosphaerella fijiensis). Trans. Br. Mycol. Soc. 60:547-554.
- Mobambo, K. N., Gauhl, F., Pasberg-Gauhl, C., et Zuofa, K. 1996. Évaluation de l'effet de la saison et de l'âge des plantes sur la réaction du plantain à la maladie de Sigatoka noir. Crop Prot. 15:609- 614.
- Parnell, M., Burt, P. J. A., et Wilson, K. 1998. The influence of exposure to ultraviolet radiation in simulated sunlight on ascospores causing black Sigatoka disease of banana and plantain. Int. J. Biometeorol. 42:22-27.
- Romero, R. A. 1995. Dynamique des populations de Mycosphaerella fijiensis résistantes aux fongicides et épidémiologie de la Sigatoka noire du bananier. Thèse de doctorat. North Carolina State, Raleigh.
- Romero, R. A., et Sutton, T. B. 1997. Réaction de quatre génotypes de Musa à trois températures à des isolats de Mycosphaerella fijiensis provenant de différentes régions. Plant Dis. 81:1139-1142.
- Stover, R. H. 1980. Sigatoka leaf spot of bananas and plantains. Plant Dis. 64:750-756.
- Stover, R. H. 1983. The effect of temperature on ascospore germ tube growth of Mycosphaerella musicola and Mycosphaerela fijiensis var. difformis. Fruits 38:625-628.
Modèle d'infection par le sigatoka noir
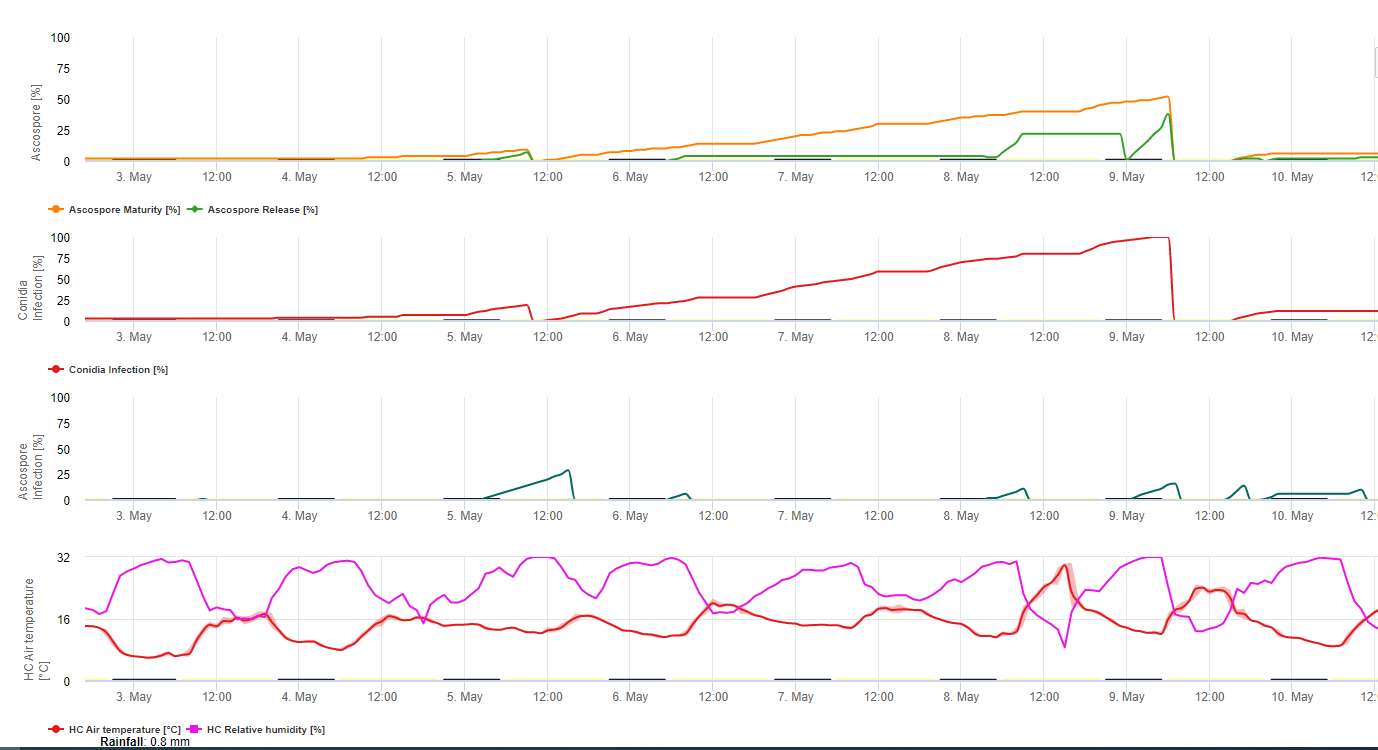
Le modèle d'infection Sigatoka sur FieldClimate.com consiste en un modèle pour :
- Formation des ascospores
- Émission d'ascospores
- Infection par les ascospores
Le modèle de formation des conidies utilise l'humidité relative et la température de l'air. La formation de conidies se produit si l'humidité relative est égale ou supérieure à 70%. La vitesse de formation des conidies dépend de la température. La température optimale pour la formation des conidies est de 27°C à 30°C. À cette température maximale, les conidies se formeront si l'humidité relative est de 70% pendant plus de 24 heures. Si la température est plus froide ou plus chaude, la formation maximale des conidies prendra 32 heures.
Le modèle de formation des ascospores utilise également la température et l'humidité relative. La formation d'ascospores a lieu si l'humidité relative est égale ou supérieure à 70%. La température optimale se situe entre 27 °C et 30 °C. À cette température, le nombre maximum d'ascospores est atteint après 48 heures. A des températures plus basses, il faut 2 jours pour former le maximum d'ascospores.
La décharge d'ascospores a lieu pendant la pluie. La plus grande quantité d'ascospores est libérée au début de la pluie. Par conséquent, les spores seront libérées au début de l'infection. La quantité d'ascospores libérées est limitée au nombre d'ascospores formées.
L'infection a lieu pendant les périodes d'humidité des feuilles ou d'humidité relative supérieure à 90%. Sous une température optimale, l'infection sera terminée après 12 heures de conditions humides. Si la température n'est pas aussi élevée, il faudra 15 à 24 heures.
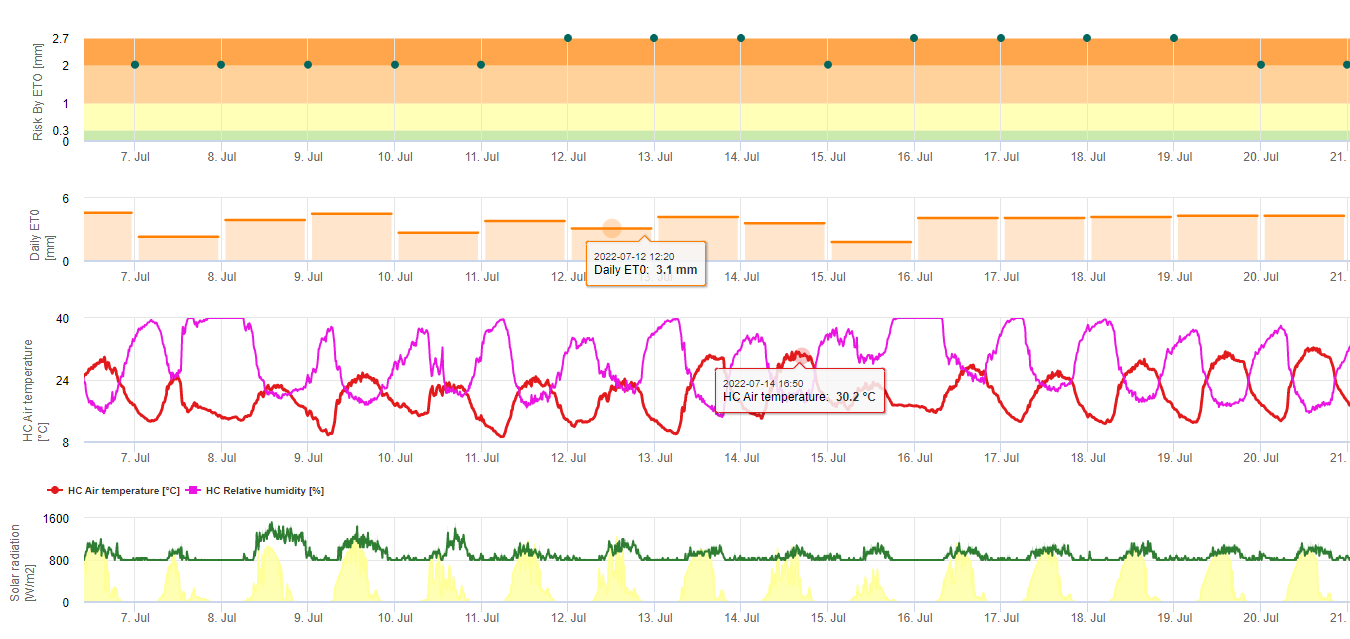
Modèle de risque Sigatoka noir
Un modèle (risque Sigatoka par ET) est basé sur a) la détermination de la valeur de l'investissement et de la valeur de l'investissement. évapotranspiration (capteurs nécessaires : température, humidité relative, vitesse du vent et rayonnement global). Ce modèle est basé sur les travaux de Ganry, J. & Meyer,J.P. (1972) : La lutte contrôlée contre le Cercospora aux Antilles. Bases climatiques de l'avertissement. Fruits 27(11):767-774. Dans cette étude, l'ETpiche a été utilisé pour évaluer la favorabilité climatique du sigatoka. Field.Climate utilise l'équation "Penman Montheith" (la plus générale et la plus largement utilisée pour le calcul de l'ET de référence) au lieu de l'ETpiche. Si l'évapotranspiration cumulée des 7 derniers jours est :
> 40 mm Aucun risque
> 30 mm Risque faible
> 22 mm Risque moyen
< 22 mm Risque élevé
Informations pour l'évaluation du Sigatoka noir par pulvérisation
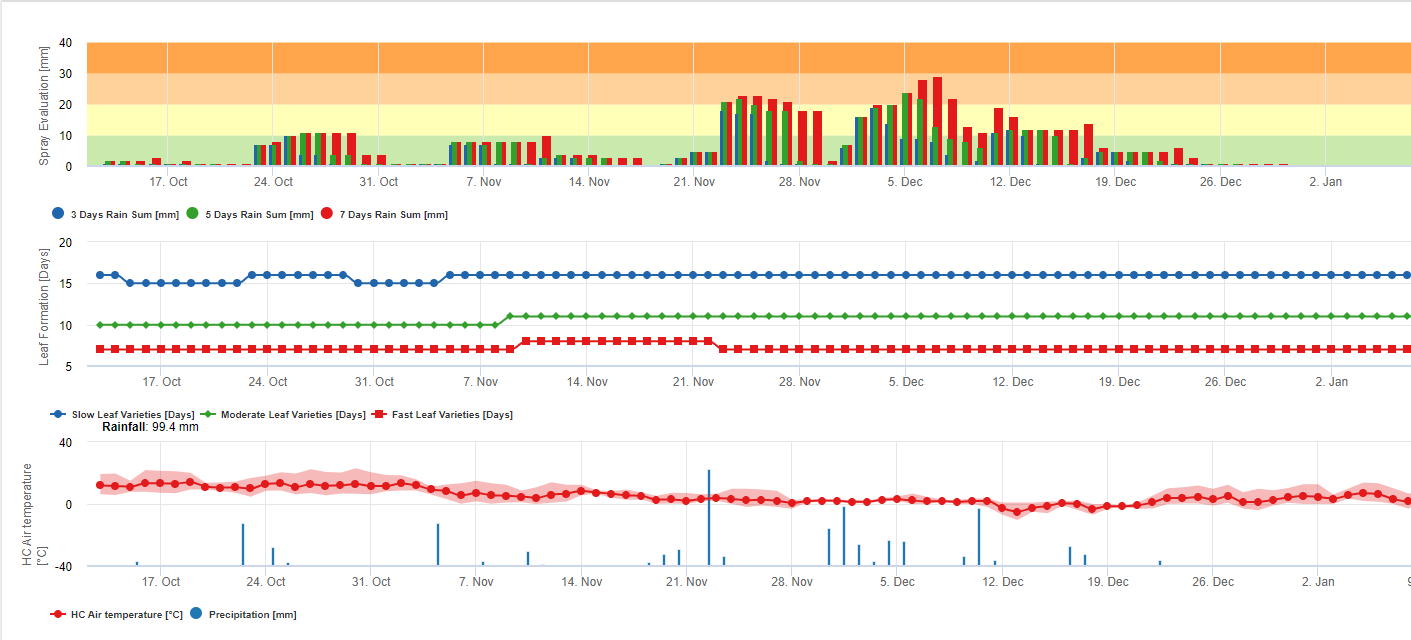
Accumulation de pluie pour l'évaluation des résidus sur FieldClimate :
Si la pluie est >= 3mm, elle est comptée et accumulée :
- 3 jours
- 5 jours
- 7 jours
Le cumul des pluies se traduit par un graphique en référence à un seuil de 10, 20 et 30 mm.
Formation de feuilles pour l'évaluation des résidus sur FieldClimate :
Si les températures diurnes et nocturnes de l'air sont :
12-14°C et 12-13°C il faut 23, 16 ou 21 jours 15-17°C et 14-15°C il faut 20, 14 ou 10 jours 18-20°C et 16-22°C il faut <15, <12, ou <8 jours 21-27°C et 16-22°C il faut <13, <11, ou <6 jours 28-30°C et 23-24°C il faut <14, <12, ou <8 jours 31-40°C et 25-40°C il faut 20, 14, ou 10 jours pour former toutes les feuilles sur les variétés à formation foliaire moyenne, rapide et très rapide.
Ces informations devraient permettre d'évaluer les tissus non protégés. Les raisons peuvent donc être une grande quantité de pluie depuis la dernière application de mesures phytopharmaceutiques (les résidus sont déjà lavés ou de nouvelles feuilles se sont formées).
Équipement recommandé
Vérifiez quel jeu de capteurs est nécessaire pour surveiller les maladies potentielles de cette culture.