
Trigo modelos de enfermedad
Trigo blando
Patógeno
Pyricularia griseatambién conocido como Magnaporthe oryzaees un hongo patógeno responsable del añublo del trigo, una importante enfermedad que afecta a los cultivos de trigo. El patógeno se reproduce principalmente de forma asexual a través de conidios (esporas asexuales), que sirven como inóculo primario para iniciar las infecciones. Estas conidias se producen en conidióforos y se dispersan por el viento, la lluvia y medios mecánicos, como la maquinaria agrícola. Al aterrizar en un huésped de trigo susceptible, las conidias germinan y forman apresorios, estructuras especializadas que facilitan la penetración en el tejido vegetal. Una vez dentro, el hongo coloniza las células del huésped, provocando el desarrollo de la enfermedad. Las condiciones ambientales desempeñan un papel crucial en el proceso de infección de P. grisea. El hongo prospera en climas cálidos y húmedos, con temperaturas que oscilan entre los 15°C y los 30°C y largos periodos de humedad foliar o alta humedad relativa. La humedad continua de la hoja durante al menos 14 horas es necesaria para iniciar la infección, por lo que la nubosidad excesiva, la humedad alta, el riego excesivo y el riego inoportuno favorecen el desarrollo de la enfermedad. Además, factores de estrés como la sequía, la compactación del suelo, las alturas de siega bajas y la fertilización nitrogenada excesiva pueden exacerbar la gravedad de la enfermedad.
Síntomas
Los síntomas iniciales del añublo del trigo se manifiestan como lesiones en forma de diamante, empapadas de agua, en las hojas, que luego se vuelven grises a medida que avanza la enfermedad. Estas lesiones pueden expandirse y unirse, dando lugar a un extenso tizón foliar y necrosis. Las espigas infectadas muestran un blanqueamiento parcial o completo, a menudo a partir de un punto de infección gris negruzco en el raquis o la base de las espigas. Cuando la presión del inóculo es alta, pueden producirse múltiples puntos de infección en un solo raquis, lo que provoca importantes pérdidas de rendimiento. Además de los síntomas foliares, P. grisea puede infectar otras partes aéreas de la planta de trigo, incluidos los nudos y los cuellos, provocando la pudrición del cuello o la explosión de los nudos. Esto puede provocar la rotura de las partes afectadas, con el consiguiente encamado y una mayor reducción del rendimiento. La capacidad del patógeno para infectar diversas partes de la planta a lo largo del periodo vegetativo lo hace especialmente destructivo, sobre todo en condiciones ambientales favorables.
Modelo FieldClimate
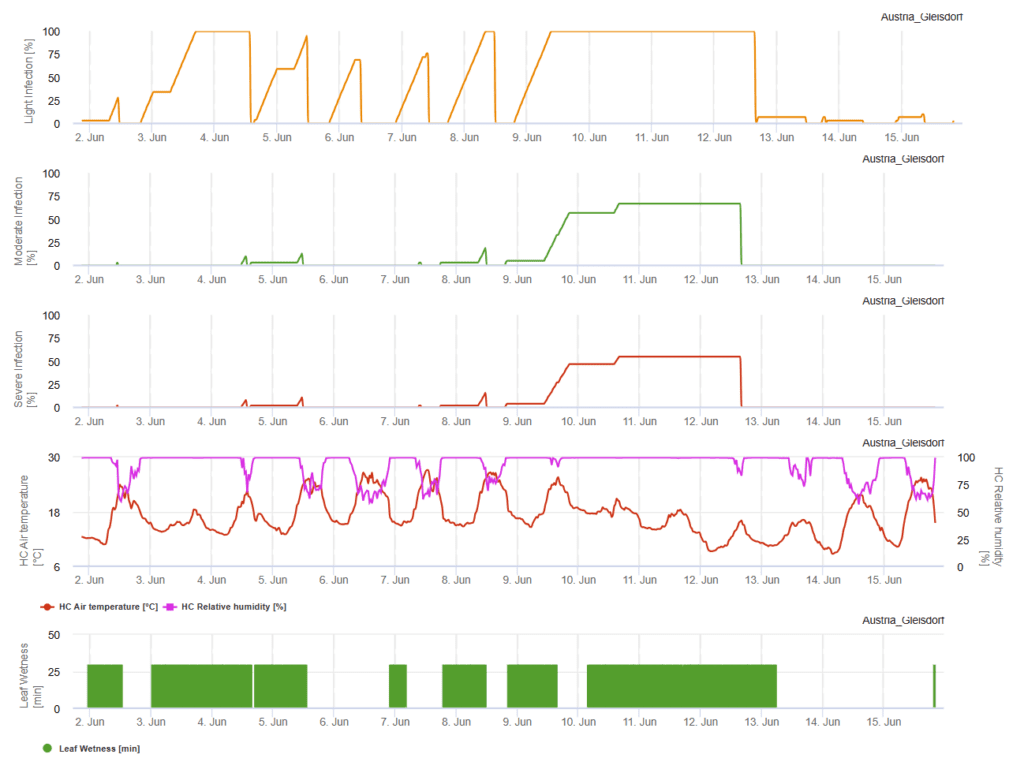
Sensores necesarios:
- Temperatura del aire
- Humedad relativa
- Humedad de la hoja
Los cielos nublados, las condiciones húmedas y las lloviznas favorecen el desarrollo y la gravedad de la enfermedad. En FieldClimate se calculan tres clases de gravedad y cuando se alcanzan 100% de infección se han dado en el campo las condiciones óptimas para el hongo patógeno. En función de la variedad, hay que tener en cuenta las medidas fitosanitarias curativas del historial de campo cuando se ha alcanzado una infección ligera, moderada o grave de 100%.
Literatura
- Cruz, C. D., & Valent, B. (2017). Enfermedad del añublo del trigo: peligro en movimiento. Patología vegetal tropical, 42(3), 210-222.
- Islam, M. T., Croll, D., Gladieux, P., Soanes, D. M., Persoons, A., Bhattacharjee, P., ... & Talbot, N. J. (2016). Emergence of wheat blast in Bangladesh was caused by a South American lineage of Magnaporthe oryzae. BMC Biología, 14(1), 84.
Pyrenophora teres
Patógeno
Pyrenophora teres (Drechslera teres) existe en dos formas - P. teres f. teres y P. teres f. maculata que inducen la formación de manchas netas y manchas netas puntuales, respectivamente.
Las ascosporas liberadas de los pseudotecios infectan los residuos, iniciando la infección primaria. Los micelios y conidios transmitidos por semillas también sirven como inóculo primario en algunos casos. Las esporas germinan en las hojas y penetran en la pared celular epidérmica externa para que el patógeno pueda desarrollarse dentro de una gran vesícula intracelular. A continuación se produce la fase asexual, durante la cual se producen conidios que desencadenan la infección secundaria, aumentando la gravedad de la enfermedad. Al final del periodo vegetativo, el patógeno produce pseudotecas como fuente de sobreestacionamiento y permanecen en los restos de cebada infectada.
Síntomas
Los síntomas se manifiestan en las hojas, los tallos y los granos, y la enfermedad avanza desde la parte inferior a la superior de las plantas. Las plantas más viejas suelen experimentar daños menos graves, ya que poseen una cutícula más gruesa que impide la penetración del patógeno y una mayor capacidad para producir compuestos antifúngicos. Los patógenos producen toxinas que son responsables de los síntomas, contribuyendo a la necrosis y la clorosis o alterando el equilibrio hídrico a nivel celular.
En el caso de la enfermedad de la mancha de tipo red, los síntomas aparecen como lesiones longitudinales estrechas de color marrón oscuro. En las variedades muy resistentes sólo se desarrollarán unas pocas lesiones pequeñas en forma de puntos, sin que se forme un patrón neto distintivo. Por el contrario, la mayoría de las variedades susceptibles pueden mostrar zonas cloróticas o empapadas de agua alrededor de las lesiones necróticas.
En el caso de la mancha tipo mancha, los síntomas consisten en lesiones de color marrón oscuro, circulares o elípticas, que a menudo están rodeadas por un halo clorótico o necrótico de anchura variable. En las variedades menos susceptibles, las lesiones son generalmente más pequeñas y pueden carecer de un halo clorótico circundante.
Las infecciones graves pueden provocar la muerte completa de las hojas, que aparecen secas. Las hojas más viejas suelen marchitarse primero, seguidas de las más jóvenes.
Modelo FieldClimate
Modelo Drechslera teres
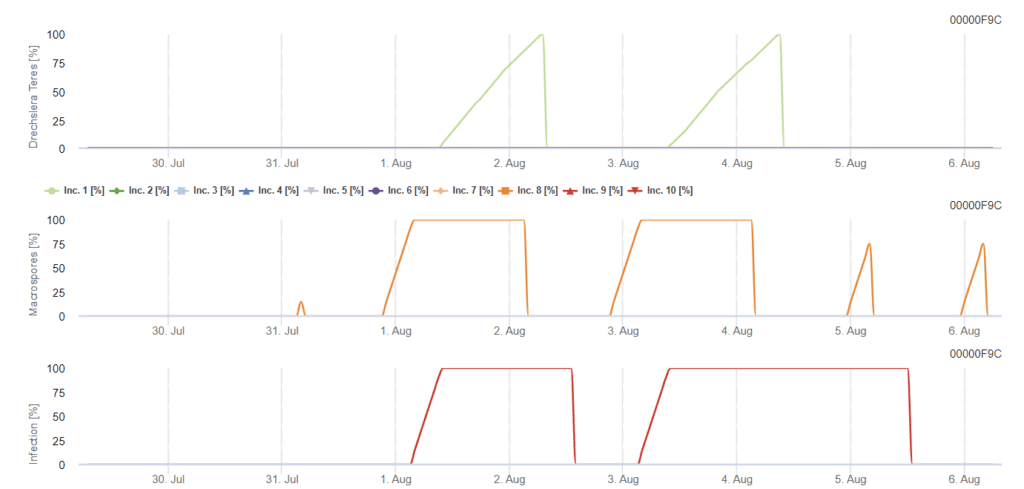
Sensores necesarios:
- Temperatura del aire
- Humedad relativa
- Humedad de la hoja
- Precipitación
El inóculo primario se desarrolla bajo temperaturas óptimas de entre 15°C y 25°C, siendo la óptima de 20°C. Las condiciones de más de 6 horas de oscuridad conducen a un crecimiento óptimo de las conidias, como se muestra en un gráfico de esporulación de conidias. Si el gráfico de esporulación alcanza 100%, se establecen las condiciones óptimas en el campo.
La dispersión posterior tiene lugar a través del viento o la lluvia. Las infecciones de los tejidos vegetales necesitan condiciones húmedas como la humedad de las hojas o una humedad relativa alta durante unas 10 a 30 horas con temperaturas óptimas de 15°C y 25°C, como se muestra en un gráfico de infección. Cuando se alcanza 100%, se determina que se han medido las condiciones óptimas para la infección en el campo. La luz solar también puede potenciar el crecimiento de los conidóforos que producen conidios siguiendo condiciones alteradas de periodos húmedos y secos con alta radiación solar y baja humedad relativa y el viento favorece el desarrollo de la enfermedad.
Literatura
- Backes, A., Guerriero, G., Ait Barka, E., & Jacquard, C. (2021). Pyrenophora teres: taxonomía, morfología, interacción con la cebada y modo de control. Fronteras de la ciencia de las plantas, 12, 614951.
- Liu, Z., Ellwood, S. R., Oliver, R. P., & Friesen, T. L. (2011). Pyrenophora teres: perfil de un patógeno de la cebada cada vez más perjudicial. Patología vegetal molecular, 12(1), 1-19.
- Obst, A., y Paul, VH (1993). Enfermedades y plagas de los cereales, Verlag Th. Mann, Gelsenkirchen-Buer.
Take-all
Patógeno
La enfermedad "Take-all", causada por Gaeumannomyces graminises una de las enfermedades más devastadoras de los cereales. El nombre procede de los agricultores del sur de Australia, ya que la enfermedad es tan dañina que no les deja grano para cosechar. El patógeno daña el sistema radicular y el tallo, causando deficiencia de agua y nutrientes, lo que finalmente conduce a la muerte de la planta.
El hongo sobrevive como micelio en restos de cultivos de forma saprofítica y los fragmentos que se encuentran en el suelo pueden ser transportados por el viento, el agua y los animales. La infección primaria se produce una vez que las raíces de las plántulas entran en contacto con restos infectados, a lo que sigue el crecimiento y la extensión de las hifas. Al penetrar en la epidermis de la raíz e invadir la corteza radicular, coloniza y destruye los tejidos. La infección progresa hacia arriba y hacia abajo. La infección secundaria se produce por contacto de raíz a raíz, y las plantas gravemente infectadas aparecen en manchas.
Síntomas
La enfermedad de la maleza en el trigo suele afectar durante las fases de plántula y ahijamiento, causando síntomas cerca de la superficie del suelo. Las plantas infectadas pueden atrofiarse, con hojas amarillentas y espigas de maduración prematura que carecen de granos completamente desarrollados. Las manchas muertas circulares, de unos pocos centímetros a metros, suelen tener márgenes amarillo anaranjados o bronceados y pueden reaparecer en la misma zona en años posteriores.
Los síntomas clave incluyen espigas blanquecinas o vacías, bases del tallo ennegrecidas y raíces oscuras y podridas con pequeñas lesiones negras que se expanden. Las raíces gravemente dañadas son quebradizas y puede aparecer una decoloración negra brillante en el tallo basal. Las plantas pueden arrancarse fácilmente del suelo debido al debilitamiento de sus sistemas radiculares. La enfermedad puede parecerse al estrés por sequía, ya que interrumpe el flujo de agua a las partes superiores de la planta, provocando un marchitamiento prematuro.
Modelo FieldClimate
Take-all
Modelo Sensores:
- Temperatura del suelo
El modelo de riesgo take-all aplica la duración del día y la temperatura del suelo para determinar los periodos de riesgo. Los días con menos de 13 horas de luz solar y las temperaturas del suelo entre 10°C y 20°C favorecen el desarrollo de la enfermedad.
Cuando el valor de riesgo alcanza 100%, se han dado las condiciones óptimas para el desarrollo del patógeno en el campo. La rotación de cultivos con intervalos de al menos 2 a 3 años entre cereales susceptibles es la estrategia de protección más importante.
Literatura
- Cook, R. J. (2003). El trigo para llevar. Patología Vegetal Fisiológica y Molecular, 62(2), 73-86.
- Palma-Guerrero, J., Chancellor, T., Spong, J., Canning, G., Hammond, J., McMillan, V. E., & Hammond-Kosack, K. E. (2021). Take-all disease: new insights into an important wheat root pathogen. Trends in Plant Science, 26(8), 836-848. https://www.apsnet.org/edcenter/disandpath/fungalasco/pdlessons/Pages/Takeall.aspx
Tizón de la cabeza por Fusarium
Patógeno
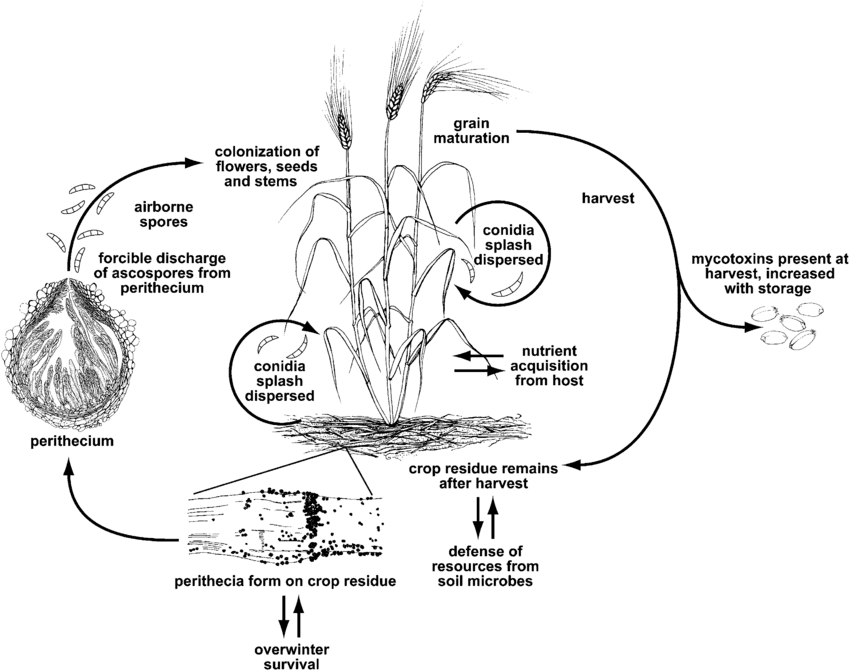
El tizón de la cabeza o roña del fusarium está causado por el género Fusarium. La especie más común es Fusarium graminearum pero las especies más prevalentes pueden diferir según las regiones.
F. graminearum puede infectar las plantas de trigo en cualquier fase de crecimiento. Sobrevive al invierno en los residuos de cultivos infectados y, en primavera, se produce la infección primaria cuando las ascosporas de los peritecios y los conidios se dispersan por las glumas o las anteras del trigo. Los ramilletes infectados producen granos arrugados o marchitos, a menudo denominados granos "lápida". Aunque los granos no parezcan afectados, pueden estar contaminados con micotoxinas. La infección secundaria se produce a través de conidios, pero las epidemias de trigo dependen principalmente de la cantidad de inóculo primario y no de fuentes secundarias.
La fusariosis también provoca la acumulación de micotoxinas nocivas en los cultivos, lo que supone un riesgo potencial para los animales. Estas micotoxinas desactivan los mecanismos de defensa de las plantas o protegen al hongo contra otros organismos. La principal toxina es el deoxinivalenol (DON) e inhibe la síntesis de proteínas, alterando el funcionamiento normal de las células. Los seres humanos que hayan consumido trigo con DON experimentarán síntomas como náuseas, fiebre o vómitos.
Síntomas

En el trigo y el durum, cualquier parte o la totalidad de la cabeza puede aparecer blanqueada. Las cabezas parcialmente blancas y verdes son diagnósticas de la enfermedad en el trigo. El hongo también puede infectar el tallo, causando una decoloración de marrón a púrpura. A menudo se observan masas de esporas de color rosa a naranja salmón en las espiguillas y glumas infectadas en condiciones húmedas. Muchos granos se arrugan y pierden peso, y a veces se les llama "lápidas" por su aspecto calcáreo y sin vida. En condiciones favorables, la infección puede extenderse a las espiguillas adyacentes e infectar toda la espiga, incluidos el raquis y el pedúnculo. Los granos pueden tener un aspecto opaco y una decoloración rosada de tamaño normal cuando la infección se ha producido en una fase tardía del desarrollo.
En la cebada, las espiguillas infectadas se decoloran y muestran un aspecto empapado de agua. Los granos también pueden mostrar decoloración y, ocasionalmente, pueden verse masas de esporas de color naranja salmón en la espiguilla y las glumas en condiciones húmedas.
Modelos FieldClimate
Las estimaciones de los niveles de FHB en un campo se basan en recuentos de cabezas o granos tiznados. La escala visual de colores para estimar la severidad de FHB en trigo está disponible en el Servicio de Extensión de NDSU (publicación PP-1095): https://library.ndsu.edu/ir/bitstream/handle/10365/9187/PP1095_1998.pdf?sequence=1&isAllowed=y.
Modelo de infección del tizón de la cabeza por Fusarium (Riesgo de tizón de la cabeza por Fusarium)
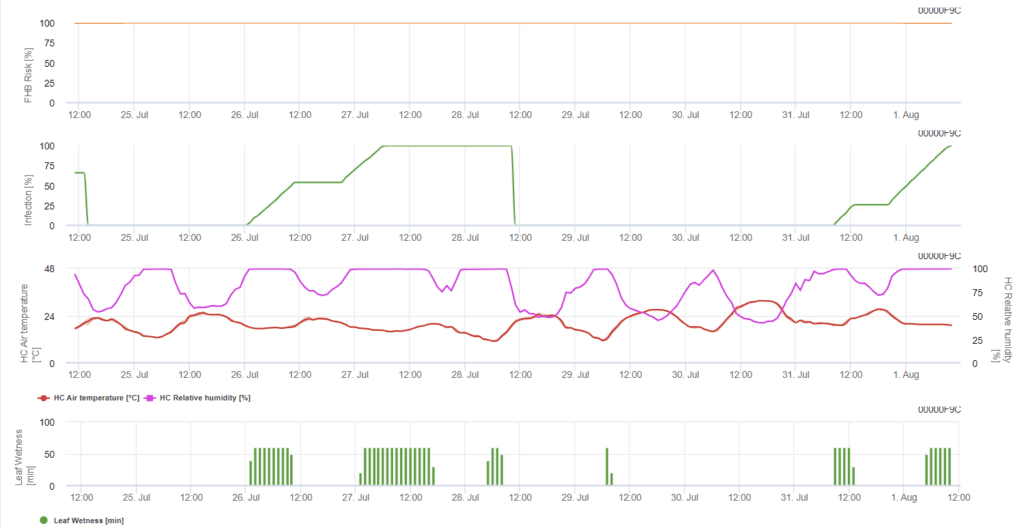
Sensores necesarios:
- Temperatura del aire
- Humedad relativa
- Humedad de las hojas
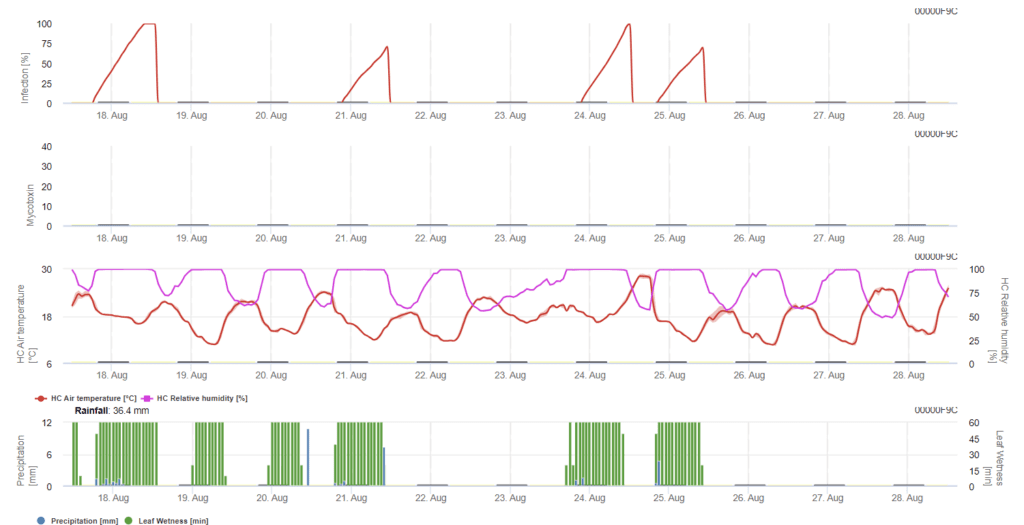
El modelo determina los periodos de riesgo para una infección. Cuando se alcanza la infección 100%, el riesgo es muy alto, y las condiciones para el hongo han sido favorables para la infección. Los conocimientos del agricultor sobre el estado de desarrollo de las distintas variedades de trigo permiten decidir la aplicación de una pulverización curativa inmediatamente después de la infección.
Los agentes fúngicos del Tizón de la Cabeza por Fusarium en el trigo se ven favorecidos por temperaturas cálidas de 20°C a 30°C y largos periodos húmedos. Varios periodos de humedad foliar de un día de duración darán lugar a síntomas visibles tempranos. También pueden observarse síntomas tras un largo periodo de latencia si la infección va seguida de un periodo de humectación de la hoja de 18 horas o incluso menos y tras un inóculo artificial a temperaturas de 15°C.
Resumiendo todas las diferentes combinaciones de temperatura y humedad que hemos encontrado en la literatura, hemos decidido señalar las Infecciones de Tizón de la Cabeza por Fusarium si la temperatura y el periodo o periodos de humedad foliar con más de 85% de humedad relativa superan los valores visualizados en el siguiente gráfico. El cálculo del valor de avance sigue la relación entre la duración de las condiciones de humedad y la temperatura.
Modelo de alerta de micotoxinas de Fusarium (tizón de la fusariosis)
Sensores necesarios:
- Temperatura del aire
- Humedad relativa
- Humedad de las hojas
- Precipitación
en este modelo la infección del FHB se calcula por la precipitación (se necesitan 2mm), la humedad relativa (por encima de 85%) o la humedad de la hoja, la temperatura durante el proceso. Si la infección alcanza los 100%, se habrán alcanzado las condiciones óptimas para el hongo patógeno. A continuación, el modelo calcula el riesgo de micotoxinas del FHB.
Los ensayos de infección con periodos prolongados de humectación de las hojas de Fusarium head blight dan lugar a contenidos elevados de micotoxinas. A partir de esta información, se supone que un periodo de humectación de la hoja de 48 horas o más durante los estadios 61 y 69 supone un alto riesgo de micotoxinas.
Las experiencias realizadas a lo largo del análisis de DON en trigo cultivado comercialmente mostraron que los periodos de humedad de la hoja suficientemente largos para la infección tras una infección inicial en los estadios 61 a 69 pueden aumentar los valores de DON. En caso de periodos de humedad foliar más largos, las micotoxinas pueden aumentar hasta el estadio 85.
- BBCH estadio 61: Comienzo de la floración; primeras anteras visibles
- Estado BBCH 69: Fin de la floración; todas las espiguillas han terminado de florecer, pero pueden quedar algunas anteras deshidratadas.
- BBCH estadio 85: En plena maduración; masa blanda con contenido de grano blando pero seco, impresión de la uña no sostenida.
El modelo acumula la cifra de riesgo proporcional al progreso de la infección por cada periodo de infección con éxito durante el periodo seleccionado para el cálculo. Seis infecciones completadas conducirían al riesgo de 100%. Normalmente, el periodo de humedad de la hoja que conduce a una infección por fusarium es superior al mínimo necesario. Por lo tanto, la mayoría de las infecciones por fusarium darán lugar a un aumento del riesgo superior a 17%.
El valor del riesgo de micotoxinas en la historia del campo. El trigo cultivado después de la siembra directa sólo puede conllevar un pequeño riesgo si no se pulveriza en la situación óptima. En el trigo sin rociar, tenemos que esperar un aumento de los valores de DON después de 35% del riesgo. Trigo después de trigo sin labranza después de cualquier otro cultivo puede llevar un mayor riesgo de 50%. Si tenemos trigo después de trigo con laboreo, el riesgo puede aumentar hasta 70%. El trigo de primer año debe someterse a pruebas de DON si el riesgo alcanza 100%.
Literatura
- https://www.fao.org/4/y4011e/y4011e0j.htm
- https://scabusa.org/pdfs/NDSU_PP-804_FHB-Small-Grains.pdf
- Lancashire, P. D., Bleiholder, H., Boom, T. V. D., Langelüddeke, P., Stauss, R., Weber, E., & Witzenberger, A. (1991). A uniform decimal code for growth stages of crops and weeds. Anales de biología aplicada, 119(3), 561-601.
- Trail, F. (2009). Por oleadas de granos marchitos: Fusarium graminearum en la era postgenómica. Fisiología vegetal, 149(1), 103-110.
- Schumann, G. L. (2010). El instructor fitosanitario| Volumen: 10 Año: 2010 Tipo de artículo: Lesson Plans. Sanidad Vegetal, 10.
Raya de cebada
Patógeno
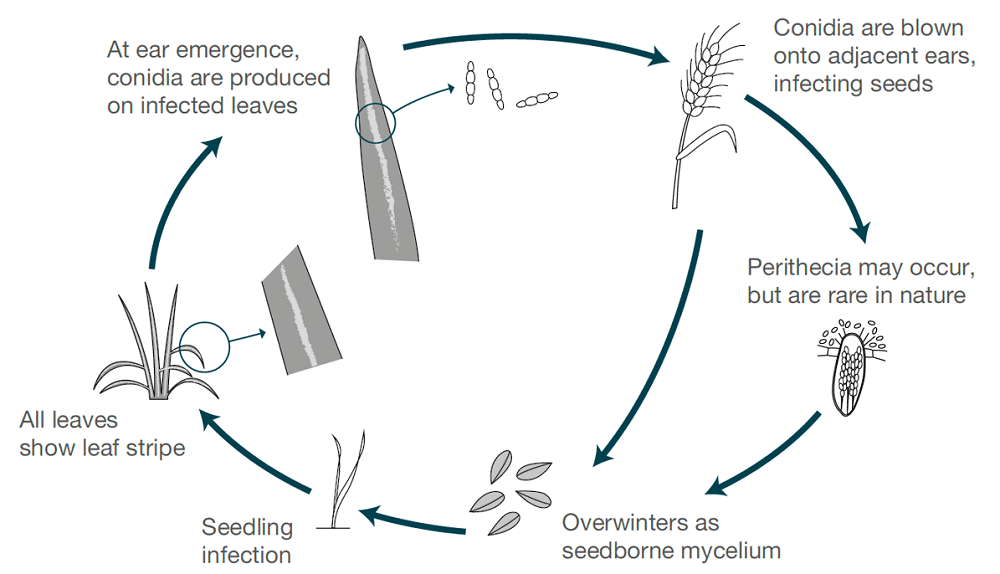
La raya de la cebada está causada por Pyrenophora graminea (Drechslera graminea), un patógeno transmitido por las semillas que sobrevive en la epidermis de una semilla infectada. El hongo infecta las plántulas en condiciones frescas y húmedas. El hongo crece sistémicamente dentro de la planta, infecta toda la planta, produce toxinas, mata las células y decolora el tejido de la hoja entre las venas, causando así lesiones de rayas. La raya es más frecuente en la cebada de invierno que en la de primavera.
Cuando las condiciones son húmedas o mojadas, las esporas se producen en la superficie de las hojas cuando florecen las espigas sanas de la planta. Las esporas son dispersadas por el viento hacia estas espigas en desarrollo, germinan y causan infecciones. Los granos son más susceptibles durante su desarrollo temprano. Sólo se produce un ciclo de infección y producción de esporas cada temporada.
Síntomas

Los síntomas se manifiestan sobre todo en la fase de aparición de la espiga.
Inicialmente aparecen rayas de color verde pálido a amarillo en la parte basal de la hoja y la vaina foliar. Estas rayas se vuelven gradualmente de color marrón a marrón oscuro, seguidas de una desecación y división del limbo de la hoja. Se extienden en tamaño a toda la longitud de la hoja, se vuelven necróticas y se unen, provocando finalmente la muerte de la planta.
Las plantas pueden parecer atrofiadas, producir pocos macollos y no descabezar o producir semillas en los casos graves. La longitud de las espigas también puede verse reducida debido al escaso desarrollo de los granos marrones.
Modelo FieldClimate
Pyrenophora graminea Modelo
Sensores necesarios:
- Temperatura del aire
- Humedad relativa
- Humedad de las hojas
- Precipitación
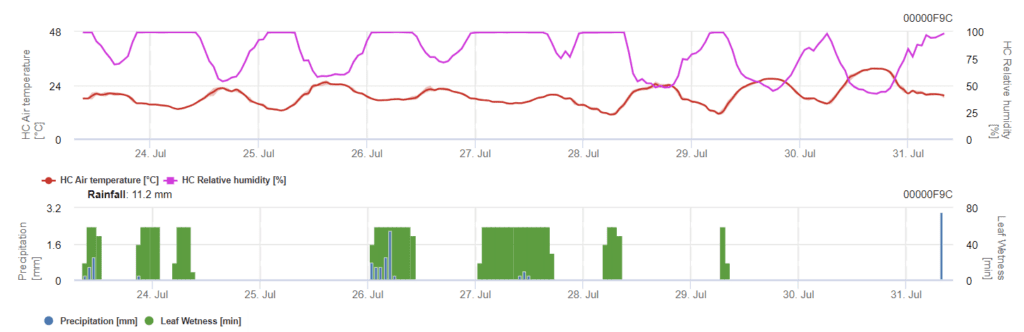
El modelo muestra dos etapas. La primera etapa es de riesgo durante los periodos de emergencia de la planta, etapas tempranas. La segunda etapa es durante la floración y el desarrollo de la cabeza de la cebada. Cuando la infección alcanza 100%, se han creado las condiciones óptimas en el campo para que el hongo infecte los tejidos de la planta y crezca sistemáticamente en su interior.
Literatura
- Richardson, M. J. (1996). Micología de las semillas. Investigación micológica, 100(4), 385-392. https://ahdb.org.uk/knowledge-library/barley-leaf-stripe-life-cycle-and-disease-symptoms https://plantwiseplusknowledgebank.org/doi/full/10.1079/pwkb.species.46115
Septoria
Patógeno
Hay dos enfermedades principales de Septoria en el trigo: la mancha Septoria tritici causada por Septoria tritici y la mancha Septoria nodorum causada por Septoriosis nodular.
Septoria tritici sobrevive en los residuos de cultivos infectados durante el verano y comienza a infectar las plantas de trigo en otoño. El hongo prospera en condiciones frescas y húmedas. Tiene dos fases: una latente y otra necrótica. Durante la fase latente, el hongo inocula tejido vegetal nuevo y, al entrar a través de los estomas, sigue la colonización, que crece intercelularmente dentro de los tejidos vegetales. S. tritici no requiere ninguna estructura física de alimentación, sino que se alimenta extrayendo nutrientes de las células del huésped que han perdido su integridad estructural. Las plantas pueden mostrar una respuesta hipersensible y pueden desarrollarse lesiones necróticas en los tejidos afectados como respuesta a la infección.
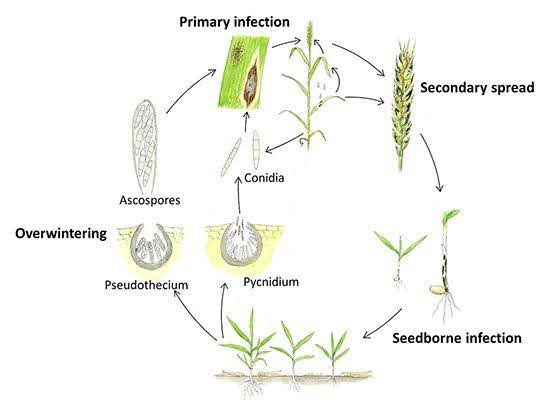
Septoriosis nodular sobrevive durante el verano en forma de micelios latentes, picnidios y pseudotecios en los residuos de los cultivos. La infección suele comenzar en otoño, cuando el viento y la lluvia dispersan las picnidiosporas de los picnidios y las ascosporas de los pseudotecios, iniciando la infección primaria. Estas esporas penetran en la cutícula de la hoja y la formación de picnidios sigue a la infección. La infección secundaria se produce cuando las picnidiosporas se producen y dispersan desde las hojas inferiores a las superiores y las glumas. El patógeno también produce toxinas que contribuyen al desarrollo de la enfermedad.
Síntomas
Mancha por Septoria tritici
En otoño, Septoria tritici Los síntomas aparecen inicialmente como pequeñas manchas amarillas en las hojas, que contienen diminutas motas negras, que son cuerpos fructíferos fúngicos. Las lesiones tienen forma irregular, de elíptica a alargada y estrecha, se agrandan y se vuelven de color marrón a marrón rojizo al madurar. La enfermedad suele comenzar en las hojas inferiores y se desplaza gradualmente hacia arriba, afectando finalmente a la hoja bandera. En condiciones húmedas, el hongo puede extenderse a las espigas, causando lesiones marrones en las glumas y las espigas, conocidas como manchas de las glumas. La septoriosis puede confundirse con otras enfermedades del trigo. Sin embargo, la presencia de cuerpos fúngicos negros es una característica clave de la enfermedad. S. tritici. Aunque Septoria nodorum también puede producir cuerpos fructíferos marrones en condiciones húmedas, difieren en color y tamaño, con Septoria tritici cuerpos fructíferos más grandes.
Mancha por Septoria nodorum
Septoriosis nodular Los síntomas aparecen primero principalmente en las hojas superiores. Al principio, aparecen en las hojas manchas de color marrón oscuro con un halo amarillo. La quemadura de la punta de las hojas es otro indicio inicial. Al madurar, las lesiones se expanden y se vuelven necróticas con un centro marrón oscuro. En el interior de las lesiones pueden verse pequeñas estructuras de color marrón oscuro, que son cuerpos fructíferos. Los conidios liberados de los cuerpos fructíferos parecen masas de color blanco a rosado. Las hojas gravemente infectadas pueden quedar completamente cubiertas de lesiones, lo que finalmente provoca la muerte del tejido foliar. El hongo también puede afectar a glumas y axilas: aparecen lesiones marrones similares y la enfermedad progresa hacia abajo.
Modelo FieldClimate
Las infecciones por Septoria son posibles a bajas temperaturas, mientras que las temperaturas inferiores a 7°C pueden no provocar una infección en 2 días. La temperatura óptima de la enfermedad se alcanza en la zona de 16 a 21°C. Las infecciones son posibles dentro de un periodo de alta humedad relativa o humedad foliar de 14 horas o más.
Modelo Septoria tritici
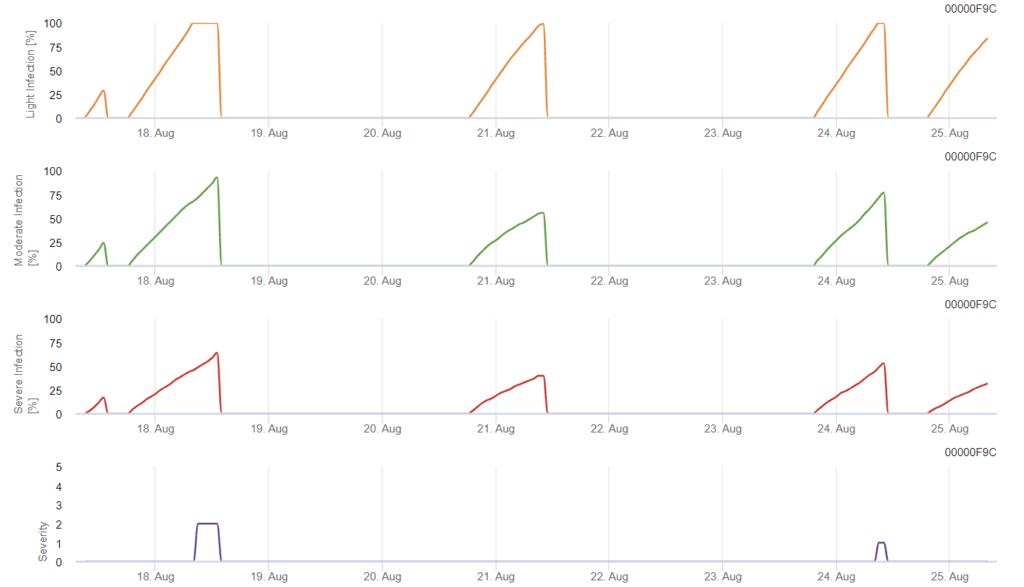
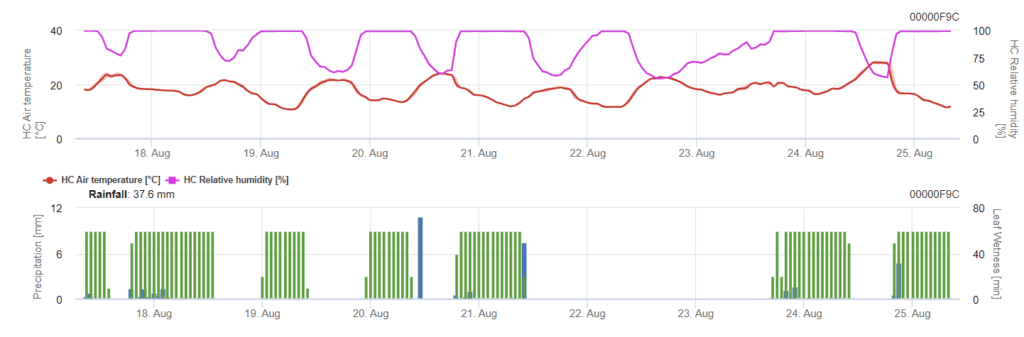
La infección comienza tras una lluvia de 0,5 mm. Las temperaturas óptimas para las infecciones por Septoria se sitúan entre 16°C y 21°C y la humedad de las hojas o una humedad relativa alta durante más de 14 horas. Septoria tritici se calcula en tres clases de severidad. Además, se determinan niveles de severidad que permiten evaluar la presión de infección entre los estadios 10 a 32 de BBCH del trigo.
- Estado BBCH 10: Desarrollo foliar; primera hoja a través del coleóptilo
- Estado BBCH 32: Alargamiento del tallo; nudo 2 al menos 2 cm por encima del nudo 1
- Estado BBCH 51: Emergencia de la inflorescencia y espigado; comienzo del espigado con la punta de la inflorescencia emergida de la vaina y la primera espiguilla apenas visible.
Hemos decidido no utilizar un modelo para la formación de picnidios. Se supone que la condición necesaria para la formación de picnidios es un periodo con una humedad relativa superior a 85%. La vida útil de los picnidios es de 24 horas. En todos los climas en los que el hongo tiene oportunidad de infectar, encontraremos dos horas que cumplen esta condición casi todos los días alrededor de la salida del sol.
Evaluación de la gravedad de la infección
Para evaluar la Septoria tritici presión de infección entre los estadios 10 y 32 y entre 32 y 51, tenemos que evaluar la gravedad de las infecciones en función de las condiciones climáticas. La gravedad de la infección se evalúa en una escala de 1 a 5:
- 1: infección débil con lluvias inferiores a 5 mm
- 2: infección débil con lluvia de más de 5 mm
- 3: infección moderada con lluvia inferior a 5 mm
- 4: infección moderada con lluvia de más de 5 mm/ infección grave con lluvia de menos de 5 mm
- 5: infección grave con lluvia de más de 5 mm
Evaluación de la presión de la enfermedad
Hay tres factores que influyen en la presión de la enfermedad en el campo: el clima, el historial del campo y la susceptibilidad de la variedad cultivada. Si podemos acumular los valores de gravedad de la enfermedad desde el estadio 10 al 32 hasta el valor 4, podemos esperar una presión débil de la enfermedad por el clima. Si este valor alcanza 6, podemos esperar una presión moderada de la enfermedad, y si alcanza 10, una mayor presión de la enfermedad por parte del clima.
Conocer la susceptibilidad de la variedad y el historial de campo nos llevará a pulverizar o no sobre una presión de enfermedad débil o moderada en la situación. Tener un valor acumulado de 10 puede conducir a una pulverización en la fase 32 de todos modos.
La decisión de fumigar en una fase posterior depende del clima primaveral. Si podemos acumular los valores de severidad desde el estadio 10 hasta un valor de 6, podemos esperar una presión débil de la enfermedad. Si este valor alcanza 10, podemos esperar una presión moderada de la enfermedad y si este valor alcanza 15, podemos esperar una presión alta de la enfermedad por la situación climática.
En FieldClimate, el Septoria tritici junto con las tres diferentes severidades de infección. Debido a las precipitaciones y a los largos periodos de humedad de las hojas, se han cumplido las condiciones para una infección grave por S. tritici. Los niveles de gravedad alcanzan el valor más alto de 5, lo que significa que existe un alto riesgo de infección.
Modelo Septoria nodorum
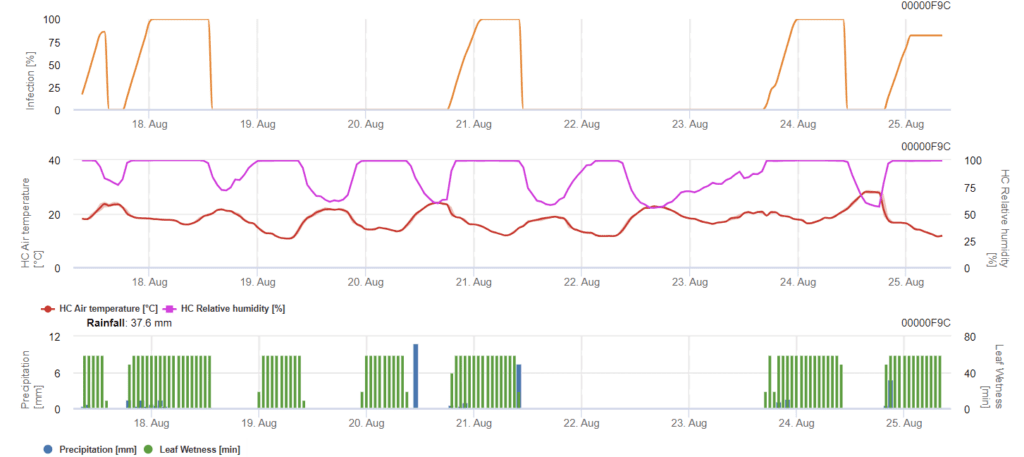
Septoriosis nodulardifiere en cierta medida de la biología de la infección de Septoria tritici pero la diferencia no es lo suficientemente grande para un modelo separado. Por lo tanto, sugerimos utilizar el modelo tritici para todo el complejo de la enfermedad de Septoria. En zonas con alta presión de S. nodorum, las infecciones clasificadas como débiles con un valor de gravedad de 2 deben tratarse más seriamente que en otros ámbitos.
En Septoriosis nodular calcula el riesgo de la enfermedad. Las medidas fitosanitarias deben considerarse si el riesgo alcanza 80%. Cuando el riesgo es de 100% y la infección ya está determinada, deben tomarse medidas fitosanitarias sistémicas (aplicaciones curativas).
Literatura
- Brennan, C. J., Benbow, H. R., Mullins, E., & Doohan, F. M. (2019). A review of the known unknowns in the early stages of septoria tritici blotch disease of wheat. Patología vegetal, 68(8), 1427-1438.
- De Wolf, E. D. (2008). Septoria tritici blotch. Mehra, L. K., Adhikari, U., Ojiambo, P. S., & Cowger, C. (2019). Mancha Septoria nodorum del trigo. El instructor de sanidad vegetal.
- Solomon, P. S., Lowe, R. G., TAN, K. C., Waters, O. D., & Oliver, R. P. (2006). Stagonospora nodorum: cause of stagonospora nodorum blotch of wheat. Patología vegetal molecular, 7(3), 147-156.
Mancha foliar
Patógeno
La mancha foliar está causada por Rynchosporium secalis.
La infección primaria se produce por ascosporas o conidios en restos de cultivos. Estas esporas son dispersadas por el viento y la lluvia, germinan y, a medida que las células epidérmicas y mesófilas se colapsan tras una infección, los síntomas se hacen visibles. La infección secundaria es provocada por los conidios de las hojas infectadas. En condiciones húmedas, los conidios germinan en la superficie de la hoja y producen hifas que penetran la cutícula directamente por encima de las células epidérmicas. El crecimiento fúngico posterior se limita a la región subcuticular de la epidermis.
Síntomas
R. secalis puede infectar cualquier parte de las hojas. Las manchas de forma irregular son la característica clave y la infección comienza desde la parte inferior hasta las hojas superiores. Las manchas aparecen inicialmente como zonas empapadas de agua. A medida que la enfermedad progresa, se vuelven grisáceas en el centro debido a la formación de esporas, con un margen marrón. Pueden aparecer necrosis y clorosis. Las manchas se unen y destruyen todas las hojas.
Modelo FieldClimate
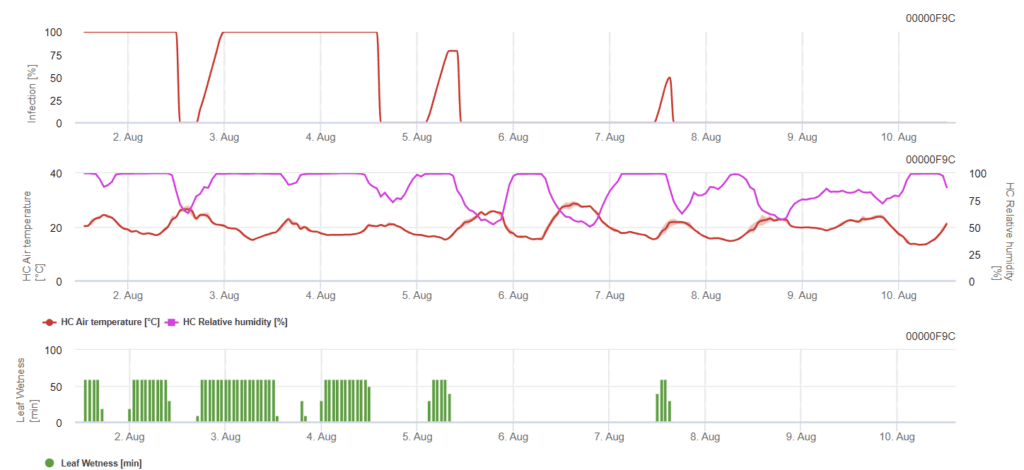
Modelo Rynchosporium de la mancha foliar
Sensores necesarios:
- Temperatura del aire
- Humedad relativa
- Humedad de las hojas
Para que se produzca una infección, se necesita un mínimo de 7 a 15 horas de humectación del plomo, en función de la temperatura (óptima a 20'C). Cuando el gráfico alcanza 100%, significa que se han determinado las condiciones óptimas sobre el terreno.
Literatura
- Brooks, F. T. (1928). Observations on Rhynchosporium secalis (Oud.) Davis, leaf blotch of barley and rye. New Phytologist, 27(4), 215-219.
- Fowler, A. M., & Owen, H. (1971). Studies on leaf blotch of barley (Rhynchosporium secalis). Transacciones de la Sociedad Micológica Británica, 56(1), 137-152.
- Zhan, J., Fitt, B. D., Pinnschmidt, H. O., Oxley, S. J. P., & Newton, A. C. (2008). Resistencia, epidemiología y gestión sostenible de poblaciones de Rhynchosporium secalis en cebada. Patología vegetal, 57(1), 1-14.
Mancha foliar por Ramularia
Patógeno
Ramularia collo-cygniEl hongo Ramularia, agente causal de la mancha foliar por Ramularia en la cebada, se propaga principalmente por reproducción asexual a través de conidios, que requieren humedad para su germinación y desarrollo temprano. Después de la germinación en la superficie de la hoja, el hongo entra en la hoja a través de los estomas y coloniza el tejido intercelularmente. Las plantas de cebada infectadas pueden no mostrar síntomas inicialmente, pero los daños suelen aparecer después de la floración.
El ciclo de vida de R. collo-cygni no se conoce del todo, pero implica la transmisión vertical a través de semillas infectadas, lo que permite al patógeno sobrevivir entre temporadas de cultivo. Los conidios transportados por el aire también contribuyen a la propagación secundaria, iniciando nuevas infecciones en condiciones favorables. Aunque las semillas son el principal mecanismo de hibernación, el papel de los hospedadores alternativos y de una estructura fúngica secundaria denominada Asteromella sigue siendo incierto y aún se está estudiando.
Síntomas

Los síntomas aparecen en ambos lados de las hojas después de la floración en general, pero son más comunes en las hojas superiores. Los síntomas iniciales aparecen como manchas amarillas a marrones junto a las nervaduras de la hoja rodeadas de un halo clorótico. Una vez que aparecen las manchas, la hoja se vuelve clorótica y necrótica, empezando normalmente por el extremo y los márgenes de la hoja. Las manchas vecinas pueden juntarse, creando zonas oscuras más grandes. También pueden observarse pequeñas manchas puntiformes. Aunque los síntomas de la mancha foliar por Ramularia pueden confundirse con los de otras enfermedades, la característica clave es que las manchas foliares están delimitadas a las venas de las hojas.
Existen las llamadas 5R para distinguir las manchas foliares de Ramularia:
- Anillado con un margen amarillo de clorosis
- Forma rectangular
- Restringido por las venas de la hoja
- Coloración marrón rojiza
- A través de la hoja
Modelo FieldClimate
Modelo Ramularia
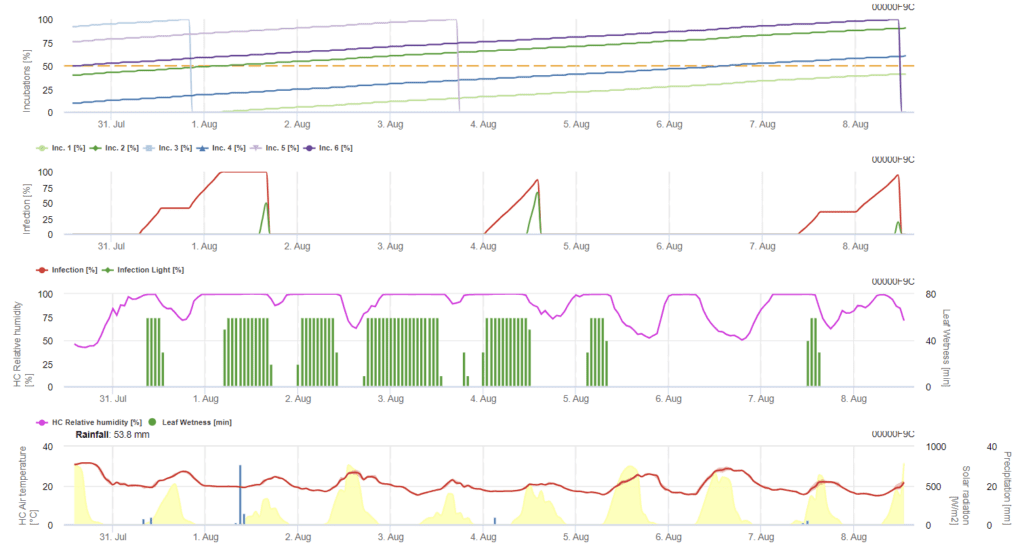
La infección por Ramularia en la cebada se debe sobre todo a las condiciones de humedad. Así pues, comenzamos el cálculo con un episodio de lluvia, seguido de una humedad de la hoja o una humedad relativa superior a 85%.
Se describen dos formas de infección:
- Infección: una vez que las condiciones de humedad simplemente promueven un evento de infección.
- Infección: una vez cuando se necesita radiación global para terminar un evento de infección.
Más adelante, cuando se alcanza la infección 100%, el modelo empieza a determinar el tiempo de incubación. Cuando la incubación alcanza 50%, se recomienda controlar el campo en busca de nuevo inóculo y, cuando alcanza 100%, se predicen lesiones necróticas en las hojas.
Literatura
- Havis, N. D., Brown, J. K., Clemente, G., Frei, P., Jedryczka, M., Kaczmarek, J., ... & Hess, M. (2015). Ramularia collo-cygni-un patógeno emergente de los cultivos de cebada. Fitopatología, 105(7), 895-904.
- Huss, H. (2002, abril). Biología de Ramularia collo-cygni. En Proc. Second Int. Workshop Barley Leaf Blights. Aleppo, Siria (pp. 321-328).
- Walters, D. R., Havis, N. D., & Oxley, S. J. (2008). Ramularia collo-cygni: la biología de un patógeno emergente de la cebada. FEMS Microbiology Letters, 279(1), 1-7. https://grdc.com.au/__data/assets/pdf_file/0025/443509/GRDC_FS2103_Ramularia_03.pdf
Rhizoctonia solani
Patógeno
La podredumbre radicular por Rhizoctonia en el trigo está causada por Rhizoctonia solani. El patógeno puede sobrevivir muchos años en el suelo en forma de esclerocios. En algunos casos, también sobrevive como micelio en restos vegetales. En cuanto aumenta la temperatura, los esclerocios se activan y generan una masa de hifas que permiten la infección al adherirse a las raíces. El micelio produce los llamados "cojines de infección" y el hongo invade y coloniza el tejido radicular. La infección de las raíces debilita las plántulas, lo que provoca un crecimiento deficiente, y reduce la capacidad de transportar agua y nutrientes a los tejidos vegetales aéreos, provocando finalmente la muerte de la planta.
Síntomas
Al principio aparecen manchas desnudas, cuyo tamaño varía entre unos pocos centímetros y varios metros de diámetro. Estas manchas desnudas suelen ir asociadas a plantas atrofiadas que pueden mostrar amarilleamiento, marchitamiento o incluso una coloración púrpura. Las plantas infectadas pueden estar muy atrofiadas y mostrar signos de estrés por sequía o carencia de nutrientes, lo que en algunos casos puede provocar su muerte prematura.
Se desarrollan lesiones de color marrón rojizo en tallos y raíces por debajo de la línea del suelo, que se hunden a medida que avanza la enfermedad. La podredumbre de la raíz puede reducir la nodulación y hacer que la corteza de la raíz se rompa con facilidad, lo que da lugar a puntas de lanza marrones.
Modelo FieldClimate
Modelo de riesgo de Rhizoctonia solani
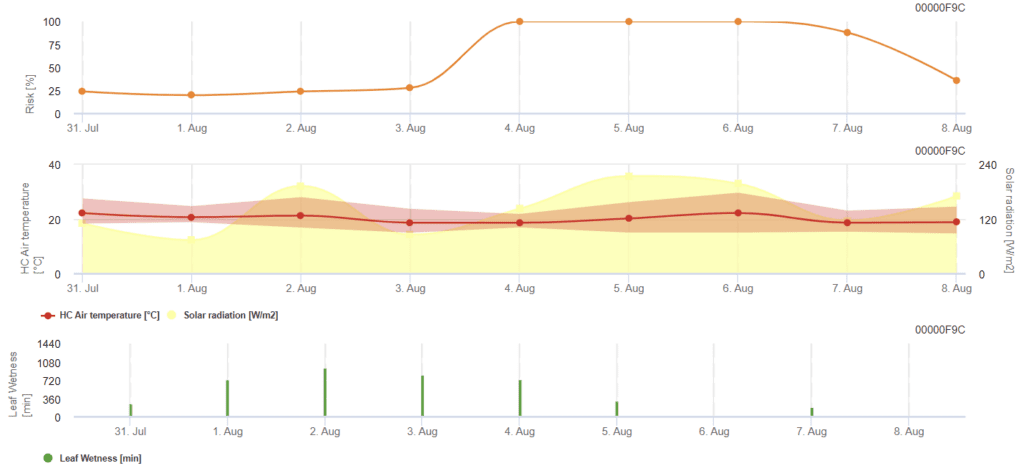
Sensores necesarios:
- Temperatura del aire
- Radiación solar
- Humedad de las hojas
El modelo calcula periodos de riesgo de Rhizoctonia solani comprobando las condiciones de las últimas 120 horas. El resultado es un valor de riesgo de 0 a 100, que indica condiciones favorables para la enfermedad.
No se necesitan pulverizaciones cuando el riesgo es bajo. En los periodos de riesgo moderado, el intervalo de pulverización puede prolongarse, y en los periodos de riesgo alto, puede ser necesario reducirlo, o se recomendaría el uso de compuestos más eficaces.
En caso de humedecimiento consecutivo de las hojas, acumula valores dependientes de la temperatura por cada minuto:
- 12 °C a 15 °C: acumulación de 1 por minuto
- 16 °C a 17 °C: acumulación de 2 por minuto
- 18°C y más: acumulación de 4 por minuto
Al final de los periodos de humectación de las hojas, evalúa los valores acumulados:
- Valores > 4096: El riesgo aumenta en 64 puntos y se resta 4096 al valor
- Valores residuales > 2048: El riesgo aumenta en 16 puntos y se resta 2048 del valor
- Valores de residuos >1024: El riesgo aumenta por 4 y se resta 1024 del valor
Si la radiación global es consecutiva superior a 800 W/m², acumula el tiempo en minutos y evalúa los valores cuando la radiación es inferior:
- Valor > 512: Riesgo - 32 puntos, valor - 512
- Valor > 256: Riesgo - 8 puntos, valor - 256
- Valor > 128: Riesgo - 2 puntos, valor - 128
Literatura
- https://cropprotectionnetwork.org/encyclopedia/rhizoctonia-root-rot-of-wheat#:~:text=It%20is%20caused%20by%20Rhizoctonia,result%20in%20premature%20plant%20death.
- https://ahdb.org.uk/knowledge-library/rhizoctonia-stunt-symptoms-and-risk-in-cereals
- https://cropwatch.unl.edu/rhizoctonia-root-rot#:~:text=Disease%20Symptoms&text=These%20reddish%20brown%20lesions%20may,uneven%20because%20of%20stunted%20plants.
- https://extensionaus.com.au/FieldCropDiseasesVic/docs/identification-management-of-field-crop-diseases-in-victoria/soil-borne-diseases/rhizoctonia-root-rot/
- https://www.florimond-desprez.com/es/wp-content/uploads/sites/6/2015/11/rhizoctonia_eng.pdf
Oidio
Patógeno
Blumeria graminis es el agente patógeno del oídio en el trigo y la cebada. Puede pasar el invierno en forma de micelio o cleistotecios. En primavera, las esporas germinan e infectan las plantas huésped en condiciones frescas y húmedas, sin necesidad de agua libre en las superficies de las plantas.
El hongo se reproduce tanto asexual como sexualmente.
En el ciclo asexual, el patógeno experimenta ciclos rápidos de infección y producción de conidios (esporas asexuales), que son clave para la propagación de la enfermedad. Las conidias se producen en el micelio cada 7 a 10 días en condiciones favorables. Una vez dispersadas por el viento, estas conidias aterrizan en un nuevo huésped, germinan y forman apresorios y haustorios para extraer nutrientes de la planta. Los conidios de Blumeria graminis pueden germinar incluso a baja humedad y a diversas temperaturas.
En el ciclo sexual, el hongo produce cleistotecios, estructuras resistentes que pueden sobrevivir bien a condiciones adversas. Los cleistotecios contienen ascosporas (esporas sexuales) y las nuevas infecciones se inician cuando se liberan estas esporas.
Síntomas

El oídio en el trigo y la cebada afecta al rendimiento del grano al reducir el número de cabezas y disminuir el tamaño y el peso de los granos. Cuanto antes se produzca la infección, mayores serán los daños.
La cebada muestra una resistencia al oídio relacionada con la edad. A medida que la cebada madura, en lugar de las típicas manchas de micelio, pueden aparecer en las hojas manchas bien definidas de color negro-marrón ("manchas de alquitrán").
El trigo es especialmente sensible al oídio entre el periodo de ahijamiento y la maduración de la leche, sobre todo cuando se ven afectadas las hojas bandera y las cáscaras. Sin embargo, en comparación con la cebada, el trigo tolera mejor las infecciones tempranas.
El oídio blanco grisáceo se desarrolla en hojas, tallos y cogollos. El crecimiento fúngico es más prominente en la superficie superior de la hoja, aunque también puede desarrollarse en el envés. Inicialmente, las pústulas parecen blancas, pero gradualmente se vuelven de color gris a marrón a medida que maduran y pueden unirse, formando masas más grandes a menudo rodeadas de clorosis. En el lado opuesto de las hojas infectadas, los tejidos se vuelven amarillos, y posteriormente se tornan de color bronceado o marrón. Cleistothecia también son visibles, como pequeños puntos negros redondos dentro de colonias grises más antiguas. En casos graves, las hojas pueden morir.
Modelo FieldClimate
Modelo del mildiú polvoroso del trigo
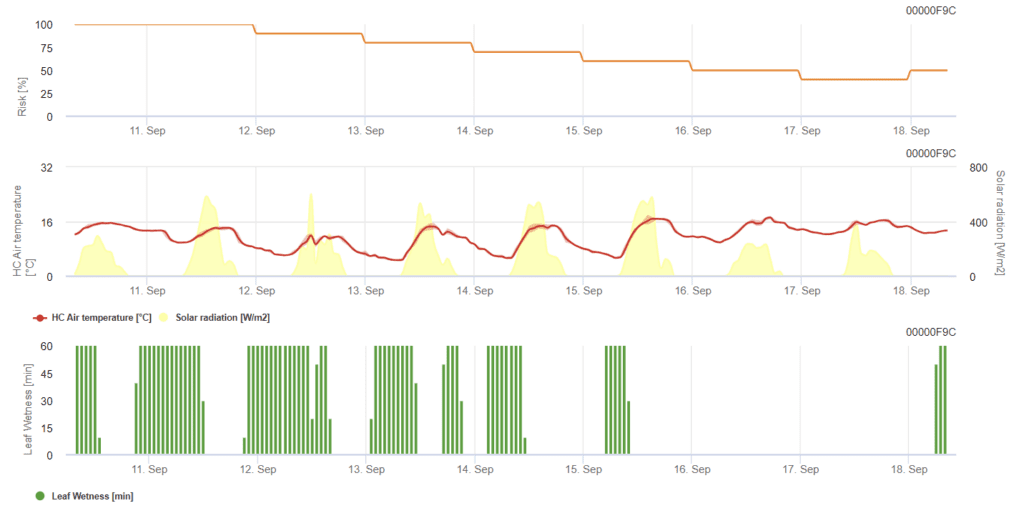
Sensores necesarios:
- Temperatura del aire
- Humedad de las hojas
- Radiación solar
El modelo determina el riesgo de oídio variando en una escala de 0 (sin infección) a 100% (infección total). Es pertinente durante el estadio BBCH de 21 a 39 para la cebada y de 21 a 75 para el trigo y la avena.
El estadio BBCH es una escala de crecimiento para describir el desarrollo de las plantas. Tiene dos dígitos, la escala va de 00 a 99 - 00 se refiere al tratamiento de la semilla y 99 es cuando tiene lugar el tratamiento posterior a la cosecha. El primer dígito indica el estado de desarrollo específico: 0 es germinación, 1 es desarrollo foliar, 2 es laboreo, 3 es elongación del tallo, 4 es arranque, 5 es emergencia de la inflorescencia y espigado, 6 es floración y antesis, 7 es desarrollo del fruto, 8 es maduración y 9 es senescencia.
- BBCH 21: Ahijamiento - Comienzo del ahijamiento; primer ahijamiento detectable.
- BBCH 39: Alargamiento del tallo - fase de hoja bandera; hoja bandera completamente desenrollada y lígula apenas visible.
- BBCH 75: Desarrollo del fruto - lácteo medio; contenido de grano lechoso y los granos alcanzan el tamaño final, pero aún verdes.
El riesgo aumenta con temperaturas entre 12 °C y 21°C durante la mayoría de las horas del día y baja radiación global. Por el contrario, la humedad de las hojas, la radiación global elevada y las temperaturas altas superiores a 32 °C disminuyen el riesgo.
Literatura
- Both, M., & Spanu, P. D. (2004). Blumeria graminis f. sp. hordei, an obligate pathogen of barley. Revistas anuales de plantas, 11, 202-218.
- Cunfer, B. M. (2002). Oídio. Trigo panificable: mejora y producción, 30, 317-330.
- Der Gräser, E. M. Krankheiten und Schädlinge des Getreides. Lancashire, P. D., Bleiholder, H., Boom, T. V. D., Langelüddeke, P., Stauss, R., Weber, E., & Witzenberger, A. (1991). A uniform decimal code for growth stages of crops and weeds. Anales de biología aplicada, 119(3), 561-601. https://ohioline.osu.edu/factsheet/plpath-cer-11
Óxido marrón
Patógeno
Hay tres royas y patógenos importantes:
- Roya de la hoja/roya parda: Puccinia triticina
- Vástago/ Óxido negro: Puccinia graminis
- Raya/ Amarillo óxido: Puccinia striiformis
La roya parda es la enfermedad más común de la roya del trigo. La roya negra también se conoce como roya de verano debido al abundante desarrollo de teliosporas negras brillantes. Es la enfermedad de la roya más devastadora, causando el 50% de las pérdidas en un mes en condiciones favorables. La roya amarilla es una enfermedad del trigo en climas más fríos, generalmente asociada a elevaciones más altas y latitudes septentrionales. Se caracteriza por las urediniosporas de color amarillo. En casos graves, puede causar daños tan importantes como la roya negra.
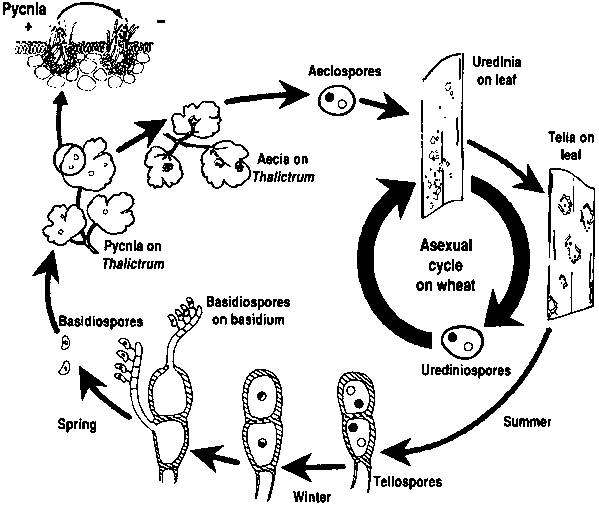
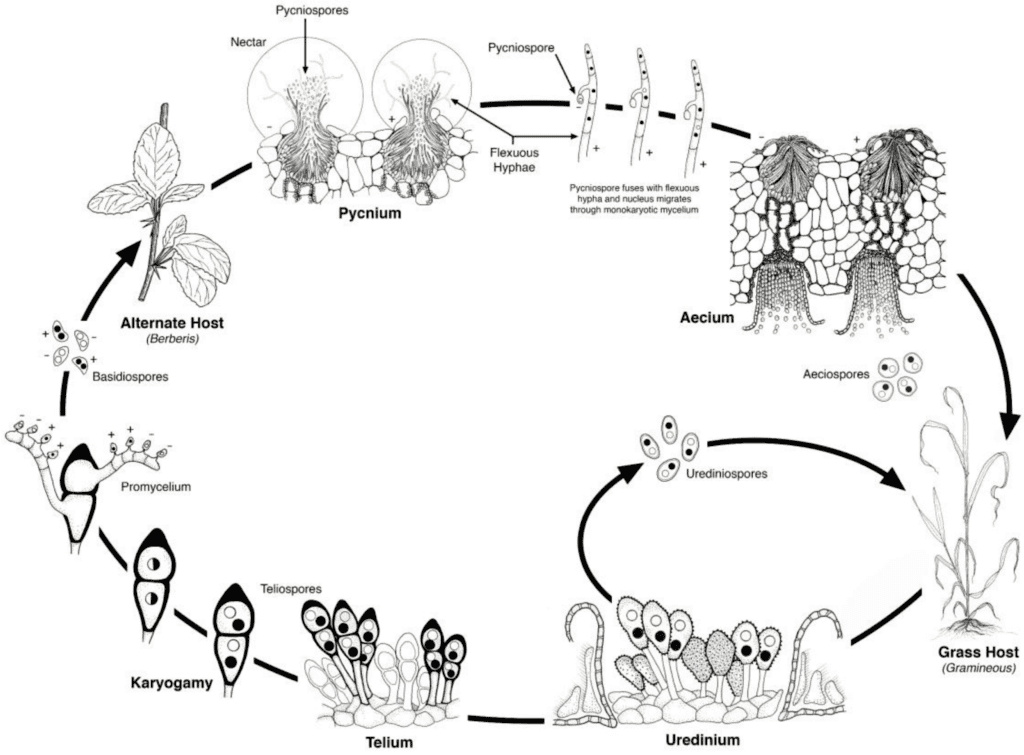
Los patógenos de la roya del trigo experimentan ciclos reproductivos tanto asexuales como sexuales y requieren dos plantas huésped: un huésped económico y un huésped alternativo. El huésped económico es el trigo, y el huésped alternativo suele ser una mala hierba o una planta autóctona, lo que permite a los hongos pasar a la fase sexual. Puccinia striiformis no se le conoce ningún hospedador alternativo, y consta de estadios uredinial y telial.
En el ciclo asexual, las urediniosporas se producen en la planta huésped y pueden seguir infectándola repetidamente, lo que da lugar a una infección rápida y generalizada en condiciones favorables.
El ciclo sexual del patógeno comienza cuando las teliosporas, formadas en infecciones urediniales en la planta huésped, germinan y sufren meiosis para producir basidiosporas. Estas basidiosporas se dispersan a un hospedador alternativo, donde inician la infección, dando lugar a la formación de picniosporas que contienen picniosporas e hifas receptivas. La fecundación se produce cuando las picniosporas de un tipo de apareamiento se transfieren al opuesto a través del néctar. Tras la fecundación, se desarrollan copas aeciales en el envés de las hojas del hospedador alternativo, que liberan aeciosporas. Estas aeciosporas se dispersan e infectan a nuevos hospedadores, a lo que sigue la infección uredinial, que completa el ciclo de vida del patógeno.
Síntomas

A) Puccinia graminis
B) Puccinia striiformis
C) Puccinia triticina
Puccinia triticina
P. triticina infecta principalmente las láminas foliares, pero ocasionalmente puede afectar a las vainas, glumas y axilas de las hojas, formando pequeñas manchas amarillas en la superficie superior de la hoja. Estas manchas se convierten en pústulas de color naranja rodeadas de un halo amarillo a medida que la enfermedad progresa. Las pústulas producen esporas naranjas o negras visibles en las hojas. Produce menos teliosporas, a diferencia de la roya negra. Algunas pueden presentar manchas hipersensibles o uredinias rodeadas de zonas cloróticas o necróticas.
Puccinia graminis
P. graminis afecta principalmente a los tallos, pero también puede infectar hojas, vainas, glumas, cañas e incluso semillas. Al principio aparecen lesiones de color marrón rojizo y, a medida que avanza la enfermedad, se forman teliosporas negras dentro de las pústulas. Las masas de urediniosporas de color rojo ladrillo se desarrollan primero en los tallos y las vainas de las hojas y aparecen pequeñas motas cloróticas, que se convierten en pústulas lineales o en forma de diamante que pueden aumentar de tamaño. Al madurar, la producción de urediniosporas se detiene y se produce una capa de teliosporas negras, lo que hace que los tallos aparezcan ennegrecidos a finales de la temporada. En casos graves, la infección debilita los tallos de las plantas, lo que provoca su encamado.
Puccinia striiformis
El rasgo característico de P. striiformis es la presencia de pústulas amarillas de lados rectos. Las pústulas aparecen en franjas estrechas y alargadas de varias longitudes, a menudo acompañadas de clorosis y necrosis. A medida que la enfermedad madura, se desarrollan esporas amarillo-anaranjadas dentro de las pústulas y los tejidos circundantes se vuelven marrones y se secan, creando un aspecto chamuscado.
Modelo FieldClimate
Modelo de la roya puccinia
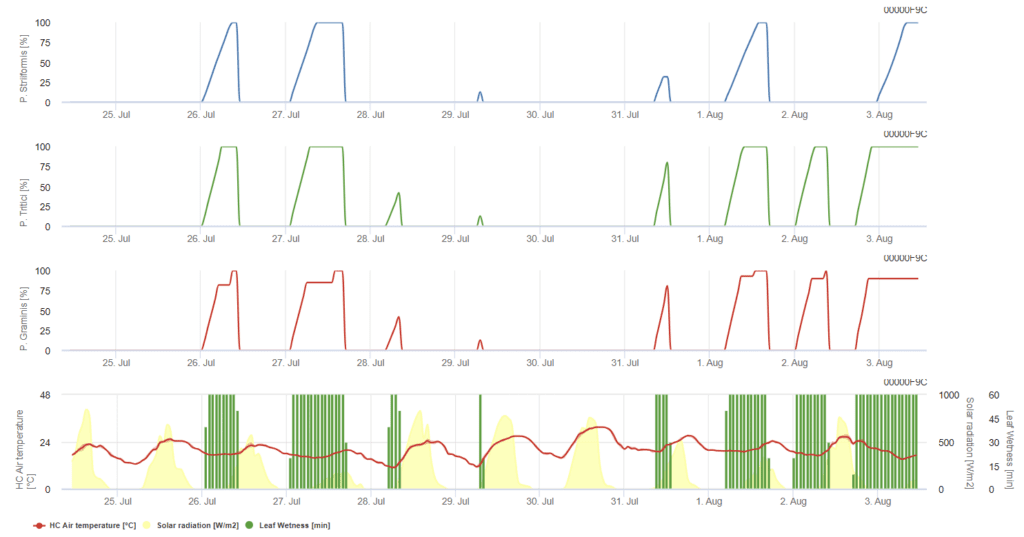
P. triticina, P. graminis, P. striiformis se presentan en tres gráficos de colores diferentes.
Modelo de infección por Puccinia triticna
El modelo supone que la infección necesita una temperatura acumulada por hora de 90°C de humedad foliar en un rango de temperatura del aire de 5°C a 30°C. Las condiciones son similares a P. graminispero con un umbral de temperatura inferior, de 5 °C.
Si se muestra una infección de 100%, debería considerarse una medida fitosanitaria curativa. Si el riesgo se sitúa en 80% y la previsión meteorológica pronostica más periodos de humedad foliar, podrían realizarse aplicaciones foliares protectoras.
Humedad de la hoja para temperaturas medias horarias acumuladas para 90°C:
- (si T <= 22,5°C entonces ∑(Th) si no ∑ (22,5-(Th-22,5))
- 5°C < Temp. < 30°C
Modelo de infección por Puccinia graminis
Las infecciones tienen lugar después de algunas horas de humedad de la hoja en condiciones óptimas de temperatura. El modelo supone que la infección necesita una temperatura acumulada por hora de 80°C de humedad de la hoja en un rango de temperatura del aire de 10°C a 35°C. Prefiere una temperatura ligeramente superior a P. triticina y la infección tiene que ir seguida de luz solar.
Cuando se muestra la infección por 100%, las condiciones han sido favorables para el hongo y, por tanto, deben considerarse las medidas fitosanitarias.
Humedad de la hoja para temperaturas medias horarias acumuladas para 80°C seguidas de un periodo de luz (150 W/m²) para temperaturas medias horarias acumuladas para 30°C:
- (si T <= 24°C entonces ∑(Th) si no ∑ (Th-24))
- 10°C < Temp. < 35°C
Modelo de infección por Puccinia striiformis
Puccinia striiformis es la roya del trigo de climas fríos que tiene su temperatura óptima ya a partir de los 15°C. Las infecciones tienen lugar después de algunas horas de humedad de la hoja en condiciones óptimas de temperatura. El modelo supone que la infección necesita una temperatura horaria acumulada de 80°C de humedad foliar en un rango de temperatura del aire de 5°C a 20°C. No se producen infecciones en periodos de baja intensidad luminosa.
Antes de que el gráfico alcance 100%, se podría realizar una aplicación protectora, mientras que después de que lo haga, se deberían considerar estrategias de protección curativas (sistémicas).
Humedad de la hoja y luz para temperaturas medias horarias acumuladas para 80°C:
- (si T <= 15°C entonces ∑(Th) si no ∑ (Th-15))
- 5°C < Temp. < 20°C
Literatura
- Bolton, M. D., Kolmer, J. A., & Garvin, D. F. (2008). Roya de la hoja del trigo causada por Puccinia triticina. Patología vegetal molecular, 9(5), 563-575.
- Chen, X. M. (2005). Epidemiología y control de la roya amarilla [Puccinia striiformis f. sp. tritici] en el trigo. Revista canadiense de fitopatología, 27(3), 314-337.
- Figueroa, M., Hammond-Kosack, K. E., & Solomon, P. S. (2018). Una revisión de las enfermedades del trigo-una perspectiva de campo. Patología vegetal molecular, 19(6), 1523-1536.
- Guide, A. Leaf, Stem, and Stripe Rust Diseases of Wheat. Leonard, K. J., & Szabo, L. J. (2005). Roya del tallo de pequeños cereales y gramíneas causada por Puccinia graminis. Patología vegetal molecular, 6(2), 99-111.
- Kolmer, J. (2013). Roya de la hoja del trigo: biología del patógeno, variación y resistencia del huésped. Bosques, 4(1), 70-84.
- Singh, R. P., Huerta-Espino, J., Roelfs, A. P., & Curtis, B. C. (2002). Las royas del trigo. Crecimiento, 2(25), 35.
Equipamiento recomendado
Compruebe qué conjunto de sensores se necesita para vigilar las posibles enfermedades de este cultivo.
