Hanf und Leinsamen Krankheitsmodelle
Sklerotinia-Fäule
Die Sklerotinia-Fäule befällt ein breites Spektrum von Pflanzen, insbesondere nicht verholzende Arten. Sclerotinia-Fäule wird durch S. sclerotiorum verursacht. Sclerotinia-Fäule kann Pflanzen in jedem Produktionsstadium befallen, einschließlich Sämlinge, reife Pflanzen und Ernteprodukte. Pflanzen mit alterndem oder abgestorbenem Gewebe sind besonders anfällig für eine Infektion.
Symptome
Der befallene Bereich einer Pflanze nimmt zunächst ein dunkelgrünes oder braunes, wasserdurchtränktes Aussehen an und kann dann eine blassere Farbe annehmen. In der Regel entwickelt sich ein dichtes weißes, watteartiges Myzel, und die Pflanze beginnt zu welken und stirbt schließlich ab. Ruhe- oder Überlebensstrukturen (Sklerotien) bilden sich äußerlich an den befallenen Pflanzenteilen und innerlich in den Markhöhlen der Stängel. Die Sklerotien sind hart, schwarz, unregelmäßig geformt, meist 2-4 mm groß und schwer zu erkennen, sobald sie in den Boden eingedrungen sind.
Krankheitsquellen und -ausbreitung
Der Lebenszyklus von S. sclerotiorum umfasst sowohl eine bodenbürtige als auch eine luftbürtige Phase. Sklerotien von S. sclerotiorum können zehn Jahre oder länger im Boden überleben. Sie keimen und bilden kleine trichterförmige Fruchtkörper (Apothecien) mit einem Durchmesser von etwa 1 cm. Die Apothecien produzieren luftgetragene Sporen, die eine Infektion verursachen können, wenn sie auf einer anfälligen Wirtspflanze landen, entweder über die Blüten oder durch direkte Keimung auf Blättern. Gelegentlich kann es zu einer Infektion der Stängelbasen kommen, wenn sich Pilzstränge (Myzel) direkt aus Sklerotien nahe der Oberfläche entwickeln. Neue Sklerotien entwickeln sich in infiziertem Pflanzengewebe, und wenn die Pflanze abstirbt, verbleiben sie auf der Bodenoberfläche oder können bei der anschließenden Bodenbearbeitung in den Boden gelangen.
Bedingungen für eine Infektion
Nach einer Kälteperiode im Winter keimen die Sklerotien, die in den obersten 5 cm des Bodens überwintern, ab dem Frühjahr und bilden Apothecien, wenn die Bodentemperaturen 10°C oder höher sind und der Boden feucht ist. Sklerotien keimen nicht in trockenem Boden oder bei einer Bodentemperatur von über 25 °C. Sklerotien, die weniger als 5 cm in den Boden eingegraben sind, keimen weniger wahrscheinlich. Sobald die Apothecien vollständig ausgebildet sind, die Sporenfreisetzung kann im Licht oder im Dunkeln erfolgen, ist aber temperaturabhängigDer Höhepunkt wird also um die Mittagszeit erreicht. Die Apothecien können bei 15 bis 20 °C etwa 20 Tage überdauern, schrumpfen jedoch nach weniger als 10 Tagen bei 25 °C. Für blühende Kräuter, Sporen, die auf Blütenblättern und Staubgefäßen landen, keimen schnell (Keimung innerhalb von 3-6 Stunden und Infektion innerhalb von 24 Stunden) unter optimalen Bedingungen von 15-25°C, kontinuierlicher Blattnässe und hohe Luftfeuchtigkeit innerhalb der Pflanze. Die anschließende Infektion von Blättern und Stängeln hängt davon ab, dass Blütenblätter abfallen und an den Blättern haften bleiben. Das Infektionsrisiko erhöht sich, wenn die Blätter feucht sind, da dann mehr Blütenblätter anhaften. Infizierte, abgestorbene oder absterbende Blütenblätter liefern Nährstoffe für das Eindringen des Pilzes in Blätter und Stängel. Für bei nicht blühenden Kräutern erfolgt die Infektion hauptsächlich durch Sporen, die aus der Luft direkt auf die Blätter gelangen. Die Sporen können mehrere Wochen lang auf den Blättern überleben, bis die Bedingungen für eine Blattinfektion günstig sind. Sporenkeimung und Infektion hängen vom Vorhandensein von Nährstoffen auf den Blättern ab, die entweder aus Pflanzenwunden oder aus alterndem Pflanzenmaterial stammen. Wie bei blühenden Kräutern liegen die optimalen Bedingungen für die Sporenkeimung und Infektion bei 15-25 °C mit kontinuierlicher Blattnässe und hoher Luftfeuchtigkeit. Ist die Infektion der Pflanzen einmal erfolgt, wird ein rascher Krankheitsverlauf durch warme (15-20°C) und feuchte Bedingungen in dichten Beständen begünstigt.
Sclerotinia-Infektionsmodell
Pflanzeninfektion durch S. sclerotiorum
Die karpogene Keimung von Sklerotien wird durch Perioden von kontinuierliche Bodenfeuchtigkeit. Auf der Bodenoberfläche bilden sich Apothecien, aus denen Ascosporen in die Luft abgegeben werden. Die Infektion der meisten Kulturpflanzenarten erfolgt hauptsächlich durch Ascosporen, aber eine direkte Infektion von gesundem, intaktem Pflanzengewebe durch keimende Ascosporen findet normalerweise nicht statt. Stattdessen kommt es nur dann zu einer Infektion von Blatt- und Stängelgewebe gesunder Pflanzen, wenn keimende Ascosporen abgestorbene oder alternde Gewebe, in der Regel Blütenteile wie abgeschnittene Blütenblätter, besiedeln, bevor sie Infektionsstrukturen bilden und in diese eindringen. Die myceliogene Keimung von Sklerotien an der Bodenoberfläche kann auch zur Besiedlung von abgestorbenem organischem Material mit anschließender Infektion angrenzender lebender Pflanzen führen. Bei einigen Kulturpflanzen, zum Beispiel Bei Sonnenblumen kann die myceliogene Keimung von Sklerotien direkt den Infektionsprozess der Wurzeln und des basalen Stängels einleiten, was zur Welke führt. Der Stimulus für die Myzelkeimung und -infektion bei Sonnenblumen ist nicht bekannt, hängt aber wahrscheinlich von Nährstoffsignalen in der Rhizosphäre ab, die von den Wirtspflanzen stammen.
Der Infektionsprozess
Die Infektion von gesundem Gewebe hängt von den Bildung eines Appressoriumsdie je nach Wirtsoberfläche eine einfache oder komplexe Struktur aufweisen können. In den meisten Fällen ist das Eindringen direkt durch die Kutikula und nicht durch Spaltöffnungen. Appressorien entwickeln sich aus terminalen, dichotomen Verzweigungen von Hyphen, die auf der Wirtsoberfläche wachsen, und bestehen aus einem Polster aus breiten, mehrseptigen, kurzen Hyphen, die senkrecht zur Wirtsoberfläche ausgerichtet sind, an der sie durch Schleim befestigt sind. Komplexe Appressorien werden oft als Infektionskissen bezeichnet. Obwohl frühere Forscher davon ausgingen, dass das Eindringen in die Kutikula ein rein mechanischer Prozess ist, gibt es deutliche Hinweise aus Ultrastrukturstudien, dass die enzymatische Verdauung der Kutikula spielt ebenfalls eine Rolle in den Penetrationsprozess. Es ist wenig bekannt über S. sclerotiorum Cutinasen, jedoch kodiert das Genom für mindestens vier Cutinase-ähnliche Enzyme (Hegedus unveröffentlicht). Ein großes Vesikel, das vor dem Eindringen an der Appressoriumspitze gebildet wird, scheint während des Eindringens in die Wirtskutikula freigesetzt zu werden. Nach dem Eindringen in die Kutikula bildet sich ein subkutikuläres Vesikel, aus dem sich große Hyphen ausbreiten, die über die subkutikuläre Wand der Epidermis wachsen und diese auflösen.
Infektion durch enzymatische Degradation der Seuchenzellen: Oxalsäure wirkt mit zellwandabbauenden Enzymen wie Polygalacturonase (PG) zusammen, um die Zerstörung des Wirtsgewebes zu bewirken, indem sie ein günstiges Umfeld für den PG-Angriff auf Pektin in der Mittellamelle schafft. Dadurch werden wiederum Derivate mit niedrigem Molekulargewicht freigesetzt, die die Expression weiterer PG-Gene induzieren. Tatsächlich wird die gesamte PG-Aktivität durch Pektin oder aus Pektin gewonnene Monosaccharide wie Galakturonsäure induziert und durch die Anwesenheit von Glukose unterdrückt. Die Untersuchung der Expressionsmuster einzelner Sspg-Gene hat gezeigt, dass das Zusammenspiel der PGs untereinander und mit dem Wirt während der verschiedenen Infektionsstadien sehr gut koordiniert ist. (Dwayne D. Hegedus *, S. Roger Rimmer: Sclerotinia sclerotiorum: Wann ist man ein Erreger oder nicht? FEMS Microbiology Letters 251 (2005) 177-184)
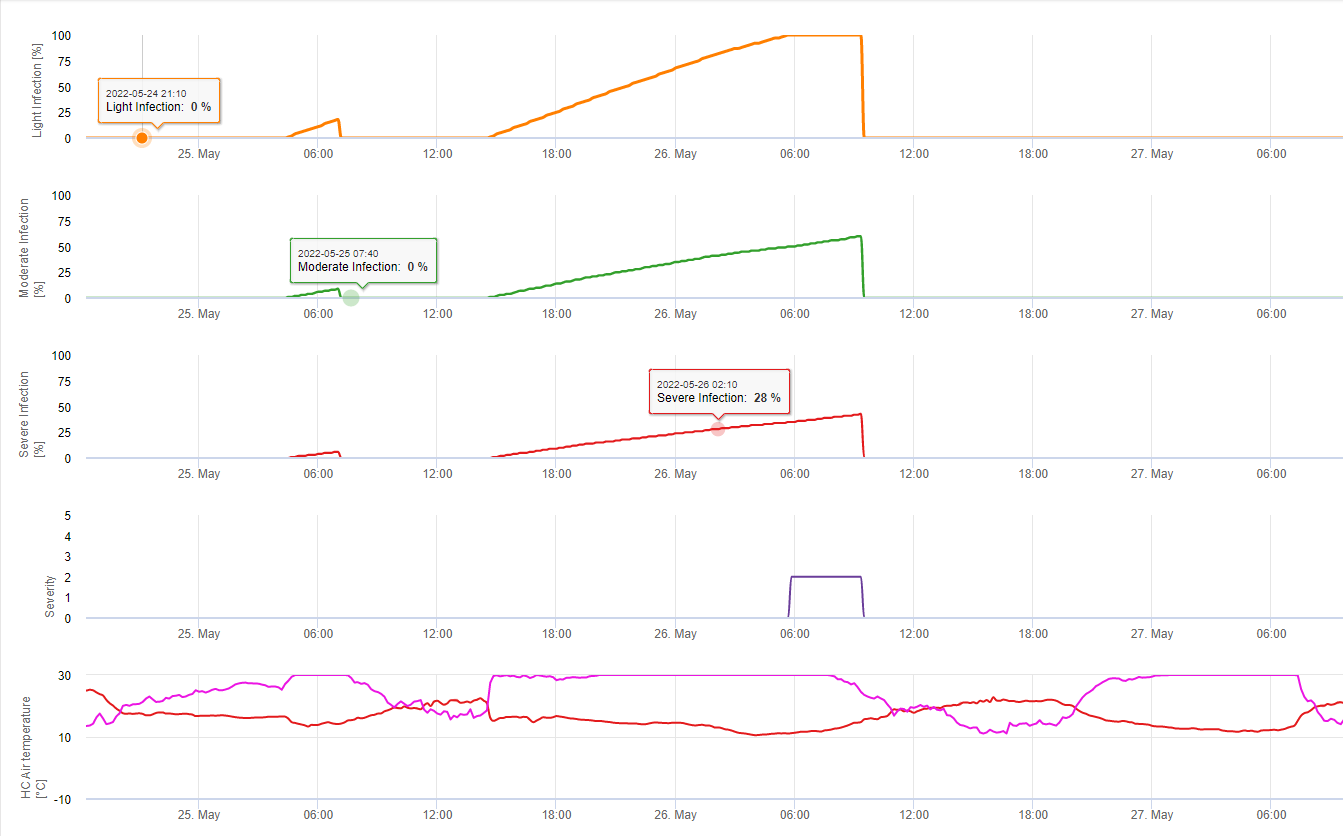
Bei der Suche nach den klimatischen Bedingungen für die Infektion von S. sclerotiorum müssen die Bildung von Apothecien, die Sporenbildung, die direkte Infektion durch Apothecien (auch wenn sie nicht sehr häufig vorkommt) und die Infektion aus etablierten Mycelien durch enzymatischen Abbau der epidemischen Zellen berücksichtigt werden.
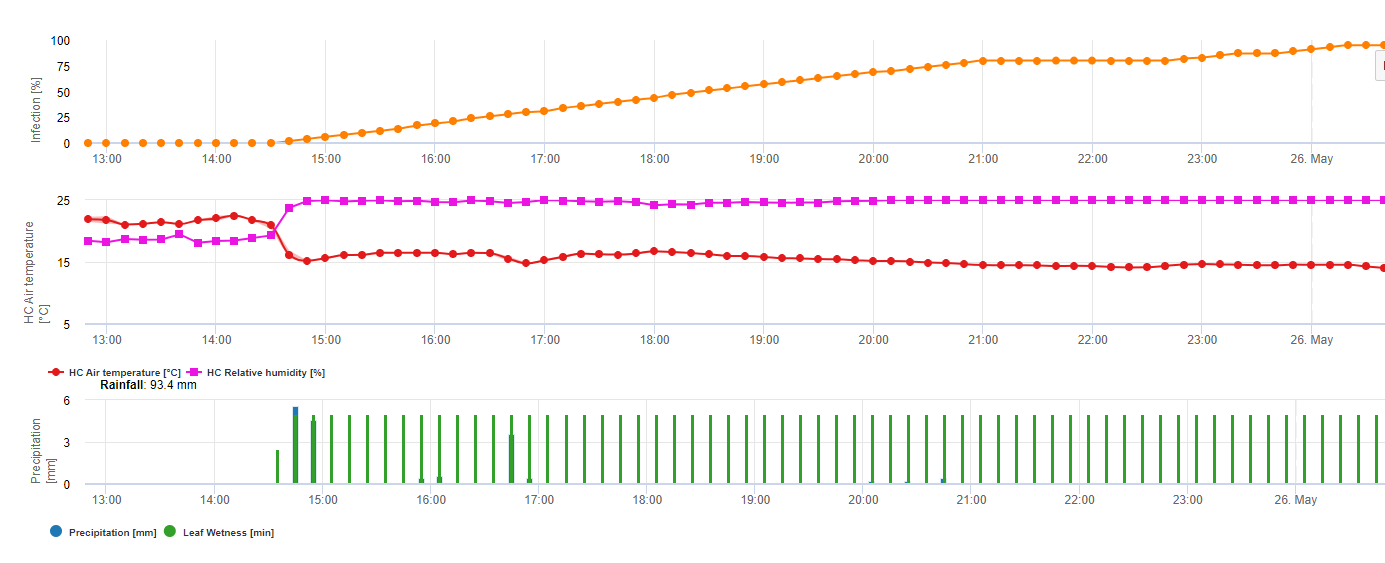
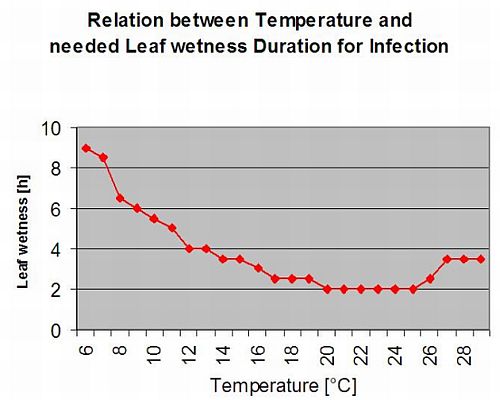
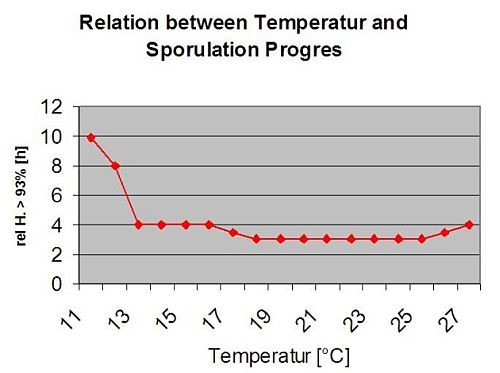
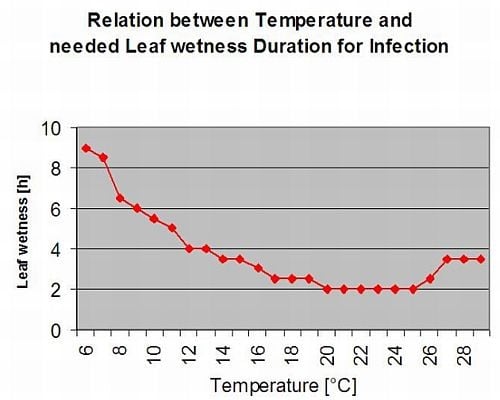
Apothecienbildung und Sporenbildung findet statt, wenn eine Regen von mehr als 8 mm folgt ein Zeitraum von hohe relative Luftfeuchtigkeit, die länger als 20 Stunden bei einer optimalen Temperatur von 21°C bis 26°C anhält.
Direkte Infektion durch Apothecien zu erwarten, nachdem ein Blattnässeperiode gefolgt von 16 Stunden relativer Luftfeuchtigkeit höher als 90% unter optimalen 21°C bis 26°C ("Appressorieninfektion"). Ein saprophytisches Wachstum mit anschließender enzymatischer Degradation der Epidermiszellen ("hydrolytische Infektion") ist bei einer etwas niedrigeren relativen Feuchtigkeit von 80% über einen Zeitraum von 24 Stunden unter optimalen Bedingungen von 21°C bis 26°C zu erwarten.
Literatur:
- Lumsden, R.D. (1976) Pectolytische Enzyme von Sclerotinia sclerotiorum und ihre Lokalisierung auf infizierten Bohnen. Can. J. Bot. 54,2630-2641.
Tariq, V.N. und Jeffries, P. (1984) Appressoriumbildung durch Sclerotinia sclerotiorum: Rasterelektronenmikroskopie. Trans. Brit. Mycol. Soc. 82, 645-651. - Boyle, C. (1921) Studien zur Physiologie des Parasitismus. VI. Infektion durch Sclerotinia libertiana. Ann. Bot. 35, 337-347.
Abawi, G.S., Polach, F.J. und Molin, W.T. (1975) Infection of bean by ascospores of Whetzelinia sclerotiorum. Phytopathologie 65, 673-678. - Tariq, V.N. und Jeffries, P. (1986) Ultrastruktur der Penetration von Phaseolus spp. durch Sclerotinia sclerotiorum. Can. J. Bot. 64, 2909- 2915.
- Marciano, P., Di Lenna, P. und Magro, P. (1983) Oxalsäure, zellwandabbauende Enzyme und pH-Wert in der Pathogenese und ihre Bedeutung für die Virulenz von zwei Isolaten von Sclerotinia sclerotiorum auf Sonnenblumen. Physiol. Plant Pathol. 22, 339-345.
- Fraissinet-Tachet, L. und Fevre, M. (1996) Regulation der Produktion ppektinolytischer Enzyme durch Sclerotinia sclerotiorum durch Galakturonsäure. Curr. Microbiol. 33, 49-53.
Praktische Anwendung des Sclerotinia-Modells
Das White Leg Infection Model zeigt die Zeiträume, in denen die Bildung von Apotheken erwartet werden. Wenn diese Zeiträume mit der Blütezeit von Raps oder Canola übereinstimmen, ist zu erwarten S. sclerotiorum Infektionen während einer feuchten Periode. Die in den Apothecien gebildeten Sporen können ein bis mehrere Tage lang verfügbar sein. Die Möglichkeit von Infektionen wird durch die Berechnung des Infektionsfortschritts für direkte oder indirekte Infektionen durch Appressorien oder enzymatische Zellwanddegradation angezeigt. Erreicht die Infektionsfortschrittslinie den Wert 100%, so ist von einer Infektion auszugehen. Diese Infektionen sollten präventiv oder mit einem kurativ wirkenden Fungizid behandelt werden gegen S. sclerotiorum verwendet werden muss.
Grauschimmel
Biologie des Grauschimmels
Grauer Schimmel (Botrytis cinerea) ist eine verheerende Krankheit mit großen wirtschaftlichen Auswirkungen auf die Produktion. B. cinerea infiziert die Blüten und die Früchte kurz vor der Reife.
Der Pilzerreger hat ein sehr breites Wirtsspektrum und infiziert mehr als 200 verschiedene Wirte. Das Pilzwachstum erfolgt saprophytisch und parasitär.
Symptome
Bei Sonnenblumen verursacht der Erreger einen Grauschimmel an Kopf und Stängel. Gleichzeitig beginnen die Blätter zu vertrocknen. Diese Symptome treten während der Reifung der Körner am Kopf auf. Auf der Rückseite sind braune Flecken zu sehen. Diese Flecken sind mit dem Pilzmyzel und den Sporen bedeckt, so dass sie wie ein Pulver aussehen. Die Sporen können bei feuchter Witterung verbreitet werden.
Schwarze Sklerotien ohne Mark erscheinen auf den Ernterückständen nach der Ernte oder direkt auf den Pflanzen, wenn sie zu spät geerntet werden.
Der Pilz überwintert auf der Bodenoberfläche oder im Boden als Myzel oder Sklerotien. Im Frühjahr beginnt die überwinternde Form zu keimen und Konidien zu produzieren. Diese Konidien werden durch Wind und Regen verbreitet und infizieren neues Pflanzengewebe.
Die Keimung ist bei einer relativen Luftfeuchtigkeit über 85% möglich. Die optimale Keimtemperatur liegt bei 18°C. Der Pilzerreger kann sich mehrfach vermehren.
Kontrollmöglichkeiten: Die Saatgutbekämpfung kann die Pflanzen vor Dämpfungserregern schützen. Die chemische Bekämpfung ist aufgrund der Resistenz des Erregers schwierig. Daher wird versucht, natürliche Bekämpfungsstrategien mit Trichoderma harzianum zu entwickeln.
Bedingungen für die Modellierung der Infektion
B. cinerea Infektionen sind verbunden mit freie Feuchtigkeit. Daher wird in der Freilandproduktion Blattnässeder ein guter Indikator ist, wird ermittelt.
Bulger et al. (1987) untersuchten den Zusammenhang zwischen der Blattnässe während der Blüte und dem Auftreten von Grauschimmel an den Früchten. Sie fanden heraus, dass für eine bei 20°C besteht ein höheres Infektionsrisiko, daher ist eine Zeitspanne von mehr als 32 Stunden mit Blattnässe erforderlich. Bei niedrigeren Temperaturen müssen die Blattnässeperioden länger sein, damit sich die Krankheit ausbreiten kann.
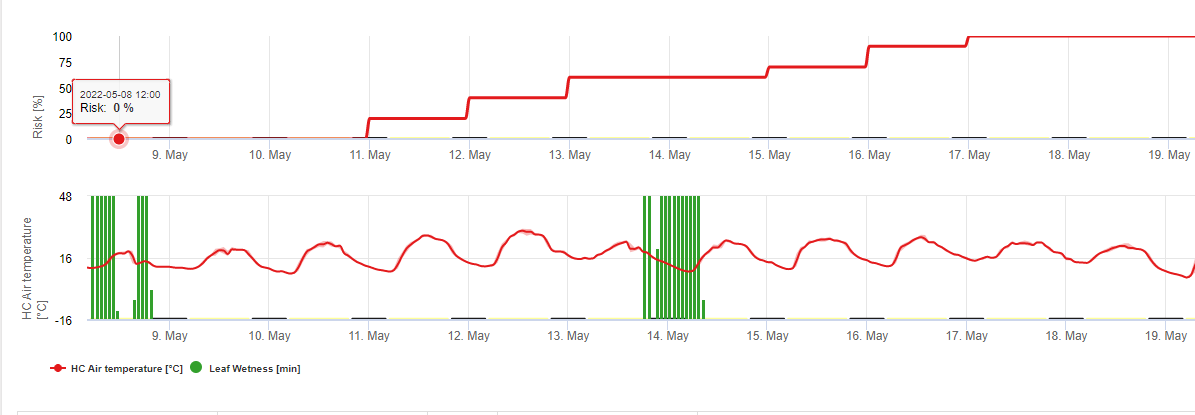
FieldClimate zeigt das Risiko an, dass Botrytis cinerea an der Basis von Blattnässeperioden und die Temperatur während dieser Zeiträume.
Das nachstehende Diagramm zeigt die Dauer der nassen Blätter in Abhängigkeit von der tatsächlichen Temperatur, die für eine Botrytis Infektion. Wenn das Risiko höher als 0 ist, erhöht jede Blattnässe, die länger als 4 Stunden andauert, das Risiko um das gleiche Verhältnis.
Ein Tag mit einer Blattnässeperiode von weniger als 4 Stunden wird als trockener Tag angenommen und reduziert das Risiko um 20% des tatsächlichen Wertes.
Praktische Anwendung des Grauformenmodells: Das Modell zeigt Zeiträume mit einem Risiko von Botrytis Infektion. Diese Risikoperiode während der Erdbeerblüte wird zu infizierten Früchten führen. Je länger die Risikoperiode dauert und je höher das Risiko ist, desto höher ist die Wahrscheinlichkeit und die Anzahl der infizierten Früchte. Das Risiko, das in Betracht gezogen werden kann, hängt vom Markt ab. Erzeuger, die ihre Früchte an Supermärkte verkaufen, gehen kein Risiko ein, da sie wissen, dass sie keine infizierten Früchte verkaufen können. Erzeuger, die ihre Früchte direkt an die Bevölkerung verkaufen, können dagegen ein höheres Risiko eingehen.
Literatur:
- Bulger M.A., Ellis M. A., Madden L. V. (1987): Einfluss von Temperatur und Nässe auf die Infektion von Erdbeerblüten durch Botrytis cinerea und das Auftreten der Krankheit bei Früchten, die aus infizierten Blüten stammen. Ökologie und Epidemiologie; Vol 77 (8): 1225-1230.
- Sosa-Alvarez M., Madden L.V., Ellis M.A. (1995): Auswirkungen von Temperatur und Feuchtigkeitsdauer auf die Sporulation von Botrytis cinerea auf Erdbeerblattresten. Plant Disease 79, 609-615.
Braunfäule
Kraut- und Knollenfäule bei Kartoffel und Tomate
Randall C. Rowe, Sally A. Miller, Richard M. Riedel, Ohio State University Extension Service
Die Kraut- und Knollenfäule ist eine sehr verbreitete Krankheit sowohl bei Kartoffeln als auch bei Tomaten. Bei der Kartoffel verursacht sie Blattflecken und Knollenfäule, bei der Tomate Blattflecken, Fruchtfäule und Stammläsionen. Die Krankheit kann in einem breiten Spektrum von Klimabedingungen auftreten und sehr zerstörerisch sein, wenn sie unkontrolliert bleibt, was oft zu einer vollständigen Entlaubung der Pflanzen führt. Anders als der Name vermuten lässt, entwickelt sich die Krankheit selten früh, sondern tritt meist auf reifem Laub auf.
Symptome
Auf den Blättern beider Kulturen treten die ersten Symptome in der Regel auf älteren Blättern auf und bestehen aus kleinen, unregelmäßigen, dunkelbraunen bis schwarzen, abgestorbenen Flecken, die eine Größe von einem winzigen Punkt bis zu einem halben Zoll im Durchmesser haben. Wenn sich die Flecken vergrößern, können sich konzentrische Ringe bilden, die auf unregelmäßige Wachstumsmuster des Organismus im Blattgewebe zurückzuführen sind. Dies verleiht der Läsion das charakteristische Aussehen eines "Zielpunkts" oder "Bullauges". Um jeden Fleck befindet sich oft ein schmaler, gelber Lichthof, und die Läsionen sind in der Regel von Adern umgeben. Wenn die Flecken zahlreich sind, können sie zusammenwachsen, so dass die infizierten Blätter gelb werden und absterben. In der Regel werden die ältesten Blätter zuerst befallen, sie vertrocknen und fallen von der Pflanze ab, wenn die Krankheit den Hauptstamm hinauf fortschreitet.
Bei der Tomate können Stängelinfektionen in jedem Alter auftreten und zu kleinen, dunklen, leicht eingesunkenen Bereichen führen, die sich zu kreisförmigen oder länglichen Flecken mit helleren Zentren ausweiten. An den Stängelläsionen bilden sich oft konzentrische Markierungen, die denen auf Blättern ähneln. Wird befallenes Saatgut für die Anzucht von Tomatenpflanzen verwendet, können die Sämlinge kurz nach dem Auflaufen absterben. Wenn sich große Läsionen an der Bodenlinie der Stängel von Transplantaten oder Sämlingen entwickeln, können die Pflanzen umgürtet werden, was als "Kragenfäule" bekannt ist. Solche Pflanzen können absterben, wenn sie ins Feld gesetzt werden, oder, wenn die Stängel geschwächt sind, früh in der Saison umbrechen. Einige Pflanzen können mit einem reduzierten Wurzelsystem überleben, wenn Teile der Stängel oberhalb des Krebses dort Wurzeln entwickeln, wo sie den Boden berühren. Solche Pflanzen bilden jedoch in der Regel nur wenige oder gar keine Früchte aus. Stammläsionen sind bei der Kartoffel viel seltener und weniger zerstörerisch.
Blütenabfall und Fleckenbildung an den Fruchtstielen sowie der Verlust von jungen Früchten können auftreten, wenn die Kraut- und Knollenfäule Tomaten in der Blütephase befällt. An älteren Früchten verursacht die Kraut- und Knollenfäule dunkle, ledrige, eingesunkene Flecken, meist an der Stielansatzstelle. Diese Flecken können sich auf den gesamten oberen Teil der Frucht ausdehnen und zeigen oft konzentrische Markierungen wie auf Blättern. Die befallenen Stellen können mit samtigen schwarzen Sporenmassen bedeckt sein. Früchte können auch im grünen oder reifen Stadium durch Wachstumsrisse und andere Wunden infiziert werden. Befallene Früchte fallen oft ab, bevor sie die Reife erreichen.
Auf Kartoffelknollen führt die Kraut- und Knollenfäule zu Oberflächenläsionen, die etwas dunkler erscheinen als die angrenzende gesunde Haut. Die Läsionen sind in der Regel leicht eingesunken, kreisförmig oder unregelmäßig und variieren in der Größe von bis zu 3/4 Zoll im Durchmesser. Zwischen gesundem und erkranktem Gewebe ist in der Regel ein gut definierter und manchmal leicht erhöhter Rand vorhanden. Im Inneren weist das Gewebe eine braune bis schwarze, korkartige Trockenfäule auf, die in der Regel nicht mehr als 1/4 bis 3/8 Zoll tief ist. In älteren Läsionen können sich tiefe Risse bilden. Eine Knolleninfektion ist unter Ohio-Bedingungen unüblich.
Krankheitserreger
Die Kraut- und Knollenfäule wird durch den Pilz Alternaria solani verursacht, der in infiziertem Blatt- oder Stängelgewebe auf oder im Boden überlebt. Dieser Pilz ist auf Feldern, auf denen diese Pflanzen angebaut wurden, überall zu finden. Er kann auch auf Tomatensamen und in Kartoffelknollen übertragen werden. Die Sporen bilden sich auf befallenen Pflanzenteilen an der Bodenoberfläche oder auf aktiven Läsionen in einem ziemlich breiten Temperaturbereich, insbesondere unter abwechselnd feuchten und trockenen Bedingungen. Sie werden leicht durch Luftströmungen, vom Wind verwehte Erde, Regenspritzer und Bewässerungswasser übertragen. Die Infektion von anfälligem Blatt- oder Stängelgewebe erfolgt bei warmem, feuchtem Wetter mit starkem Tau oder Regen. Die Kraut- und Knollenfäule kann sich in der Mitte bis zum Ende der Saison recht schnell entwickeln und ist schwerwiegender, wenn die Pflanzen durch schlechte Ernährung, Trockenheit oder andere Schädlinge gestresst sind. Die Infektion von Kartoffelknollen erfolgt durch natürliche Öffnungen in der Schale oder durch Verletzungen. Die Knollen können bei der Ernte mit den Sporen in Berührung kommen, und die Läsionen können sich während der Lagerung weiter entwickeln.
TOMCAST (Jim Jasinski, TOMCAST-Koordinator für OHIO, INDIANA, & MICHIGAN)
Hintergrund
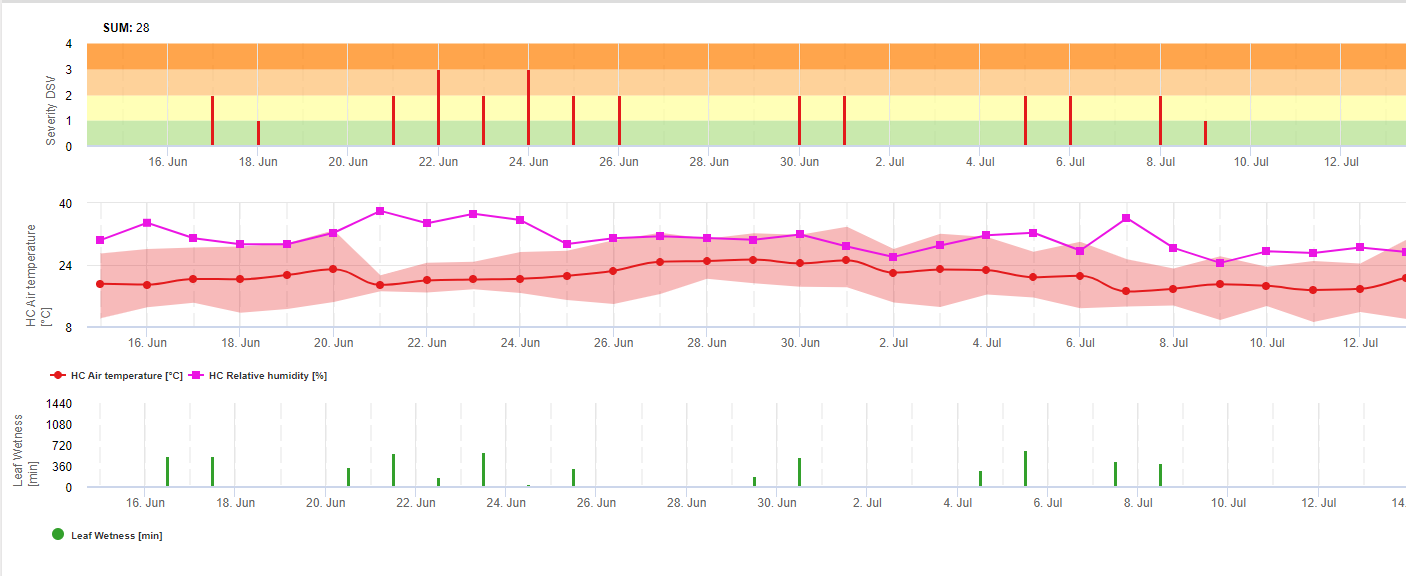
TOMCAST (TOMato disease foreCASTing) ist ein Computermodell, das auf Felddaten basiert und versucht, die Entwicklung von Pilzkrankheiten wie Kraut- und Knollenfäule, Septoria-Blattflecken und Anthraknose bei Tomaten vorherzusagen. Im Feld platzierte Datenlogger zeichnen auf stündliche Daten über Blattnässe und Temperatur. Diese Daten wurden über einen Zeitraum von 24 Stunden ausgewertet und können zu folgenden Ergebnissen führen Bildung eines Krankheitsschweregrades (DSV); im Wesentlichen eine Zunahme der Krankheitsentwicklung. Mit der Anhäufung von DSV nimmt der Krankheitsdruck auf die Kultur weiter zu. Wenn die Anzahl der akkumulierten DSV das Spritzintervall überschreitet, wird eine Fungizidanwendung empfohlen, um den Krankheitsdruck zu mindern.
TOMCAST
Zeitpunkt der Fungizidanwendungen gegen Kraut- und Knollenfäule, Septoria-Blattflecken und Anthraknose
Ein wetterbasiertes Krankheitsprognosesystem namens TOMCAST, das von Dr. Ron Pitblado am Ridgetown College of Agricultural Technology in Ontario, Kanada, entwickelt wurde, kann zur rechtzeitigen Anwendung von Fungiziden gegen drei Pilzkrankheiten eingesetzt werden: Krautfäule (verursacht durch Alternaria solani), Septoria-Blattfleckenkrankheit (verursacht durch Septoria lycopersici) und Fruchtanthraknose (verursacht durch Colletotrichum coccodes). Wenn die Kraut- und Knollenfäule in Ihrem Bezirk oder in angrenzenden Bezirken auftritt oder die Bedingungen für eine Sporenverschleppung in Ihr Gebiet gegeben sind, nutzen Sie das Simcast-System zur Vorhersage der Kraut- und Knollenfäule, um den Zeitpunkt der Fungizidanwendungen zu bestimmen.
WICHTIGER WARNHINWEIS:
TOMCAST ist nicht für Betriebe geeignet, in denen bereits bakterielle Krankheiten aufgetreten sind. Wenn Sie häufig Probleme mit bakteriellen Flecken, Flecken oder Krebs bei Ihren Tomaten haben, sollten Sie TOMCAST nicht verwenden, da die empfohlenen Spritzintervalle nicht ausreichen, um bakterielle Krankheiten zu bekämpfen, wenn Sie Kupfer in Tankmischungen mit Ihren Fungizidanwendungen einsetzen. Informationen zur Bekämpfung bakterieller Krankheiten finden Sie hier: http://extension.psu.edu/plants/vegetable-fruit/news/2015/farming-like-you-expect-bacterial-diseases
TOMCAST verwendet Blattnässe- und Temperaturdaten zur Berechnung von Krankheitsschweregraden (DSV), wie in Tabelle 1 dargestellt.
TOMCAST ist vom ursprünglichen F.A.S.T.-Modell (Forecasting Alternaria solani on Tomatoes) abgeleitet, das von Dr. Madden, Pennypacker und MacNab ? an der Pennsylvania State University (PSU) entwickelt wurde. Das F.A.S.T.-Modell der PSU wurde von Dr. Pitblado am Ridgetown College in Ontario zu dem Modell weiterentwickelt, das wir heute als TOMCAST kennen und das von der Ohio State University Extension verwendet wird.
DSV Ein Disease Severity Value (DSV) ist die Maßeinheit für ein bestimmtes Entwicklungsstadium der Krankheit (Frühfäule). Mit anderen Worten, ein DSV ist eine numerische Darstellung dafür, wie schnell oder langsam sich die Krankheit (Kraut- und Knollenfäule) in einem Tomatenfeld ausbreitet. Der DSV wird von zwei Faktoren bestimmt: der Blattnässe und der Temperatur während der "blattnassen" Stunden. Mit zunehmender Anzahl der blattfeuchten Stunden und Temperatur nimmt der DSV-Wert schneller zu. Siehe die nachstehende Tabelle des Krankheitsschweregrads.
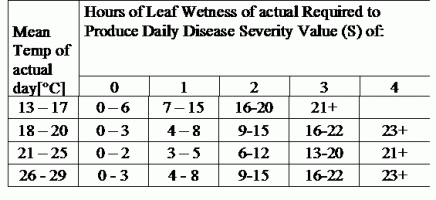
Umgekehrt reichern sich DSV bei weniger Blattnässe und niedrigeren Temperaturen nur langsam oder gar nicht an. Wenn die Gesamtzahl der akkumulierten DSV einen vorgegebenen Grenzwert überschreitet, der als Spritzintervall oder Schwellenwert bezeichnet wird, wird eine Fungizidspritzung empfohlen, um das Laub und die Früchte vor der Krankheitsentwicklung zu schützen.

Das Spritzintervall (das bestimmt, wann gespritzt werden sollte) kann zwischen 15-20 DSV liegen. Das genaue DSV, das ein Anbauer verwenden sollte, wird in der Regel vom Verarbeiter angegeben und hängt von der Fruchtqualität und der Endverwendung der Tomaten ab. Die Einhaltung eines Spritzintervalls von 15 DSV ist eine konservative Anwendung des TOMCAST-Systems, d. h. Sie werden häufiger spritzen als ein Landwirt, der mit dem TOMCAST-System ein Spritzintervall von 19 DSV verwendet. Der Kompromiss besteht in der Anzahl der während der Saison ausgebrachten Spritzungen und dem Potenzial für Unterschiede in der Fruchtqualität.
TOMCAST VERWENDEN
Tomaten, die im Umkreis von 10 Meilen um eine Meldestation angebaut werden, sollten von der Krankheitsmanagementfunktion von TOMCAST profitieren, um die Vorhersage von Krautfäule, Septoria und Anthraknose zu unterstützen. Wenn Sie sich entscheiden, TOMCAST in dieser Saison auszuprobieren, beachten Sie bitte drei sehr wichtige Konzepte.
Erstens: Wenn Sie das System zum ersten Mal verwenden, sollten Sie nur einen Teil Ihrer Anbaufläche in das Programm aufnehmen, um zu sehen, wie es zu Ihren Qualitätsstandards und Ihrem Arbeitsstil passt.
Zweitens: Nutzen Sie TOMCAST als Leitfaden, um den Zeitpunkt der Fungizidanwendungen besser zu bestimmen, denn in manchen Jahreszeiten kann es sein, dass Sie mehr Produkt anwenden, als ein festes Programm erfordert.
Drittens: Je weiter ein Tomatenfeld von einem Meldeort entfernt ist, desto größer ist die Wahrscheinlichkeit einer Verzerrung der DSV-Akkumulation, d. h. der gemeldete Wert kann um einige DSV höher oder niedriger sein als der Wert am Feldstandort. Dies sollte in Betracht gezogen werden, wenn der Einsatz von Fungiziden wahrscheinlich erst in einigen Tagen erfolgt. Hören Sie sich die DSV-Meldungen von nahegelegenen Stationen an und nehmen Sie eine Triangulation zu Ihrem eigenen Standort vor, um Ihre DSV-Akkumulation grob abschätzen zu können.
ERSTES SPRÜHEN MIT TOMCAST
Im Laufe der Jahre gab es einige Diskussionen über die Anwendung der ersten Spritzung bei der Anwendung von TOMCAST. Die im Leitfaden für den Gemüseanbau von 1997 genannte Regel bezieht sich auf das Pflanzdatum.
Bei Tomatenpflanzen, die vor dem 20. Mai auf das Feld kommen, sollte die erste Spritzung durchgeführt werden, wenn der DSV-Wert für das betreffende Gebiet 25 übersteigt oder wenn der 15. Juni als Fail-Safe-Datum gilt. Das Fail-Safe-Datum wird nur verwendet, wenn Sie seit dem 20. Mai nicht behandelt haben, und ist ein Mittel zur Beseitigung des anfänglichen Krankheitsinokulums. Nach der ersten Spritzung werden diese Tomaten dann behandelt, wenn das gewählte Spritzintervall (Bereich 15-20 DSV) überschritten wird.
Tomaten, die nach dem 20. Mai gepflanzt werden, werden behandelt, wenn sie das gewählte Spritzintervall (15-20 DSV) überschreiten oder wenn sie bis zum 15. Juni, dem Fail-Safe-Datum, noch nicht behandelt wurden. Daher ist es wichtig, das Datum der Tomatenpflanzung mit dem Datum zu vergleichen, an dem die DSV-Meldungen in diesem Gebiet begannen, um die Entscheidung über die Behandlung zu treffen.
Schwarzbeinigkeit
Krankheitszyklus
Die Krankheit hat vier Hauptstufen auf Winterraps:
Die wichtigsten Infektionsquellen für neu aufkommende Pflanzen sind luftgetragene Sporen, die nach der Ernte auf Rapsstoppeln gebildet werden. Fruchtkörper, die luftgetragene Sporen produzieren, brauchen etwa 20 Tage mit Regen, um zu reifen. So wurden die Sporen nach dem feuchten August 2005 und 2006 früh freigesetzt, 2003 jedoch erst spät, als dieser Monat trocken war.
Über die Luft übertragene Sporen, die vor allem an regnerischen Tagen freigesetzt werden, infizieren die Blätter und bilden das Blattfleckenstadium. Die Symptome treten bei 15-20 °C nach 5-7 Tagen auf, bei 3 °C dauert es über 30 Tage, bis sie sich entwickeln.
Es sind keine Symptome sichtbar, während der Pilz vom Blattfleck über den Blattstiel bis zum Stiel wächst. Die Wachstumsrate am Blattstiel kann bei 15-20°C bis zu 5 mm/Tag betragen, verlangsamt sich jedoch bei 3-5°C auf 1 mm/Tag. Fungizide bieten keine Kontrolle mehr, sobald der Stamm infiziert ist.
Der Pilz breitet sich im Stängel aus und führt etwa sechs Monate nach der Blattinfektion zu sichtbaren Stängelkrebserscheinungen. Eine frühe Blattfleckung führt zu frühem Stängelkrebs, der höchstwahrscheinlich das Ertragspotenzial verringert.
Verständnis der Variation
Das Wetter: Die Niederschläge im August und September sind der entscheidende Faktor für den Beginn der Blattfleckenbildung. Überdurchschnittliche Niederschläge, insbesondere im August, deuten auf ein frühes Risiko hin.
Biologie
Leptosphaeria maculans oder Phoma lingam überlebt die Zwischenfruchtperiode als Myzel und Pseudothecien in Ernterückständen. In Kanada überdauert das Blattgewebe nicht lange genug, um die Entwicklung von Pseudothecien zu ermöglichen, aber Pseudothecien bilden sich auf basalem Stammgewebe. Nach der Reife produzieren die Pseudothezien Ascosporen.
Die Askosporen des Pilzes werden freigesetzt nach Regenfällen, wenn die Temperaturen zwischen 8-12ºC/46-54ºF liegen. Diese Sporen können vom Wind über Hunderte von Metern verbreitet werden. Pyknidien können problemlos in Stoppeln überwintern und tun dies auch, aber da Pyknidiensporen nicht in nennenswertem Umfang über die Luft übertragen werden, sind sie für die Einleitung des ersten Krankheitszyklus von geringer Bedeutung.
Askosporen keimen in Gegenwart von freiem Wasser von 4-28ºC (40-82ºF). Das Eindringen erfolgt über die Spaltöffnungen. Der Erreger kann auch über die Samen übertragen werden. Die Samen können infiziert und/oder von dem Erreger befallen sein. Infiziertes Saatgut kann zu infizierten Sämlingen führen, aber die Kontamination des Saatguts ist immer sehr gering. Primärinfektionen treten in der Regel auf den Keimblättern oder den basalen Rosettenblättern der Pflanze auf. Feuchte Witterung begünstigt diese Primärinfektionen.
Der Pilz dringt in die Interzellularräume ein zwischen den Palisaden- und Epidermisschichten des Blattes. Auf diese symptomlose biotrophe Phase folgt das Eindringen in das Mesophyll mit dem daraus resultierenden Absterben von Zellen und dem Auftreten von grau-grünen Läsionen. Die Hyphen verzweigen sich weiter durch das Blattgewebe, bis sie eine Blattvene erreichen. Dann besiedelt der Pilz die Rinde und/oder das Xylemparenchym des Blattstiels. An der Verbindungsstelle zwischen Blattstiel und Stamm dringt der Pilz in die Stammrinde ein und verursacht dort einen Krebs. An diesem Punkt zeigt sich die Resistenz des Stängels und entscheidet darüber, ob die Krankheit zum schädlichen Stängelkrebs übergehen kann. Stängelkrebs entsteht, wenn die Pflanzen aus der Rosette, an der sich die Blüten bilden, einen aufrechten Stängel bilden. Stängelkrebse entwickeln sich am schnellsten bei 20-24ºC/68-75ºF und sind am schwersten unter Stressbedingungen wie mechanischen, Insekten- oder Herbizidschäden.
Pyknidiensporen (Konidien) werden freigesetzt aus den Pyknidien unter feuchten Bedingungen in einem Schleim, einer wässrigen, klebrigen Lösung. Diese Sporen sind für die sekundären Krankheitszyklen verantwortlich, aber die Ascosporen sind die wichtigere Quelle für das Inokulum, da sie infektiöser sind und über die Luft übertragen werden.
Die Pynidiosporen werden durch Regenspritzer an neue Infektionsorte verbreitet. Pyknidiosporen keimen langsamer als Ascosporen und benötigen mehr als 16 Stunden ununterbrochene Nässe im optimalen Temperaturbereich von 20-25 ºC/68-77 ºF. Die minimale Latenzzeit (die Zeit von der Infektion bis zur Produktion eines neuen Inokulums) nach einer Infektion durch Pyknidiensporen beträgt 13 Tage. Obwohl es zu Sekundärinfektionen durch Pyknidiosporen kommt, sind die meisten Verluste auf Primärinfektionen der Blätter durch Ascosporen zurückzuführen, die zu basalen Stammkrebsen und schließlich zum Absterben der Pflanzen führen.
Modell für die erste mögliche Infektion im Herbst
Die Entwicklung einer Phomastammkrebsepidemie lässt sich in drei Phasen unterteilen.
1) In der erste EtappeDer Zeitpunkt des Beginns der Phoma-Blattfleckenepidemie im Herbst wurde anhand der Sommerwetterdaten vorhergesagt. Da es sich bei Phoma-Stammkrebs um eine monozyklische Krankheit handelt (ein Zyklus pro Wachstumsperiode), ist das Datum im Herbst, an dem die Blattfleckenbildung beginnt, ein entscheidender Faktor, der die Schwere der Phoma-Stammkrebsepidemien an den Stämmen im folgenden Sommer beeinflusst (West et al. 2001). Das Datum, an dem die Phoma-Blattfleckenbildung im Herbst beginnt, wird anhand der Temperatur und der Niederschläge während der Zwischenfruchtperiode zwischen der Ernte der Vorfrucht und der Etablierung der neuen Kultur geschätzt. Bei einer Niederschlagsmenge von etwa 4 mm tritt die Schwarzbeinigkeit einen Tag früher auf, und die Temperatur hat zu Beginn des Zeitraums im Hochsommer einen größeren Einfluss als im Herbst.
Wenn die Ascosporeninfektion aufgrund des Herbstklimas möglich ist, müssen wir nach den klimatischen Voraussetzungen für die Ascosporeninfektion suchen.
2) In diesem zweite Stufe können wir nach reifen Ascosporen suchen. Um die Ascosporen reifen zu lassen, benötigt sie je nach Temperatur mehr als 288 Stunden Lufttemperatur zwischen 5 und 25°C und eine relative Luftfeuchtigkeit von mehr als 85%. Jetzt braucht er 4 mm oder mehr Regen, um die Ascosporen zu verteilen. Eine Blattnässeperiode muss eine Ascosporeninfektion einleiten und kann bei optimaler Temperatur innerhalb von 8 Stunden abgeschlossen werden.
Im Spätherbst und im Frühjahr können sich auf reifen Läsionen der Schwarzbeinigkeit Konidien bilden.
3) In der dritte Stufe müssen wir mit Konidieninfektionen rechnen, die durch eine Blattnässeperiode eingeleitet und durch Perioden mit einer relativen Luftfeuchtigkeit von mehr als 85% für länger als 8 Stunden bei optimaler Temperatur beendet werden.
Praktische Anwendung der Black Leg Modelle
Das Black-Leg-Modell beginnt mit der Einschätzung, ob eine Black-Leg-Infektion im Spätsommer und Frühherbst möglich ist. Dieser Teil des Modells kann als Negativprognose verwendet werden. Es wurde für das britische Klima getestet, um das erste Auftreten von P. lingam Infektionen. Dieses Modell ist für kühles und feuchtes Klima geeignet. In kontinentalem Klima wie in Ungarn oder Österreich sollte es mit einer gewissen Vorsicht angewendet werden. Die Modelle für Ascosporenreifung, Ascosporenrealisierung und Ascosporeninfektion zeigen mögliche Ascosporeninfektionen im Herbst. Diese Modelle basieren auf der Biologie des Erregers und zeigen höchstwahrscheinlich mehr Ascosporeninfektionen an, als man im Feld finden kann. Das liegt daran, dass wir auf der Grundlage der Klimadaten nichts über die Inokulumdichte und die Vorfrüchte auf den Rapsfeldern wissen. Wenn jedoch eine oder mehrere Ascosporeninfektionen auf die anfälligen Pflanzenstadien nach dem Auflaufen passen, kommt es zu P. lingam-Infektionen, und während warmer und feuchter Perioden im Herbst oder Frühjahr muss mit Sekundärinfektionen durch Konidien gerechnet werden.
Konidieninfektionen sind aufgrund der für eine Konidieninfektion erforderlichen Blattnässezeiten angezeigt.
Septoria-Krankheit
Es gibt zwei wichtige Septoria-Krankheiten bei Weizen. Es handelt sich um die Septoria tritici-Fleckenkrankheit, die durch den Pilz ausgelöst wird Septoria tritici (Teleomorph: Mycophaerella graminicola), und Septoria nodorum Fleckenkrankheit, verursacht durch den Pilz Septoria nodorum (Teleomorph: Leptosphaeria nodorum). Beide Krankheiten verursachen schwere Ertragseinbußen, die Berichten zufolge zwischen 31 und 53 Prozent liegen (Eyal, 1981; Babadoost und Herbert, 1984; Polley und Thomas, 1991). Weltweit sind mehr als 50 Millionen Hektar Weizen betroffen, die hauptsächlich in niederschlagsreichen Gebieten wachsen. In den letzten 25 Jahren haben diese Krankheiten zugenommen und sind in bestimmten Gebieten zu einem wichtigen limitierenden Faktor für die Weizenproduktion geworden. Bei schweren Epidemien schrumpfen die Körner anfälliger Weizensorten und sind nicht mehr mahlfähig. Epidemien der Septoria tritici-Fleckenkrankheit und der Septoria nodorum-Fleckenkrankheit des Weizens stehen in Zusammenhang mit günstigen Witterungsbedingungen (häufige Regenfälle und gemäßigte Temperaturen), bestimmten Anbaumethoden, der Verfügbarkeit von Inokulum und dem Vorhandensein anfälliger Weizensorten (Eyal et al., 1987).
Septoria spp. Biologie
Nach Erick De Wolf, Septoria Tritici Blotch, Kansas State University, April 2008 Septoria tritici Fleck, der als gefleckter Blattfleck bekannt ist, wird durch den Pilz Septoria tritici. Sie ist in allen Weizenanbaugebieten der Welt verbreitet und stellt in vielen Regionen ein ernstes Problem dar. Der Septoria tritici-Fleck ist am schädlichsten, wenn die Krankheit die oberen Blätter und Köpfe anfälliger Sorten spät in der Saison befällt.
Symptome
Septoria tritici Die Fleckensymptome treten erstmals im Herbst auf. Die ersten Symptome sind kleine gelbe Flecken auf den Blättern. Diese Läsionen werden mit zunehmendem Alter oft hellbraun, und die Pilzfruchtkörper sind in den Läsionen an den Grannen eingebettet zu sehen. Die Läsionen sind unregelmäßig geformt und reichen von elliptisch bis lang und schmal (Abbildung 1). Die Läsionen enthalten kleine, runde, schwarze Sprenkel, die die Fruchtkörper des Pilzes darstellen. Die schwarzen Fruchtkörper sehen aus wie schwarze Pfefferkörner und sind in der Regel auch ohne Lupe zu erkennen. Die Krankheit beginnt an den unteren Blättern und breitet sich allmählich auf das Fahnenblatt aus. Auch die Blattscheiden sind anfällig für den Befall. In feuchten Jahren kann der gesprenkelte Blattfleckenpilz auf die Köpfe übergehen und braune Läsionen auf den Hüllspelzen und Grannen verursachen, die als Hüllspelzenfleck bekannt sind. Diese Läsionen werden mit zunehmendem Alter oft hellbraun, und die Pilzfruchtkörper sind oft in den Läsionen an den Grannen eingebettet.
Die Spelzenfäule kann zu erheblichen Ertragseinbußen führen, aber der Zusammenhang zwischen der Schwere der Krankheit und den Ertragseinbußen ist nicht genau bekannt. Septoria tritici Flecken können mit anderen Blattkrankheiten verwechselt werden, die sehr ähnliche Symptome aufweisen: Bräunungsflecken und Stagonspora nodorum Fleckenkrankheit, zum Beispiel. In der Regel sind die Pflanzen von mehr als einer dieser Blattkrankheiten befallen, und es kann eine Laboruntersuchung erforderlich sein, um genau zu bestimmen, welche Krankheiten am häufigsten vorkommen. Eine Laboruntersuchung ist fast immer erforderlich, um die Ursache der Spelzenfleckenkrankheit zu bestimmen. Die Kenntnis der Art ist für Spritzentscheidungen nicht wichtig, da alle drei Krankheiten ähnlich auf Fungizide ansprechen. Für die Sortenwahl ist es jedoch wichtig zu wissen, welche Krankheiten am häufigsten vorkommen, da die Resistenz gegen die Krankheiten von verschiedenen Genen gesteuert wird.
Die zuverlässigste Methode, den Septoria tritici-Fleck von den anderen Krankheiten zu unterscheiden, ist das Vorhandensein der schwarzen Pilzfruchtkörper. Der Pilz, der die Bräunungsfleckenkrankheit verursacht, bildet diese Art von Fortpflanzungsorganen nicht aus. Der Pilz, der den Stagonospora nodorum-Fleck verursacht, bildet jedoch unter feuchten Bedingungen hellbraune Fruchtkörper aus. Abgesehen von dem Farbunterschied sind diese Strukturen auch kleiner als die von Septoria tritici.
Lebenszyklus
Septoria tritici überlebt den Sommer über auf den Rückständen einer früheren Weizenernte und beginnt im Herbst mit der Infektion. Es gibt einige Hinweise darauf, dass der Pilz in Verbindung mit anderen Graswirten und Weizensamen überleben kann. Diese Quellen für den Pilz sind wahrscheinlich am wichtigsten, wenn keine Weizenrückstände vorhanden sind. Unabhängig von der Fruchtfolge oder der Rückstandsbewirtschaftung ist in der Regel genügend Inokulum vorhanden, um Herbstinfektionen auszulösen. Septoria tritici Fleckenkrankheit wird durch kühles, feuchtes Wetter begünstigt. Der optimale Temperaturbereich liegt bei 16 bis 21 °C; Infektionen können jedoch auch in den Wintermonaten bei Temperaturen von bis zu 5 °C auftreten. Die Infektion erfordert mindestens 6 Stunden Blattnässe, für eine maximale Infektion sind bis zu 48 Stunden Nässe erforderlich. Nach der Infektion benötigt der Pilz 21 bis 28 Tage, um die charakteristischen schwarzen Fruchtkörper zu entwickeln und eine neue Generation von Sporen zu produzieren. Die in diesen Fruchtkörpern produzierten Sporen werden in klebrigen Massen ausgeschieden und benötigen Regen, um sie auf die oberen Blätter und Köpfe zu spritzen.
Infektion durch Septoria tritici
Pyknidiensporen von S. tritici keimen in freiem Wasser aus beiden Enden der Spore oder aus Zwischenzellen (Weber, 1922). Die Sporenkeimung beginnt erst etwa 12 Stunden nach dem Kontakt mit dem Blatt. Die Keimschläuche wachsen willkürlich über die Blattoberfläche. Weber (1922) beobachtete nur die direkte Penetration zwischen den Epidermiszellen, andere Forscher kamen jedoch zu dem Schluss, dass die Penetration durch offene und geschlossene Spaltöffnungen das wichtigste Mittel für das Eindringen in den Wirt ist (Benedict, 1971; Cohen und Eyal, 1993; Hilu und Bever, 1957). Kema et al. (1996) beobachteten nur die Stomata-Penetration. Hyphen, die durch Spaltöffnungen wachsen, verengen sich auf einen Durchmesser von etwa 1 μm und werden dann breiter, wenn sie die substomatäre Höhle erreichen.
Die Hyphen wachsen parallel zur Blattoberfläche unter den Epidermiszellen, dann durch das Mesophyll zu den Zellen der unteren Epidermis, aber nicht in die Epidermis. Es werden keine Haustorien gebildet, und das Hyphenwachstum wird durch Sklerenchymzellen um die Gefäßbündel herum begrenzt, außer wenn die Hyphen sehr dicht sind. Gefäßbündel werden nicht durchdrungen. Die Hyphen wachsen interzellulär entlang der Zellwände durch das Mesophyll und verzweigen sich an einem Septum oder in der Mitte einer Zelle. Etwa 9 Tage lang treten keine makroskopischen Symptome auf, abgesehen von einer gelegentlichen toten Zelle, aber nach 11 Tagen sterben die Mesophyllzellen rasch ab. Die Pyknidien entwickeln sich in substomatalen Kammern. Die Hyphen wachsen nur selten in die Wirtszellen ein (Hilu und Bever, 1957; Kema et al, 1996; Weber, 1922).
Eine erfolgreiche Infektion erfolgt erst nach mindestens 20 Stunden hoher Luftfeuchtigkeit. Nur wenige braune Flecken entstanden, wenn die Blätter 5-10 Stunden nach der Sporenablage feucht blieben (Holmes und Colhoun, 1974) oder bis zu 24 Stunden (Kema et al., 1996). Die Wirt-Parasit-Beziehungen sind bei resistenten und anfälligen Weizenarten gleich. Die Sporenkeimung auf der Blattoberfläche ist unabhängig von der Anfälligkeit die gleiche. Die Zahl der erfolgreichen Penetrationen ist ungefähr gleich, aber das Hyphenwachstum ist bei den anfälligen Sorten schneller, was zu mehr Läsionen führt. Die Hyphen reichen bei allen Sorten über den nekrotischen Bereich hinaus. 44 Sitzung 2 - B.M. Cunfer Ein Toxin könnte bei der Pathogenese eine Rolle spielen (Cohen und Eyal, 1993; Hilu und Bever, 1957). Im Gegensatz dazu war die Kolonisierung bei einer resistenten Linie stark reduziert (Kema et al., 1996).
Stagonospora (Septoria) und Septoria-Pathogene des Getreides: Der Infektionsprozess
B.M. Cunfer, Abteilung für Pflanzenpathologie, Universität von Georgia, Griffin, GA
Der Infektionsprozess wurde am intensivsten für Stagonospora (Septoria) nodorum und Septoria tritici. Eine eingehende Studie über Septoria passerinii verfügbar ist. Fast alle Informationen beziehen sich auf die Infektion durch Pyknidiensporen. Der Infektionsprozess für andere Sporenformen ist jedoch recht ähnlich. Die vorliegenden Informationen beziehen sich meist auf die Infektion von Blättern unter optimalen Bedingungen. Einige Studien wurden an intakten Sämlingspflanzen durchgeführt, andere an abgetrennten Blättern. Infektion der Weizenkoleoptile und des Keimlings durch S. nodorum wurde von Baker (1971) ausführlich beschrieben und von Cunfer (1983) überprüft. Obwohl keine genauen Vergleiche angestellt wurden, hat es den Anschein, dass der Infektionsprozess in jedem Wirt-Parasit-System viele Ähnlichkeiten aufweist und typisch für viele nekrotrophe Krankheitserreger ist. Informationen über Faktoren, die die Entwicklung von Symptomen und die Ausprägung der Krankheit beeinflussen, sind nicht vorhanden, wurden aber von anderen Autoren geprüft (Eyal et al., 1987; King et al., 1983; Shipton et al., 1971). Eine Zusammenfassung der Faktoren, die die Langlebigkeit der Sporen auf der Blattoberfläche beeinflussen, ist enthalten.
Die Rolle des Cirrus und das Überleben der Sporen auf der Blattoberfläche Die detailliertesten Informationen über die Funktion der Zirren, die die aus dem Pyknidium ausgeschiedenen Pyknidiensporen umhüllen, sind für S. nodorum. Der Zirrus ist ein Gel, das aus Protein- und Saccharidverbindungen besteht. Seine Zusammensetzung und Funktion sind ähnlich wie bei anderen Pilzen der Sphaeropsidales (Fournet, 1969; Fournet et al., 1970; Griffiths und Peverett, 1980). Die Hauptaufgaben der Zirruskomponenten sind der Schutz der Pyknidiensporen vor Austrocknung und die Verhinderung einer vorzeitigen Keimung.
Die Zirruslösung schützt die Pyknidiosporen, so dass einige von ihnen mindestens 28 Tage lang lebensfähig bleiben (Fournet, 1969). Wurde der Cirrus mit Wasser verdünnt, keimten bei einer Konzentration der Cirruslösung von >20% weniger als 10% der Pyknidiensporen. Bei einer niedrigeren Konzentration liefern die Komponenten Nährstoffe, die die Keimung der Sporen und die Verlängerung der Keimschläuche stimulieren. Die Länge der Keimschläuche nahm bis zu einer Zirruskonzentration von 15% zu und ging dann bei höheren Konzentrationen mäßig zurück (Harrower, 1976). Brennan et al. (1986) berichteten über eine stärkere Keimung in verdünnter Zirrusflüssigkeit. Zirruskomponenten verringerten die Keimung bei einer relativen Luftfeuchtigkeit von 10-60%. Sobald die Sporen verteilt sind, ist die stimulierende Wirkung der Zirrusflüssigkeit wahrscheinlich vernachlässigbar (Griffiths und Peverett, 1980).
Bei einer relativen Luftfeuchtigkeit von 35-45% werden Sporen von S. tritici in Zirren mindestens 60 Tage lang lebensfähig blieben (Gough und Lee, 1985). Die Bestandteile der Zirren können die Keimung der Sporen hemmen, oder das hohe osmotische Potential der Zirren kann die Keimung verhindern. Pyknidiensporen von S. nodorum überlebten keine 24 Stunden bei einer relativen Luftfeuchtigkeit von über 80% bei 20 C. Sporen überlebten zwei Wochen oder länger bei einer relativen Luftfeuchtigkeit von <10% (Griffiths und Peverett, 1980). Wenn die Zirrusflüssigkeit von S. nodorum mit Wasser verdünnt wurde, verloren etwa zwei Drittel der Pyknidiensporen innerhalb von 8 Stunden ihre Lebensfähigkeit, und nach 30 Stunden bei Tageslicht keimten nur 5%. Wurden die Sporen im Dunkeln gelagert, blieben 40% nach 30 Stunden lebensfähig (Brennan et al., 1986).
Trockene Konidien von S. nodorumim Schatten und bei direkter Sonneneinstrahlung mindestens 56 Stunden im Freien überlebten (Fernandes und Hendrix, 1986a). Die Keimung der Pyknidiensporen von S. nodorum wurde durch kontinuierliche UV-B-Bestrahlung (280-320 nm) gehemmt, während die Keimung von S. tritici war es nicht. Die Ausdehnung der Keimschläuche unter kontinuierlicher UV-B-Strahlung wurde bei beiden Pilzen im Vergleich zur Dunkelheit gehemmt (Rasanayagam et al., 1995).
Infektion durch Septoria nodorum
Der Prozess des Eindringens in den Wirt und die Entwicklung von S. nodorum innerhalb des Blattes wurde von mehreren Forschern eingehend untersucht (Baker und Smith, 1978, Bird und Ride 1981, Karjalainen und Lounatmaa, 1986; Keon und Hargreaves, 1984; Straley, 1979; Weber, 1922). Die Pyknidiensporen setzen sich in der Regel in den Vertiefungen zwischen zwei Epidermiszellen fest, und viele Versuche, in das Blatt einzudringen, beginnen dort. Die Sporen keimen auf der Blattoberfläche als Reaktion auf freie Feuchtigkeit (Fernandes und Hendrix, 1986b). Sie beginnen 2-3 Stunden nach der Ablagerung zu keimen, und nach 8 Stunden kann die Keimung 90% erreichen. Das Eindringen in die Blätter beginnt etwa 10 Stunden nach der Ablagerung der Sporen (Bird und Ride, 1981; Brönnimann et al., 1972; Holmes und Colhoun, 1974).
Zu Beginn der Keimung ist der Keimschlauch von einem amorphen Material umgeben, das mit dem Blatt verwachsen ist. Keimschläuche, die aus beiden Enden einer Spore und aus Zwischenzellen wachsen, neigen dazu, entlang der Vertiefungen zwischen den Zellen zu wachsen und sind oft entlang der Längsachse des Blattes ausgerichtet (O'Reilly und Downes, 1986). Die Hyphen von Sporen, die sich nicht in Vertiefungen befinden, wachsen willkürlich und verzweigen sich gelegentlich (Straley, 1979). Es bildet sich ein Appressorium mit einem Infektionszapfen, der die Kutikula und die periklinen Wände der Epidermiszellen direkt in das Zelllumen durchdringt, was zu einem schnellen Zelltod führt.
Viele Penetrationen erfolgen zunächst subkutikulär oder durch seitliches Wachstum der Hyphen innerhalb der Zellwand, bevor sie in das Zytoplasma eindringen (Bird und Ride, 1981; O'Reilly und Downes, 1986). Das Eindringen durch offene und geschlossene Spaltöffnungen erfolgt ebenfalls und kann schneller sein als das direkte Eindringen (Harrower, 1976; Jenkins, 1978; O'Reilly und Downes, 1986; Straley, 1979). Die Keimschläuche verzweigen sich an den Spaltöffnungen und den Verbindungsstellen der Epidermiszellen. Das Eindringen eines Keimschlauches in eine Spaltöffnung kann ohne Bildung eines Appressoriums erfolgen. Manchmal erfolgt das Eindringen durch Trichome (Straley, 1979). Offenbar scheitern die meisten Penetrationsversuche, wobei sich in den Zellen an der Stelle des versuchten Eindringens dichte Papillen bilden (Karjalainen und Lounatmaa, 1986; Bird und Ride, 1981).
Nach dem Eindringen sterben die Epidermiszellen schnell ab und verholzen, und die Hyphen wachsen in das Mesophyll. Die Mesophyllzellen verformen sich, und verholztes Material lagert sich außerhalb einiger Zellen ab, die dann kollabieren. Die Verholzung erfolgt, bevor die Hyphen die Zelle erreichen. Der Prozess ist bei allen Sorten gleich, entwickelt sich aber bei resistenten Sorten langsamer. Die Hyphen wachsen interzellulär zwischen den Epidermiszellen und dann in das Mesophyll. Wenn das Mesophyll durchdrungen ist, beginnt die Zerstörung der Chloroplasten innerhalb von 6-9 Tagen (Karjalainen und Lounatmaa, 1986).
Die Photosyntheserate beginnt jedoch innerhalb eines Tages nach der Infektion und vor dem Auftreten von Symptomen zu sinken (Krupinsky et al., 1973). Sklerenchymgewebe um die Gefäßbündel verhindert eine Infektion des Gefäßgewebes. Die Gefäßbündel blockieren die Ausbreitung der Hyphen durch das Mesophyll, es sei denn, das Sklerenchymgewebe ist noch jung und nicht vollständig ausgebildet (Baker und Smith, 1978).
Stagonospora nodorum setzt in vitro und während der Infektion von Weizenblättern ein breites Spektrum an zellwandabbauenden Enzymen frei, darunter Amylase, Pektinmethylesterase, Polygalacturonasen, Xylanasen und Cellulase (Baker, 1969; Lehtinen, 1993; Magro, 1984). Die Informationen über den Zellwandabbau durch Enzyme stimmen mit histologischen Beobachtungen überein, wobei diese Enzyme in Verbindung mit Toxinen wirken können. Die Enzymempfindlichkeit kann mit der Resistenz und der Geschwindigkeit der Pilzbesiedlung zusammenhängen (Magro, 1984). Wie viele Nekrotrophen produzieren auch Septoria- und Stagonospora-Pilze in vitro phytotoxische Verbindungen. Das Absterben und der Tod von Zellen vor dem Wachstum der Hyphen in das Mesophyllgewebe (Bird und Ride, 1981) steht im Einklang mit der Toxinproduktion. Eine endgültige Rolle der Toxine im Infektionsprozess und ihr Zusammenhang mit der Wirtsresistenz ist jedoch noch nicht nachgewiesen (Bethenod et al., 1982; Bousquet et al., 1980; Essad und Bousquet, 1981; King et al., 1983). Unterschiede im Wirtsspektrum zwischen weizen- und gerstenadaptierten Stämmen von S. nodorum kann mit der Toxinproduktion zusammenhängen (Bousquet und Kollmann, 1998). Der Beginn der Sporenkeimung und der prozentuale Anteil der gekeimten Sporen werden durch die Wirtsanfälligkeit nicht beeinflusst (Bird und Ride, 1981; Morgan 1974; Straley, 1979; Straley und Scharen, 1979; Baker und Smith, 1978).
Bird und Ride (1981) berichteten, dass die Ausdehnung der Keimschläuche auf der Blattoberfläche bei resistenten Sorten langsamer war als bei anfälligen Sorten. Dieser Mechanismus, der mindestens 48 Stunden nach der Sporenablage zum Tragen kommt, deutet auf eine Resistenz gegen die Ausdehnung der Keimschläuche vor dem Eindringen hin. Bei resistenten Sorten gab es weniger erfolgreiche Penetrationen, und die Penetration verlief bei resistenten Sorten langsamer (Baker und Smith, 1978; Bird und Ride, 1981). Es wurde angenommen, dass die Lignifizierung die Infektion sowohl bei resistenten als auch bei anfälligen Sorten einschränkt, aber andere Faktoren verlangsamten die Entwicklung des Pilzes bei resistenten Linien. Bei anfälligen Linien können schneller wachsende Hyphen der Lignifizierung der Wirtszellen entgehen. Vier Tage nach der Inokulation von Gerste mit einem Weizenbiotyp-Isolat von S. nodorumDie Hyphen wuchsen durch die Kutikula und manchmal durch die äußeren Zelluloseschichten der epidermalen Zellwände. Unter den Penetrationshyphen lagerten sich dicke Papillen ab, und die Zellen wurden nicht durchdrungen (Keon und Hargreaves, 1984).
Infektion durch Septoria passerinii: Green und Dickson (1957) legen eine detaillierte Beschreibung des Infektionsprozesses von S. passerinii auf Gerste. Der Infektionsprozess ist ähnlich wie bei S. tritici. Wie bei S. tritici ist die Zeitspanne, die für die Durchdringung der Blätter erforderlich ist, wesentlich länger als bei S. nodorum. Die Keimschläuche verzweigen sich und wachsen wahllos über die Blattoberfläche, manchmal aber auch entlang der Vertiefungen zwischen den Epidermiszellen. Das Eindringen in das Blatt erfolgt fast ausschließlich über die Spaltöffnungen. Die Keimhyphen schwellen an, und wenn die Penetration erfolglos bleibt, dehnen sich die Hyphen weiter aus. 48 Stunden nach der Sporenablage findet keine Penetration mehr statt. Nach 72 Stunden verdicken sich die Keimschläuche über den Spaltöffnungen, wachsen zwischen den Wächterzellen und auf den Stirnflächen der Nebenzellen sowie in die substomatären Hohlräume. Ein direktes Eindringen zwischen Epidermiszellen ist nur selten zu beobachten.
Die Sporenkeimung und das Eindringen in den Wirt sind bei resistenten und anfälligen Sorten gleich. Die Ausdehnung der Hyphen innerhalb der Blätter ist bei resistenten Sorten viel geringer, und Papillen werden auf vielen, aber nicht auf allen Zellwänden beobachtet. Die Hyphen wachsen unter der Epidermis von einem Stoma zum anderen, dringen aber nicht zwischen die Epidermiszellen ein. Das Mesophyll ist kolonisiert, aber es bilden sich keine Haustorien. Nachdem die Mesophyllzellen nekrotisch geworden sind, kollabieren die Epidermiszellen. Die Myzelentwicklung im Blatt ist spärlich und wird in der Regel durch Gefäßbündel blockiert. In jüngeren Blättern, wenn die Gefäßscheide weniger entwickelt ist, dringen die Hyphen zwischen dem Bündel und der Epidermis hindurch. Pyknidien bilden sich in substomatalen Hohlräumen, meist auf der Blattoberseite (Green und Dickson, 1957).
Faktoren, die die Langlebigkeit von Sporen beeinflussen auf der Blattoberfläche Von den Stagonospora- und Septoria-Erregern des Getreides sind endgültige Informationen über den Infektionsprozess nur für folgende Arten bekannt S. nodorum, S. triticiund S. passerinii. Wie viele andere nekrotrophe Krankheitserreger lösen auch diese beiden Erregergruppen keine Überempfindlichkeitsreaktion aus. Ein wesentlicher Unterschied im Infektionsprozess zwischen Septoria- und Stagonospora-Erregern besteht darin, dass die Sporenauskeimung und -penetration bei S. nodorum als für S. tritici und S. passerinii. Dies hat einen erheblichen Einfluss auf die Epidemiologie von Krankheiten.
Die Septoria-Erreger dringen hauptsächlich über die Spaltöffnungen in die Pflanze ein, während S. nodorum dringt sowohl direkt als auch über die Spaltöffnungen ein. S. nodorum dringt in die Epidermiszellen ein und tötet sie schnell ab, aber S. tritici und S. passerinii töten die Epidermiszellen erst ab, wenn sich die Hyphen durch das Blattmesophyll verzweigt haben und eine schnelle Nekrose einsetzt. Histologische Untersuchungen des Pilzwachstums nach dem Eindringen in den Wirt stimmen mit den Daten überein, die aus epidemiologischen Studien zur Wirtsresistenz gewonnen wurden. Die Resistenz verlangsamt die Geschwindigkeit der Wirtskolonisierung, hat aber keine nennenswerten Auswirkungen auf die Entwicklung der Läsionen.
Die Mechanismen, die die Reaktion des Wirts steuern, ob sie nun mit Enzymen und Toxinen oder anderen Stoffwechselprodukten zusammenhängen, die von den Erregern während der Infektion freigesetzt werden, sind noch unklar. Es gibt nur wenige Informationen über die Infektion durch Ascosporen. Der Infektionsprozess ist wahrscheinlich dem der Pyknidiensporen sehr ähnlich. Die Ascosporen von Phaeosphaeria nodorum keimen in einem breiten Temperaturbereich, und ihre Keimschläuche dringen direkt in das Blatt ein. Nach Rapilly et al. (1973) keimen die Ascosporen jedoch im Gegensatz zu den Pyknidiensporen nicht in freiem Wasser.
Septoria spp. Infektionsmodell
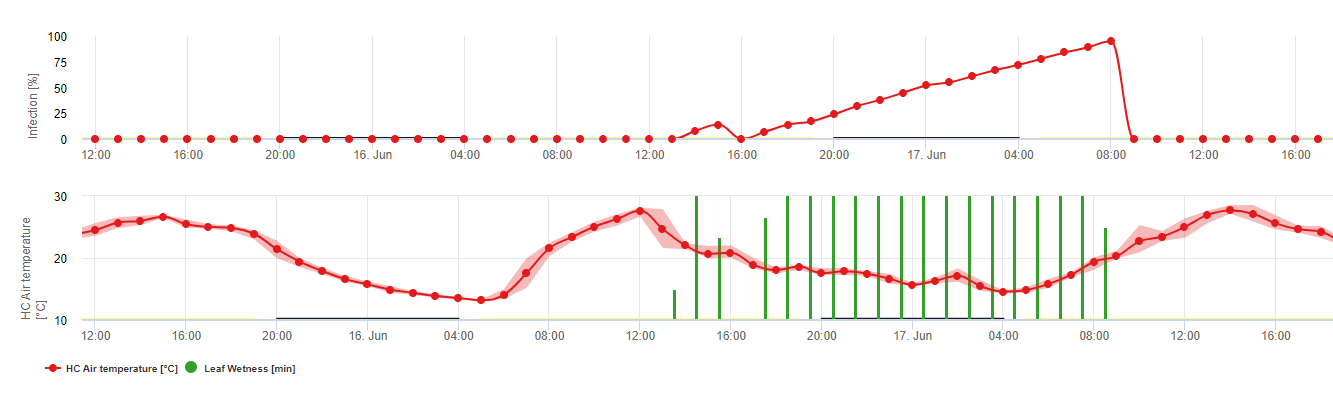
Septoria-Infektionen sind bei niedrigen Temperaturen möglich, wobei Temperaturen unter 7°C nicht unbedingt innerhalb von 2 Tagen zu einer Infektion führen. Das Temperaturoptimum der Krankheit wird im Bereich von 16 bis 21°C erreicht. Infektionen sind bei einer hohen relativen Luftfeuchtigkeit oder Blattnässe von 14 Stunden oder länger möglich. Um den Bedingungen gerecht zu werden, haben wir uns entschlossen, in Modelle für schwache, mittlere und schwere Infektionen zu unterteilen. Schwache Infektionen können gegeben sein, wenn es dem Erreger möglich ist, das Wirtsgewebe zu infizieren. Das bedeutet, dass eine schwache Infektion stattfinden kann, wenn die Temperaturen im Minimalbereich liegen und die Blattnässeperioden von kritischer Dauer sind. Eine mäßige Infektion findet unter Bedingungen statt, bei denen die meisten Infektionsversuche zu vernünftigen Ergebnissen führen, und eine schwere Infektion findet unter Bedingungen statt, bei denen der Erreger optimale Infektionsbedingungen vorfindet.

Die Infektion beginnt nach einem Regen von 0,5 mm. Wir haben beschlossen, kein Modell für die Pyknidienbildung zu verwenden. Als Voraussetzung für die Pyknidienbildung wird ein Zeitraum mit einer relativen Luftfeuchtigkeit von mehr als 85% angenommen. Die Lebensdauer der Pyknidien wird auf 24 Stunden geschätzt. In allen Klimazonen, in denen Septoria tritici eine Chance hat, sich zu infizieren, werden wir 2 Stunden finden, die diese Bedingungen an fast jedem Tag um den Sonnenaufgang herum erfüllen.
Bewertung des Schweregrads der Infektion: Um den Infektionsdruck durch Septoria tritici zwischen dem Stadium 10 (erstes Blatt durch die Koleoptile) und dem Stadium 32 (zweiter Knoten mindestens 2 cm über dem ersten Knoten) sowie zwischen 32 und 51 (Beginn des Blattaustriebs) beurteilen zu können, müssen wir den Schweregrad der Infektionen anhand der klimatischen Bedingungen bewerten. Diese Bewertung erfolgt auf einer Skala von 1 bis 5. Ein Schweregrad von 1 wird vergeben, wenn die Bedingungen für eine schwache Infektion erfüllt sind und es weniger als 5 mm geregnet hat, andernfalls ist der entsprechende Schweregrad 2. Ein Schweregrad von 3 wird vergeben, wenn eine mäßige Infektion erfüllt ist und es weniger als 5 mm geregnet hat. Wenn es bei einer mäßigen Infektion mehr als 5 mm oder bei einer schweren Infektion weniger als 5 mm geregnet hat, wird ein Schweregrad von 4 vergeben.
Eine schwere Infektion mit mehr als 5 mm Regen entspricht einem Schweregrad von 5.
Septoria tritici Bewertung des Krankheitsdrucks: Das Klima ist nur ein Faktor, der über den Krankheitsdruck im Feld entscheidet. Die beiden anderen Faktoren sind die Geschichte des Feldes und die Anfälligkeit der angebauten Sorte. Wenn wir die Krankheitsschwerewerte von Stadium 10 bis Stadium 32 auf einen Wert von 4 akkumulieren können, können wir einen schwachen Krankheitsdruck durch das Klima erwarten. Erreicht dieser Wert den Wert 6, ist mit einem mäßigen Krankheitsdruck zu rechnen, und wenn er den Wert 10 erreicht, ist mit einem hohen Krankheitsdruck durch das Klima zu rechnen. Wenn wir die Anfälligkeit der Sorte und die Vorgeschichte des Feldes kennen, können wir in dieser Situation bei schwachem oder mittlerem Krankheitsdruck spritzen oder nicht. Ein akkumulierter Wert von 10 kann in jedem Fall zu einer Spritzung im Stadium 32 führen. Die Entscheidung für eine Spritzung in einem späteren Stadium hängt eher vom Frühjahrsklima ab. Wenn es uns gelingt, die Schweregrade seit Stadium 10 auf einen Wert von 6 zu akkumulieren, können wir mit einem schwachen Krankheitsdruck rechnen. Erreicht dieser Wert 10, so ist mit einem mittleren Krankheitsdruck zu rechnen und erreicht dieser Wert 15, so ist aufgrund der klimatischen Situation mit einem hohen Krankheitsdruck zu rechnen.
In FieldClimate zeigen wir die Septoria tritici Schweregrad zusammen mit den drei verschiedenen Infektionsschweregraden in einer Grafik (siehe oben). Aufgrund der Niederschläge und der langen Blattnässeperioden sind die Bedingungen für eine schwere Infektion durch S. tritici wurden am 14. und 16. Mai voll erfasst. Die Schweregrade erreichen am 14. Mai den höchsten Wert von 5, was bedeutet, dass jetzt ein hohes Infektionsrisiko besteht.
Die Infektionsbiologie von Stagonospora nodorum unterscheidet sich in gewissem Maße von der von S. tritici, aber dieser Unterschied ist nicht groß genug für ein eigenes Modell. Daher schlagen wir vor, dieses Modell für den gesamten Komplex der Stagnospora- und Septoria-Krankheiten bei Getreide zu verwenden, einschließlich S. passerinii. S. tritici und S. passerinii benötigen in der Regel längere Blattnässeperioden als S. nodorum. In Gebieten mit einem hohen Druck von S. nodorum Infektionen, die als schwach eingestuft werden und einen Schweregrad von 2 aufweisen, sollten ernster behandelt werden als in anderen Bereichen.
Für Septoria nodorum ein Risikomodell ist in FieldClimate dargestellt (siehe oben). Ein hohes Risiko wurde am 17. Juni und 7. Juli (100%) festgestellt. Je nach dem Stadium der anfälligen Pflanzen für eine Infektion müssen Pflanzenschutzmaßnahmen in Betracht gezogen werden, wenn das Risiko 80% erreicht (siehe auch Wettervorhersage, Pflanzenschutz). Liegt das Risiko bei 100% und wurde bereits eine Infektion festgestellt, müssen systemische Pflanzenschutzmaßnahmen (kurative Anwendung) ergriffen werden, um die Pflanze zu schützen.
Anthraknose
Mehrere Arten von pflanzenpathogenen Pilzen der Gattung Colletotrichum verursachen Anthraknose bei Paprika und vielen anderen Gemüse- und Obstsorten. Bis in die späten 1990er Jahre wurde Anthraknose bei Paprika und Tomaten nur mit reifen oder reifenden Früchten in Verbindung gebracht. Seitdem hat sich eine aggressivere Form der Krankheit durchgesetzt. Diese Form befällt Paprika in jedem Stadium der Fruchtentwicklung und kann die Rentabilität der Paprikakulturen in Gebieten, in denen sie sich etabliert, gefährden. Diese Krankheit kann auch Tomaten, Erdbeeren und möglicherweise andere Obst- und Gemüsekulturen befallen.
Symptome
An unreifen Früchten jeder Größe entstehen kreisförmige oder eckige, eingesunkene Läsionen. Oft bilden sich auf einzelnen Früchten mehrere Läsionen. Bei schwerem Befall können die Läsionen zusammenwachsen. Oft bilden sich rosa bis orangefarbene Massen von Pilzsporen in konzentrischen Ringen auf der Oberfläche der Läsionen. Bei älteren Läsionen können schwarze Strukturen, sogenannte Acervuli, beobachtet werden. Mit einer Handlinse sehen diese wie kleine schwarze Punkte aus; unter dem Mikroskop sehen sie wie Büschel winziger schwarzer Haare aus. Der Erreger bildet schnell und reichlich Sporen und kann sich rasch in einer Paprikakultur ausbreiten, was zu Ertragseinbußen von bis zu 100% führen kann. Läsionen können auch an Stängeln und Blättern als unregelmäßig geformte braune Flecken mit dunkelbraunen Rändern auftreten.
Krankheitserreger
Diese Form der Paprika-Anthraknose wird durch den Pilz Colletotrichum acutatum. Der Erreger überlebt auf Pflanzenresten von infizierten Kulturen und auf anderen anfälligen Pflanzenarten. Ohne befallene Pflanzenreste ist der Pilz nicht über lange Zeiträume hinweg bodenbürtig. Der Pilz kann auch über befallenes Saatgut in eine Kultur eingeschleppt werden. Während warme und feuchte Perioden, Sporen werden durch Regen- oder Bewässerungswasser verspritzt von kranken auf gesunde Früchte. Erkrankte Früchte dienen als Quelle für Inokulum, so dass sich die Krankheit auf dem Feld von Pflanze zu Pflanze ausbreiten kann. Der Pilz überlebt in und auf Samen. Anthraknose wird über infizierte Pflanzen in das Feld eingeschleppt oder kann zwischen den Saisons in Pflanzenresten oder auf Unkrautwirten überleben. Zu den alternativen Wirten gehören Unkräuter und andere Pflanzen der Solanaceae (Tomaten, Kartoffeln, Auberginen), obwohl Infektionen dieser Wirte in Florida äußerst selten sind. Früchte werden infiziert, wenn Sporen des Pilzes oder befallene Abfälle durch Regen auf Paprikapflanzen gespritzt werden. In dem infizierten Gewebe werden neue Sporen produziert, die dann auf andere Früchte übertragen werden. Arbeiter können die Sporen auch mit Geräten oder beim Umgang mit infizierten Pflanzen übertragen. Die Infektion erfolgt in der Regel bei warmem, feuchtem Wetter. Temperaturen um 80° F (27° C) sind optimale Temperaturen für die Krankheitsentwicklung, obwohl die Infektion sowohl bei höheren als auch bei niedrigeren Temperaturen auftritt. Schwere Verluste treten bei Regenwetter auf, weil die Sporen auf andere Früchte geschwemmt oder gespritzt werden, was zu mehr Infektionen führt. Die Krankheit entwickelt sich eher an reifen Früchten, die über einen längeren Zeitraum an der Pflanze verbleiben, obwohl sie sowohl an unreifen als auch an reifen Früchten auftreten kann. Anthraknose kann bei Temperaturen von 15 °C bis 30 °C auftreten. Aber eine lange Blattnässe ist erforderlich, um den Bedarf für eine Infektion zu decken. Bei optimaler Temperatur von 20°C bis 25°C noch 12 Stunden Blattnässe benötigt werden. Höhere oder kühlere Temperaturen erfordern noch längere Blattnässeperioden (keine lineare Funktion/keine lineare Reihe für die Berechnung erforderlich). FieldClimate berechnet die möglichen Infektionsereignisse auf der Grundlage der Blattnässe und der Temperaturen während dieses Ereignisses.
Falscher Mehltau
Biologie der Plasmopara viticola (Echter Mehltau)
P. viticola ist ein obligater Parasit. Das bedeutet, dass er grüne, frische Rebenorgane zum Wachstum benötigt. Während der vegetationslosen Zeit überdauert er und bildet Fruchtkörper, so genannte Oosporen. Oosporen von Oomyceten können sehr lange im Boden überleben. Daher können wir den Falschen Mehltau an Orten finden, an denen eine Infektion nicht in jedem Jahr möglich ist. Im Frühjahr, wenn der Oberboden feucht und warm genug ist, bilden die Oosporen so genannte Makrosporangien, die bis zu 200 Zoosporen ins freie Wasser abgeben können. Die Zoosporen werden mit dem Wind in Wassertröpfchen zu den Blättern und Büscheln transportiert. Sie haben zwei Geißeln und bewegen sich in einem Wasserfilm auf der Unterseite der Blätter oder der Trauben und jungen Beeren, um ein Stoma zu finden und in das Pflanzengewebe einzudringen. Sie dringen in das Stoma ein und keimen dort aus, wobei sie innerhalb von weniger als einer Stunde ihr gesamtes Plasma übertragen. In mikroskopischen Untersuchungen waren das Auffinden des Stomas, die Zystierung und die Keimung im Stoma innerhalb von 90 Minuten abgeschlossen.
P. viticola wächst im Interzellularraum und ernährt sich von Haustorien, die die Epidermis- und Parenchymzellen durchdringen. In Abhängigkeit von Temperatur und relativer Luftfeuchtigkeit entwickelt er genügend interzelluläres Wachstum mit genügend Haustorien, um einen Substomatelkörper zu bilden, der den gesamten Substomatelbereich ausfüllt und das Epidermisgewebe vom Parenchymgewebe abhebt. Dies führt zu dem sichtbaren Symptom des Ölflecks.
Oomyceten sind Sporenbildung in Abwesenheit von Licht, wenn die relative Luftfeuchtigkeit ist sehr hoch. Unter P. viticola Bei Temperaturen unter 12 °C und einer relativen Luftfeuchtigkeit unter 95% findet keine Sporenbildung statt. Die Sporangiaphoren werden von den Substomatellbläschen gebildet und treten aus dem Stoma aus. Die frisch gebildeten Sporangien sind klebrig und können nur mit Wasser aus den Sporangiaphoren entfernt werden. Wenn die relative Luftfeuchtigkeit abnimmt, werden die Sporangien klebrig und können auch durch Wind entfernt werden.
Die Sporangien geben bis zu 20 Zoosporen in freies Wasser ab. Diese Zoosporen müssen durch den Wind in Wassertröpfchen verteilt werden, um auf frische Blätter zu gelangen, oder die Sporangien können durch Regen oder Wind selbst verteilt werden. Der Infektionsprozess der Primär- und Sekundärinfektion ist derselbe.
Aufgrund der großen Bedeutung des Sexualstadiums für die Überwinterung des Erregers kann man davon ausgehen, dass in allen Weinbergen, in denen der Falsche Mehltau auftritt, passende Paarungsformen vorkommen. Die Zoosporenbildung findet auf älteren Blättern im Sommer und Frühherbst statt.
Primäre Infektion im Detail
Infektionen, die von den Oosporen ausgehen, werden als Primärinfektionen bezeichnet. Dieser Begriff ist irreführend, da im Frühsommer mehrere Primärinfektionen auftreten können. Im epidemiologischen Geschehen spielt die Primärinfektion keine große Rolle, wenn genügend Ölflecken in den Weinbergen vorhanden sind und das Infektionspotenzial der Sommersporen (Sporangien) die Oosporen übersteigt.
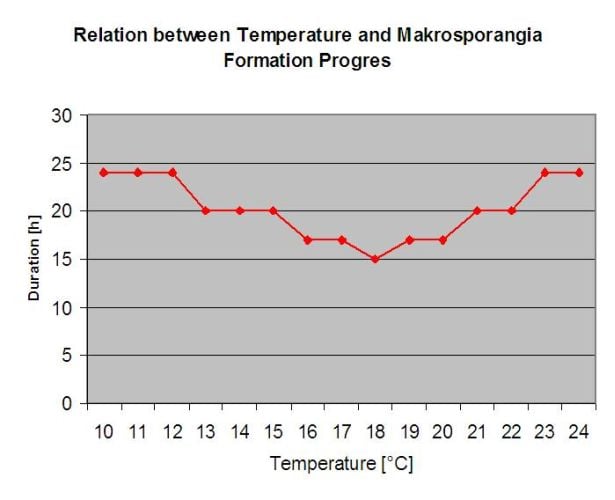
Die überwinternden Oosporen entwickeln sich zu sogenannten Makrosporangien, wenn etwa 24 Stunden lang eine ausreichende relative Luftfeuchtigkeit herrscht. Die Makrosporangien entlassen ihre Zoosporen in freies Wasser und starken Regen (wie bei einem Gewitter). Die Sporen werden zu den Blättern und/oder grünen Trieben der Rebe getragen. Primärinfektionen also, brauchen länger regnerisch Perioden oder mehrere aufeinander folgende Gewitter. Der erste Regen führt dazu, dass die abgefallenen Blätter mit Wasser gesättigt werden, und starker Regen an den folgenden Tagen bewirkt, dass die Makrosporangien ihre Zoosporen freisetzen, die die Weinblätter oder -triebe erreichen. Für eine erfolgreiche Infektion ist eine ausreichend lange Periode der Blattnässe erforderlich, damit die Zoosporen die Stomata der Blätter oder Triebe erreichen und diese infizieren können (die Abbildung oben zeigt den Entwicklungszyklus des Falschen Mehltaus der Rebe (Plasmopara viticola).
Das Modell für die Primärinfektion mit Falschem Mehltau prüft zunächst, ob das Wetter für die Entwicklung von Makrosporangien geeignet ist. Dies ist der Fall, solange die Blätter feucht sind oder die relative Luftfeuchtigkeit nach dem Regen nicht unter 70% fällt. Je nach Temperatur können sich die Makrosporangien innerhalb von 16 bis 24 Stunden entwickeln. Wenn reife Makrosporangien vorhanden sind, wird dies in der Anzeige der Primärinfektion des Falschen Mehltaus grafisch dargestellt. Wenn Makrosporangien vorhanden sind, kann ein starker Regenfall ihre Zoosporen verbreiten. Ein Dauerregen von 5 mm wird als Starkregen interpretiert und die Zoosporen werden verbreitet, eine Primärinfektion ist dann möglich, wenn die Blattnässe lange genug angedauert hat.
Sekundäre Infektionen
Sekundärinfektionen von Plasmopara viticola sind nur möglich, wenn in Ihrem Weinberg oder in dessen Nähe bereits reife Ölflecken vorhanden sind. Ölflecken sind reif, wenn sie in der Lage sind, zu sporulieren (Sporangien zu bilden). Sporangien werden nur gebildet von Nacht. Sonnenlicht hemmt die Sporenbildung. Sporangien werden produziert, wenn es wärmer als 12°C und dem relative Luftfeuchtigkeit ist sehr hoch. Die Sporangienproduktion nimmt mit der Temperatur bis zu 24 °C zu. Die optimale Temperatur für die Sporenbildung bei europäischen Rebsorten (Vitis vinifera) liegt bei etwa 24°C. Wenn die Temperaturen 29°C überschreiten, kann keine Sporenbildung stattfinden. In unserem Modell prüfen wir, ob Feuchtigkeit von mehr als 95% während der Nacht auftritt. Wenn diese Bedingung für eine akkumulierte stündliche Temperatur von mehr als 50°C andauert, ist die Sporulation beendet und neue Sporangien von Plasmopara im Weinberg existieren. Zum Beispiel entsprechen 50°C Stunden 4 Stunden mit 13°C oder 3 Stunden mit 17°C.
Das folgende Diagramm zeigt die Beziehung zwischen Temperatur und feuchten Bedingungen (relative Luftfeuchtigkeit, Blattnässe, Niederschlag), die zur Modellierung der Infektionsereignisse in fieldclimate.com.
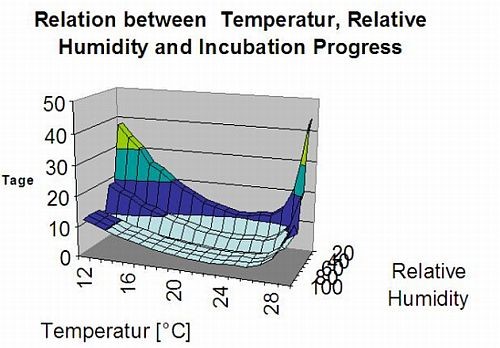
Sporangien von Plasmopara viticola haben eine begrenzte Lebensdauer. Je wärmer es ist und je trockener die Luft, desto schneller sterben sie ab (in fieldclimate.com setzen wir auf 0 zurück, wenn die relative Luftfeuchtigkeit unter 50% liegt). Sie sterben definitiv in der nächsten Tau- oder Blattnässeperiode ab, die für eine Infektion zu kurz ist. Die Fitness älterer Sporangien ist daher recht begrenzt. Unser Modell geht davon aus, dass die Lebensdauer der Sporangien auf einen Tag begrenzt ist.
Um neue Infektionen zu verursachen, müssen die Sporangien verbreitet werden. Für die Verbreitung der Sporen gibt es zwei Möglichkeiten: Wenn es unmittelbar nach der Bildung der Sporangien regnet, verbreiten sie sich mit den Regenspritzern. Bleiben die Weinblätter lange genug feucht, entsteht eine hohe Anzahl von Plasmopara viticola Infektionen stattfindet. Wenn der nächste Morgen ohne Regen und mit abnehmender Luftfeuchtigkeit beginnt, lösen sich die vertrockneten Sporangien von den Zweigen. Schon eine leichte Luftbewegung trägt sie auf gesunde Blätter. Wenn es nicht bald regnet, werden sie absterben.
Falscher Mehltau Primärinfektion
Die Infektionen werden nach der Makrosporenentwicklung (orange, fünftes Diagramm) in drei verschiedenen Schweregraden dargestellt (schwach: orange, mäßig: grün, stark: rot), die von der Regenmenge und damit der Verteilung der Sporen im Weinberg abhängen. Wenn eine Infektion mit 100% festgestellt wird, sind optimale Bedingungen für das Eindringen in das Pflanzengewebe gegeben (Pflanzenschutzmittel) und die Inkubationskurve (erstes Diagramm) beginnt anzusteigen. Wenn die Inkubationszeit beendet ist (100%) und kein Pflanzenschutzmittel eingesetzt wurde, sollten die Symptome (Ölflecken) auf dem Feld kontrolliert werden.
1. Die Kurve des Infektionsverlaufs und nach vollständiger Infektion die sich daraus ergebende Inkubationszeit (Zeit zwischen Infektion und sichtbaren Symptomen auf dem Feld).
2. Eine Infektionsverlaufskurve wird ermittelt, wenn Makrosporangien oder Sporangien vorhanden sind und die Blätter feucht sind. Sie steigt mit zunehmender Blattnässe und Temperatur an. Erreicht die Infektionsverlaufskurve den Wert 100%, kann davon ausgegangen werden, dass die Infektion abgeschlossen ist. Die zur jeweiligen Infektion gehörende Inkubationsverlaufskurve wird mit dem Beginn einer Infektion berechnet. Wenn eine Infektion nicht abgeschlossen werden kann, wird die Inkubationskurve ebenfalls gestoppt.
3. Die Wetterbedingungen werden auf der gleichen Seite wie die Ergebnisse des Krankheitsmodells angezeigt. So können Sie mit einem Blick Temperatur, relative Luftfeuchtigkeit, Regen und Blattnässe während der Infektion überprüfen.
4. Das Modell zeigt die Infektionsdaten für die Primär- und Sekundärinfektionen mit Falschem Mehltau an Weinreben auf. Dies ist die wichtigste Information. Infektionen, die noch nicht durch präventive oder kurative Fungizide abgedeckt sind, können katastrophale Auswirkungen auf den Ertrag/ die Qualität haben. Weitere Informationen über die Schwere der Infektion (schwach/mittel/schwer) könnten hilfreich sein, um eine Pflanzenschutzstrategie in Abhängigkeit von der Geschichte des Weinbergs (Menge des Inokulums), der Sorte und der Erfahrung der letzten Jahre festzulegen.
Strategien für den Pflanzenschutz
- Prophylaktische und systemische oder kurative Fungizide werden in großem Umfang zur Bekämpfung von Falschem Mehltau eingesetzt. Prophylaktische Chemikalien werden vor, aber so nah wie möglich an einem Infektionsereignis in der Zeit der größten Wirtsanfälligkeit, zwischen einer Trieblänge von 10 cm und erbsengroßen Beeren, eingesetzt.
- Prophylaktische Chemikalien können auch eingesetzt werden, indem so kurz wie möglich vor einem vorhergesagten Wetterereignis mit mehr als 2 mm Regen gesprüht wird (für den Primärkreis).
- Ein kuratives Fungizid sollte so schnell wie möglich nach einem Infektionsereignis (100%-Infektion) und vor dem Auftreten von Ölflecken angewendet werden. Achten Sie darauf, die Entwicklung einer Fungizidresistenz zu verhindern.
- Die Überwachung des Weinbergs auf das Auftreten von Falschem Mehltau (Ölflecken) sollte regelmäßig und unter Berücksichtigung von mindestens 200 Rebstöcken durchgeführt werden. Ein Risiko wird als gegeben angesehen, wenn mehr als zwei Ölflecken pro 50 Rebstöcke festgestellt werden.
Das Modell basiert auf den Veröffentlichungen von MUELLER-THURGAU, ARENS, MUELLER und SLEUMER, BLAESER, HERZOG, GEHMANN und vielen anderen Arbeitern, die seit dem frühen neunzehnten Jahrhundert mit dem Forschungsnetzwerk zur Epidemiologie des Falschen und Echten Mehltaus an Weinreben verbunden sind.
Echter Mehltau
Der Mehltau der Tomate kann weltweit durch drei Erreger verursacht werden.
Leveillula taurica (Oidiopsis taurica) ist ein Erreger einer Vielzahl von Wirtsarten in warmen, trockenen bis halbtrockenen Klimazonen in Asien, im Mittelmeerraum, in Afrika und neuerdings auch im Südwesten der Vereinigten Staaten.
Erysiphe orontii (E. cichoracearum und E. polyphaga) ist eine weitere Art, die auf vielen Wirtspflanzen sowohl in gemäßigten als auch in tropischen Regionen vorkommt.
Und als dritte Art Odium lycopersicum.
Faktoren für die Krankheitsentwicklung
- relative Luftfeuchtigkeit > 50% (optimale Luftfeuchtigkeit > 90%)
- freies Wasser auf den Blattoberflächen ist nicht erforderlich
- Temperaturbereich: 10-35 °C (am besten unter 30 °C)
Echter Mehltau ist eine inokulumgetriebene Krankheit. Daher konnten nur Risikoperioden bestimmt werden, Hauptfaktor für den Schaden, z. B. den Ausbruch, ist das Ausgangsinokulum (das in einem breiten Temperaturbereich aktiv ist). Für Bekämpfungsstrategien gilt daher: Kombinieren Sie die Modellierung der Risikoperiode mit der Überwachung des Pilzinokulums (Krankheit) im Feld!
Freiland-Tomate
Spargelrost
Spargelrost Puccinia asparagi wird durch feuchtes und warmes Klima begünstigt. Geringe Regenmengen und Wind verteilen die Urediasporen, während starke Regenfälle sie in den Boden spülen können. Aus diesem Grund wird eine Blattnässeperiode mit mehr als 10 mm Regen nicht für eine Infektionsperiode gehalten. Blattnässeperioden mit leichtem Regen und Tau von 3 bis 8 Stunden bei Temperaturen von 25°C bis hinunter zu 10°C können im Sommer und Spätsommer Infektionsperioden für Urediasporen sein.
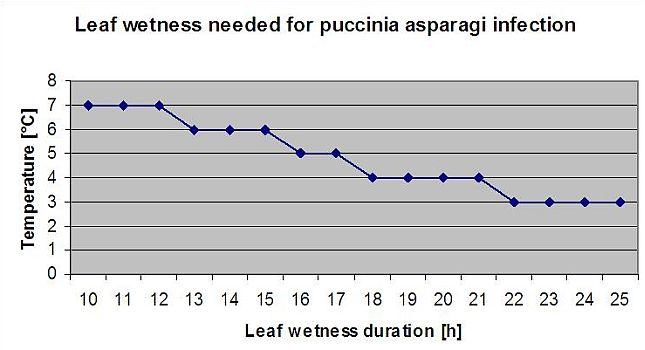
Stemphylium-Blattfleckenkrankheit
Stemphylium Die Krautfäule wird durch den Pilz Stemphylium vesicarium. Auf den Blättern entstehen kleine, hellgelbe bis braune, wassergetränkte Läsionen. Diese kleinen Läsionen wachsen zu länglichen Flecken heran, die häufig zusammenwachsen und zu faulen Blättern führen. Die Läsionen färben sich in der Regel in der Mitte hellbraun bis hellbraun und später dunkelolivbraun bis schwarz, wenn sich die Sporen dieses Krankheitserregers entwickeln. S. vesicarium befällt normalerweise abgestorbenes und absterbendes Zwiebelgewebe, wie Blattspitzen, Purpurflecken und Falscher Mehltau, verletztes Gewebe und seneszentes Gewebe. Die Infektion bleibt in der Regel auf die Blätter beschränkt und erstreckt sich nicht auf die Zwiebelschuppen. Die Läsionen treten im Allgemeinen auf der dem Wind zugewandten Seite des Blattes auf. Lange Perioden mit warmen und feuchten Bedingungen fördern die Entwicklung der Krankheit.
Stemphylium versicarium Das Modell basiert auf den Arbeiten von SUHERI und PRICE bei Zwiebeln und LLorent, VILARDELL, BUGIANI, GHERARDI und MONTESINO bei Birnen. Es werden Infektionskurven für schwache, mittlere und schwere Infektionen berechnet. Es hängt von der Krankheitsgeschichte des Standortes ab, ob eine Behandlung bei einer schwachen, mittleren oder schweren Infektion in Betracht gezogen werden muss.
Mit dieser Einteilung in günstige, mäßig günstige und sehr günstige Situationen liegt es im Ermessen des Landwirts, wie hoch der Krankheitsdruck auf einem bestimmten Feld sein wird und ob er eine bestimmte Infektion abdecken muss.
Temperatur: 11-30°C
Blattnässe: > 0 (Beginn der Infektion) oder rel. Luftfeuchtigkeit > 90% (nur wenn bereits eine Infektion vor der Berechnung vorlag und noch anhält)
leichte Infektion (11-30°C), mäßige Infektion (13-30°C), schwere Infektion (16-30°C), Reihe mit Blattnässedauer (siehe oben)
Reset: wenn die rel. Luftfeuchtigkeit niedriger ist als 70%.
S. versicarium Infektionen besteht oft zusammen mit Alternaria porri Infektionen. Daher wird das TomCast (Alternaria)-Modell recht häufig für beides verwendet.
Cercospora-Blattfleck
Dieses Modell schätzt das Datum des ersten Auftretens von C. beticola auf der Grundlage der kumulierten täglichen Durchschnittstemperaturen seit dem ersten Januar über 5°C. In Zeiten mit einer relativen Luftfeuchtigkeit von mehr als 60% wird ein Schwellenwert von 1006,2°C angenommen, und wenn keine relative Luftfeuchtigkeit vorhanden ist, gilt ein Schwellenwert von 1081,9°C.
Dieses Modell wurde für Italien entwickelt und wird in Italien und Deutschland verwendet.
Für das Jahr 2010 in der Steiermark gibt CercoPrim den 19. Juni als Termin für die erste Spritzung an. Dies ist ungefähr das gleiche Datum, das das Pessl Instruments-Risikomodell oder das DIV-Modell für anfällige Sorten angezeigt hätte.
Purpurfleckenkrankheit
Der Krankheitserreger
Die Purpurfleckenkrankheit an Spargelstangen und Farn wird durch den Pilz Stemphylium vesicarium. Der Pilz überlebt den Winter als geschlechtliche Sporen (Ascosporen) in einem Sack (Ascus), der in überwinternden Strukturen (Pseudothecien) gebildet wird, die als kleine schwarze Punkte auf den Spargelresten der vergangenen Saison erscheinen. Die Ascosporen werden durch Regen aus dem Ascus freigesetzt und können durch den Wind auf neu austreibende Spargelpflanzen getragen werden, wo sie die erste Infektion der Vegetationsperiode verursachen. Aus diesen Neuinfektionen entstehen durch einen ungeschlechtlichen Prozess Sporen (Konidien), die wiederum Sekundärinfektionen verursachen können, ein Prozess, der sich wiederholt, solange die Temperaturen und Niederschläge günstig sind.
Die Krankheit
Das Auftreten der Purpurfleckenkrankheit als bedeutendes Problem bei der Spargelproduktion in Michigan ist möglicherweise auf die Einführung eines No-Till-Kultursystems zurückzuführen, bei dem der getrocknete Farn der vorangegangenen Saison im April gehäckselt und auf der Bodenoberfläche belassen wird. Diese Rückstände bleiben während der Erntesaison (Mitte Juni) und während der Wachstumsperiode des Farns (Ende Juni bis September) sichtbar und sind die Quelle von Ascosporen, die schon früh in der Wachstumsperiode Infektionen auslösen. Die Symptome der Krankheit sind: Die Krankheit zeigt sich als zahlreiche, leicht eingesunkene, violette Flecken mit braunen Zentren auf geernteten Stängeln und Farn. Die Läsionen an den Stängeln befinden sich häufig auf der Windseite, da der aufgewirbelte Sand Wunden verursacht, die die Infektion begünstigen. In Epidemiejahren können Flecken auf 60-90% der Stangen auftreten und dazu führen, dass die Ernte zurückgewiesen wird, insbesondere für den Verkauf auf dem Frischmarkt. Flecken treten auch an Spargelfarnen auf und befallen den Hauptstamm, die Nebenzweige und die Nadeln (Cladophylle). Ein schwerer Befall des Farns kann zu einem vorzeitigen Absterben der Pflanze führen. Die Schwere der Purpurfleckenkrankheit nimmt zu, wenn es längere Zeit regnet, nebelt oder taut.
Textnachweis: Mary K. Hausbeck, Professorin und Beratungsspezialistin, Michigan State University, Abteilung für Pflanzenpathologie, E. Lansing
TomCast für Spargel
Hintergrund: TOMCAST (TOMato disease foreCASTing) ist ein Computermodell, das auf Felddaten basiert und versucht, die Entwicklung von Pilzkrankheiten vorherzusagen, und zwar Kraut- und Knollenfäule, Septoria-Blattflecken und Anthraknose an Tomaten. Im Feld installierte Datenlogger zeichnen stündlich Daten über Blattnässe und Temperatur auf. Diese Daten werden über einen Zeitraum von 24 Stunden ausgewertet und können zur Bildung eines Krankheitsschweregrads (DSV) führen, der im Wesentlichen ein Maß für die Krankheitsentwicklung ist. Mit zunehmender Anzahl von DSV nimmt der Krankheitsdruck auf die Kultur weiter zu. Wenn die Anzahl der akkumulierten DSV das Spritzintervall überschreitet, wird eine Fungizidanwendung empfohlen, um den Krankheitsdruck zu mindern.
TOMCAST basiert auf dem ursprünglichen F.A.S.T.-Modell (Forecasting Alternaria solani on Tomatoes), das von Dr. Madden, Pennypacker und MacNab an der Pennsylvania State University (PSU) entwickelt wurde. Das F.A.S.T.-Modell der PSU wurde von Dr. Pitblado am Ridgetown College in Ontario weiter modifiziert, so dass daraus das TOMCAST-Modell entstand, das heute von der Ohio State University Extension verwendet wird.
DSV sind: Der Krankheitsschweregrad (Disease Severity Value, DSV) ist die Maßeinheit für ein bestimmtes Entwicklungsstadium der Krankheit (Frühfäule).
Mit anderen Worten, ein DSV ist eine numerische Darstellung dafür, wie schnell oder langsam sich die Krankheit (Kraut- und Knollenfäule) in einem Tomatenfeld ausbreitet. Der DSV wird durch zwei Faktoren bestimmt: Blattfeuchte und Temperatur während der "blattfeuchten" Stunden. Mit zunehmender Anzahl der blattfeuchten Stunden und Temperatur nimmt der DSV-Wert schneller zu. Siehe die nachstehende Tabelle des Krankheitsschweregrads.
Umgekehrt reichern sich DSV bei weniger Blattnässe und niedrigeren Temperaturen nur langsam oder gar nicht an. Wenn die Gesamtzahl der akkumulierten DSV einen vorgegebenen Grenzwert überschreitet, der als Spritzintervall oder Schwellenwert bezeichnet wird, wird eine Fungizidspritzung empfohlen, um das Laub und die Früchte vor der Krankheitsentwicklung zu schützen.
Das Spritzintervall (das bestimmt, wann gespritzt werden sollte) kann zwischen 15-20 DSV liegen. Das genaue DSV, das ein Anbauer verwenden sollte, wird in der Regel vom Verarbeiter angegeben und hängt von der Fruchtqualität und der Endverwendung der Tomaten ab. Die Einhaltung eines Spritzintervalls von 15 DSV ist eine konservative Anwendung des TOMCAST-Systems, d. h. Sie werden häufiger spritzen als ein Landwirt, der mit dem TOMCAST-System ein Spritzintervall von 19 DSV verwendet. Der Kompromiss besteht in der Anzahl der während der Saison ausgebrachten Spritzungen und dem Potenzial für Unterschiede in der Fruchtqualität.
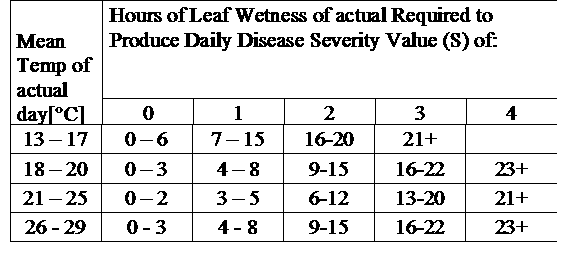 TomCast mit Spargel
TomCast mit Spargel
Untersuchungen haben ergeben, dass der Tom-Cast-Krankheitsvorhersager eine vielversprechende Alternative zum kalenderbasierten Spritzen von Farn in kommerziellen Spargelfeldern ist. Tom-Cast warnt die Erzeuger, wenn die die Umweltbedingungen sind günstig für die Entwicklung der Purpurfleckenkrankheit (längere Tau- oder Regenperioden, begleitet von warmen Temperaturen). Wirksame Fungizide, die gemäß dem Tom-Cast-Krankheitsprognoseprogramm eingesetzt werden, ermöglichen es den Landwirten, die Purpurfleckenkrankheit des Spargels in den Griff zu bekommen und gleichzeitig Geld zu sparen und die Umwelt zu schützen.
Textnachweis: Jim Jasinski, TOMCAST-Koordinator für OHIO, INDIANA, & MICHIGAN
Lila Fleck Infektionsmodell
Die Stemphylium versicarium Das Infektionsmodell basiert auf den Arbeiten von SUHERI und PRICE bei Zwiebeln und LLorent, VILARDELL, BUGIANI, GHERARDI und MONTESINO bei Birnen.
Es werden Infektionskurven für leichte, mittelschwere und schwere Infektionen berechnet.
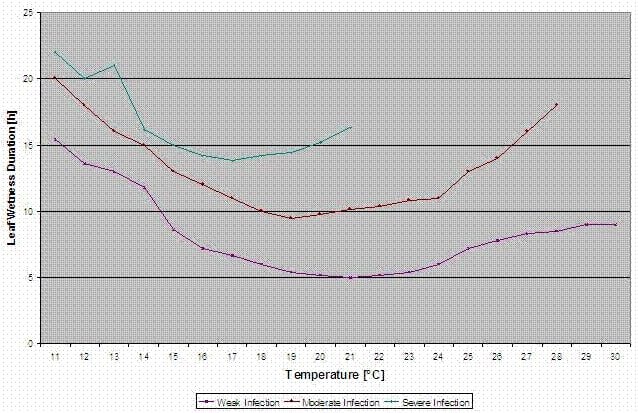
Mit dieser Einteilung in günstige, mäßig günstige und sehr günstige Situationen liegt es am Landwirt zu entscheiden, wie groß der Krankheitsdruck auf einem bestimmten Feld sein wird und ob er eine bestimmte Infektion abdecken muss.
Bedingungen:
Temperatur: 11-30°C
Blattnässe > 0 (Beginn der Infektion) oder rel. Luftfeuchtigkeit > 90% (nur wenn bereits eine Infektion vor der Berechnung vorlag und noch anhält)
leichte Infektion (11-30°C), mäßige Infektion (13-30°C), schwere Infektion (16-30°C), eine Reihe mit der Dauer der Blattnässe (siehe oben)
Reset: wenn die rel. Luftfeuchtigkeit niedriger ist als 70%.
Empfohlene Ausrüstung
Prüfen Sie, welcher Sensorensatz für die Überwachung potenzieller Krankheiten dieser Kultur benötigt wird.