
Weintraube Krankheitsmodelle
Falscher Mehltau
Krankheitserreger
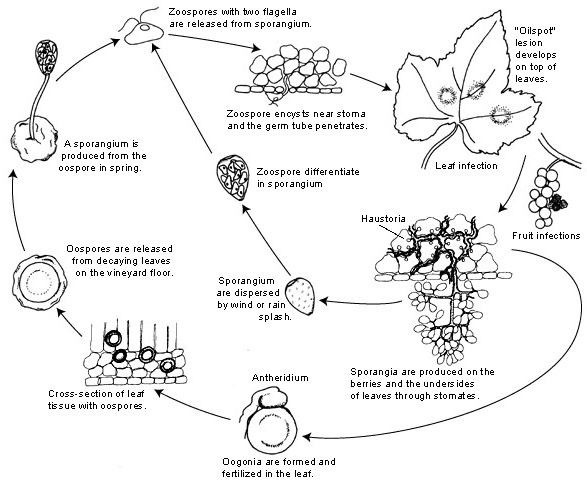
Der Erreger von Falschem Mehltau bei Weintrauben ist Plasmopara viticola. Er ist ein obligater Parasit, d. h. er benötigt grüne und frische Rebenorgane für sein Wachstum. Er hat sowohl ungeschlechtliche als auch geschlechtliche Fortpflanzungsstadien - Zoosporen und Oosporen. Daher gibt es zwei Infektionsstadien: die Primär- und die Sekundärinfektion.
Die Primärinfektion beginnt mit der Keimung der überwinternden Oosporen, die im Frühjahr, wenn das Wetter warm wird, Sporangien bilden. Die Sporangien werden nachts produziert, da das Sonnenlicht die Sporulation hemmt. Die dickwandigen Oosporen helfen dem Erreger, den strengen Winter zu überstehen und die Primärinfektion einzuleiten. Die Sporangien werden entweder durch Regen oder Wind verbreitet und setzen Zoosporen im freien Wasser frei. Für eine erfolgreiche Infektion sind ausreichend lange Blattnässe oder Regenfälle erforderlich.
Eine Sekundärinfektion ist nur bei Vorhandensein von reifen Ölflecken möglich und erfolgt durch Zoosporen und Sporangien. Zoosporen und Sporangien reagieren sehr empfindlich auf niedrige Luftfeuchtigkeit und Licht, was ihre Lebensfähigkeit verkürzt, was bedeutet, dass die meisten Infektionen kurz nach der Freisetzung erfolgen. Die Zoosporen dringen über Keimschläuche in das Pflanzengewebe ein und entwickeln Hyphen zur weiteren Infektion. Diese Hyphen bilden nach der Inkubationszeit, die je nach Temperatur zwischen 5 und 21 Tagen beträgt, ölige Läsionen - je niedriger die Temperatur, desto länger dauert es.
Sobald das Wetter wieder kälter wird, was für den Erreger ungünstig ist, geht er zur sexuellen Produktion über und produziert Oosporen. Diese Oosporen bleiben während des Winters inaktiv, und der Zyklus wiederholt sich.
Symptome

Auf der Oberseite der Blätter erscheinen kleine gelbe Läsionen, die manchmal von bräunlichen Lichthöfen umgeben sind. Die Ölflecken dehnen sich aus und wachsen mit der Reifung zusammen, und die Lichthöfe verblassen. Die Sporangien produzieren später auf der Unterseite der Läsionen einen weiß-rotbraunen Mehltau, der zu Nekrosen führt. Ölige braune Stellen erscheinen auch auf Trieben, Stängeln und Beeren. In feuchtwarmen Nächten können sie aufgrund der Sporenbildung mit weißem Flaum bedeckt werden. Eine schwere Infektion führt zum vorzeitigen Fall.
FieldClimate-Modelle
- In FieldClimate gibt es zwei Modelle - Primär- und Sekundärinfektion.
- Das erste Diagramm zeigt die Inkubationszeit nach Abschluss einer Infektion. Die unteren Diagramme zeigen den Infektionsverlauf für einen schwachen, mittleren und schweren Schweregrad. Von einer Infektion ist auszugehen, wenn die ansteigende Kurve in der Grafik den Wert 100% erreicht - bei einem schweren Infektionsgrad kann eine Spritzung in Betracht gezogen werden.
Primäre Infektion
Benötigte Sensoren:
- Lufttemperatur
- Relative Luftfeuchtigkeit
- Blattnässe
- Niederschlag
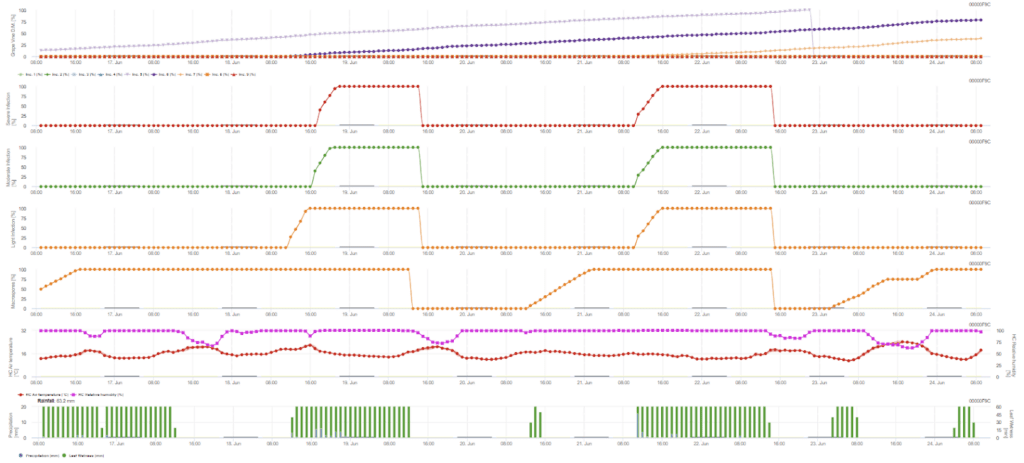
Die Primärinfektion prüft, ob das Wetter für die Entwicklung von Sporangien geeignet ist. Dies ist der Fall, solange die Blätter feucht sind oder die relative Luftfeuchtigkeit nach dem Regen nicht unter 70% fällt. Die Sporangien können sich je nach Temperatur innerhalb von 16 bis 24 Stunden entwickeln. Ein Dauerregen von 5 mm wird als starker Regen interpretiert, der Zoosporen verbreiten kann.
Sekundärinfektion
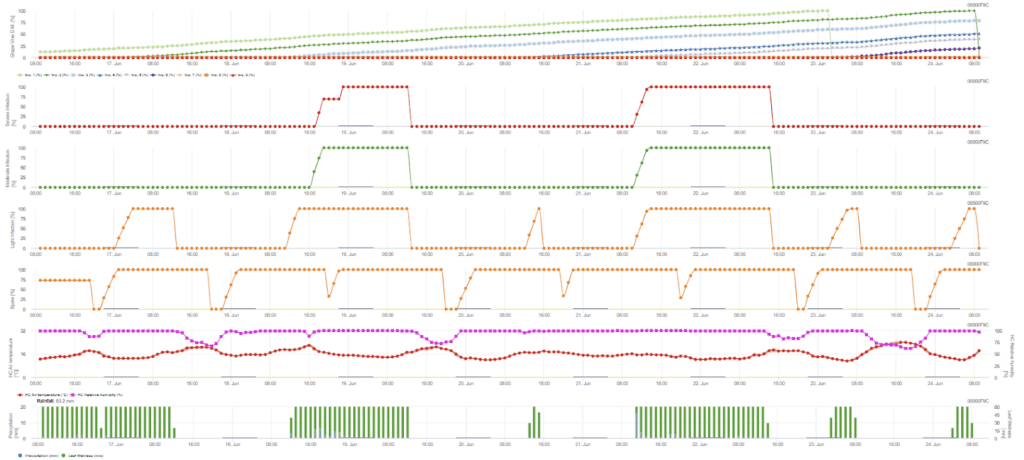
Benötigte Sensoren:
- Lufttemperatur
- Relative Luftfeuchtigkeit
- Blattnässe
- Niederschlag
Die Sekundärinfektion wird geprüft, wenn die Temperatur über 12 °C und die relative Luftfeuchtigkeit über 95% liegt. Die Sporangienproduktionsrate steigt bei Temperaturen bis zu 23 °C. Wenn diese Bedingung für eine kumulierte Stundentemperatur von mehr als 50 °C anhält, gehen wir davon aus, dass die Sporulation abgeschlossen ist und neue Sporangien im Weinberg vorhanden sind. Die kumulierten 50 °C entsprechen z. B. 4 Stunden bei 13 °C oder 3 Stunden bei 17 °C. Die Sporangien sterben schnell ab, wenn es wärmer und trockener wird - wenn die relative Luftfeuchtigkeit unter 50% fällt, setzen wir sie auf 0 zurück, und wenn die Temperatur 29 °C übersteigt, kann keine Sporulation mehr stattfinden.
Literatur
- Ash, G. (2000). Falscher Mehltau der Weintraube. The Plant Health Instructor.
- Gessler, C., Pertot, I., & Perazzolli, M. (2011). Plasmopara viticola: ein Überblick über den Wissensstand zum Falschen Mehltau der Weinrebe und eine effektive Krankheitsbekämpfung. Phytopathologia Mediterranea, 50(1), 3-44.
- Kennelly, M. M., Gadoury, D. M., Wilcox, W. F., Magarey, P. A., & Seem, R. C. (2007). Primärinfektion, Läsionsproduktivität und Überleben von Sporangien beim Erreger des Falschen Mehltaus der Weinrebe, Plasmopara viticola. Phytopathologie, 97(4), 512-522.
- Koledenkova, K., Esmaeel, Q., Jacquard, C., Nowak, J., Clément, C., & Ait Barka, E. (2022). Plasmopara viticola, der Erreger des Falschen Mehltaus der Weinrebe: von der Taxonomie bis zum Krankheitsmanagement. Frontiers in Microbiology, 13, 889472.
Echter Mehltau
Krankheitserreger
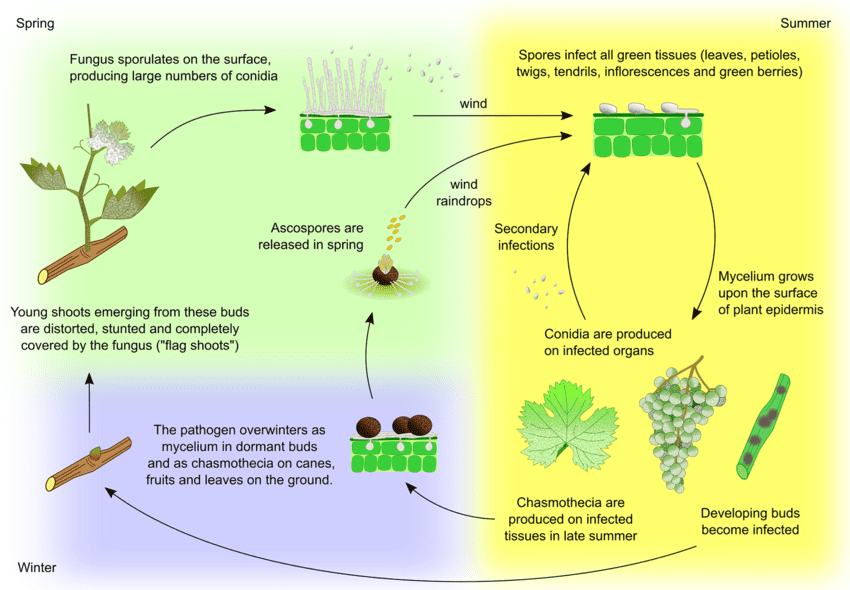
Der Erreger des Echten Mehltaus bei Weintrauben ist Uncinula necator. Es gibt zwei Hauptquellen für das Inokulum - überwinterndes Myzel und Ascosporen von Cleistothecien - die je nach Region unterschiedlich wichtig sein können.
Das Myzel verursacht im Frühjahr Fahnentriebe. Fahnentriebe sind teilweise oder vollständig mit Mehltau bedeckte Triebe, die sich aus latent infizierten Knospen bilden. Da sich darin Kolonien bilden, sind diese Triebe gut sichtbar und haben oft deformierte Blätter.
Cleistothecien setzen im zeitigen Frühjahr Ascosporen frei. Niederschläge spielen eine wichtige Rolle bei der Freisetzung der Ascosporen. Mit steigender Temperatur kommt es häufiger zur Dehiszenz. Die Ascosporen keimen innerhalb von 12 Stunden und bilden Keimschläuche und Appressorium auf dem Pflanzengewebe, was zu einer verstreuten Koloniebildung führt.
Die Sekundärinfektion erfolgt über Konidien, die in Kolonien gebildet werden. Genau wie Ascosporen keimen sie aus und entwickeln Keimschläuche und Appressorium. U. necator benötigt kein freies Wasser für die Infektion und keine hohe relative Luftfeuchtigkeit für die Konidienbildung. Wenn die Witterungsbedingungen ungünstiger werden, bildet der Pilz Cleistothecien. Er überwintert entweder in Cleistothezien oder als vegetatives Myzel in ruhenden infizierten Knospen, und der Zyklus wiederholt sich.
Symptome

Die Symptome sind an allen grünen Teilen der Rebe zu finden. An den Trieben bilden sich Kolonien und sie werden mit weiß-grauem Myzel bedeckt, das als "Fahnenschösslinge" bezeichnet wird. Sie bilden verzerrte Blätter. Mehltaukolonien finden sich auch auf Blättern - entweder auf der Unterseite oder auf beiden Seiten. Die Beeren entwickeln aschgraue Flecken und werden in schweren Fällen gespalten. Die Stöcke weisen dunkelrot-braune Flecken auf und können an den Spitzen absterben.
FieldClimate-Modelle
Ascosporen-Infektion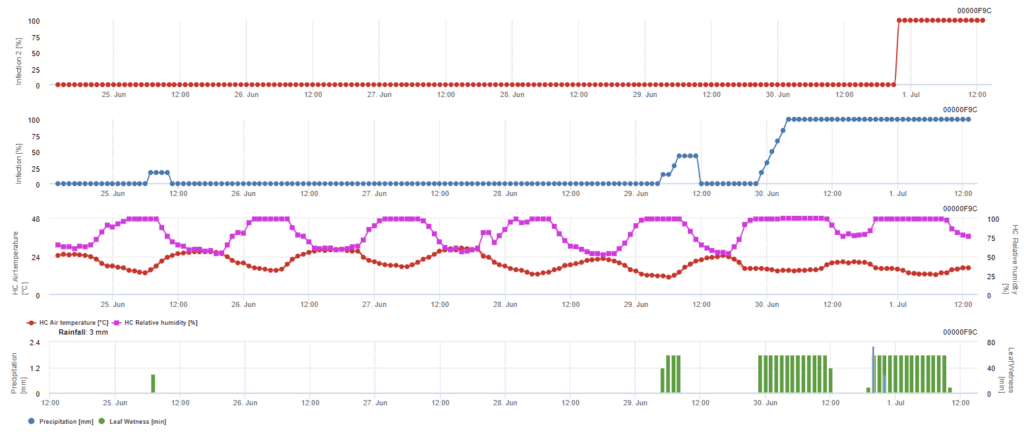
Benötigte Sensoren:
- Lufttemperatur
- Relative Luftfeuchtigkeit
- Blattnässe
- Niederschlag
Dieses Modell wird empfohlen, wenn die Ascosporen während des kalten Winters gebildet werden (also keine Infektion durch Myzel). Die Ascosporeninfektion prognostiziert die Ascosporenfreisetzung und die Erstinfektion auf der Grundlage der Durchschnittstemperaturen während längerer Blattnässeperioden. Zur Berechnung sind etwa 2,5 mm Niederschlag erforderlich, um Ascosporen freizusetzen, gefolgt von mindestens 8 bis 12 Stunden Blattnässe und Temperaturen zwischen 10 und 15 °C. Sobald die Infektion stattgefunden hat, geht das Modell in eine Phase der Bewertung des Krankheitsrisikos über (Californian Risk Modell) und basiert auf den Auswirkungen der Temperatur auf die Vermehrungsrate des Erregers.
Kalifornisches Risikomodell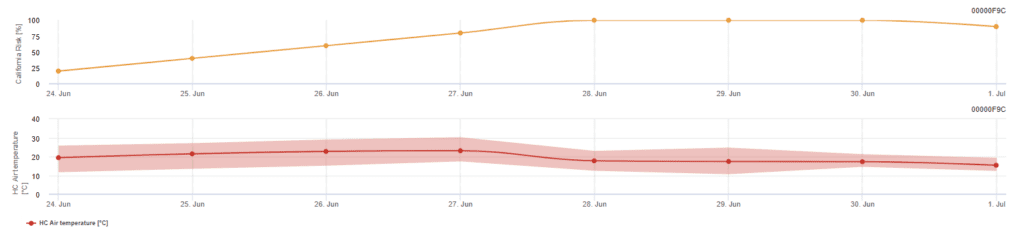
Benötigte Sensoren:
- Lufttemperatur
Das Modell stützt sich auf Laborstudien in Kalifornien. Nach der Freisetzung von Ascosporen und der Keimung (Modell) werden die anschließende Entwicklung und Vermehrung des Echten Mehltaus von den Temperaturen beeinflusst. Es bewertet die Temperaturen und schätzt das Risiko der Mehltauentwicklung anhand eines Index von 0 bis 100 Punkten ein.
Drei aufeinanderfolgende Tage mit mindestens sechs aufeinanderfolgenden Stunden mit Temperaturen zwischen 21 und 30°C sind erforderlich, um den Risikobewertungsindex zu starten. Für jeden Tag, an dem sechs oder mehr aufeinanderfolgende Stunden zwischen 21 und 32°C erreicht werden, werden 20 Punkte gutgeschrieben, während für die Tage, an denen dies nicht der Fall ist oder an denen die Temperatur über 32°C oder unter 21°C sinkt, 10 Punkte abgezogen werden.
Niedrige Indexwerte von 0~30 bedeuten, dass sich der Erreger nicht vermehrt. Ein Index von 40-50 gilt als moderat und bedeutet eine Vermehrungsrate des Mehltaus von etwa 15 Tagen. Indexwerte über 60 deuten darauf hin, dass sich der Erreger schnell vermehrt (alle 5 Tage) und dass die Gefahr einer Krankheitsepidemie groß ist.
Pessl Instruments-Risikomodell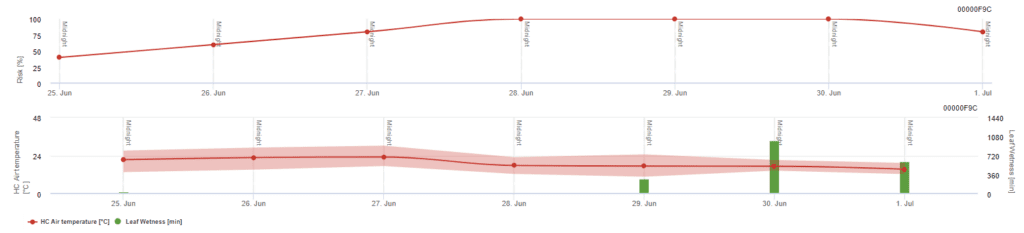
Benötigte Sensoren:
- Lufttemperatur
- Blattnässe
Neben der Lufttemperatur kann auch die Blattnässe ein steuernder Faktor sein, da lange Perioden der Blattnässe zur Etablierung eines antagonistischen Pilzes (Ampelomyces quisqualis) führen, der einen Rückgang von U. necator bewirkt. Die Grundlagen des Modells entsprechen dem kalifornischen Risikomodell, aber die Blattnässe wird auch in diesem Modell berücksichtigt. Blattnässe, die länger als 8 Stunden andauert, führt zu einem Rückgang von 10 Punkten.
Niedrige Indexwerte von 0~20 bedeuten, dass sich der Erreger nicht vermehrt. Ein Index von 20~60 gilt als moderat und ein normales Sprühintervall ist gültig. Indexwerte über 60 zeigen an, dass sich der Erreger schnell vermehrt (alle 5 Tage) und dass das Risiko einer Krankheitsepidemie groß ist, so dass eine Verkürzung des Spritzintervalls empfohlen wird.
Literatur
- Gadoury, D. M., & Pearson, R. C. (1990). Ascocarp dehiscence and ascospore discharge in Uncinula necator. Phytopathologie, 80(4), 393-401.
- Gadoury, D. M., & Pearson, R. C. (1990). Germination of ascospores and infection of Vitis by Uncinula necator. Phytopathologie, 80(11), 1198-1203.
- Hall, T. W. (2000). Epidemiologie des Traubenmehltaus, Uncinula necator, im Willamette Valley.
- Halleen, F., & Holz, G. (2001). An Overview of the Biology, Epidemiology and Control of Uncinula Necator (Powdery Mildew) on Grapevine, with Ref Ere Nee to South Africa. South african journal of Enology and Viticulture, 22(2), 111-121.
- Rügner, A., Rumbolz, J., Huber, B., Bleyer, G., Gisi, U., Kassemeyer, H. H., & Guggenheim, R. (2002). Bildung von Überwinterungsstrukturen von Uncinula necator und Besiedlung von Weinreben unter Feldbedingungen. Pflanzenpathologie, 51(3), 322-330.
Schwarzfäule
Krankheitserreger
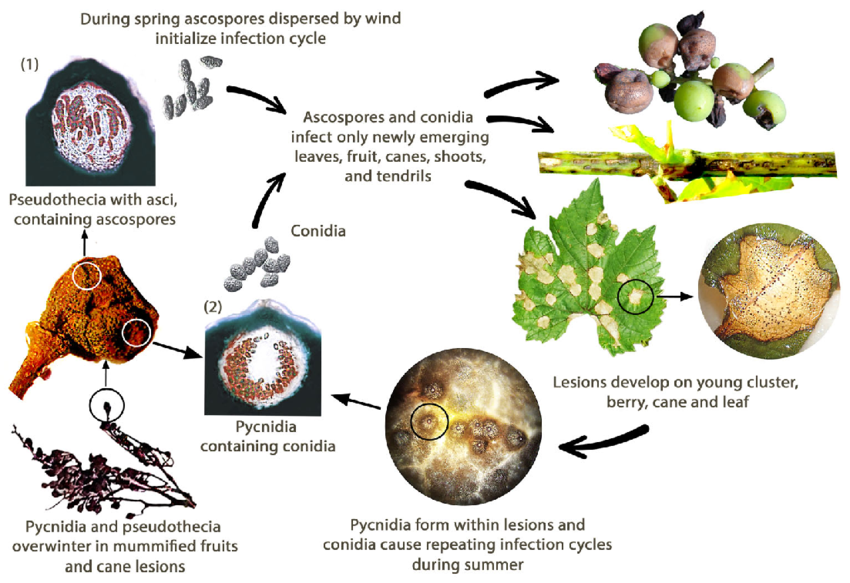
Die Schwarzfäule der Weinrebe wird durch den Pilz Guignardia bidwellii verursacht. Der Pilz überwintert in verschiedenen Teilen der Rebe und kann in den Läsionen infizierter Triebe über zwei Jahre lang überleben.
Im Frühjahr produzieren die Pyknidien Konidien (ungeschlechtliche Sporen) und die Pseudothecien Ascosporen (geschlechtliche Sporen). Die Konidien werden in der Regel über kurze Entfernungen verbreitet, während die Ascosporen über größere Entfernungen infizieren können. Diese Sporen werden durch Wind und Regen übertragen, um junge Gewebe empfänglicher Wirte zu infizieren und Primärinfektionen auszulösen. Konidien dienen auch als sekundäres Inokulum und tragen so zur schnellen und wiederholten Ausbreitung der Krankheit bei.
Im August verwandeln sich die Pyknidien in ein Überwinterungsstadium, das Pseudothecien hervorbringt, aus denen Ascosporen entstehen. Diese Ascosporen sind wichtige Quellen für Primärinfektionen im folgenden Frühjahr.
Symptome

Es bilden sich rötlich-braune Flecken, die schließlich ineinander übergehen und oft von kleinen schwarzen Punkten umgeben sind, bei denen es sich um als Pyknidien bekannte Pilzstrukturen handelt, die Konidien produzieren. Junge und schnell wachsende Blätter sind besonders anfällig für diese Infektion.
Fruchtinfektionen treten in der Regel nach dem Abfallen des Kelchs auf, wobei sich die meisten Symptome zeigen, wenn die Frucht halb bis fast ganz ausgewachsen ist. Zunächst treten kleine Flecken auf, die von einem braunen Ring umgeben sind, der sich dann vergrößert und verdunkelt und schließlich die gesamte Beere bedeckt, wenn sich die Krankheit weiterentwickelt. Innerhalb weniger Tage können die befallenen Beeren mumifiziert werden, zerbrechen oder vorzeitig abfallen.
Darüber hinaus werden auch andere Pflanzenteile wie Triebe, Stängel und Ranken befallen. Es bilden sich ovale Läsionen, die violett bis schwarz sind, und Pyknidien werden über die Oberfläche dieser Läsionen verstreut.
FieldClimate Modell
Weinbau Schwarzfäule Modell
Benötigte Sensoren:
- Lufttemperatur
- Relative Luftfeuchtigkeit
- Blattnässe
- Niederschlag
Das Modell basiert ursprünglich auf der von Spotts veröffentlichten Literatur, wurde aber von Daniel Molitor modifiziert. Bei der Überarbeitung wurden drei Schweregrade (leicht, mäßig und schwer) eingeführt, ähnlich wie bei den Modellen für Apfelschorf. Bei warmen Temperaturen reicht die Blattnässe von 8 Stunden aus, um Infektionen zu begünstigen, und es wird angenommen, dass eine Infektion abgeschlossen ist, wenn ein Graph 100% erreicht.
Der Schweregrad der Infektion hängt von der Dauer der optimalen Temperatur und der Nässeperiode des Pilzes ab. Infektionen, die die Spotts-Kriterien erfüllen, werden als leichte Infektionen eingestuft. Infektionen, die die Spotts-Kriterien von 150% und 200% erfüllen, werden als mäßige bzw. schwere Infektionen eingestuft.
Je nach Infektionsdruck sollten die Infektionen präventiv abgedeckt werden oder es muss kurz nach der Infektion eine kurative Spritzung durchgeführt werden. Im gemäßigten, halbtrockenen Klima der Mosel oder der meisten österreichischen Weinbaugebiete wäre eine Spritzung nach Feststellung einer leichten Infektion nicht zu empfehlen.
Literatur
- Wilcox, Wayne F. "Schwarzfäule Guignardia bidwellii". Krankheitserkennungsblatt Nr. 102GFSG-D4. 2003. Cornell. 24 Oct. 2010
- http://www.nysipm.cornell.edu/factsheets/grapes/diseases/grape_br.pdf
- Ellis, Michael A. "Merkblatt Landwirtschaftliche und natürliche Ressourcen: Schwarzfäule der Trauben". Abteilung für Pflanzenpathologie. Die Universität von Ohio State Extension. 2008
- http://ohioline.osu.edu/hyg-fact/3000/pdf/HYG_3004_08.pdf
- Molitor, D. (2009). Untersuchungen zur Biologie und Bekämpfung der Schwarzfäule (Guignardia bidwellii) an Weinreben. Gesellschaft zur Förderung der Forschungsanstalt Geisenheim.
- Ries, S. M. (1999). Berichte über Pflanzenkrankheiten: Schwarzfäule der Weintraube. Integrierte Schädlingsbekämpfung an der Universität von Illinois. http://ipm. illinois. edu/diseases/series700/rpd703.
- Spotts, R. A. (1977). Effect of leaf wetness duration and temperature on the infectivity of Guignardia bidwellii on grape leaves. Phytopathology, 67(11), 1378-1381.
- Szabó, M., Csikász-Krizsics, A., Dula, T., Farkas, E., Roznik, D., Kozma, P., & Deák, T. (2023). Schwarzfäule der Weintrauben (Guignardia bidwellii) - ein umfassender Überblick. Horticulturae, 9(2), 130.
- http://extension.cropsciences.illinois.edu/fruitveg/pdfs/771-BlackRotOfGrape.pdf
- https://www.missouribotanicalgarden.org/gardens-gardening/your-garden/help-for-the-home-gardener/advice-tips-resources/insects-pests-and-problems/diseases/fruit-spots/black-rot-of-grapes
Beerenmotten
Krankheitserreger

Lobesia botrana vollzieht je nach Region in der Regel zwei bis drei Generationen pro Jahr. Die erste Generation (Mai und Juni) befällt nur die Blüten, so dass eine Behandlung nur notwendig ist, wenn die Mottenpopulationen besonders hoch sind. Die zweite Generation (Juli und August) und die dritte Generation verursachen die meisten Schäden, wobei die dritte Generation besonders schädlich ist, da sie mit der Reifung der Trauben zusammenfällt. Eine vierte Generation kann in wärmeren Klimazonen auftreten, doch ist eine Behandlung im Allgemeinen nicht erforderlich, da sie mit der Weinlese zusammenfällt.
Der Falter überwintert als Puppe in einem Kokon, und wenn die Temperaturen im Frühjahr steigen, schlüpfen die erwachsenen Tiere der ersten Generation, wobei die Männchen in der Regel vor den Weibchen erscheinen. Der Flug der ersten Generation beginnt mit dem Knospenaufbruch und dauert 4 bis 5 Wochen, in denen die Paarung stattfindet. Ein bis zwei Tage nach der Paarung legen die Weibchen zwischen 80 und 160 Eier ab.
Die Eier mit einem Durchmesser von 0,6 bis 0,8 mm sind mit bloßem Auge sichtbar. Sie sind zunächst cremeweiß und färben sich mit der Entwicklung des Embryos gelb, wobei der Kopf der Larve schwarz ist. Die Eier schlüpfen nach 66 Grad Celsius (DDC), also nach etwa 7 bis 11 Tagen. Die Larven nisten sich in Blütenteilen ein, wobei die Entwicklung 20 bis 30 Tage dauert. Es folgt die Verpuppung, aus der 6 bis 14 Tage später die erwachsenen Tiere schlüpfen.
Die "Gradtage" werden berechnet, indem gemessen wird, um wie viel die tägliche Durchschnittstemperatur eine bestimmte für die Entwicklung erforderliche Basistemperatur überschreitet. Wenn die Temperaturen über den Basiswert steigen, häufen sich die Gradtage.
Erwachsene Falter sind etwa 6 bis 8 mm lang und haben eine Flügelspannweite von 11 bis 13 mm. Die Weibchen sind etwas größer als die Männchen, obwohl beide ähnliche mosaikartig gemusterte Flügel haben.
Die Eier der zweiten und dritten Generation schlüpfen schneller, innerhalb von 3 bis 5 Tagen. Die Weibchen legen ihre Eier einzeln auf schattige Beeren, und nach dem Schlüpfen dringen die Larven in die Beeren ein und höhlen sie aus. Im Herbst lösen Nächte, die länger als 11 Stunden dauern, eine Diapause aus, ein Ruhestadium, das es den Puppen ermöglicht, Kälte besser zu vertragen, so dass sie überwintern können.
Symptome
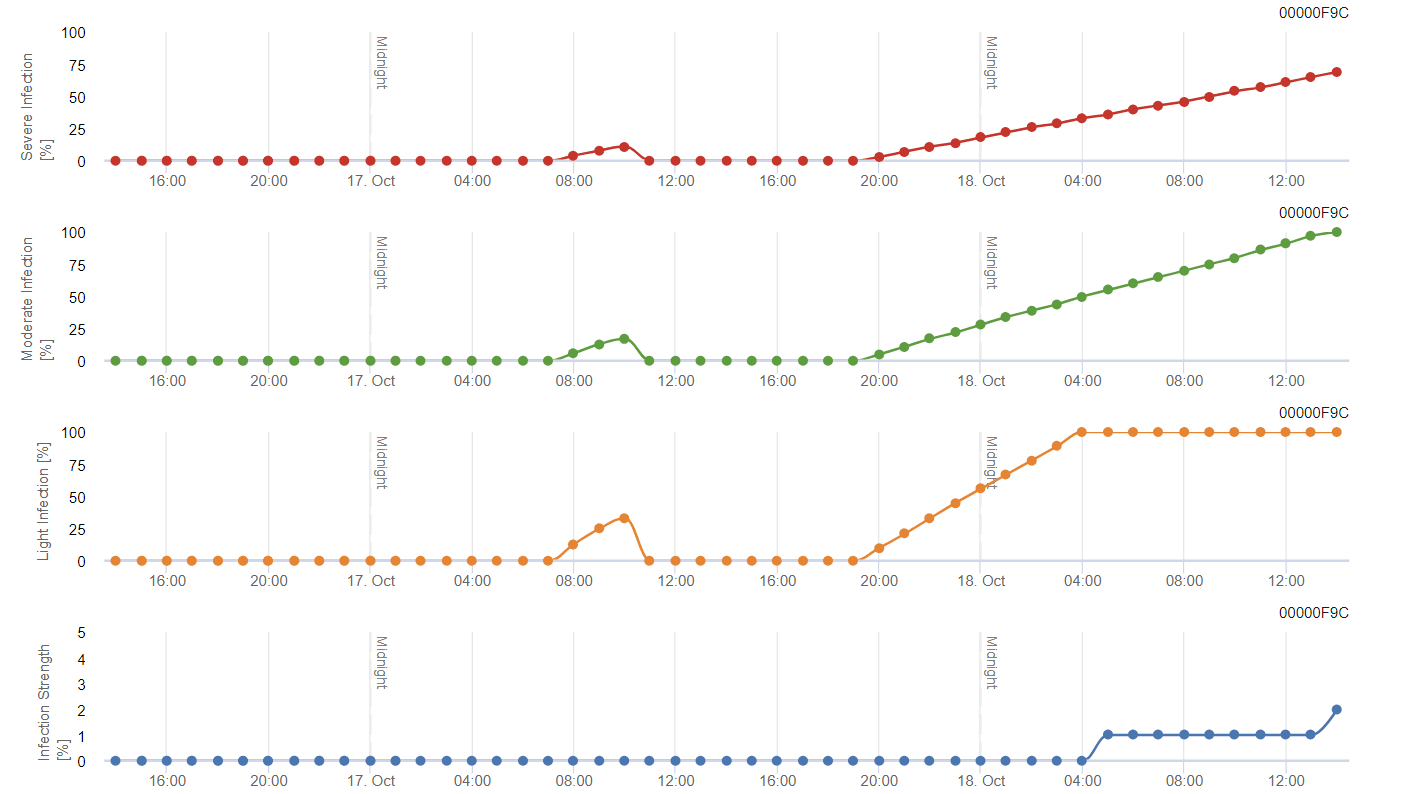
Die Raupen der ersten Generation ernähren sich von den Blütenständen der Rebe, wobei sie die Blütenknospen aushöhlen und zum Schutz einspinnen, was zu Schäden innerhalb der Traube führt. In der zweiten Generation zielen die Larven auf die sich entwickelnden Beeren ab und schaffen so Eintrittspforten für pilzliche Krankheitserreger wie Botrytis cinerea. Dieser direkte Fraß verursacht sichtbare Schäden, die typischerweise durch dunkle Flecken um die Fraßstellen herum gekennzeichnet sind. Die dritte Generation verursacht den größten Schaden, da die Larven in die reifenden Beeren eindringen und sich von ihnen ernähren.
Zurück bleiben geschrumpfte Beeren und Larvenausscheidungen. Fetzen der Beerenepidermis bleiben lose an den Stielen hängen, zusammen mit trockener, ausgehöhlter Beeren-"Haut".
FieldClimate Modell
Rebenbeerenwickler Modell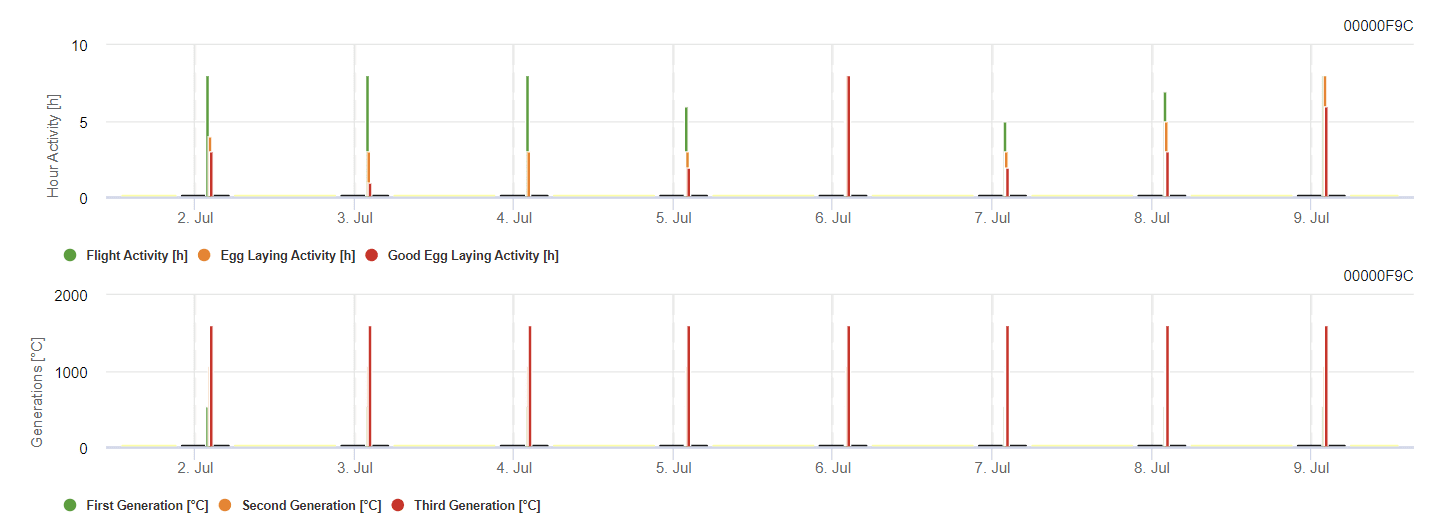
Sensor benötigt:
- Lufttemperatur
Das Modell berechnet das Risiko anhand der Lufttemperatur. Die erste Grafik zeigt die Flugaktivitätsperioden mit Eiablage und guter Eiablageaktivität des Insekts. Das zweite Diagramm zeigt, welche Generation in dem Zeitraum zu erwarten ist. In der dritten Grafik werden Klimadaten dargestellt, die die Häufung der Gradtage (Temperaturen > 8°C bis 24°C pro Stunde geteilt durch 24) zeigen.
Literatur
- Varela, L. G., Smith, R. J., Cooper, M. L., & Hoenisch, R. W. (2010). Europäischer Traubenwickler, Lobesia botrana. Napa Valley vineyards. Pract. Winery Vineyard, 2010, 1-5.
- https://ipm.ucanr.edu/invasive-and-exotic-pests/european-grapevine-moth/
- https://www.ages.at/en/plant/plant-health/pests-from-a-to-z/grape-berry-moth
Grauschimmel
Krankheitserreger
Der Erreger des Grauschimmels bei Weinreben ist Botrytis cinerea.
Die Epidemiologie des Grauschimmels wird maßgeblich durch latente Infektionen beeinflusst, die durch Blüteninfektionen ausgelöst werden. Es wurden verschiedene Wege von der Blüte zur Frucht identifiziert: Der Pilz infiziert den Griffel der Blüte und erreicht die Eizelle, wo er aufgrund der vorbereiteten Abwehrmechanismen der Pflanze latent bleibt. Infektionen über Staubblätter, Blütenblätter und Kelchblätter sind ebenfalls entscheidend. B. cinerea kann Staubgefäße infizieren und sich systematisch in Richtung Blütenboden ausbreiten, wobei er auch den Blütenstiel und das Gefäßgewebe in den Beeren befällt. Andere Wege beinhalten auch das saprophytische Wachstum des Erregers.
Überwinternde Myzelien oder Sklerotien sind die Hauptinfektionsquelle im Frühjahr. Konidien (ungeschlechtliche Sporen) werden produziert und durch Wind und Regen verbreitet. Nach der Landung keimen die Konidien und bilden Keimschläuche und Appressorien, die in die Pflanze eindringen und sie infizieren. Der Pilz kann latent bleiben, bis die Früchte reif sind und der Zuckergehalt steigt. Konidien, die aus primären Inokulumquellen stammen, folgen einem täglichen Zyklus von Initiierung, Produktion und Verbreitung.
Während das sexuelle Stadium von B. cinerea nur selten beobachtet wird, wird der Erreger mit der Reifung der Beeren aktiver. Ein höherer Zuckergehalt in den Beeren erhöht die Anfälligkeit für Infektionen. In gleicher Weise sind die Blüten hochgradig anfällig, wenn sie verblüht sind, wobei der reichlich vorhandene Pollen die Infektionsschwere erhöht.
Symptome

Der Grauschimmel befällt vor allem reife Traubenbeeren, die zunächst weich und wasserdurchtränkt erscheinen. Mit der Zeit verfärben sich die Beeren rötlich-braun und schrumpfen. Unter günstigen Bedingungen werden sie mit grauen Massen von Pilzmyzelen und Konidien bedeckt. Gesunde Beeren können auch durch direkten Kontakt mit kranken Beeren infiziert werden.
Der Pilz kann auch eine Blütenfäule verursachen, die schon früh in der Saison zu erheblichen Ernteverlusten führen kann. Blattinfektionen sind zwar selten, aber wenn sie auftreten, beginnen sie als stumpfe grüne Flecken entlang der Blattadern, die sich schließlich zu nekrotischen Läsionen entwickeln.
FieldClimate Modell
Allgemeines Graumodell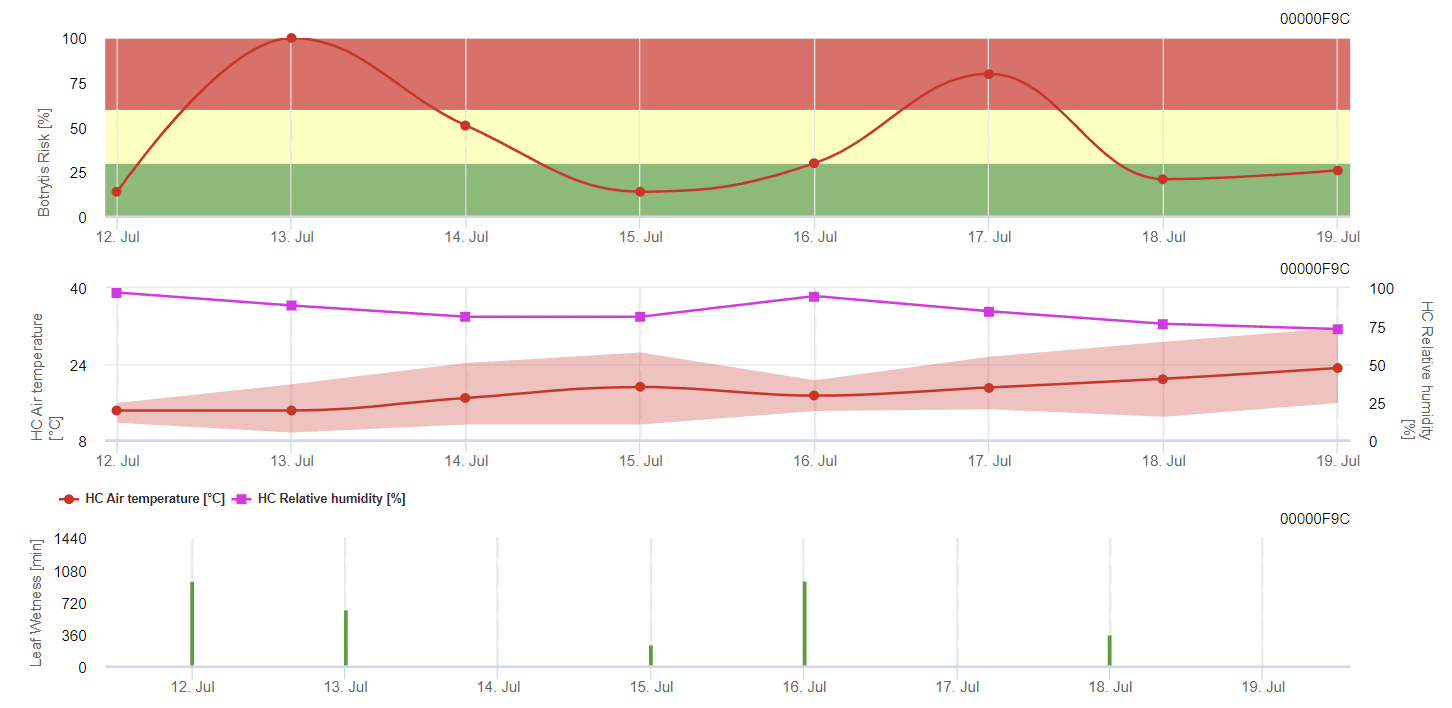
Benötigte Sensoren:
- Lufttemperatur
- Relative Luftfeuchtigkeit
- Blattnässe
B. cinerea ist mit feuchtem Klima verbunden. Der Pilz benötigt für eine Infektion eine hohe relative Luftfeuchtigkeit oder das Vorhandensein von freiem Wasser. Warme Perioden mit längerer Blattnässe führen zu einem erhöhten B. cinerea-Risiko, während trockene Perioden dieses Risiko verringern. Die Infektion erfolgt an jungen Trieben während langer feuchter Perioden oder bei schädlichen Hagelstürmen.
Das Modell berechnet das Risiko mit einem Wert von 0 bis 100%. Dieser Wert gibt den Druck von B. cinerea zu diesem Zeitpunkt - wenn wir einen Wert von 100% haben, bedeutet dies, dass es mehrmals eine Nässeperiode gab, die lang genug war, um das anfällige Gewebe zu infizieren. Wir berechnen so genannte "nasse Punkte" zwischen Blattnässe und Temperatur mit einem Maximum von zunächst 38400 Punkten (Beginn der Saison, die ein Risiko von 30% aufweist). Danach erhöht jede nasse Periode mit etwa 4000 nassen Punkten das Risiko um 10%, oder umgekehrt reduziert jede trockene Periode das Risiko um ⅕ des vorherigen Wertes.
Literatur
- Broome, J. C., English, J. T., Marois, J. J., Latorre, B. A., & Aviles, J. C. (1995). Entwicklung eines Infektionsmodells für die Botrytis-Traubenfäule auf der Grundlage von Feuchtigkeitsdauer und Temperatur. Phytopathologie, 85(1), 97-102.
- Elmer, P. A., & Michailides, T. J. (2007). Epidemiologie von Botrytis cinerea in Obst- und Weinbaukulturen. In Botrytis: Biologie, Pathologie und Bekämpfung (S. 243-272). Dordrecht: Springer Niederlande.
- Williamson, B., Tudzynski, B., Tudzynski, P., & Van Kan, J. A. (2007). Botrytis cinerea: die Ursache der Grauschimmelkrankheit. Molekulare Pflanzenpathologie, 8(5), 561-580.
- Ciliberti, N., Fermaud, M., Roudet, J., & Rossi, V. (2015). Environmental conditions affect Botrytis cinerea infection of mature grape berries more than the strain or transposon genotype. Phytopathology, 105(8), 1090-1096.
Anthraknose
Krankheitserreger
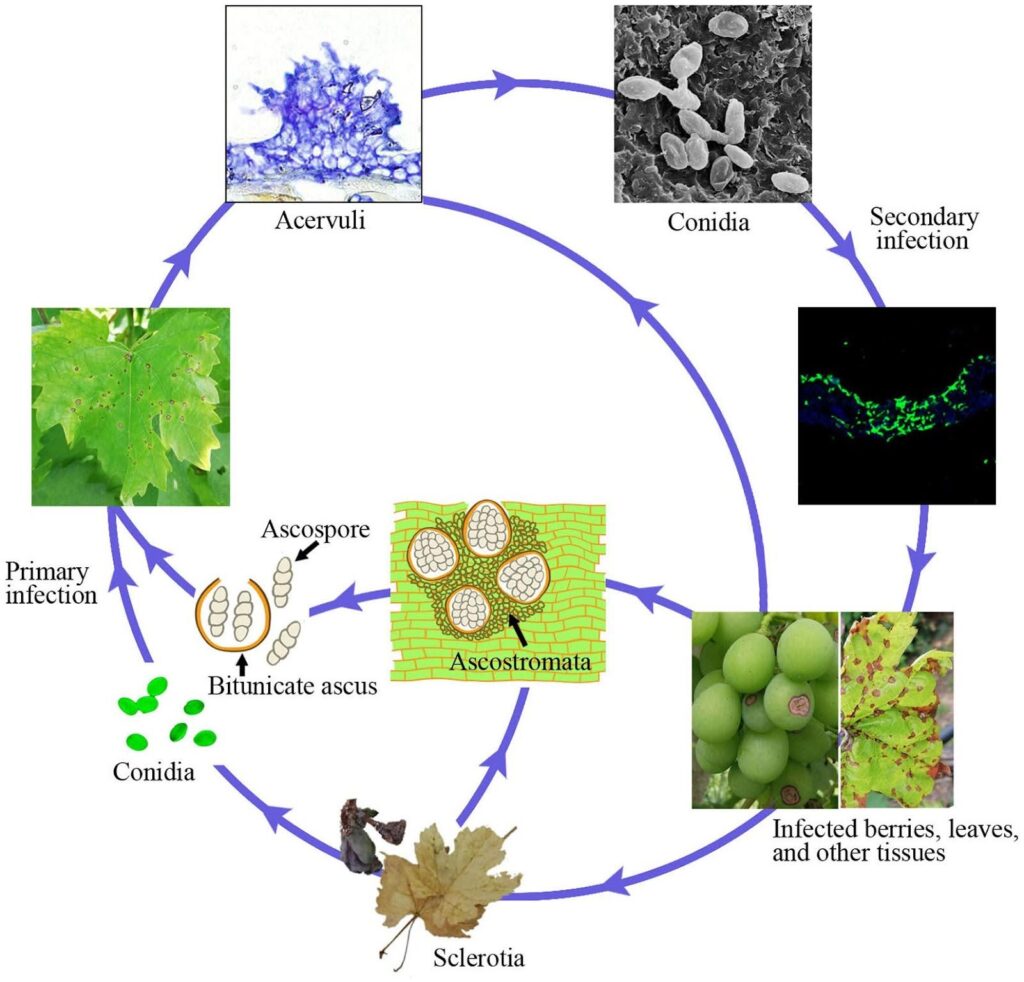
Die Anthraknose bei Weinreben wird durch den Erreger Elsinoe ampelina.
Befallene Stöcke sind die Hauptquelle der Krankheit. Sklerotien und Myzelien, die im Winter in den Läsionen und Beeren überleben, werden im Frühjahr aktiv und produzieren Ascosporen (sexuelle Sporen) und Konidien (ungeschlechtliche Sporen) unter feuchten Bedingungen (Regen oder Tau für 24 Stunden) in einem Temperaturbereich von 2 bis 40 °C.
Diese Sporen werden durch Regenspritzer und Wind auf neue Gewebe verteilt. Sobald sie dort gelandet sind, keimen sie und bilden Keimschläuche und Appressorien, die eine neue Infektion auslösen. Sie können neue Blätter, Triebe, Ranken und junge Beeren infizieren. Warmes Wetter verkürzt die für die Erstinfektion und die Inkubationszeit erforderliche Feuchtigkeitsdauer. Die optimale Sporenkeimung findet bei 25-30 °C statt, wobei mindestens 3 bis 4 Stunden Blattnässe erforderlich sind. Bei Infektionen bei Temperaturen um 10 °C beträgt die Inkubationszeit etwa 14 Tage.
Mit fortschreitender Besiedlung entstehen Acervuli und neue Konidien, die als Sekundärinfektionsinokulum dienen. Sie sind für eine schnelle und weitere Infektion während der Saison verantwortlich.
Symptome
E. ampelina befällt die oberirdischen, saftigen Teile der Rebe, einschließlich Triebe, Blätter, Blattstiele, Ranken, Rachis und Beeren; am häufigsten sind Läsionen an Trieben und Beeren. Trauben haben eine ontogenetische Resistenz gegen den Pilz, so dass junge Gewebe anfälliger sind.
Zunächst treten kleine rotbraune Flecken auf, die sich bei nassem Wetter vergrößern und leicht eingesunken sind, mit einem grauen Zentrum, das von einem dunklen Rand umgeben ist. Manchmal können die Symptome wie Hagelschäden aussehen. Das nekrotische Zentrum auf den Blättern fällt in der Regel heraus, wodurch ein "Einschussloch" entsteht.
Bei schwerem Befall können die Pflanzen frühzeitig entlaubt werden, das Wachstum der Ruten verkümmern, Stängel brechen, Beeren fallen und die Entwicklung und Reifung der Beeren verzögern.
FieldClimate Modell
Weinbau Anthraknose-Modell
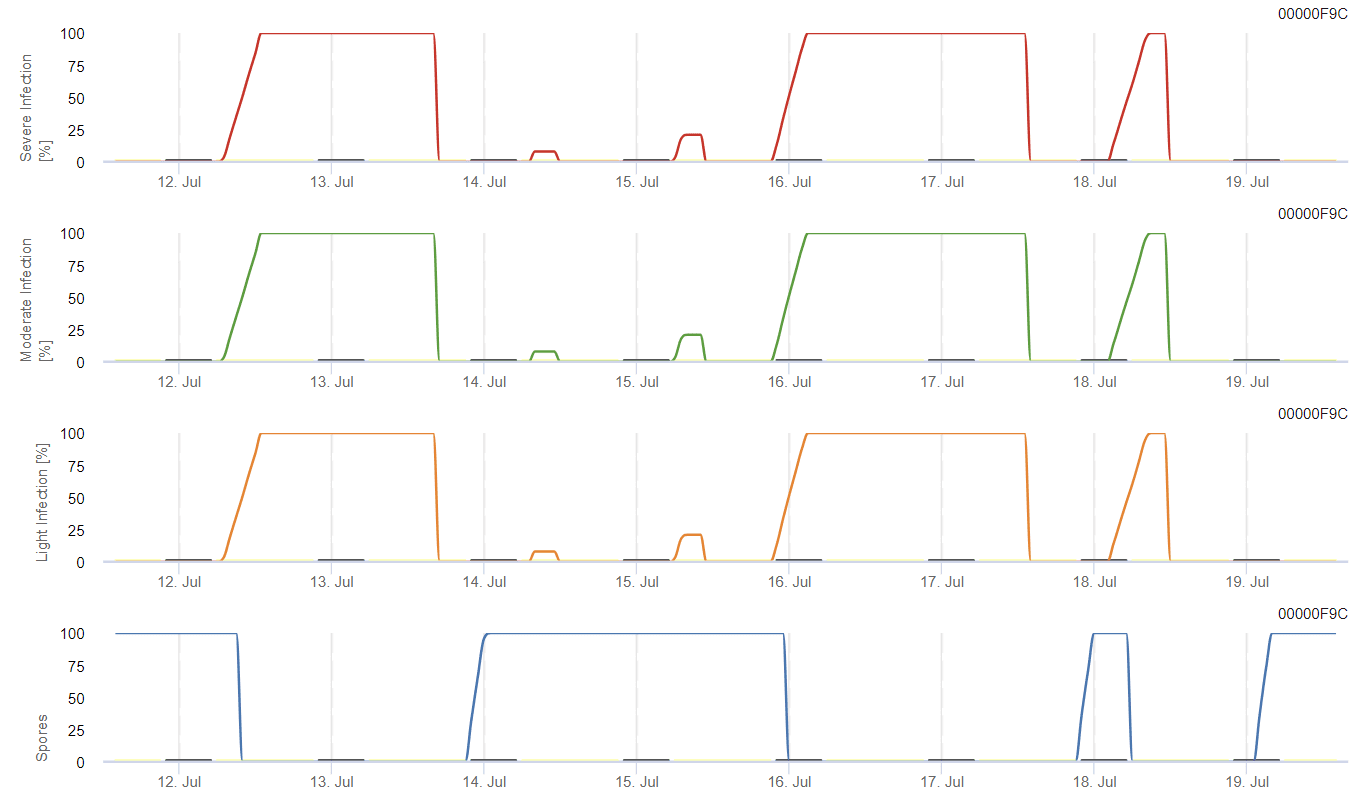
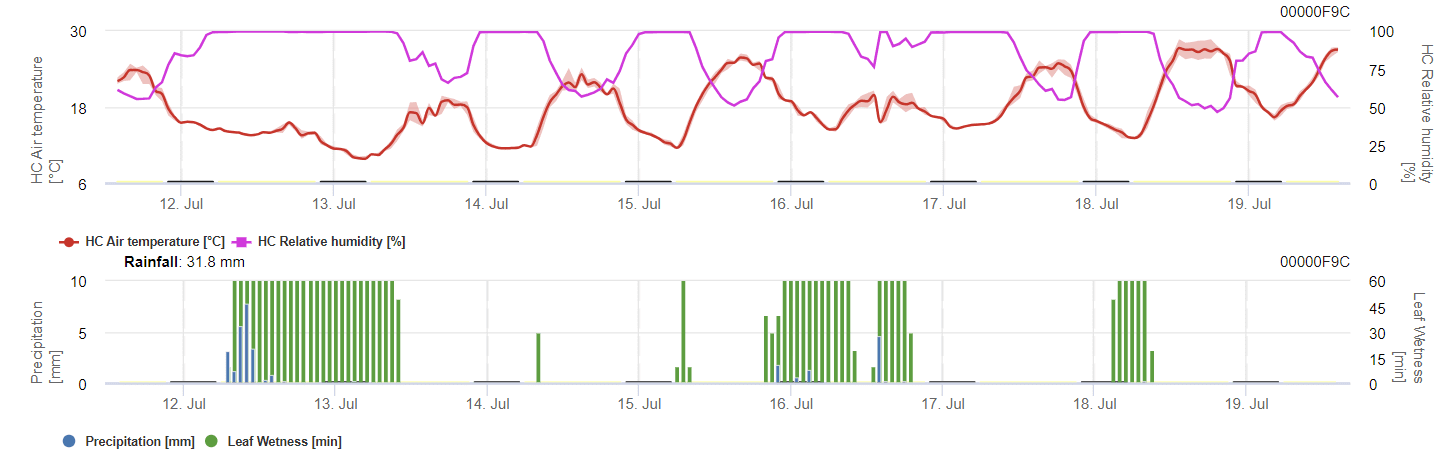
Benötigte Sensoren:
- Lufttemperatur
- Relative Luftfeuchtigkeit
- Blattnässe
- Niederschlag
Das Modell berechnet das Anthraknoserisiko unter Berücksichtigung von Lufttemperatur, relativer Luftfeuchtigkeit, Blattnässe und Niederschlag.
Die mögliche Entwicklung einer schwachen, mäßigen und schweren Infektion wird in separaten Diagrammen dargestellt. Eine Infektion gilt als abgeschlossen, wenn die ansteigende Kurve 100% erreicht. Das letzte Diagramm zeigt die Sporulation von E. ampelinaWenn der Wert dort 100% erreicht, wird angenommen, dass Sporen von E. ampelina vorhanden sind.
Damit sich die überwinternden Sporen entwickeln können, müssen die Bedingungen einen Temperaturbereich von 2 bis 40 °C, eine relative Luftfeuchtigkeit von über 90% oder Blattnässe aufweisen. Sobald die Sporenentwicklung 100% erreicht, beginnt die Infektion zu berechnen. Der Schweregrad der Infektion hängt von den feuchten Bedingungen (Regenereignisse) ab. Fällt die Luftfeuchtigkeit jedoch unter 50%, werden sowohl die Sporenentwicklung als auch die Infektion nicht mehr berechnet.
Literatur
- Li, Z., Dos Santos, R. F., Gao, L., Chang, P., & Wang, X. (2021). Aktueller Stand und Zukunftsaussichten der durch Elsinoe ampelina verursachten Anthraknose der Weinrebe: Eine wichtige Krankheit in feuchten Weinbauregionen. Molekulare Pflanzenpathologie, 22(8), 899-910
PHOMOPSIS ROHR- UND BLATTFLECKENKRANKHEIT
Krankheitserreger
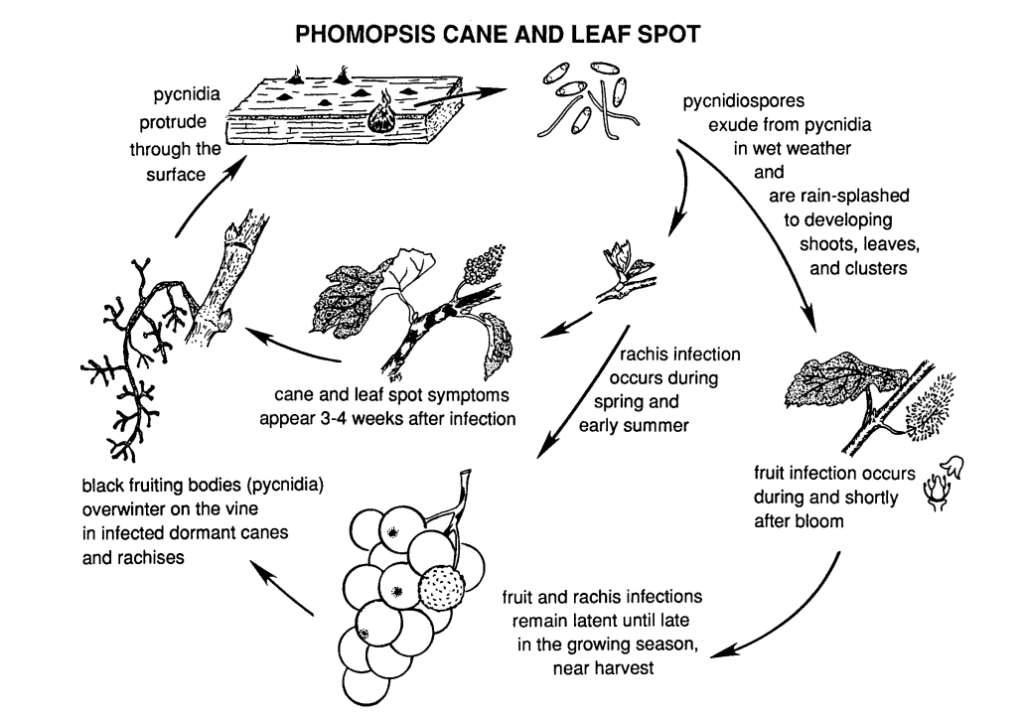
Die Phomopsis Stock- und Blattfleckenkrankheit bei Weinreben wird verursacht durch Phomopsis viticola.
Der Pilz überwintert in den holzigen Teilen der Rebe und wird im folgenden Frühjahr wieder aktiv. Sobald die Temperaturen steigen und der Frühlingsregen einsetzt, werden die Sporen aus den Überwinterungsstrukturen, den Pyknidien, freigesetzt. Da die Sporen durch Regen und Wind auf neues Gewebe verteilt werden, breitet sich die Infektion aus.
Die Hauptinfektionszeit fällt in der Regel mit den ersten Regenfällen im Frühjahr zusammen und beginnt kurz nach dem Knospenaufbruch, wenn die Triebe ein frühes Wachstumsstadium aufweisen. Junge Triebe, Triebspitzen, Fruchtstände und die Rachis sind alle anfällig für Infektionen. Obwohl Triebspitzen während der gesamten Vegetationsperiode infiziert werden können, sind Infektionen vom Knospenbruch bis zur Blüte am häufigsten. In den Früchten kann der Erreger bis zur Reifung der Früchte inaktiv bleiben. Die Inkubationszeit dauert in der Regel etwa 3 bis 4 Wochen.
Symptome
Auf Blättern und Blattstielen bilden sich kleine dunkle Flecken mit schwarzen Zentren, die von gelben Rändern umgeben sind und sich schließlich zusammenschließen. Die grundständigen Blätter können sich verformen und zerknittern und entwickeln sich möglicherweise nicht zur vollen Größe. Wenn die Blattstiele stark befallen sind, vergilben sie und fallen ab, was zum Blattfall führt. Die Blätter bilden einen Schirmeffekt, der weitere Infektionen durch Sporen verhindert.
Ähnliche Flecken erscheinen an den Trieben, wodurch die Epidermisschichten an den Infektionsstellen aufbrechen. Wenn die Flecken zusammenwachsen, entwickeln die infizierten Triebbereiche eine schorfige Textur. In schweren Fällen können die Triebe verkümmern, brechen oder sogar absterben.
Läsionen an der Rachis führen dazu, dass sie eingesunken und brüchig wird. Nach einer Ruhephase im Sommer reaktiviert sich der Pilz im Frühherbst und führt zu Beeren- und Traubenfäule. Obwohl der Befall der Früchte im Allgemeinen nicht sehr stark ist, bilden sich auf den Beeren Flecken, oft begleitet von schwarzen Flecken (Pyknidien) auf der Beerenhaut. Unter feuchten Bedingungen können gelbe Sporenmassen aus den Pyknidien sickern, was zu einer Verfärbung der Früchte, einer rauen Textur und Mumifizierung führt.
Befallenes Holz zeigt in der Ruhezeit ein gebleichtes Aussehen. Stark befallene Stöcke und Ausläufer zeigen dunkle Verfärbungen, gemischt mit gebleichten Stellen in der Rinde. Pycinidien können auch die Oberfläche durchbrechen. Niedrige Temperaturen sowie eine Beeinträchtigung der Phloem- und Xylemfunktion schwächen die Stöcke, Ausläufer und Knospen und lassen sie absterben.
FieldClimate Modell
Weinbau Phomopsis-Infektionsmodell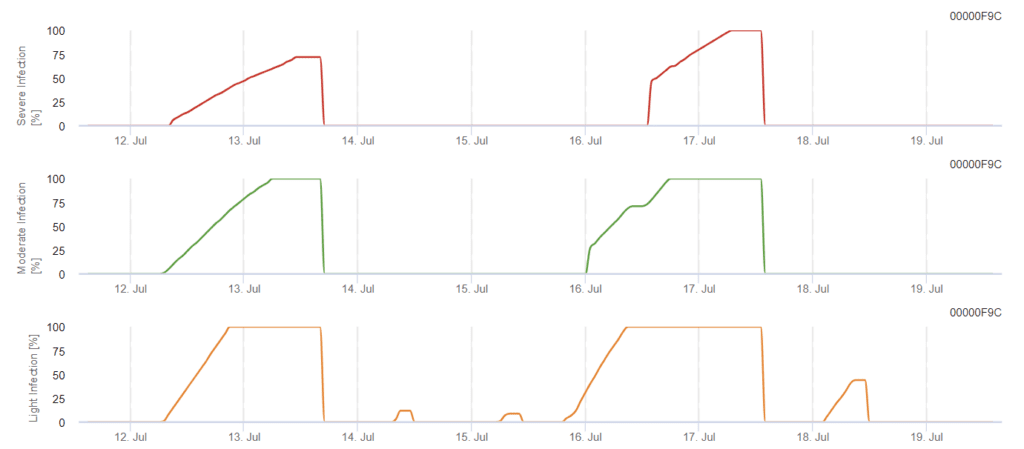
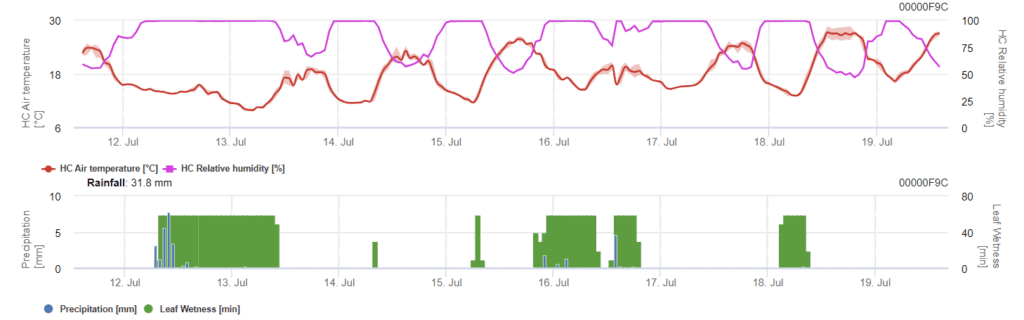
Benötigte Sensoren:
- Lufttemperatur
- Relative Luftfeuchtigkeit
- Blattnässe
- Niederschlag
Das Modell ermittelt das Risiko einer Phomopsis-Infektion im Temperaturbereich von 5 bis 35 °C und unter feuchten Bedingungen (Blattnässe, hohe relative Luftfeuchtigkeit). Die Schwere der Infektion hängt von der Regenmenge (mehr als 2 mm) ab, da die Sporen schneller auf gesundes Pflanzenmaterial verteilt werden. Wenn eine Infektion mit 100% angezeigt wird, deutet dies darauf hin, dass im Feld optimale Bedingungen für die Infektion von Pflanzengewebe gemessen wurden, so dass Pflanzenschutzmaßnahmen berücksichtigt werden sollten.
Literatur
- https://agriculture.vic.gov.au/biosecurity/plant-diseases/grapevine-diseases/phomopsis-cane-and-leaf-spot-of-grapevines
- Bettiga, L. J. (Hrsg.). (2013). Traubenschädlingsbekämpfung (Bd. 3343). UCANR Publications.
- Pscheidt, J. W., & Pearson, R. C. (1991). Phomopsis cane & leaf spot.
Empfohlene Ausrüstung
Prüfen Sie, welcher Sensorensatz für die Überwachung potenzieller Krankheiten dieser Kultur benötigt wird.
