Betterave sucrière modèles de maladies
Au dix-neuvième siècle, les agriculteurs avaient déjà appris que le rendement de la betterave sucrière diminuait régulièrement lorsque les cultures de betteraves étaient répétées dans des rotations étroites. En 1859, Schacht a démontré que ces dommages étaient causés par les nématodes à kystes de la betterave, Heterodera schachtiiun parasite qui a été un facteur limitant de la production de betteraves jusqu'à aujourd'hui. Il existe d'autres nématodes qui causent des dommages considérables à la betterave sucrière mais H. schachtii est le plus important. Les insectes Atomaria linearis (coléoptère pygmée), Agriotes obscures (ver à fil), Tipula paludosa (jaquette en cuir), Chaetocnema tibialis (fleabeetle) et Onychiurus armatus (queue de printemps) provoquent la mort des semis. Les dégâts de succion sur les feuilles des semis sont causés par Calocoris norvegicus (punaise de la pomme de terre) et Piesma quadrata (punaise du colza). Pegomyia betae (mouche de la betterave) est un insecte qui exploite les feuilles.
Les virus importants sont le Beet necrotic yellow vein virus (virus de la veine jaune de la betterave), qui provoque la maladie Rhizomaniequi est véhiculé par le champignon Polymyxa betaeet le virus de la jaunisse douce de la betterave dont le vecteur est le puceron Myzus persicae. Les principales maladies fongiques du sol de la betterave sucrière sont les suivantes Rhizoctonia solani, Aphanomyces cochlioides, Fusarium spp.et Verticillium dahliae. En surface, les feuilles de la betterave sucrière sont attaquées par Erysiphe betae (mildiou), Uromyces betae (rouille), et les agents pathogènes de la tache foliaire Ramularia beticola et Cercospora beticola.
Cercospora leaf spot
Dommages et prévalence des Cercospora beticola
Dans les épidémies graves, le CLS provoque une destruction progressive des feuilles, suivie d'un remplacement continu des nouvelles feuilles au détriment des réserves stockées dans la racine, ce qui entraîne une réduction du rendement et de la teneur en sucre. Aux Pays-Bas, des réductions de rendement allant jusqu'à 21% pour le rendement en sucre (teneur en sucre x rendement des racines) et 23% pour le rendement financier ont été observées (cette thèse), mais pour des champs de betteraves individuels, des réductions de rendement en sucre allant jusqu'à 40% ont été observées. Cela se traduit non seulement par une baisse de revenu pour les agriculteurs, mais aussi pour l'industrie sucrière, car l'extractibilité du sucre est moindre en cas d'infection par le CLS. Le pourcentage de champs de betteraves aux Pays-Bas dans lesquels une infestation par le CLS a été observée est passé de 13% en 2000 à 32% en 2002. Par conséquent, le pourcentage de champs de betteraves dans lesquels une pulvérisation de fongicide contre le CLS a été effectuée a augmenté. C. beticola a augmenté de 9% en 2000 à 23% en 2002.
Le champignon Cercospora beticola
Cercospora beticola Sacc.Le Cercospora, agent causal de la tache foliaire du Cercospora (CLS) sur la betterave sucrière, est la maladie foliaire la plus courante et la plus destructrice de la betterave sucrière dans le monde entier. Le champignon appartient à la classe des Fungi Imperfecti (Deuteromycetes), à l'ordre des Moniliales, à la famille des Dematiaceae, à la section des Phaeophragmosporae. Les hyphes sont hyalines à brun olivâtre pâle, intercellulaires, septés, de 2 à 4 μm de diamètre, et forment des pseudostromates dans les cavités sous-matales de l'hôte, à partir desquels les conidiophores sont portés en grappes. Les conidiophores, qui émergent uniquement des stomates de l'hôte, mesurent 10-100 (le plus souvent 46-60) μm x 3-5,5 μm et ne sont pas ramifiés, avec de petites cicatrices conidiennes visibles au niveau des génicules et de l'apex. Les conidies, 20-200 x 2,5-4 μm (le plus souvent 36-107 x 2-3 μm), sont à parois lisses, droites à légèrement incurvées, hyalines, aciculaires et progressivement atténuées à partir de la base tronquée, avec 3-14 (parfois jusqu'à 24) septa. Aucun stade téléomorphe de C. beticola est connue à l'heure actuelle.
Épidémiologie et cycle de vie de la tache foliaire de Cercospora sur la betterave sucrière
Les symptômes de la tache foliaire du Cercospora (CLS) consistent en des taches circulaires délimitées qui se développent sur les feuilles plus âgées et s'élargissent pour atteindre 2 à 5 mm à maturité. Les lésions sont de couleur fauve à brun clair foncé avec des marges brunes ou rouge-violet. Des lésions allongées apparaissent sur les pétioles, et des lésions circulaires peuvent apparaître sur les hypocotyles de betterave sucrière non recouverts par le sol. Les taches individuelles sur les feuilles fusionnent au fur et à mesure que la maladie progresse, et de grandes zones ou des feuilles deviennent brunes et nécrotiques. De minuscules points noirs, les pseudostromates, sont souvent visibles au centre des lésions matures. En conditions humides, des conidiophores se forment sur les pseudostromates, et les taches foliaires deviennent grises et veloutées avec la production de conidies. Les feuilles atteintes finissent par s'effondrer et tomber au sol, mais restent attachées à la couronne. Les jeunes feuilles du cœur sont généralement malades plus tard que les feuilles plus âgées. Toutes les parties aériennes des plantes à graines, y compris les grappes de graines, peuvent être affectées.
Cercospora beticola est inactif à des températures inférieures à 10°C, et peut infecter entre 12 et 37°C. Les températures optimales pour la production de conidies se situent entre 20 et 26°C si l'humidité relative est comprise entre 98 et 100% ou à 25°C. On peut s'attendre à de graves épidémies lorsque l'humidité relative reste supérieure à 96% pendant 10 à 12 heures chaque jour pendant 3 à 5 jours et que la température reste supérieure à 10°C. Malgré ces températures plutôt élevées, de graves épidémies de taches foliaires à Cercospora peuvent se développer aux Pays-Bas. Les conidies sont libérées par la pluie et la rosée (Meredith, 1967) et sont disséminées principalement par les éclaboussures de pluie, et moins efficacement par le vent, l'eau d'irrigation, les insectes et les acariens.
BeetCast
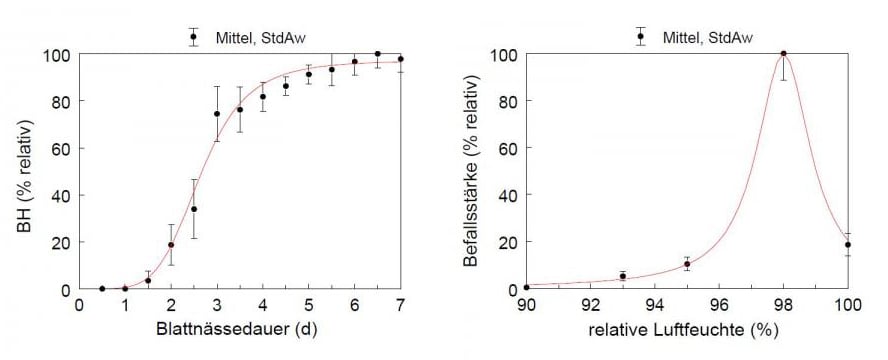
Si nous appliquons BeetCast, nous pouvons le faire sur la base de l'impact élevé de l'humidité relative et de l'humidité des feuilles sur les épidémies de C. beticolaC'est ce qu'ont constaté Wolf P.F.J. et al (2001). Les résultats de cette équipe de chercheurs sont présentés dans les deux graphiques à droite de cet article.
Modèle d'évaluation de la gravité de la maladie :
Ce modèle est calculé à la fin d'une journée, à 23h30. Le modèle calcule et compare les valeurs de gravité de la maladie selon les tableaux ci-dessous.

Règles de prédiction BeetCast :
Pour établir les règles d'application des fongicides, Beetcast est combiné avec les résultats du modèle CercoPRI. Il peut s'agir du pronostic de la première pulvérisation par le modèle de risque Pessl Instruments ou par le modèle DIV à utiliser de la même manière.
- Lorsque le CercoPRI atteint le seuil avant le 01.06., appliquer le premier fongicide lorsque 55 unités DSV sont accumulées, répéter la pulvérisation lorsque 35 unités DSV sont à nouveau atteintes.
- CercoPRI atteint le seuil avant le 01.07. appliquer le premier fongicide lorsque 70 unités DSV sont accumulées répéter la pulvérisation lorsque 55 unités DSV sont de nouveau atteintes
- CercoPRI atteint le seuil après le 01.07. Appliquer le premier fongicide lorsque 80 unités DSV sont accumulées, répéter la pulvérisation lorsque 55 unités DSV sont de nouveau atteintes.
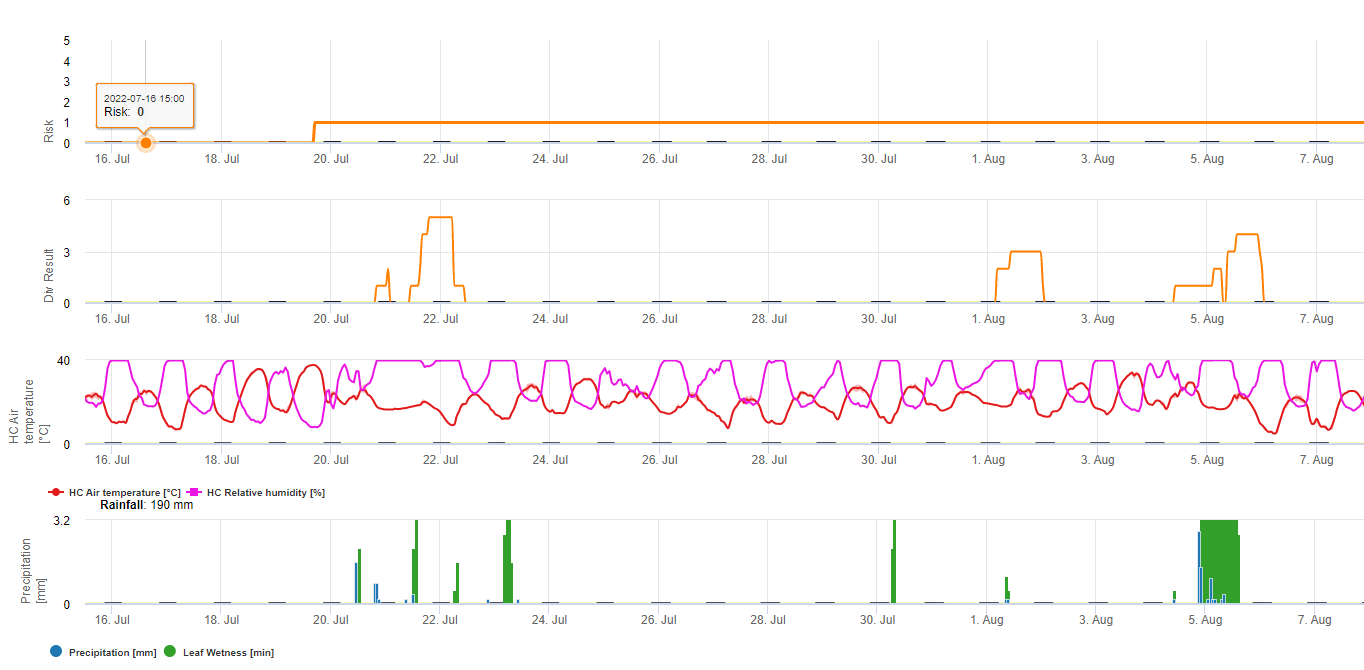
Instruments Pessl C. beticola Modèle de risque
Bleiholder et Wetzien 1972 où l'on a étudié en profondeur la reproduction de l'ADN. C. beticola. Ils ont constaté que le pathogène était bien adapté au climat chaud. La période de latence et la sporulation dépendaient strictement de la température et l'optimum de température était assez élevé. Les résultats de Wolf, P.F.J. et all (2001) sont très similaires à ceux de Bleiholder et Weltzien (1972). A des températures inférieures à 14°C, la période d'incubation dépasse les 14 jours. Si la température est inférieure à 10°C, il y a très peu de progrès dans le développement fongique et à 5°C, aucun développement fongique n'est visible.
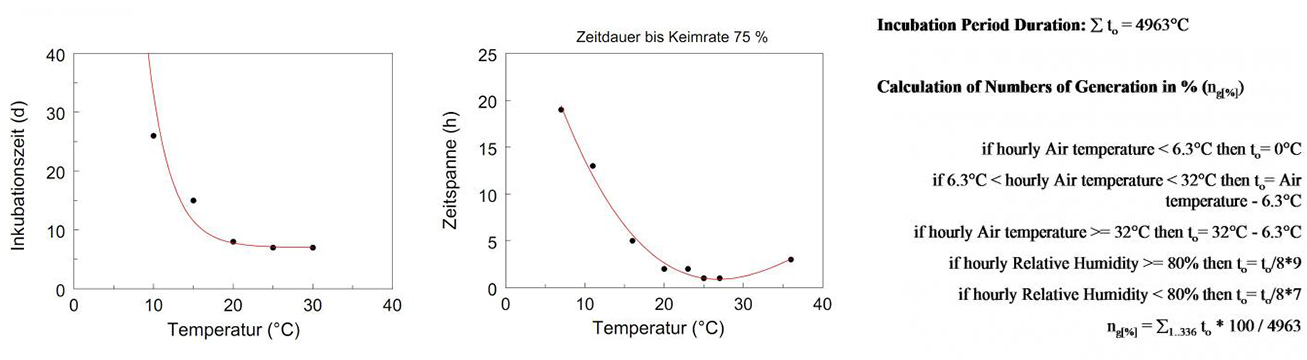
Cela explique l'apparition tardive du pathogène dans les champs de betteraves sucrières sous climat frais. Si l'on consulte les publications du siècle dernier, on constate que, même dans les régions plus fraîches, l'agent pathogène n'est pas présent dans les champs de betteraves sucrières. C. beticola jusqu'à la fin du mois de juin. Retour aux années soixante-dix et quatre-vingt du siècle dernier C. beticola a été trouvé dans ces lieux au cours du mois de juillet et les premières pulvérisations ont dû être appliquées à la fin du mois de juillet et au début du mois d'août.
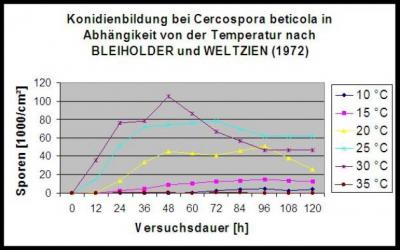
Bleiholder et Weltzien ont également étudié l'impact de la température sur la formation des conidies. Ils ont trouvé très peu de formation de conidies en dessous de 15°C mais un optimum à 25°C et 30°C. Wolf et al (2001) ont étudié la germination et ont trouvé des températures optimales supérieures à 22°C.
Le modèle de risque simple utilise ces résultats pour évaluer si l'on peut s'attendre à ce que l'on soit en mesure de faire face à des situations d'urgence. C. beticola du tout. Pour cela, il faut d'abord vérifier si la période d'incubation a pu être remplie au cours des deux dernières semaines. Si oui, nous obtenons 100% d'incubation, sinon le pourcentage d'incubation au cours des deux dernières semaines sera inférieur à 100%. Outre le modèle d'incubation, le modèle de risque utilise un modèle de sporulation. Les conditions optimales de 48 heures d'humidité relative élevée avec une température moyenne de 30°C sont utilisées comme 100% de sporulation.
Le risque est de 0 si la période d'incubation est supérieure à 2 semaines. Dans le cas contraire, le résultat du modèle sera de 1. Si le résultat du modèle de sporulation calculé au cours de la dernière semaine est supérieur à 10%, le risque sera de 2 et si le résultat de la sporulation est supérieur à 30%, le risque sera de 3. Si nous cherchons le résultat du modèle, ici pour l'année 2010 pour un iMETOS situé en Styrie en Autriche, nous pouvons trouver le modèle de risque affiché avec le modèle DIV. Les deux modèles indiquent le premier risque raisonnable et les premières valeurs DIV cumulées à 6 sur deux jours consécutifs à la mi-juin. Cela indiquerait la première pulvérisation pour les variétés sensibles sur ce site. Les variétés modérément sensibles pourraient être pulvérisées un peu plus tard, au mieux au début de la période suivante avec des valeurs de risque et de DIV élevées.
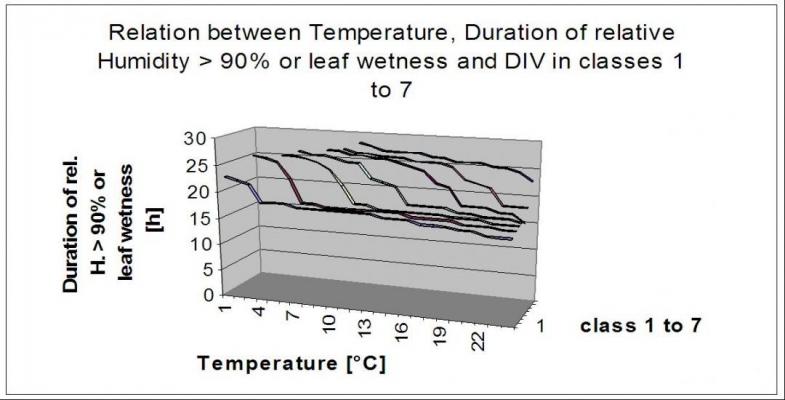
Modèle DIV suivant Shane et Teng
Wolf P.F.J. et al (2001) ont cherché à déterminer l'influence de l'humidité sur l'épidémiologie de la maladie d'Alzheimer. C. beticola de nouveau. Leurs conclusions sont très similaires à celles d'autres chercheurs. Shane et Teng (1985) ont formulé leur modèle Cercopsora sur la base des besoins en humidité de la maladie. Le modèle DIV recherche les heures où l'humidité relative est supérieure à 85% ou où les feuilles sont humides. Sur la base du nombre d'heures et de la température moyenne pendant cette période, il indique une DIV (valeur d'infection journalière) pour ce jour. En fonction de la sensibilité de la variété, une valeur DIV accumulée sur deux jours consécutifs de 6 ou plus indiquera la nécessité d'une première pulvérisation. Si nous avons des variétés plus résistantes, nous pouvons attendre des valeurs DIV cumulées plus élevées sur des jours consécutifs. Dans notre exemple ci-dessous, nous pulvériserons les variétés sensibles à la mi-juin et les variétés plus résistantes à la mi-juillet.
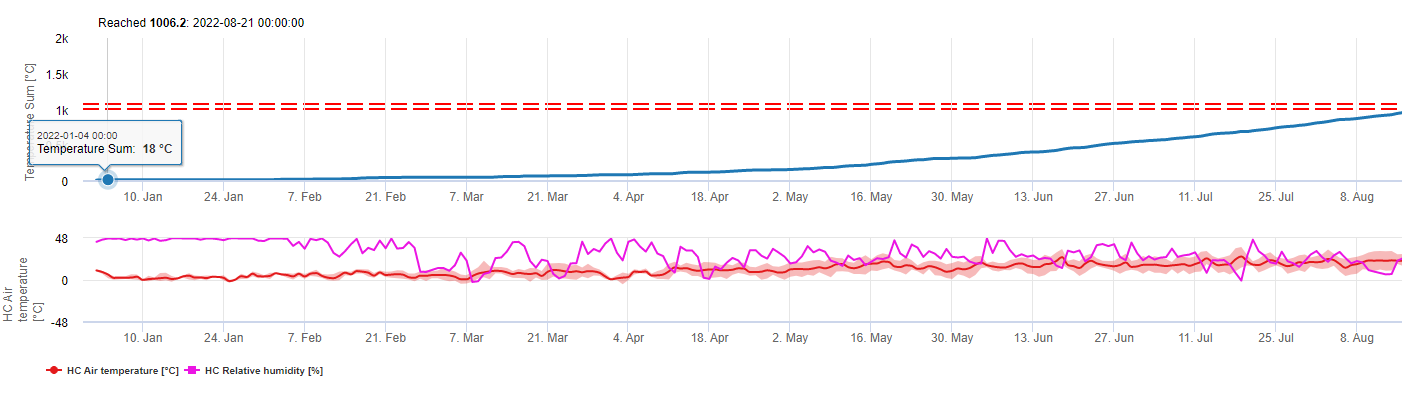
CercoPrim
Ce modèle permet d'estimer la date de la première apparition de la C. beticola sur la base des températures moyennes journalières cumulées depuis le premier janvier supérieures à 5°C. Il prend le seuil de 1006,2°C dans les périodes où l'humidité relative est supérieure à 60% et si nous n'avons pas d'humidité relative, le seuil de 1081,9°C est valable.
Ce modèle a été développé pour l'Italie et est utilisé en Italie et en Allemagne.
Pour l'année 2010 en Styrie, CercoPrim indique le 19 juin pour la première pulvérisation. C'est à peu près la même date que le modèle de risque Pessl Instruments ou le modèle DIV aurait indiqué pour arroser les variétés sensibles.
Utilisation pratique de la C. beticola modèles
Les trois modèles indiquent des périodes de risque pour les Cercospora beticola. Le modèle vérifiant si la période d'incubation de Cercospora beticola La vérification des possibilités de sporulation et le modèle de risque utilisant la période d'incubation et les possibilités de sporulation seront utiles au printemps et au début de l'été pour indiquer une apparition précoce de cette maladie, comme cela s'est produit dans de nombreuses régions d'Europe au cours de la saison 2000. La vérification des possibilités de sporulation et le modèle de risque utilisant la période d'incubation et les possibilités de sporulation indiqueront les périodes de forte pression de la maladie pendant la saison en cours, comme le modèle d'infection DIV de l'Université du Minnesota à Crookston. Le modèle DIV indique une pulvérisation lorsque nous avons eu 2 jours consécutifs avec des valeurs DIV de 6 ou plus. En combinant le modèle DIV avec les résultats du modèle CercoPrim, on obtient une indication du moment où l'on a appliqué la première pulvérisation et du moment où l'on doit répéter la pulvérisation.
Équipement recommandé
Vérifiez quel jeu de capteurs est nécessaire pour surveiller les maladies potentielles de cette culture.