
Fresa modelos de enfermedad
Antracnosis
Patógeno
Antracnosis en fresas, causada por Colletotrichum acutatumse manifiesta en forma de lesiones negras y hundidas en tallos, estolones y frutos. Esta enfermedad fúngica afecta a todas las partes de la planta, incluidas la corona, las raíces, los pecíolos y los estolones.
La enfermedad puede desarrollarse rápidamente en condiciones favorables, con hasta 90% de la fruta potencialmente infectada en una semana o menos. Tanto la fruta inmadura como la madura son susceptibles a la infección, pero la enfermedad es más prevalente en la fruta madura o completamente madura. Las plantas infectadas o los restos vegetales pueden servir como fuentes de inóculo invernal. En primavera, la lluvia y el viento producen y dispersan esporas a distancias relativamente cortas.
El patógeno entra en la planta a través de un apresorio, que penetra en la cutícula e invade las células epidérmicas. Inicialmente, C. acutatum existe en una fase biotrófica y pasa a una fase necrótrofa, en la que el hongo prolifera dentro de las células muertas. A medida que avanza la enfermedad, el hongo forma estructuras de acérvulos bajo las paredes celulares epidérmicas. Estos acérvulos maduran y liberan conidios, que propagan la enfermedad con mayor rapidez, especialmente bajo las salpicaduras de la lluvia. Las conidias secundarias también constituyen una importante fuente de inóculo.
Síntomas
Los síntomas aparecen primero como un marchitamiento de las hojas más jóvenes, que pueden recuperarse temporalmente pero pronto mueren. Aparecen manchas negras irregulares en las hojas, sobre todo en la punta de los foliolos.
El tejido de la corona muestra entonces una decoloración rojiza que acaba volviéndose marrón oscuro o negro a medida que la planta se deteriora. Las coronas infectadas suelen estar parcialmente dañadas, lo que provoca un retraso del crecimiento pero no la muerte completa de la planta. Normalmente, sólo se infecta un lado de la corona, en lugar de toda ella.
Se forman lesiones oscuras y alargadas en los pecíolos y tallos. Los pecíolos y tallos afectados pueden quedar ceñidos por las lesiones, lo que provoca que las hojas o plantas hijas enteras se marchiten y mueran.
Los frutos pueden infectarse en cualquier fase de desarrollo, endureciéndose y volviéndose marrones. En los frutos maduros se desarrollan lesiones oscuras y hundidas que provocan la momificación en lugar de la maduración. Los frutos también pueden aparecer cubiertos de masas de conidios de color rosa o salmón.
Modelo FieldClimate
Modelo general de antracnosis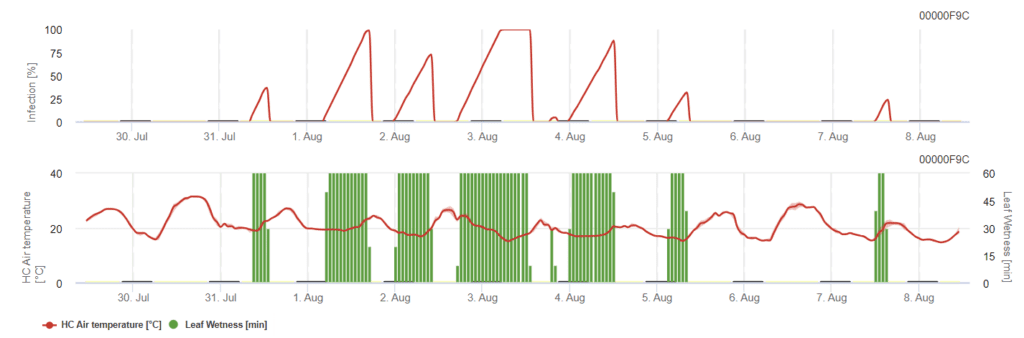
Sensores necesarios:
- Temperatura del aire
- Humedad de las hojas
C. acutatum Infecta a las plantas a temperaturas comprendidas entre 15°C y 30°C, pero se necesita un periodo de humectación de las hojas de larga duración. A temperaturas óptimas de 20°C a 25°C, es necesario un periodo de humectación foliar de 12 horas. Cuando el gráfico de infección alcanza 100%, se dan las condiciones óptimas en el campo para una infección.
Literatura
- Aljawasim, B. D., Samtani, J. B., & Rahman, M. (2023). New Insights in the detection and management of anthracnose diseases in strawberries. Plants, 12(21), 3704.
- Ellis, M. A., & Erincik, O. (2008). Antracnosis de la fresa. Extensión de la Universidad Estatal de Ohio.
- Smith, B. J. (2008). Epidemiología y patología de la antracnosis de la fresa: una perspectiva norteamericana. HortScience, 43(1), 69-73.
Oidio
Patógeno
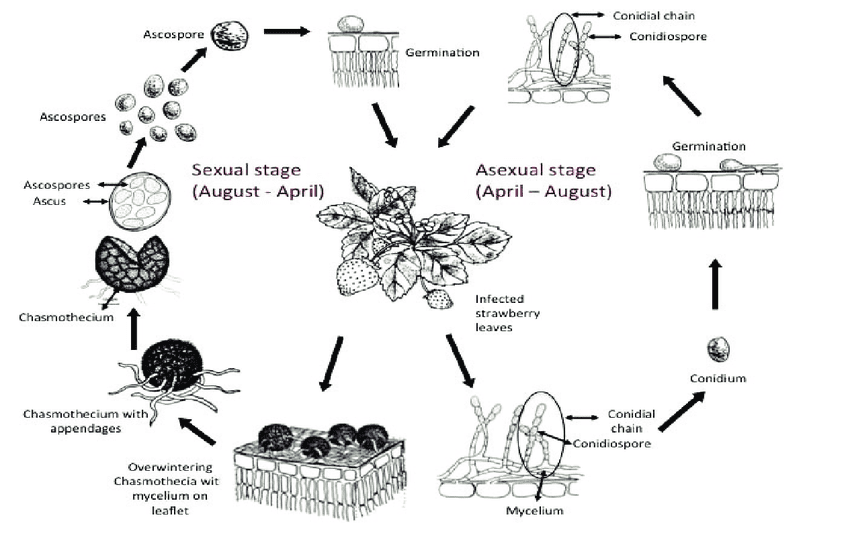
El agente patógeno del oídio en las fresas es Podosphaera aphanis. Pasa el invierno en dos formas: micelio y cleistotecios.
El micelio invernante se activa en primavera, produciendo conidióforos que liberan conidios (esporas reproductoras asexuales) cuando maduran. Los conidios se posan en un tejido nuevo, germinan y forman apresorios, estructuras de infección especializadas que penetran en las células vegetales. El proceso da lugar a la formación de nuevas colonias.
Cleistothecia libera ascosporas (esporas reproductoras sexuales) de marzo a mayo. Las ascosporas también se posan en nuevos tejidos, germinan y forman nuevas colonias.
Tanto el micelio como las conidias sirven como inóculo primario. Las infecciones secundarias se producen principalmente a través de conidios, que se dispersan por el viento y se propagan rápidamente.
Cuando las condiciones ambientales se vuelven menos favorables, el hongo pasa a la reproducción sexual -formación de cleistotecios- y el ciclo se repite a medida que los inóculos pasan el invierno.
Síntomas
En todas las partes aéreas aparecen manchas blancas pulverulentas de micelios y conidios que se unen y cubren toda la superficie. Los órganos jóvenes son más susceptibles que los viejos. En cuanto a las hojas, el haz presenta más oídio que el envés. La infección grave provoca una reducción de la fotosíntesis, defoliación y deformación del fruto. A medida que se desarrolla la enfermedad, la hoja se curva hacia arriba y se forman manchas de color púrpura a rojizo en la superficie de las hojas.
Modelos FieldClimate
Modelo Gubler modificado Broome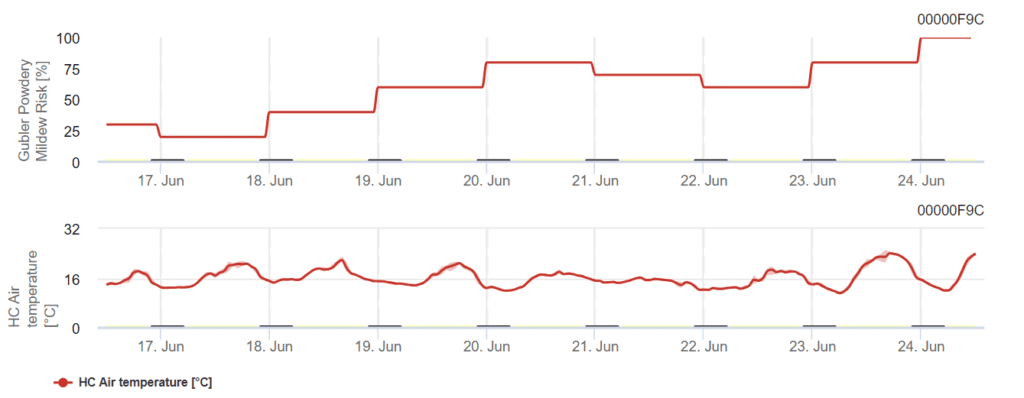
Sensores necesarios:
- Temperatura del aire
El modelo se basa en el marco de Gubler con modificaciones en los umbrales de alta temperatura introducidas por Broome. Calcula el riesgo con la temperatura del aire y el índice de riesgo oscila entre 0 y 100. Para activar el índice, se requieren tres días consecutivos con más de 6 horas de temperaturas entre 21°C y 30°C.
El índice aumenta 20 puntos por cada día que cumple estas condiciones (un mínimo de 6 horas entre 21°C y 30°C). Por el contrario, si un día experimenta menos de 6 horas dentro de este intervalo de temperaturas o si la temperatura supera los 35°C, el índice disminuye en 10 puntos.
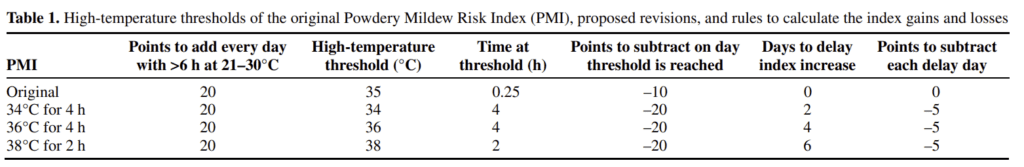
El modelo original de Gubler establecía un umbral de 35°C durante 0,35 horas, pero Broome ha introducido varios umbrales detallados de altas temperaturas. Cuando se alcanzan temperaturas específicas (34°C, 36°C y 38°C) durante un tiempo suficiente, se restan puntos. Además, el modelo tiene en cuenta el retraso en el crecimiento de los hongos; cualquier aumento del índice al día siguiente se retrasa varios días y se restan cinco puntos adicionales por cada día de retraso.
Un índice inferior a 30 indica una tasa de reproducción de 15 días o menos, mientras que un índice de 40~50 se considera normal, lo que implica una tasa de reproducción de 8 a 11 días. Un índice superior a 60 indica que el patógeno se reproduce cada 5 días y sería recomendable acortar el intervalo de pulverización.
Modelo del oídio de la fresa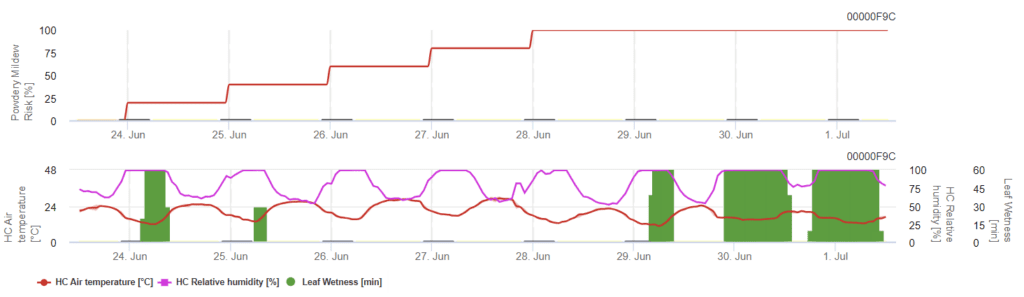
Sensores necesarios:
- Temperatura del aire
- Humedad relativa
- Humedad de las hojas
Este modelo incluye la humedad de las hojas y la humedad relativa a otro modelo. Las temperaturas del aire superiores a 21°C y la humedad relativa superior a 66% aumentan el riesgo, mientras que las temperaturas más bajas, la humedad relativa y la humedad de las hojas lo disminuyen.
El índice de riesgo inferior a 60 indica medidas fitosanitarias de bajo nivel, mientras que el riesgo superior a 60 indica un mayor riesgo de enfermedad y se recomendaría la pulverización. Los riesgos de enfermedad de 100 durante un periodo más largo requieren un aumento de la densidad de aplicación.
Literatura
- Broome, J. C., Hand, E. K., Backup, P., Janousek, C. N., & Gubler, W. D. (2010, junio). Revising the high temperature threshold for the Gubler-Thomas grape powdery mildew risk index. En PHYTOPATHOLOGY (Vol. 100, No. 6, pp. S17-S18). 3340 PILOT KNOB ROAD, ST PAUL, MN 55121 USA: AMER PHYTOPATHOLOGICAL SOC.
- Gadoury, D. M., Asalf, B., Heidenreich, M. C., Herrero, M. L., Welser, M. J., Seem, R. C., ... & Stensvand, A. (2010). Initiation, development, and survival of cleistothecia of Podosphaera aphanis and their role in the epidemiology of strawberry powdery mildew. Phytopathology, 100(3), 246-251.
- Jin XiaoLei, J. X., Fitt, B. D. L., Hall, A. M., & Huang YongJu, H. Y. (2013). The role of chasmothecia in the initiation of epidemics of powdery mildew (Podospheara aphanis) and the role of silicon in controlling the epidemics on strawberry.
- Palmer, S. A. (2007). Oidio de la fresa: epidemiología y efecto de la nutrición del huésped sobre la enfermedad (Tesis doctoral).
- Aldrighetti, A., & Pertot, I. (2023). Epidemiología y control del oídio de la fresa: una revisión. Phytopathologia Mediterranea, 62(3), 427-453.
Equipamiento recomendado
Compruebe qué conjunto de sensores se necesita para vigilar las posibles enfermedades de este cultivo.
