Cáñamo y lino modelos de enfermedad
Podredumbre por Sclerotinia
La podredumbre por Sclerotinia afecta a una amplia gama de plantas, en particular a las especies no leñosas. Está causada por S. sclerotiorum. La podredumbre por Sclerotinia puede afectar a las plantas en cualquier fase de producción, incluidas las plántulas, las plantas maduras y los productos cosechados. Las plantas con tejido senescente o muerto son especialmente susceptibles a la infección.
Síntomas
La zona infectada de una planta adquiere inicialmente un aspecto verde oscuro o marrón empapado de agua, y después puede volverse de color más pálido. Suele desarrollarse un denso micelio algodonoso blanco y la planta empieza a marchitarse y finalmente muere. Las estructuras de reposo o supervivencia (esclerocios) se producen externamente en las partes afectadas de la planta e internamente en las cavidades de la médula del tallo. Los esclerocios son duros, negros, de forma irregular, en su mayoría de 2-4 mm de tamaño, y difíciles de ver una vez incorporados al suelo.
Origen y propagación de las enfermedades
El ciclo de vida de S. sclerotiorum incluye una fase transmitida por el suelo y otra por el aire. Los esclerocios de S. sclerotiorum pueden sobrevivir en el suelo durante diez años o más. Germinan para producir pequeños cuerpos fructíferos en forma de embudo (apotecios) de aproximadamente 1 cm de diámetro. Los apotecios producen esporas transportadas por el aire, que pueden causar infección cuando aterrizan en una planta huésped susceptible, ya sea a través de las flores o por germinación directa en las hojas. Ocasionalmente, puede producirse la infección de las bases de los tallos cuando los filamentos fúngicos (micelio) se desarrollan directamente a partir de los esclerocios cerca de la superficie. Los nuevos esclerocios se desarrollan en el tejido vegetal infectado y, cuando la planta muere, permanecen en la superficie del suelo o pueden incorporarse durante el posterior cultivo del suelo.
Condiciones para la infección
Tras un período de frío invernal, los esclerocios, que han pasado el invierno en los 5 cm superiores del suelo, germinan a partir de la primavera para producir apotecios, cuando la temperatura del suelo es igual o superior a 10°C y el suelo está húmedo. Los esclerocios no germinan en suelo seco o cuando la temperatura del suelo es superior a 25 °C. Los esclerocios enterrados por debajo de 5 cm en el suelo tienen menos probabilidades de germinar. Una vez que los apotecios están completamente formados, la liberación de esporas puede producirse en la luz o en la oscuridad, pero depende de la temperaturapor lo que tiende a alcanzar su punto álgido hacia el mediodía. Los apotecios pueden durar unos 20 días a 15-20ºC, pero se marchitan tras menos de 10 días a 25ºC. En hierbas con flores, las esporas que se posan en pétalos y estambres germinan rápidamente (germinación en 3-6 horas e infección en 24 horas) en condiciones óptimas de 15-25°C, continuo humedad de las hojas y humedad elevada dentro del cultivo. La infección posterior de hojas y tallos depende de la caída de los pétalos y de su adherencia a las hojas. El riesgo de infección aumenta si las hojas están húmedas, ya que esto hace que se peguen más pétalos. Los pétalos muertos o senescentes infectados proporcionan nutrientes para la invasión del hongo en hojas y tallos. Para hierbas sin flor, la infección se produce principalmente por esporas transportadas por el aire que caen directamente sobre las hojas. Las esporas pueden sobrevivir en las hojas durante varias semanas hasta que se dan las condiciones favorables para la infección foliar. La germinación de las esporas y la infección dependen de la presencia de nutrientes en las hojas, bien procedentes de heridas de la planta o de material vegetal senescente. En el caso de las hierbas con flores, las condiciones óptimas para la germinación de las esporas y la infección son de 15-25°C con una humedad continua de las hojas y un alto grado de humedad. Una vez que se ha producido la infección de la planta, el rápido progreso de la enfermedad se ve favorecido por condiciones cálidas (15-20°C) y húmedas en cultivos densos.
Modelo de infección por esclerotinia
Infección de las plantas por S. sclerotiorum
La germinación carpogénica de los esclerocios se ve estimulada por periodos de humedad continua del suelo. En la superficie del suelo se forman apotecios de los que se liberan ascosporas al aire. La infección de la mayoría de las especies cultivadas se asocia principalmente a las ascosporas, pero no suele producirse la infección directa del tejido vegetal sano e intacto a partir de ascosporas germinativas. En cambio, la infección del tejido de hojas y tallos de plantas sanas sólo se produce cuando las ascosporas germinativas colonizan tejidos muertos o senescentes, normalmente partes de flores como pétalos abscisos, antes de la formación de estructuras de infección y penetración. La germinación miceliogénica de esclerocios en la superficie del suelo también puede dar lugar a la colonización de materia orgánica muerta con la subsiguiente infección de plantas vivas adyacentes. Sin embargo, en algunos cultivos, por ejemplo En el girasol, la germinación miceliogénica de los esclerocios puede iniciar directamente el proceso de infección de las raíces y el tallo basal que da lugar a la marchitez. Se desconoce el estímulo para la germinación miceliogénica y la infección en el girasol, pero es probable que dependa de señales nutricionales en la rizosfera derivadas de las plantas huésped.
El proceso de infección
La infección del tejido sano depende del formación de un apresorioque pueden tener una estructura simple o compleja en función de la superficie del huésped. En la mayoría de los casos, la penetración es directamente a través de la cutícula y no a través de los estomas. Los apresorios se desarrollan a partir de la ramificación dicotómica terminal de las hifas que crecen en la superficie del hospedador y consisten en una almohadilla de hifas anchas, multiseptadas y cortas que están orientadas perpendicularmente a la superficie del hospedador a la que están unidas por mucílago. Los apresorios complejos suelen denominarse cojines de infección. Aunque los primeros investigadores consideraban que la penetración de la cutícula era un proceso puramente mecánico, los estudios ultraestructurales demuestran que la digestión enzimática de la cutícula también desempeña un papel en el proceso de penetración. Se sabe poco sobre S. sclerotiorum Sin embargo, el genoma codifica al menos cuatro enzimas similares a las cutinasas (Hegedus, sin publicar). Una gran vesícula, formada en la punta del apresorio antes de la penetración, parece liberarse en la cutícula del hospedador durante la penetración. Tras la penetración de la cutícula, se forma una vesícula subcuticular desde la que se abren en abanico grandes hifas que crecen sobre la pared subcuticular de la epidermis y la disuelven.
Infección por degradación enzimática de las células epidémicas: El ácido oxálico actúa en relación con las enzimas degradadoras de la pared celular, como la poligalacturonasa (PG), para provocar la destrucción del tejido huésped creando un entorno propicio para el ataque de la PG a la pectina de la laminilla media. Esto, a su vez, libera derivados de bajo peso molecular que inducen la expresión de genes PG adicionales. De hecho, la actividad general de las PG es inducida por la pectina o los monosacáridos derivados de la pectina, como el ácido galacturónico, y es reprimida por la presencia de glucosa. El examen de los patrones de expresión de los genes Sspg individuales ha revelado que la interacción entre las PG y con el hospedador durante las diversas fases de la infección está finamente coordinada. (Dwayne D. Hegedus *, S. Roger Rimmer: Sclerotinia sclerotiorum: ¿Cuándo ''ser o no ser'' un patógeno? FEMS Microbiology Letters 251 (2005) 177-184)
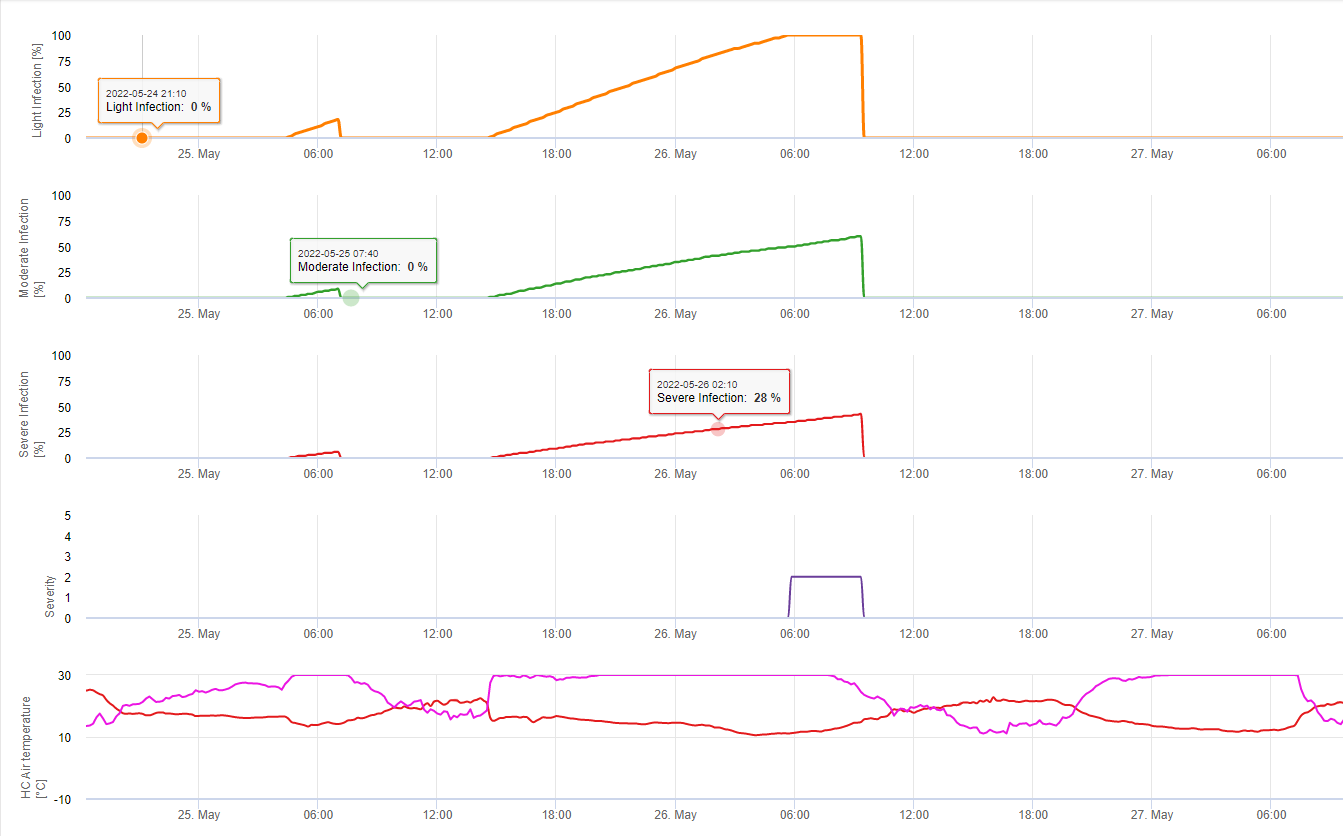
La búsqueda de condiciones climáticas para la infección de S. sclerotiorum debe tener en cuenta la formación de apotecios, la esporulación, la infección directa por apotecios (aunque no se produzca con mucha frecuencia) y la infección a partir de micelios establecidos por degradación enzimática de las células epidémicas .
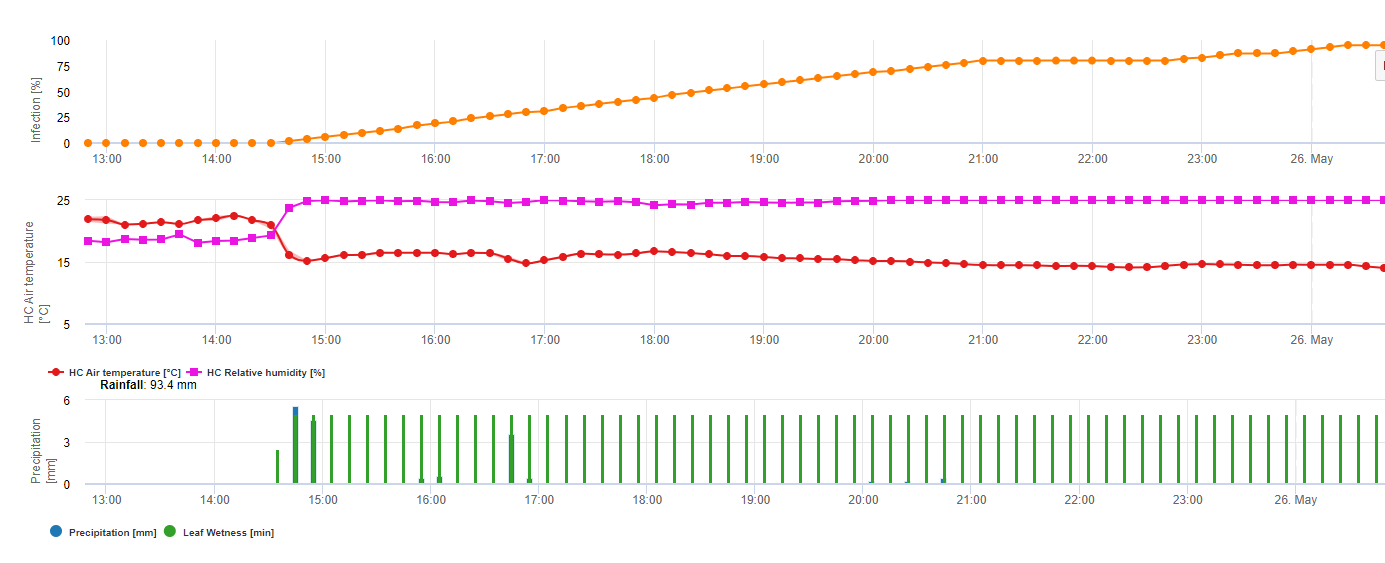
Formación de apotecios y esporulación tiene lugar si lluvia de más de 8 mm va seguido de un periodo de Humedad relativa elevada durante más de 20 horas a una temperatura óptima de 21°C a 26°C.
Infección directa por apotecios después de un período de humectación de las hojas seguido de 16 horas de humedad relativa superior a 90% bajo condiciones óptimas de 21°C a 26°C ("infección apresoria"). Mientras que puede esperarse un crecimiento saprofítico seguido de una degradación enzimática de las células epidérmicas ("infección hidrolítica") con una humedad relativa ligeramente inferior a 80% que dure 24 horas en condiciones óptimas de 21°C a 26°C.
Literatura:
- Lumsden, R.D. (1976) Pectolytic enzymes of Sclerotinia sclerotiorum and their localization on infected bean. Can. J. Bot. 54,2630-2641.
Tariq, V.N. y Jeffries, P. (1984) Appressorium formation by Sclerotinia sclerotiorum: scanning electron microscopy. Trans. Brit. Mycol. Soc. 82, 645-651. - Boyle, C. (1921) Estudios sobre la fisiología del parasitismo. VI. Infección por Sclerotinia libertiana. Ann. Bot. 35, 337-347.
Abawi, G.S., Polach, F.J. y Molin, W.T. (1975) Infection of bean by ascospores of Whetzelinia sclerotiorum. Fitopatología 65, 673-678. - Tariq, V.N. y Jeffries, P. (1986) Ultrastructure of penetration of Phaseolus spp. by Sclerotinia sclerotiorum. Can. J. Bot. 64, 2909- 2915.
- Marciano, P., Di Lenna, P. y Magro, P. (1983) Oxalic acid, cell wall degrading enzymes and pH in pathogenesis and their significance in the virulence of two Sclerotinia sclerotiorum isolates on sunflower. Physiol. Plant Pathol. 22, 339-345.
- Fraissinet-Tachet, L. y Fevre, M. (1996) Regulation by galacturonic acid of ppectinolytic enzyme production by Sclerotinia sclerotiorum. Curr. Microbiol. 33, 49-53.
Uso práctico del modelo de la esclerotinia
El modelo de infección de la pierna blanca muestra los periodos en los que la formación de apotecios . Si estos periodos coinciden con el periodo de floración de la colza o la colza, cabe esperar que S. sclerotiorum infecciones durante un periodo húmedo. Las esporas formadas en los apotecios pueden estar disponibles de uno a varios días. La oportunidad de las infecciones se indica mediante el cálculo del progreso de la infección para las infecciones directas o indirectas por apresorios o por la degradación de la pared celular encimática. Si la línea de progreso de la infección alcanza 100% se debe suponer una infección. Estas infecciones deben cubrirse preventivamente o con un fungicida de acción curativa contra S. sclerotiorum debe utilizarse.
Moho gris
Biología del moho gris
Molde gris (Botrytis cinerea) es una enfermedad devastadora con un alto impacto económico en la producción. B. cinerea infecta las flores y los frutos próximos a la madurez.
El hongo patógeno tiene un rango de hospedadores muy amplio, infectando a más de 200 hospedadores diferentes. El hongo se desarrolla de forma saprofítica y parasitaria.
Síntomas
En los girasoles el patógeno causa un moho gris en la cabeza y el tallo. Al mismo tiempo, las hojas empiezan a secarse. Estos síntomas se producen durante la maduración de los granos en el cogollo. Se observan manchas marrones en el envés. Estas manchas están cubiertas por el micelio del hongo y las esporas, dando la apariencia de un polvillo. Las esporas pueden propagarse en condiciones climáticas húmedas.
Los esclerocios negros desprovistos de médula aparecen en los restos del cultivo después de la cosecha o directamente en las plantas si se cosechan demasiado tarde.
El hongo pasa el invierno en la superficie del suelo o en el suelo como micelio o esclerocio. En primavera, la forma invernante empieza a germinar y a producir conidios. Estos conidios se propagan por el viento y la lluvia e infectan los tejidos de las nuevas plantas.
La germinación es posible con una humedad relativa superior a 85%. La temperatura óptima de germinación es de 18°C. El hongo patógeno puede reproducirse varias veces.
Opciones de control: El control de las semillas puede proteger a las plantas del damping- off. El control químico es difícil debido a la resistencia del patógeno. Por lo tanto, se intenta aplicar estrategias de control natural con Trichoderma harzianum.
Condiciones para modelar la infección
B. cinerea infecciones están relacionadas con humedad libre. Por lo tanto, en la producción a campo abierto humedad de las hojasque es un buen indicador.
Bulger et al. (1987) estudiaron la correlación de los periodos de humedad de las hojas durante la floración y la aparición de moho gris en los frutos. Encontraron que para un mayores riesgos de infección a 20°C se necesita un periodo de tiempo superior a 32 horas de humectación de la hoja. A temperaturas más bajas, los periodos de humectación de las hojas tienen que ser más largos para la infección de la enfermedad.
FieldClimate indica riesgo de Botrytis cinerea en la base de periodos de humedad de las hojas y la temperatura durante estos periodos.
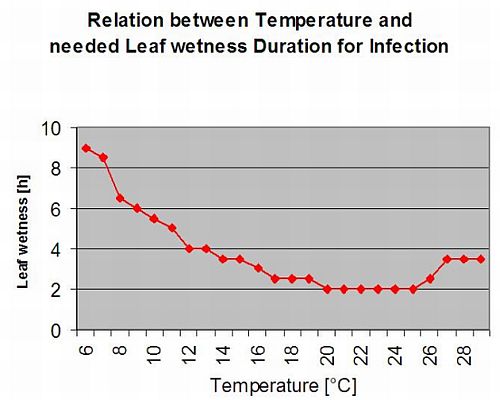
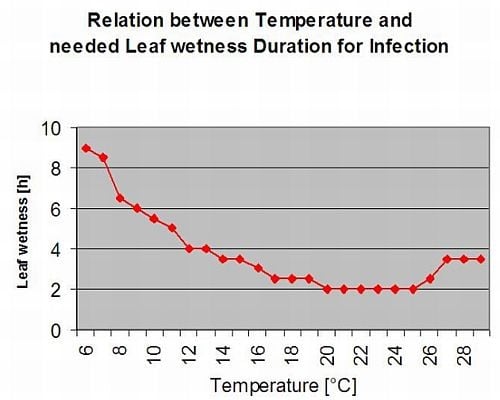
El gráfico siguiente muestra la duración de las hojas mojadas en función de la temperatura real necesaria para un Botrytis infección. Si el riesgo es superior a 0, cada periodo de humectación de las hojas superior a 4 horas aumentará el riesgo en la misma proporción.
Un día con un periodo de humedad de la hoja inferior a 4 horas se considera un día seco y reducirá el riesgo en 20% del valor real.
Utilización práctica del modelo de molde gris: El modelo indica períodos con riesgo de Botrytis infección. Este período de riesgo durante la floración de la fresa dará lugar a frutos infectados. Cuanto más dure el periodo de riesgo y cuanto mayor sea el riesgo, mayor será la probabilidad y el número de frutos infectados. El riesgo que puede tenerse en cuenta depende del mercado. Los productores que venden sus frutas a los supermercados no asumirán ningún riesgo, sabiendo que no pueden vender frutas infectadas. En cambio, los productores que venden su fruta directamente al público pueden asumir un riesgo mayor.
Literatura:
- Bulger M.A., Ellis M. A., Madden L. V. (1987): Influence of temperature and wetness druation on infection of strawberry flowers by Botrytis cinerea and disease incidence of fruit originating from infected flowers. Ecology and Epidemiology; Vol 77 (8): 1225-1230.
- Sosa-Alvarez M., Madden L.V., Ellis M.A. (1995): Efectos de la temperatura y la duración de la humedad sobre la esporulación de Botrytis cinerea en residuos foliares de fresa. Enfermedades de las plantas 79, 609-615.
Tizón pardo
Tizón temprano de la patata y el tomate
Randall C. Rowe, Sally A. Miller, Richard M. Riedel, Servicio de Extensión de la Universidad Estatal de Ohio
El tizón temprano es una enfermedad muy común tanto en la patata como en el tomate. Causa manchas en las hojas y tizón del tubérculo en la patata, y manchas en las hojas, podredumbre del fruto y lesiones en el tallo en el tomate. La enfermedad puede aparecer en una amplia gama de condiciones climáticas y puede ser muy destructiva si no se controla, provocando a menudo la defoliación completa de las plantas. En contraste con su nombre, rara vez se desarrolla temprano, sino que suele aparecer en el follaje maduro.
Síntomas
En las hojas de ambos cultivos, los primeros síntomas suelen aparecer en las hojas más viejas y consisten en pequeñas manchas muertas irregulares, de color marrón oscuro a negro, cuyo tamaño oscila entre una punta de alfiler y 1/2 pulgada de diámetro. A medida que las manchas aumentan de tamaño, pueden formarse anillos concéntricos como resultado de patrones de crecimiento irregulares del organismo en el tejido de la hoja. Esto da a la lesión un aspecto característico de "diana" u "ojo de buey". A menudo hay un halo amarillo estrecho alrededor de cada mancha y las lesiones suelen estar bordeadas por venas. Cuando las manchas son numerosas, pueden crecer juntas, haciendo que las hojas infectadas se vuelvan amarillas y mueran. Por lo general, las hojas más viejas se infectan primero y se secan y caen de la planta a medida que la enfermedad avanza por el tallo principal.
En el tomate, las infecciones del tallo pueden producirse a cualquier edad, dando lugar a zonas pequeñas, oscuras y ligeramente hundidas que se agrandan hasta formar manchas circulares o alargadas con centros de color más claro. En las lesiones del tallo suelen aparecer marcas concéntricas, similares a las de las hojas. Si se utilizan semillas infestadas para iniciar trasplantes de tomate, las plántulas pueden secarse poco después de emerger. Cuando se desarrollan grandes lesiones en la línea del suelo en los tallos de los trasplantes o plántulas, las plantas pueden quedar ceñidas, una condición conocida como "pudrición del cuello". Estas plantas pueden morir cuando se plantan en el campo o, si los tallos están debilitados, pueden romperse al principio de la temporada. Algunas plantas pueden sobrevivir con sistemas radiculares reducidos si partes de los tallos situadas por encima del cancro desarrollan raíces en contacto con el suelo. Sin embargo, estas plantas suelen producir pocos frutos o ninguno. Las lesiones del tallo son mucho menos comunes y destructivas en la patata.
La caída de la flor y las manchas en los tallos de los frutos, junto con la pérdida de frutos jóvenes, pueden producirse cuando el tizón temprano ataca a los tomates en la fase de floración. En los frutos más viejos, el tizón temprano causa manchas oscuras, coriáceas y hundidas, normalmente en el punto de unión del tallo. Estas manchas pueden agrandarse y afectar a toda la parte superior del fruto, mostrando a menudo marcas concéntricas como las de las hojas. Las zonas afectadas pueden estar cubiertas de masas negras aterciopeladas de esporas. Los frutos también pueden infectarse en la fase verde o madura a través de grietas de crecimiento y otras heridas. Los frutos infectados suelen caer antes de alcanzar la madurez.
En los tubérculos de patata, el tizón temprano produce lesiones superficiales de aspecto algo más oscuro que la piel sana adyacente. Las lesiones suelen ser ligeramente hundidas, circulares o irregulares, y varían en tamaño hasta 3/4 de pulgada de diámetro. Suele haber un margen bien definido y a veces ligeramente elevado entre el tejido sano y el enfermo. Internamente, el tejido muestra una podredumbre seca, corchosa, de color marrón a negro, que no suele tener más de 1/4 a 3/8 de pulgada de profundidad. En las lesiones más antiguas pueden formarse grietas profundas. La infección del tubérculo es poco común en las condiciones de Ohio.
Patógeno
El tizón temprano está causado por el hongo Alternaria solani, que sobrevive en los tejidos infectados de las hojas o los tallos en el suelo o dentro de él. Este hongo está universalmente presente en los campos donde se han cultivado estos productos. También puede estar presente en las semillas de tomate y en los tubérculos de patata. Las esporas se forman en los restos de plantas infestadas en la superficie del suelo o en lesiones activas en un intervalo de temperaturas bastante amplio, especialmente en condiciones húmedas y secas alternas. Son fácilmente transportadas por las corrientes de aire, el viento, las salpicaduras de lluvia y el agua de riego. La infección de los tejidos susceptibles de las hojas o los tallos se produce en climas cálidos y húmedos con lluvias o rocíos intensos. El tizón temprano puede desarrollarse con bastante rapidez a mediados o finales de la temporada y es más grave cuando las plantas están estresadas por una nutrición deficiente, sequía u otras plagas. La infección de los tubérculos de patata se produce a través de aberturas naturales en la piel o por heridas. Los tubérculos pueden entrar en contacto con las esporas durante la cosecha y las lesiones pueden seguir desarrollándose durante el almacenamiento.
TOMCAST (Jim Jasinski, coordinador de TOMCAST para OHIO, INDIANA y MICHIGAN)
Fondo
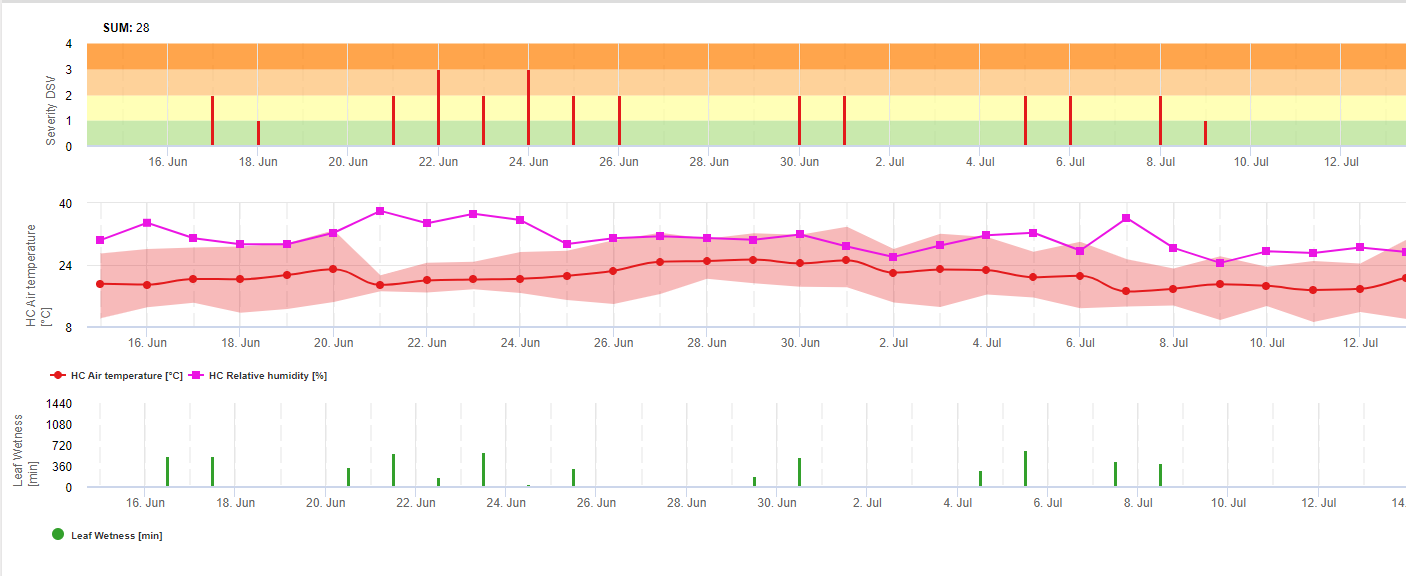
TOMCAST (TOMato disease foreCASTing) es un modelo informático basado en datos de campo que intenta predecir el desarrollo de enfermedades fúngicas, concretamente el Tizón Temprano, la Mancha Foliar por Septoriosis y la Antracnosis en el tomate. Los registradores de datos colocados en el campo registran datos horarios de humedad y temperatura de las hojas. Estos datos se analizaron durante un período de 24 horas y pueden dar lugar a la formación de un valor de gravedad de la enfermedad (DSV); esencialmente un incremento del desarrollo de la enfermedad. A medida que se acumulan DSV, la presión de la enfermedad sigue aumentando en el cultivo. Cuando el número de DSV acumulados supera el intervalo de pulverización, se recomienda una aplicación de fungicida para aliviar la presión de la enfermedad.
TOMCAST
Calendario de aplicación de fungicidas para el tizón temprano, la mancha foliar por Septoria y la antracnosis
Un sistema de previsión de enfermedades basado en las condiciones meteorológicas denominado TOMCAST, desarrollado por el Dr. Ron Pitblado en el Ridgetown College of Agricultural Technology de Ontario, Canadá, puede utilizarse para programar las aplicaciones de fungicidas para tres enfermedades fúngicas: el tizón temprano (causado por Alternaria solani), la mancha foliar por Septoria (causada por Septoria lycopersici) y la antracnosis de la fruta (causada por Colletotrichum coccodes). Si el tizón tardío está presente en su condado o condados adyacentes, o se dan las condiciones para el movimiento de esporas en su área, utilice el sistema de previsión de tizón tardío Simcast para programar las aplicaciones de fungicidas.
NOTA DE PRECAUCIÓN IMPORTANTE:
TOMCAST no es útil en explotaciones con antecedentes de enfermedades bacterianas. Si suele tener problemas de manchas bacterianas, moteado o cancro en sus tomates, no debe usar TOMCAST porque los intervalos de pulverización recomendados no serán suficientes para controlar las enfermedades bacterianas si mezcla cobre con sus aplicaciones de fungicidas. Aquí encontrará información sobre cómo reducir las enfermedades bacterianas: http://extension.psu.edu/plants/vegetable-fruit/news/2015/farming-like-you-expect-bacterial-diseases
TOMCAST utiliza los datos de humedad y temperatura de la hoja para calcular los valores de severidad de la enfermedad (DSV), como se muestra en la Tabla 1.
TOMCAST deriva del modelo original F.A.S.T. (Forecasting Alternaria solani on Tomatoes) desarrollado por los doctores Madden, Pennypacker y MacNab en la Universidad Estatal de Pensilvania (PSU). El modelo F.A.S.T. de la PSU fue modificado posteriormente por el Dr. Pitblado en el Ridgetown College de Ontario en lo que ahora reconocemos como el modelo TOMCAST utilizado por la Extensión Universitaria del Estado de Ohio.
DSV Un Valor de Gravedad de la Enfermedad (VGE) es la unidad de medida dada a un incremento específico del desarrollo de la enfermedad (tizón temprano). En otras palabras, un VDS es una representación numérica de la rapidez o lentitud con la que la enfermedad (tizón temprano) se está acumulando en un campo de tomates. El VDS viene determinado por dos factores: la humedad de la hoja y la temperatura durante las horas de "humedad de la hoja". A medida que aumenta el número de horas de humedad de la hoja y la temperatura, el DSV se acumula a un ritmo más rápido. Vea la Tabla de Valores de Severidad de la Enfermedad a continuación.
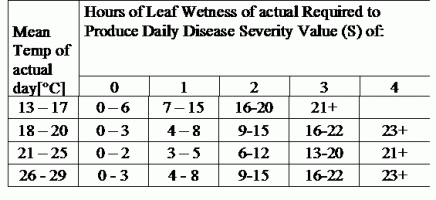
Por el contrario, cuando hay menos horas de humedad foliar y la temperatura es más baja, los DSV se acumulan lentamente, si es que lo hacen. Cuando el número total de DSV acumulados supera un límite preestablecido, denominado intervalo o umbral de pulverización, se recomienda una pulverización fungicida para proteger el follaje y el fruto del desarrollo de la enfermedad.

El intervalo de pulverización (que determina cuándo se debe pulverizar) puede oscilar entre 15 y 20 DSV. El DSV exacto que debe utilizar un agricultor suele proporcionarlo el transformador y depende de la calidad del fruto y del uso final de los tomates. Seguir un intervalo de pulverización de 15 DSV es un uso conservador del sistema TOMCAST, lo que significa que pulverizará con más frecuencia que un agricultor que utilice un intervalo de pulverización de 19 DSV con el sistema TOMCAST. La compensación está en el número de pulverizaciones aplicadas durante la temporada y la posible diferencia en la calidad de la fruta.
USO DE TOMCAST
Los tomates cultivados en un radio de 16 km de una estación de notificación deberían beneficiarse de la función de gestión de enfermedades de TOMCAST para ayudar a prever el tizón temprano, la Septoriosis y la Antracnosis. Si decide probar TOMCAST esta temporada, tenga en cuenta tres conceptos muy importantes.
Uno: Si es la primera vez que utiliza el sistema, se recomienda introducir sólo una parte de su superficie en el programa para ver cómo se adapta a sus normas de calidad y a su estilo operativo.
Dos: Utilice TOMCAST como guía para programar mejor las aplicaciones de fungicidas, teniendo en cuenta que en algunas temporadas puede aplicar más producto del que requiere un programa establecido.
Tres: Cuanto más lejos se encuentre un campo de tomates de un lugar de notificación aumenta la probabilidad de distorsión en la acumulación de DSV, es decir, el valor notificado puede ser unos DSV superior o inferior al experimentado por la ubicación del campo. Esto debe tenerse en cuenta cuando la aplicación de fungicidas esté probablemente a pocos días vista. Escuche los informes de DSV de las estaciones cercanas y triangule a su propia ubicación como la mejor manera de estimar aproximadamente su acumulación de DSV.
PRIMERA PULVERIZACIÓN CON TOMCAST
A lo largo de los años se ha discutido sobre la aplicación de la primera pulverización cuando se sigue TOMCAST. La norma establecida en la Guía de producción de hortalizas de 1997 se centra en la fecha de plantación.
A las plantas de tomate que entren en el campo antes del 20 de mayo se les debe aplicar la primera pulverización cuando el DSV para esa zona supere el 25 o cuando llegue la fecha fail safe del 15 de junio. La fecha de seguridad sólo se utiliza si no se ha tratado desde el 20 de mayo, y es un medio para eliminar el inóculo inicial de la enfermedad. Tras la primera pulverización, estos tomates se tratan posteriormente cuando se supera el intervalo de pulverización elegido (intervalo de 15-20 DSV).
Los tomates plantados después del 20 de mayo se tratan cuando superan el intervalo de pulverización elegido (intervalo de 15-20 DSV) o cuando no se han tratado en la fecha de seguridad del 15 de junio. Por lo tanto, es fundamental comparar la fecha de plantación del tomate con la fecha de inicio de la notificación de DSV en esa zona para orientar el proceso de decisión de pulverización.
Enfermedad de la pata negra
Ciclo de la enfermedad
La enfermedad ha cuatro etapas principales en la colza de invierno:
Las fuentes de infección más importantes para las plantas recién emergidas son las esporas aerotransportadas producidas en los rastrojos de colza tras la cosecha. Los cuerpos fructíferos que producen esporas aerotransportadas necesitan unos 20 días con lluvia para madurar, por ejemplo, las esporas se liberaron pronto después del húmedo agosto en 2005 y en 2006, pero tarde en 2003 cuando ese mes fue seco.
Las esporas transportadas por el aire, liberadas principalmente en días lluviosos, infectan las hojas para producir la fase de mancha foliar. Los síntomas aparecen al cabo de 5-7 días a 15-20°C, pero tardan más de 30 días en desarrollarse a 3°C.
No hay síntomas visibles mientras el hongo crece desde la mancha foliar, bajando por el pecíolo, hasta el tallo. La velocidad de crecimiento por el pecíolo puede ser de hasta 5 mm/día a 15-20°C, pero disminuye a 1 mm/día a 3-5°C. Los fungicidas no ofrecen ningún control una vez que el tallo ha sido infectado.
El hongo se propaga dentro del tallo, dando lugar a síntomas visibles de cancro del tallo unos seis meses después de la infección de las hojas. Las manchas tempranas en las hojas dan lugar a cancros tempranos en el tallo, que son los que tienen más probabilidades de reducir el potencial de rendimiento.
Comprender la variación
El tiempo: Las precipitaciones de agosto y septiembre son el factor clave que determina la aparición de las manchas foliares. Unas precipitaciones superiores a la media, sobre todo en agosto, indican un riesgo precoz.
Biología
Leptosphaeria maculans o Phoma lingam sobrevive al período intercultivo en forma de micelio y pseudotecios en los residuos de los cultivos. En Canadá, el tejido foliar no persiste lo suficiente como para permitir el desarrollo de pseudotecas, pero se forman pseudotecas en el tejido basal del tallo. Una vez maduros, los pseudotecios producen ascosporas.
Se liberan las ascosporas del hongo después de las lluvias cuando las temperaturas están entre 8-12ºC/46-54ºF. Estas esporas pueden ser dispersadas por el viento a cientos de metros de distancia. Los picnidios pueden pasar el invierno fácilmente en los rastrojos, pero como las esporas de los picnidios no se transmiten por el aire en una medida significativa, son de menor importancia para iniciar el primer ciclo de la enfermedad.
Las ascosporas germinan en presencia de agua libre de 4-28ºC (40-82ºF). La penetración se produce a través de los estomas. El patógeno también puede transmitirse por las semillas. Las semillas pueden estar infectadas y/o infestadas por el patógeno. Las semillas infectadas pueden dar lugar a plántulas infectadas, pero los niveles de contaminación de las semillas son siempre muy bajos. Las infecciones primarias suelen producirse en los cotiledones o en las hojas de la roseta basal de la planta. El clima húmedo favorece estas infecciones primarias.
El hongo invade los espacios intercelulares entre las capas empalizada y epidérmica de la hoja. A esta fase biotrófica asintomática le sigue la invasión del mesófilo con la consiguiente muerte de las células y la aparición de lesiones gris-verdosas. Las hifas continúan ramificándose a través del tejido foliar hasta que alcanzan una vena de la hoja. A continuación, el hongo coloniza la corteza y/o el parénquima xilemático del pecíolo. En la unión del pecíolo y el tallo, el hongo invade la corteza del tallo donde causa un cancro. Es en este punto donde se manifiesta la resistencia del tallo y determina la capacidad de la enfermedad para pasar a la fase dañina del cancro del tallo. Los cancros del tallo se forman cuando las plantas se atornillan (producen un tallo erguido a partir de la roseta en la que se forman las flores). Los cancros del tallo se desarrollan más rápidamente a 20-24ºC/68-75ºF y son más severos en condiciones de estrés como daños mecánicos, por insectos o herbicidas.
Se liberan las picnidiosporas (conidios) de los picnidios en condiciones de humedad en un mucílago, una solución acuosa y pegajosa. Estas esporas son responsables de ciclos secundarios de la enfermedad, pero las ascosporas son la fuente más importante de inóculo porque son más infecciosas y se transportan por el aire.
Las pynidiosporas se dispersan a nuevos focos de infección por salpicaduras de lluvia. Las picnidiosporas germinan más lentamente que las ascosporas y necesitan más de 16 horas de humedad continua a una temperatura óptima de 20-25ºC/68-77ºF. El período mínimo de latencia (el tiempo que transcurre desde la infección hasta la producción de nuevo inóculo) tras la infección por picnidiosporas es de 13 días. Aunque se producen infecciones secundarias por picnidiosporas, la mayoría de las pérdidas se deben a infecciones primarias de las hojas por ascosporas que provocan cancros basales en los tallos y, finalmente, el encamado de las plantas.
Modelo para la primera posible infección en otoño
El desarrollo de una epidemia de cancro del tallo se divide en tres etapas.
1) En el primera etapaLa fecha de inicio de las epidemias de manchas foliares de phoma en otoño se predijo a partir de los datos meteorológicos del verano. Dado que el cancro del tallo del phoma es una enfermedad monocíclica (un ciclo por estación de crecimiento), la fecha en otoño en la que comienza a desarrollarse la mancha foliar es un factor crucial que afecta a la gravedad de las epidemias de cancro del tallo del phoma en los tallos el verano siguiente (West et al. 2001). La fecha en la que comienzan las manchas foliares por phoma en otoño se estima a partir de la temperatura y la pluviometría durante el periodo intercultivo entre la cosecha del cultivo anterior y el establecimiento del nuevo cultivo. Donde aproximadamente 4 mm de lluvia harán que la aparición de la enfermedad de la pata negra sea un día antes y el impacto de la temperatura es mayor al inicio del periodo a mediados de verano que en otoño.
Si la infección por ascosporas es posible gracias al clima otoñal, tenemos que buscar las necesidades climáticas de la infección por ascosporas.
2) En este segunda fase podemos buscar ascosporas maduras. Para madurar las ascosporas necesita dependiendo de la temperatura más de 288 horas de temepratura del aire entre 5 y 25°C y humedad relativa superior a 85%. Ahora necesita 4 mm de lluvia o más para distribuir las ascosporas. Un periodo de mojado de la hoja tiene que iniciar una infección de ascosporas y si puede completarse en 8 horas bajo temperatura óptima.
A finales de otoño y en primavera pueden formarse conidios en lesiones maduras de la enfermedad de la pata negra.
3) En el tercera fase hay que esperar infecciones de conidios, que se inician por un periodo de humectación de las hojas y que se completan por periodos de humedad relativa superior a 85% durante más de 8 horas a temperatura óptima.
Uso práctico de los modelos de pata negra
El modelo de la pata negra comienza con la evaluación de si es posible una infección de pata negra a finales de verano y principios de otoño. Esta parte del modelo puede utilizarse como pronóstico negativo. Se ha probado para el clima del Reino Unido para estimar la primera aparición de P. lingam infecciones. Este modelo es válido para clima fresco y húmedo. Debe utilizarse con cierta precaución en climas continentales como Hungría o Austria. Los modelos de maduración de ascosporas, realización de ascosporas e infección por ascosporas muestran posibles infecciones por ascosporas durante el otoño. Estos modelos se basan en la biología del patógeno y probablemente mostrarán más infecciones por ascosporas de las que se pueden encontrar en el campo. Esto se debe a que, basándonos en los datos climáticos, no sabemos nada sobre la densidad del inóculo y los cultivos previos de los campos de colza. En cualquier caso, si uno o varios ascosporas infectan las plantas susceptibles después de la emergencia, se producirán infecciones por P. lingam y cabe esperar infecciones secundarias por conidios durante los periodos cálidos y húmedos del otoño o la primavera.
Las infecciones por conidios están indicadas debido a los períodos de humedad de la hoja necesarios para una infección por conidios.
Enfermedad por Septoriosis
Existen dos enfermedades principales de Septoria en el trigo. Se trata de la mancha Septoria tritici, provocada por el hongo Septoria tritici (teleomorfo: Mycophaerella graminicola), y Septoriosis nodular causada por el hongo Septoria nodorum (teleomorfo: Leptosphaeria nodorum). Ambas enfermedades causan graves pérdidas de rendimiento que oscilan entre el 31 y el 53% (Eyal, 1981; Babadoost y Herbert, 1984; Polley y Thomas, 1991). En todo el mundo están afectadas más de 50 millones de hectáreas de trigo, que crecen principalmente en zonas de alta pluviosidad. Durante los últimos 25 años, estas enfermedades han ido en aumento y se han convertido en un importante factor limitante de la producción de trigo en determinadas zonas. Cuando las epidemias son graves, los granos de los cultivares de trigo susceptibles se marchitan y no son aptos para la molienda. Las epidemias de Septoria tritici blotch y Septoria nodorum blotch del trigo están asociadas a condiciones climáticas favorables (lluvias frecuentes y temperaturas moderadas), prácticas culturales específicas, disponibilidad de inóculo y presencia de cultivares de trigo susceptibles (Eyal et al., 1987).
Septoria spp. Biología
Después de Erick De Wolf, Septoria Tritici Blotch, Kansas State University, abril de 2008 Septoria tritici mancha conocida como mancha moteada de la hoja, está causada por el hongo Septoria tritici. Se distribuye por todas las zonas trigueras del mundo y constituye un grave problema en muchas regiones. La mancha de Septoria tritici es más dañina cuando la enfermedad ataca las hojas superiores y las cabezas de las variedades susceptibles a finales de la temporada.
Síntomas
Septoria tritici Los síntomas de la mancha aparecen por primera vez en otoño. Los síntomas iniciales son pequeñas manchas amarillas en las hojas. Estas lesiones suelen adquirir un color bronceado claro a medida que envejecen, y los cuerpos fructíferos del hongo pueden verse incrustados en las lesiones de las axilas. Las lesiones tienen forma irregular y varían de elípticas a largas y estrechas (Figura 1). Las lesiones contienen pequeñas motas redondas negras que son los cuerpos fructíferos del hongo. Los cuerpos fructíferos negros parecen granos de pimienta negra y normalmente pueden verse sin ayuda de una lupa. La enfermedad comienza en las hojas inferiores y avanza gradualmente hasta la hoja bandera. Las vainas de las hojas también son susceptibles de ser atacadas. En años húmedos, el hongo de la mancha moteada de la hoja puede desplazarse a los cogollos y causar lesiones marrones en las glumas y las axilas, conocidas como mancha de las glumas. Estas lesiones a menudo se vuelven de color bronceado claro a medida que envejecen y los cuerpos fructíferos del hongo se ven a menudo incrustados en las lesiones de las glumas.
La fase de la mancha de la gluma puede causar una pérdida significativa de rendimiento, pero no se conoce bien la relación entre la gravedad de la enfermedad y la pérdida de rendimiento. Septoria tritici puede confundirse con otras enfermedades de las hojas que presentan síntomas muy similares: mancha bronceada y Stagonspora nodorum por ejemplo. Es frecuente que las plantas estén infectadas por más de una de estas enfermedades foliares, y puede ser necesario realizar exámenes de laboratorio para diagnosticar con precisión qué enfermedades son las más prevalentes. El examen de laboratorio es casi siempre necesario para distinguir la causa de la mancha de la gluma. Conocer la especie no es importante para las decisiones de pulverización porque las tres enfermedades responden de forma similar a los fungicidas. Sin embargo, saber cuáles son las enfermedades más prevalentes es una parte importante de la selección de variedades, ya que diferentes genes controlan la resistencia a las enfermedades.
La forma más fiable de distinguir la mancha por Septoria tritici de las otras enfermedades es por la presencia de los cuerpos fructíferos negros del hongo. El hongo que causa la mancha bronceada no produce este tipo de estructura reproductiva. Sin embargo, en condiciones húmedas, el hongo que causa la mancha Stagonospora nodorum producirá cuerpos fructíferos de color marrón claro. Además de la diferencia de color, estas estructuras también son más pequeñas que las producidas por Septoria tritici.
Ciclo de vida
Septoria tritici sobrevive durante el verano en los residuos de un cultivo de trigo anterior e inicia las infecciones en otoño. Existen algunas pruebas de que el hongo es capaz de sobrevivir en asociación con otras gramíneas hospedadoras y semillas de trigo. Estas fuentes del hongo son probablemente más importantes cuando no hay residuos de trigo. Independientemente de las prácticas de rotación o de gestión de residuos, suele haber suficiente inóculo para iniciar las infecciones otoñales. Septoria tritici La mancha se ve favorecida por el clima fresco y húmedo. El intervalo óptimo de temperatura es de 16 a 21 °C; sin embargo, pueden producirse infecciones durante los meses de invierno a temperaturas tan bajas como 5 °C. La infección requiere al menos 6 horas de humedad en las hojas, y hasta 48 horas de humedad para una infección máxima. Una vez que se ha producido la infección, el hongo tarda entre 21 y 28 días en desarrollar los característicos cuerpos fructíferos negros y producir una nueva generación de esporas. Las esporas producidas en estos cuerpos fructíferos se exudan en masas pegajosas y requieren lluvia para salpicarlas sobre las hojas superiores y los cogollos.
Infección por Septoria tritici
Picnidiosporas de S. tritici germinan en agua libre de ambos extremos de la espora o de las células intercalares (Weber, 1922). La germinación de las esporas no comienza hasta unas 12 horas después del contacto con la hoja. Los tubos germinativos crecen al azar sobre la superficie de la hoja. Weber (1922) sólo observó la penetración directa entre las células epidérmicas, pero otros concluyeron que la penetración a través de los estomas abiertos y cerrados es el principal medio de penetración en el hospedador (Benedict, 1971; Cohen y Eyal, 1993; Hilu y Bever, 1957). Kema et al. (1996) sólo observaron penetración estomática. Las hifas que crecen a través de los estomas se contraen hasta alcanzar un diámetro de aproximadamente 1 μm, y luego se ensanchan tras alcanzar la cavidad subestomática.
Las hifas crecen paralelas a la superficie de la hoja por debajo de las células epidérmicas, después a través del mesófilo hasta las células de la parte inferior de la epidermis, pero no dentro de la epidermis. No se forman haustorios y el crecimiento hifal está limitado por las células del esclerénquima alrededor de los haces vasculares, excepto cuando las hifas son muy densas. Los haces vasculares no son invadidos. Las hifas crecen intercelularmente a lo largo de las paredes celulares a través del mesófilo, ramificándose en el tabique o en el centro de una célula. No aparecen síntomas macroscópicos durante unos 9 días, salvo alguna célula muerta ocasional, pero las células del mesófilo mueren rápidamente a los 11 días. Los picnidios se desarrollan en cámaras substomáticas. Las hifas rara vez crecen dentro de las células huésped (Hilu y Bever, 1957; Kema et al, 1996; Weber, 1922).
La infección exitosa sólo se produce después de al menos 20 horas de alta humedad. Sólo se desarrollan unas pocas motas marrones si las hojas permanecen húmedas durante 5-10 horas después de la deposición de las esporas (Holmes y Colhoun, 1974) o hasta 24 horas (Kema et al., 1996). Las relaciones huésped-parásito son las mismas en trigos resistentes o susceptibles. La germinación de las esporas en la superficie de la hoja es la misma independientemente de la susceptibilidad. El número de penetraciones exitosas es aproximadamente el mismo, pero el crecimiento hifal es más rápido en cultivares susceptibles, resultando en más lesiones. Las hifas se extienden más allá de la zona necrótica en todos los cultivares. Una toxina puede jugar un papel en la patogénesis (Cohen y Eyal, 1993; Hilu y Bever, 1957). Por el contrario, la colonización se redujo considerablemente en una línea resistente (Kema et al., 1996).
Stagonospora (Septoria) y Septoria patógenos de los cereales: El proceso de infección
B.M. Cunfer, Departamento de Patología Vegetal, Universidad de Georgia, Griffin, GA
El proceso de infección se ha estudiado más intensamente para Stagonospora (Septoria) nodorum y Septoria tritici. Un estudio en profundidad sobre Septoria passerinii está disponible. Casi toda la información comunicada se refiere a la infección por picnidiosporas. Sin embargo, el proceso de infección de otras formas de esporas es bastante similar. La información presentada se refiere principalmente a la infección de hojas en condiciones óptimas. Algunos estudios se realizaron con plantas de semillero intactas, mientras que otros se llevaron a cabo con hojas desprendidas. Infección del coleóptilo y la plántula de trigo por S. nodorum fue descrito en detalle por Baker (1971) y revisado por Cunfer (1983). Aunque no se han hecho comparaciones precisas, parece que el proceso de infección tiene muchas similitudes en cada sistema huésped-parásito y es típico de muchos patógenos necrótrofos. Se excluye la información sobre los factores que influyen en el desarrollo de los síntomas y la expresión de la enfermedad, pero han sido revisados por otros autores (Eyal et al., 1987; King et al., 1983; Shipton et al., 1971). Se incluye un resumen de los factores que afectan a la longevidad de las esporas en la superficie de las hojas.
Papel de los cirros y supervivencia de las esporas en la superficie de la hoja La información más detallada sobre la función del cirro que recubre las picnidiosporas exudadas del picnidio corresponde a S. nodorum. El cirro es un gel formado por compuestos proteínicos y sacáridos. Su composición y función son similares a las de otros hongos de la familia Sphaeropsidales (Fournet, 1969; Fournet et al., 1970; Griffiths y Peverett, 1980). Las funciones principales de los componentes de los cirros son la protección de las picnidiosporas frente a la desecación y la prevención de la germinación prematura.
El cirro protege las picnidiosporas de modo que algunas permanecen viables al menos 28 días (Fournet, 1969). Cuando el cirro se diluía con agua, si la concentración de la solución de cirro era >20%, germinaban menos de 10% de picnidiosporas. A menor concentración, los componentes proporcionan nutrientes que estimulan la germinación de las esporas y la elongación de los tubos germinativos. La longitud de los tubos germinativos aumentó hasta una concentración de cirros de 15%, y luego disminuyó moderadamente a concentraciones más altas (Harrower, 1976). Brennan et al. (1986) informaron de una mayor germinación en cirros diluidos. Los componentes de los cirros redujeron la germinación a una humedad relativa de 10-60%. Una vez que las esporas se dispersan, los efectos estimulantes del fluido de cirros son probablemente insignificantes (Griffiths y Peverett, 1980).
A una humedad relativa de 35-45%, las esporas de S. tritici en cirros permanecieron viables al menos 60 días (Gough y Lee, 1985). Los componentes de los cirros pueden actuar como inhibidores de la germinación de las esporas, o el alto potencial osmótico de los cirros puede impedir la germinación. Las picnidiosporas de S. nodorum no sobrevivieron durante 24 horas a una humedad relativa superior a 80% a 20 C. Las esporas sobrevivieron dos semanas o más a una humedad relativa <10% (Griffiths y Peverett, 1980). Cuando el fluido cirroso de S. nodorum se diluyó con agua, aproximadamente dos tercios de las picnidiosporas perdieron viabilidad en 8 horas, y después de 30 horas a la luz del día, sólo 5% germinaron. Cuando las esporas se almacenaron en la oscuridad, 40% siguieron siendo viables después de 30 horas (Brennan et al., 1986).
Conidios secos de S. nodorum, a la sombra y a la luz solar directa, sobrevivieron a la intemperie al menos 56 horas (Fernandes y Hendrix, 1986a). La germinación de las picnidiosporas de S. nodorum fue inhibida por la UV-B continua (280-320 nm), mientras que la germinación de las de S. tritici no lo fue. La extensión del tubo germinativo bajo UV-B continua fue inhibida para ambos hongos, en comparación con la oscuridad (Rasanayagam et al., 1995).
Infección por Septoria nodorum
El proceso de penetración en el huésped y el desarrollo de S. nodorum dentro de la hoja fue examinada en detalle por varios investigadores (Baker y Smith, 1978, Bird y Ride 1981, Karjalainen y Lounatmaa, 1986; Keon y Hargreaves, 1984; Straley, 1979; Weber, 1922). Las picnidiosporas tienden a alojarse en las depresiones entre dos células epidérmicas, y muchos intentos de penetración en las hojas comienzan allí. Las esporas germinan en la superficie de la hoja en respuesta a la humedad libre (Fernandes y Hendrix, 1986b). Comienzan a germinar 2-3 horas después de la deposición, y después de 8 horas la germinación puede alcanzar 90%. La penetración en la hoja comienza unas 10 horas después de la deposición de las esporas (Bird y Ride, 1981; Brönnimann et al., 1972; Holmes y Colhoun, 1974).
Al inicio de la germinación, el tubo germinativo está rodeado de un material amorfo que se adhiere a la hoja. Los tubos germinativos que crecen desde cualquiera de los extremos de una espora y desde las células intercalares tienden a crecer a lo largo de las depresiones entre las células y a menudo se orientan a lo largo del eje largo de la hoja (O'Reilly y Downes, 1986). Las hifas de las esporas que no están en las depresiones crecen al azar con ramificaciones ocasionales (Straley, 1979). Se forma un apresorio con una púa de infección que penetra la cutícula y las paredes periclinales de las células epidérmicas directamente en el lumen celular, lo que provoca la muerte rápida de las células.
Muchas penetraciones son primero subcuticulares o el crecimiento lateral de una hifa ocurre dentro de la pared celular antes del crecimiento hacia el citoplasma (Bird y Ride, 1981; O'Reilly y Downes, 1986). La penetración a través de estomas abiertos y cerrados también se produce y puede ser más rápida que la penetración directa (Harrower, 1976; Jenkins, 1978; O'Reilly y Downes, 1986; Straley, 1979). Los tubos germinativos se ramifican en los estomas y en las uniones de las células epidérmicas. La penetración de un tubo germinativo en un estoma puede producirse sin formación de un apresorio. En ocasiones, la penetración se produce a través de los tricomas (Straley, 1979). Aparentemente, la mayoría de los intentos de penetración fracasan, formándose densas papilas en las células en el lugar del intento de penetración (Karjalainen y Lounatmaa, 1986; Bird y Ride, 1981).
Tras la penetración, las células epidérmicas mueren rápidamente y se lignifican, y las hifas crecen hacia el mesófilo. Las células del mesófilo se deforman y el material lignificado se deposita en el exterior de algunas células, que se colapsan. La lignificación se produce antes de que las hifas alcancen la célula. El proceso es el mismo en todos los cultivares, pero se desarrolla más lentamente en los cultivares resistentes. Las hifas crecen intercelularmente entre las células epidérmicas y después en el mesófilo. Cuando penetran en el mesófilo, el deterioro del cloroplasto comienza en 6-9 días (Karjalainen y Lounatmaa, 1986).
Sin embargo, la tasa fotosintética empieza a disminuir un día después de la infección y antes de que los síntomas sean visibles (Krupinsky et al, 1973). El tejido esclerénquima alrededor de los haces vasculares impide la infección del tejido vascular. Los haces vasculares bloquean la propagación de las hifas a través del mesófilo, excepto cuando el tejido esclerénquima es joven y no está completamente formado (Baker y Smith, 1978).
Stagonospora nodorum libera una amplia gama de enzimas que degradan la pared celular, como amilasa, pectina metil esterasa, poligalacturonasas, xilanasas y celulasa in vitro y durante la infección de hojas de trigo (Baker, 1969; Lehtinen, 1993; Magro, 1984). La información relacionada con la degradación de la pared celular por las enzimas concuerda con las observaciones histológicas. Estas enzimas pueden actuar conjuntamente con las toxinas. La sensibilidad enzimática puede estar relacionada con la resistencia y la tasa de colonización fúngica (Magro, 1984). Como muchos necrótrofos, los patógenos Septoria y Stagonospora producen compuestos fitotóxicos in vitro. El deterioro celular y la muerte antes del crecimiento hifal en el tejido mesófilo (Bird y Ride, 1981) es consistente con la producción de toxinas. Sin embargo, no se ha establecido un papel definitivo para las toxinas en el proceso de infección y su relación con la resistencia del huésped (Bethenod et al, 1982; Bousquet et al, 1980; Essad y Bousquet, 1981; King et al, 1983). Las diferencias en el rango de hospedadores entre las cepas de trigo y cebada adaptadas de S. nodorum puede estar relacionada con la producción de toxinas (Bousquet y Kollmann, 1998). El inicio de la germinación de las esporas y el porcentaje de esporas germinadas no están influidos por la susceptibilidad del hospedador (Bird y Ride, 1981; Morgan 1974; Straley, 1979; Straley y Scharen, 1979; Baker y Smith, 1978).
Bird y Ride (1981) informaron que la extensión de los tubos germinativos en la superficie de la hoja era más lenta en los cultivares resistentes que en los susceptibles. Este mecanismo, expresado al menos 48 horas después de la deposición de las esporas, indica una resistencia a la elongación de los tubos germinativos previa a la penetración. Hubo menos penetraciones exitosas en cultivares resistentes, y la penetración procedió más lentamente en cultivares resistentes (Baker y Smith, 1978; Bird y Ride, 1981). Se propuso que la lignificación limitaba la infección tanto en cultivares resistentes como susceptibles, pero otros factores ralentizaban el desarrollo del hongo en las líneas resistentes. En las líneas susceptibles, las hifas de crecimiento más rápido pueden escapar a la lignificación de las células huésped.Cuatro días después de la inoculación de cebada con un aislado de biotipo de trigo de S. nodorum, las hifas crecían a través de la cutícula y a veces en las capas externas de celulosa de las paredes celulares epidérmicas. Debajo de las hifas de penetración se depositaban papilas gruesas que no penetraban en las células (Keon y Hargreaves, 1984).
Infección por Septoria passerinii: Green y Dickson (1957) presentan una descripción detallada del proceso de infección de S. passerinii en la cebada. El proceso de infección es similar al S. tritici. Al igual que S. tritici, el tiempo necesario para la penetración en las hojas es considerablemente mayor que el de S. tritici. S. nodorum. Los tubos germinativos se ramifican y crecen sobre la superficie de la hoja al azar, pero a veces a lo largo de depresiones entre células epidérmicas. La penetración en la hoja se produce casi exclusivamente a través de los estomas. Las hifas germinativas se hinchan y, si la penetración no tiene éxito, las hifas siguen alargándose. No se produce penetración 48 horas después de la deposición de las esporas. Después de 72 horas, los tubos germinativos se engrosan sobre los estomas, crecen entre las células protectoras y en las caras urfales de las células accesorias y en las cavidades substomáticas. La penetración directa entre las células epidérmicas sólo se observa en raras ocasiones.
La germinación de las esporas y la penetración en el huésped son las mismas en los cultivares resistentes y susceptibles. La extensión de las hifas dentro de las hojas es mucho menor en los cultivares resistentes y se observan papilas en muchas paredes celulares, pero no en todas. Las hifas crecen bajo la epidermis de un estoma a otro, pero no penetran entre las células epidérmicas. El mesófilo está colonizado, pero no se forman haustorios. Cuando las células del mesófilo se necrosan, las células epidérmicas se colapsan. El desarrollo micelial en la hoja es escaso y suele estar bloqueado por haces vasculares. En las hojas más jóvenes, si la vaina vascular está menos desarrollada, las hifas pasan entre el haz y la epidermis. Los picnidios se forman en cavidades substomáticas, principalmente en la superficie superior de la hoja (Green y Dickson, 1957).
Factores que afectan a la longevidad de las esporas en la superficie de la hoja Entre los patógenos Stagonospora y Septoria de los cereales, sólo se dispone de información definitiva sobre el proceso de infección en el caso de S. nodorum, S. triticiy S. passerinii. Al igual que muchos otros patógenos necrótrofos, ninguno de los dos grupos de patógenos provoca la reacción de hipersensibilidad. Una diferencia significativa en el proceso de infección entre los patógenos Septoria y Stagonospora es que la germinación y penetración de las esporas es mucho más rápida en el caso de Septoria y Stagonospora. S. nodorum que para S. tritici y S. passerinii. Esto influye considerablemente en la epidemiología de las enfermedades.
Los patógenos de Septoria penetran en la planta principalmente a través de los estomas, mientras que S. nodorum penetra tanto directamente como a través de los estomas. S. nodorum penetra y mata rápidamente las células epidérmicas, pero S. tritici y S. passerinii no matan las células epidérmicas hasta que las hifas se han ramificado a través del mesófilo de la hoja y comienza una rápida necrosis. Los estudios histológicos del crecimiento del hongo tras la penetración en el hospedador coinciden con los datos generados por los estudios epidemiológicos de la resistencia del hospedador. La resistencia ralentiza la tasa de colonización del hospedador, pero no tiene un efecto apreciable en el proceso de desarrollo de la lesión.
Los mecanismos que controlan la respuesta del hospedador, ya estén relacionados con enzimas y toxinas u otros metabolitos liberados por los patógenos durante la infección, aún no están claros. Existe poca información sobre la infección por ascosporas. El proceso de infección es probablemente muy similar al de las picnidiosporas. Las ascosporas de Phaeosphaeria nodorum germinan en un amplio rango de temperaturas y sus tubos germinativos penetran directamente en la hoja. Sin embargo, según Rapilly et al. (1973), las ascosporas, a diferencia de las picnidiosporas, no germinan en agua libre.
Modelo de infección por Septoria spp.
Las infecciones por Septoria son posibles a bajas temperaturas, mientras que las temperaturas inferiores a 7°C pueden no provocar una infección en un plazo de 2 días. La temperatura óptima de la enfermedad se alcanza en la zona de 16 a 21°C. Las infecciones son posibles en un periodo de alta humedad relativa o de humedad foliar de 14 horas o más. Para cumplir las condiciones hemos decidido separar en modelos las infecciones débiles, moderadas y graves. Las infecciones débiles pueden darse si es posible que el patógeno infecte el tejido del huésped. Esto significa que las infecciones débiles pueden tener lugar si las temperaturas son mínimas y los periodos de humedad de las hojas tienen una duración crítica. Una infección moderada tendrá lugar en condiciones en las que la mayoría de los ensayos de infecitón conducen a resultados razonables y las infecciones graves tienen lugar en condiciones en las que el patógeno dispone de condiciones óptimas para la infección.

Comienza la infección tras una lluvia de 0,5 mm. Decidimos no utilizar un modelo para la formación de picnidios. Se supone que la condición necesaria para la formación de picnidios es un periodo con una humedad relativa superior a 85%. Se espera que el tiempo de vida de los picnidios sea de 24 horas. En todos los climas en los que Septoria tritici tiene posibilidades de infectar, encontraremos 2 horas cumpliendo estas condiciones casi todos los días alrededor de la salida del sol.
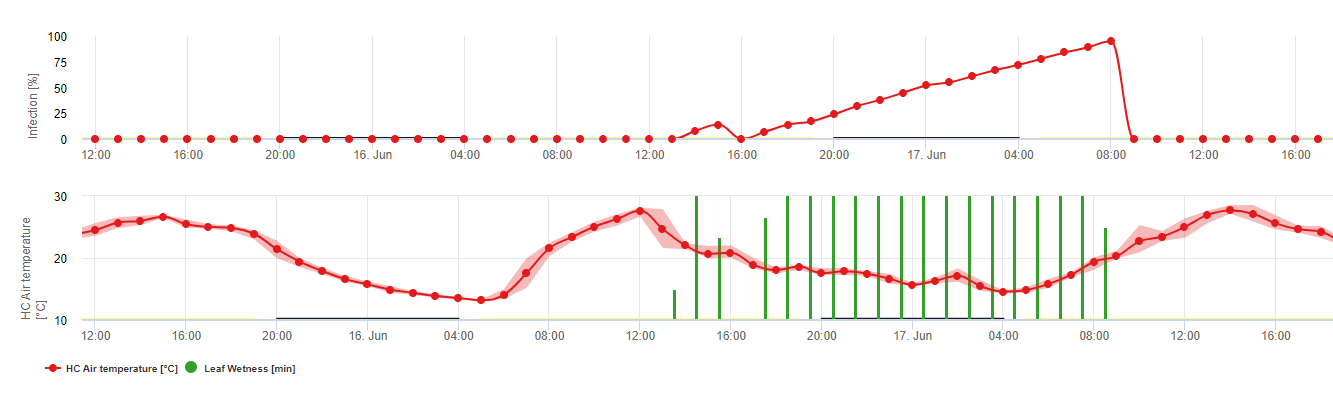
Evaluación de la gravedad de la infección: Para poder evaluar la presión de la infección por Septoria tritici entre el estadio 10 (primera hoja a través del coleóptilo) y el estadio 32 (segundo nudo al menos 2 cm por encima del primer nudo) y entre el 32 y el 51 (inicio del espigado), debemos evaluar la gravedad de las infecciones en función de las condiciones climáticas. Esta evaluación se realiza en una escala de 1 a 5. Se da una gravedad de 1 si la infección es grave. Se da una severidad de 1 si se cumplen las condiciones para una infección débil y ha llovido menos de 5 mm, de lo contrario el valor de severidad correspondiente será 2. Se da una severidad de 3 si se cumplen las condiciones para una infección débil y ha llovido menos de 5 mm, de lo contrario el valor de severidad correspondiente será 2. La gravedad será 3 si se cumple la condición de infección moderada y ha llovido menos de 5 mm. Si ha llovido más de 5 mm durante una infección moderada o menos de 5 mm durante una infección grave, la gravedad será 4.
Una infección grave con más de 5 mm de lluvia corresponde a un valor de gravedad de 5.
Septoria tritici evaluación de la presión de la enfermedad: El clima es sólo uno de los factores que determinan la presión de la enfermedad en el campo. Los otros dos factores son el historial del campo y la susceptibilidad de la variedad cultivada. Si podemos acumular los valores de severidad de la enfermedad desde el estadio 10 al 32 hasta un valor de 4, podemos esperar una presión débil de la enfermedad por el clima. Si este valor alcanza 6 podemos esperar una presión moderada de la enfermedad y si alcanza 10 podemos esperar una alta presión de la enfermedad por el clima. Conocer la susceptibilidad de la variedad y el historial del campo nos llevará a pulverizar o no sobre una presión de enfermedad débil o moderada en esta situación. Tener un valor acumulado de 10 puede conducir a una pulverización en la fase 32 de todos modos. La decisión de pulverizar en una fase posterior depende más del clima primaveral. Si somos capaces de acumular los valores de severidad desde el estadio 10 hasta un valor de 6, podemos esperar una presión débil de la enfermedad. Si este valor alcanza 10 podemos esperar una presión moderada de la enfermedad y si este valor alcanza 15 podemos esperar una alta presión de la enfermedad debido a la situación climática.
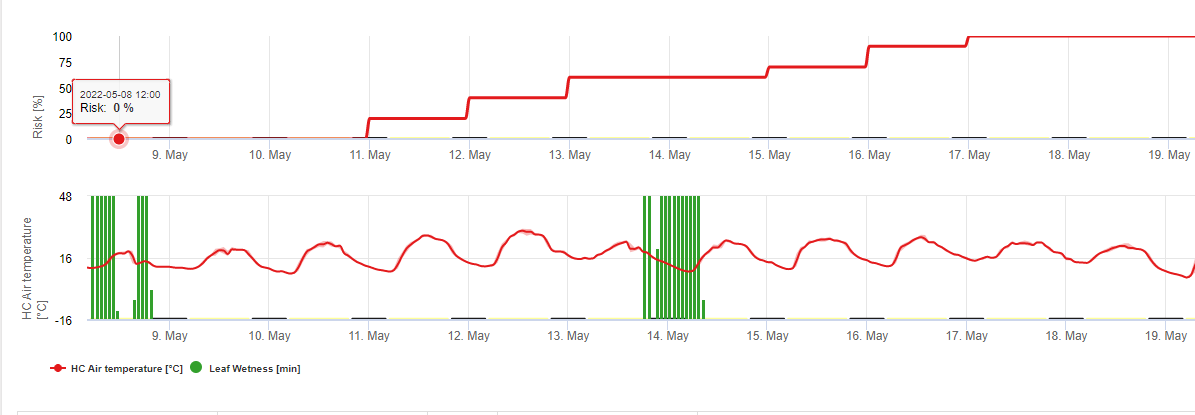
En FieldClimate mostramos el Septoria tritici Severidad junto con las tres diferentes severidades de infección en un gráfico (véase arriba). Debido a las precipitaciones y a los largos periodos de humedad de las hojas, se dan las condiciones para una infección grave por S. tritici han sido campo lleno los días 14 y 16 de mayo. Los niveles de gravedad alcanzan el valor más alto de 5 el 14 de mayo, lo que significa que ahora hay un alto riesgo de infección.
La biología de la infección por Stagonospora nodorum difiere en cierta medida de la de S. tritici, pero esta diferencia no es lo suficientemente grande como para crear un modelo independiente. Por lo tanto, sugerimos utilizar este modelo para todo el complejo de enfermedades causadas por Stagnospora y Septoria en cereales, incluyendo S. passerinii. S. tritici y S. passerinii tienden a necesitar periodos de humectación de la hoja más largos que S. nodorum. En zonas con una alta presión de S. nodorum Las infecciones clasificadas como débiles, con un valor de gravedad de 2, deben tratarse con más seriedad que en otros ámbitos.
Para Septoriosis nodular En FieldClimate se muestra un modelo de riesgo (véase más arriba). Se determinó un riesgo elevado el 17 de junio y el 7 de julio (100%). Dependiendo de la fase de la planta susceptible a la infección, deben tenerse en cuenta las medidas fitosanitarias si el riesgo alcanza los 80% (véase también la previsión meteorológica, protección fitosanitaria). Si el riesgo es de 100% y ya se ha detectado una infección, deben tomarse medidas fitosanitarias sistémicas (aplicación curativa) para proteger la planta.
Antracnosis
Varias especies de hongos fitopatógenos del género Colletotrichum causan la antracnosis en pimientos y muchas otras hortalizas y frutas. Hasta finales de la década de 1990, la antracnosis de los pimientos y los tomates sólo se asociaba a la fruta madura o en proceso de maduración. Desde entonces, se ha establecido una forma más agresiva de la enfermedad. Esta forma ataca a los pimientos en cualquier fase de desarrollo del fruto y puede amenazar la rentabilidad de los cultivos de pimiento en las zonas donde se establece. Esta enfermedad también puede afectar a los tomates, las fresas y, posiblemente, a otros cultivos de frutas y hortalizas.
Síntomas
Se desarrollan lesiones circulares o angulares hundidas en frutos inmaduros de cualquier tamaño. A menudo se forman múltiples lesiones en frutos individuales. Cuando la enfermedad es grave, las lesiones pueden unirse. A menudo se forman masas de esporas fúngicas de color rosa a naranja en anillos concéntricos en la superficie de las lesiones. En las lesiones más antiguas pueden observarse estructuras negras llamadas acérvulos. Con una lupa, parecen pequeños puntos negros; al microscopio parecen mechones de diminutos pelos negros. El patógeno forma esporas rápida y profusamente y puede propagarse con rapidez por todo un cultivo de pimiento, provocando una pérdida de rendimiento de hasta 100%. Las lesiones también pueden aparecer en tallos y hojas en forma de manchas marrones irregulares con bordes de color marrón oscuro.
Patógeno
Esta forma de antracnosis del pimiento está causada por el hongo Colletotrichum acutatum. El patógeno sobrevive en restos vegetales de cultivos infectados y en otras especies vegetales susceptibles. El hongo no se transmite por el suelo durante largos periodos en ausencia de restos vegetales infestados. El hongo también puede introducirse en un cultivo a través de semillas infestadas. Durante periodos cálidos y húmedos, las esporas son salpicadas por la lluvia o el agua de riego de la fruta enferma a la sana. La fruta enferma actúa como fuente de inóculo, permitiendo que la enfermedad se propague de planta en planta dentro del campo. El hongo sobrevive en y sobre las semillas. La antracnosis se introduce en el campo en trasplantes infectados o puede sobrevivir entre temporadas en restos vegetales o en malas hierbas. Los hospedadores alternativos incluyen malas hierbas y otras plantas de Solanaceae (tomate, patata, berenjena) aunque las infecciones de estos hospedadores son extremadamente raras en Florida. Los frutos se infectan cuando las esporas del hongo o los restos infestados son salpicados por la lluvia sobre las plantas de pimiento. Se producen nuevas esporas dentro del tejido infectado y luego se dispersan a otras frutas. Los trabajadores también pueden mover las esporas con el equipo o durante la manipulación de las plantas infectadas. La infección suele producirse cuando el tiempo es cálido y húmedo. Temperaturas en torno a 80° F (27° C) son las temperaturas óptimas para el desarrollo de la enfermedad, aunque la infección se produce tanto a temperaturas más altas como más bajas. Se producen graves pérdidas cuando llueve porque las esporas se lavan o salpican a otras frutas, lo que provoca más infecciones. Es más probable que la enfermedad se desarrolle en fruta madura que está presente durante un largo periodo en la planta, aunque puede ocurrir tanto en fruta inmadura como madura. La antracnosis puede infectar desde los 15 °C hasta los 30 °C. Pero a humedad de hoja larga para satisfacer las necesidades de una infección. A temperatura óptima de 20°C a 25°C aún 12 horas de humectación de las hojas son necesarios. Si la temperatura es más alta o más fría, se necesitarán periodos de humedad foliar aún más largos (no se necesita una función lineal para el cálculo). FieldClimate calcula los posibles eventos de infección basándose en la humedad de la hoja y las temperaturas durante este evento.
Mildiú velloso
Biología de Plasmopara viticola (Mildiú velloso)
P. viticola es un parásito obligado. Lo que significa que necesita órganos verdes y frescos de la vid para crecer. Durante el periodo libre de vegetación persiste formando cuerpos fructíferos, las llamadas oosporas. Las oosporas de los oomicetos pueden sobrevivir períodos muy largos en el suelo. Por ello, podemos encontrar mildiu velloso en lugares donde no es posible que se produzcan infecciones todos los años. En primavera, cuando la capa superior del suelo está lo suficientemente húmeda y caliente, las oosporas forman los llamados macrosporangios, que pueden liberar hasta 200 zoosporas en el agua libre. Las zoosporas se desplazan hasta las hojas y los racimos por el viento en gotas de agua. Tienen dos flagelos y se mueven en una película de agua en el envés de las hojas o los racimos y bayas jóvenes para encontrar un estoma y entrar en el tejido vegetal. Entran y germinan en el estoma, en el que transfieren todo su plasma en menos de una hora. En estudios microscópicos, el hallazgo del estoma, el enquistamiento y la germinación en el estoma finalizaron en 90 minutos.
P. viticola crece en el espacio intercelular y se alimenta de haustorias que penetran en las células epidérmicas y parenquimatosas. En función de la temperatura y la humedad relativa desarrolla suficiente crecimiento intercelular con suficientes haustorias para formar un cuerpo subestomático que llena toda la zona subestomática y que levanta el tejido epidérmico del tejido parenquimatoso. Esto da lugar al síntoma visible de la mancha de aceite.
Los oomicetos son esporulando en ausencia de luz cuando la humedad relativa es muy alto. En P. viticola no hay esporulación si las temperaturas son inferiores a 12°C y la humedad relativa es inferior a 95%. Los esporangióforos están formados por las vesículas substomatélicas y saldrán del estoma. Los esporangios recién formados son pegajosos y sólo pueden desprenderse de los esporangióforos con agua. Cuando disminuye la humedad relativa, los esporangios se vuelven pegajosos y también pueden ser eliminados por el viento.
Los esporangios liberan hasta 20 zoosporas en el agua libre. Estas zoosporas también tienen que ser distribuidas por el viento en gotitas de agua para llegar a las hojas frescas, o los esporangios pueden ser distribuidos por la lluvia o el propio viento. El proceso de infección primaria y secundaria es el mismo.
Dada la gran importancia de la fase sexual para la hibernación del patógeno, podemos suponer que los tipos de apareamiento encajan en todos los viñedos en los que se da el mildiu de la vid. La formación de zoosporas tiene lugar en las hojas más viejas durante el verano y principios del otoño.
Infección primaria en detalle
Las infecciones procedentes de las oosporas se denominan infecciones primarias. Este término es engañoso, ya que pueden producirse varias infecciones primarias a principios del verano. En los eventos epidemiológicos, la infección primaria no desempeña un papel importante si hay suficientes manchas de aceite en los viñedos y el potencial de infección de las esporas de verano (esporangios) supera al de las oosporas.
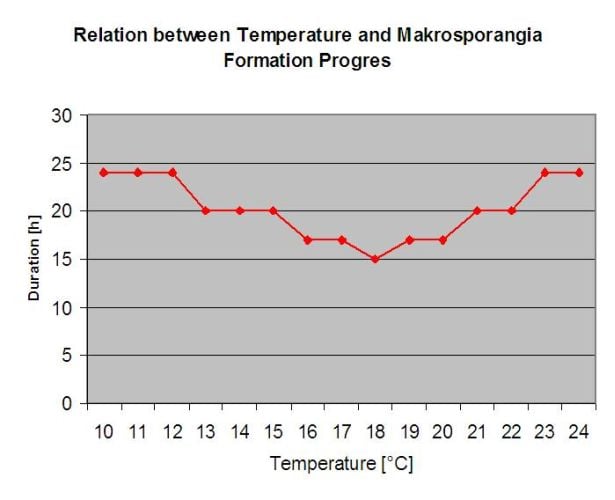
Las oosporas invernantes se convierten en los llamados macrosporangios cuando hay suficiente humedad relativa durante unas 24 horas. Los macrosporangios liberan sus zoosporas en el agua libre y la lluvia intensa (como en una tormenta eléctrica). Las esporas son transportadas a las hojas de la vid y/o a los brotes verdes. Infecciones primarias, por tanto, necesitan más tiempo lluvioso periodos o varias tormentas sucesivas. La primera lluvia hace que las hojas caídas se saturen de agua y las fuertes lluvias de los días siguientes hacen que los macrosporangios liberen sus zoosporas, que alcanzan las hojas o los sarmientos de la vid. Para que la infección tenga éxito, es necesario un periodo de humectación de las hojas suficientemente largo para que las zoosporas alcancen el estoma de las hojas o los sarmientos y los infecten (la ilustración anterior muestra el ciclo de desarrollo del mildiú velloso de la vid (Plasmopara viticola).
El Modelo para la infección primaria de Mildiu velloso comprueba primero, si el clima es adecuado para el desarrollo de macrosporangios. Este es el caso siempre y cuando las hojas estén húmedas, o la humedad relativa después de la lluvia no caiga por debajo de 70%. Dependiendo de la temperatura, los macrosporangios pueden desarrollarse en un plazo de 16 a 24 horas. Si hay macrosporangios maduros, se mostrará gráficamente en la pantalla de la infección primaria de Mildiú velloso. Si hay macrosporangios, una lluvia fuerte puede propagar sus zoosporas. Una lluvia continua de 5 mm se interpreta como una lluvia fuerte y las zoosporas se esparcen, una infección primaria es entonces posible si la humedad de la hoja ha durado lo suficiente.
Infecciones secundarias
Infecciones secundarias de Plasmopara viticola sólo son posibles si ya existen manchas de aceite maduras en su viñedo o cerca de él. Las manchas de aceite son maduras cuando son capaces de esporular (producir esporangios). Los esporangios sólo se producen noche. La luz solar inhibe la esporulación. Los esporangios se producen si más de 12°C y el humedad relativa es muy elevada. La tasa de producción de esporangios aumenta con la temperatura hasta 24°C. La temperatura óptima para la esporulación en las variedades de uva europeas (Vitis vinifera) es de unos 24°C. Si las temperaturas superan los 29°C, no puede producirse esporulación. En nuestro modelo comprobamos si humedad superior a 95% se produce durante la noche. Si esta condición se prolonga durante una temperatura horaria acumulada de más de 50°C, la esporulación finaliza y aparecen nuevos esporangios de Plasmopara existen en el viñedo. Por ejemplo, 50°C horas corresponden a 4 horas con 13°C o 3 horas con 17°C.
El siguiente gráfico muestra la relación entre la temperatura y las condiciones de humedad (humedad relativa, humedad foliar, precipitaciones) que se utilizan para modelizar los episodios de infección en fieldclimate.com.
Esporangios de Plasmopara viticola tienen una vida útil limitada. Cuanto más calor hace y más seco está el aire, más rápido mueren (en ng.fieldclimate.com se pone a 0 cuando la h.r. es inferior a 50%). Mueren definitivamente en el siguiente periodo de rocío o de humedad de las hojas, que es demasiado corto para la infección. Por tanto, la aptitud de los esporangios más viejos es bastante limitada. Nuestro modelo supone que la vida de los esporangios se limita a un día.
Para causar nuevas infecciones, los esporangios deben distribuirse. Hay dos formas de distribuir las esporas: Si llueve inmediatamente después de la formación de los esporangios, éstos se propagan con las salpicaduras de lluvia. Si las hojas de la vid permanecen el tiempo suficiente mojadas, se produce una Plasmopara viticola se produce la infección. Si la mañana siguiente comienza sin lluvia y con humedad decreciente, los esporangios desecados se desprenden de sus ramas. Incluso un ligero movimiento de aire los llevará a las hojas sanas. A menos que llueva pronto, morirán.
Mildiú velloso Infección primaria
Las infecciones se muestran tras el desarrollo de las macrosporas (naranja, quinto gráfico) en tres clases de gravedad diferentes (débil: naranja, moderada: verde, grave: rojo) en función de la cantidad de lluvia y, por tanto, de la distribución de las esporas en el viñedo. Si se determina la infección por 100% se han dado las condiciones óptimas para entrar en el tejido vegetal (curativo fitosanitario) y la curva de incubación (primer gráfico) empieza a aumentar. Si la incubación termina (100%) y no se ha tenido en cuenta la protección fitosanitaria se deberían haber comprobado los síntomas (manchas de aceite) en el campo.
1. La curva de progreso de la infección y, tras la infección completa, el consiguiente periodo de incubación (tiempo transcurrido entre la infección y los síntomas visibles en el campo).
2. Se determina una curva de progreso de la infección cuando hay macrosporangios o esporangios y las hojas están húmedas. Aumenta con la humedad de las hojas y la temperatura. Si la curva de progreso de la infección alcanza 100%, se puede suponer que la infección se ha completado. La curva de progreso de la incubación que pertenece a la infección específica se empieza a calcular con el inicio de una infección. Si una infección no puede completarse, la curva de incubación también se detendrá.
3. Las condiciones meteorológicas se muestran en la misma página que los resultados del modelo de la enfermedad. Por lo tanto, puede comprobar de un vistazo la temperatura, la humedad relativa, la lluvia y la humedad de las hojas durante la infección.
4. El modelo señala las fechas de infección para las infecciones primarias y secundarias de mildiu de la vid. Esta es la información más crítica. Las infecciones, que aún no han sido cubiertas por fungicidas preventivos o curativos, pueden ser desastrosas para el rendimiento/la calidad. Además, la información sobre la gravedad de la infección (débil/moderada/grave) podría ser útil para decidir la estrategia fitosanitaria en función del historial del viñedo (cantidad de inóculo), la variedad y la experiencia de los años anteriores.
Estrategias fitosanitarias
- Los fungicidas profilácticos y sistémicos o curativos se utilizan ampliamente para el control del mildiú velloso. Los productos químicos profilácticos se aplican antes, pero lo más cerca posible de un evento de infección en el período de mayor susceptibilidad del huésped, entre la longitud de los brotes de 10 cm y las bayas del tamaño de un guisante.
- También se pueden utilizar productos químicos profilácticos pulverizando lo más cerca posible antes de una previsión meteorológica de lluvia de más de 2 mm (para el círculo primario).
- El fungicida curativo debe aplicarse lo antes posible después de un evento de infección (infección 100%) y antes de que aparezcan las manchas de aceite. Tenga en cuenta la prevención del desarrollo de resistencia a los fungicidas.
- El seguimiento del viñedo para detectar la presencia de mildiu (manchas de aceite) debe hacerse con regularidad y teniendo en cuenta al menos 200 vides. Se considera que existe riesgo si se observan más de dos manchas por cada 50 cepas.
El modelo se basa en las publicaciones de MUELLER-THURGAU, ARENS, MUELLER y SLEUMER, BLAESER, HERZOG, GEHMANN y muchos otros trabajadores relacionados con la red de investigación sobre la epidemiología del mildiu y el oídio de la vid desde principios del siglo XIX.
Oidio
El oídio del tomate puede estar causado por tres patógenos en todo el mundo.
Leveillula taurica (Oidiopsis taurica) es un patógeno de una amplia gama de especies hospedadoras en climas cálidos áridos a semiáridos de Asia, el Mediterráneo, África y, más recientemente, el suroeste de Estados Unidos.
Erysiphe orontii (E. cichoracearum y E. polyphaga) es otra especie común a muchas plantas hospedadoras tanto en regiones templadas como tropicales.
Y como tercera especie Odium lycopersicum.
Factores de desarrollo de la enfermedad
- niveles de humedad relativa > 50% (HR óptima > 90%)
- no es necesario que haya agua libre en la superficie de las hojas
- Rango de temperaturas: 10-35 °C (mejor por debajo de 30 °C)
El oídio es una enfermedad impulsada por el inóculo. Por lo tanto, sólo se pueden determinar los periodos de riesgo, el factor principal para el daño, por ejemplo, el brote es el inóculo inicial (que es activo en un amplio rango de temperatura). Así que para las estrategias de control: ¡combinar el modelado del periodo de riesgo junto con la monitorización del inóculo fúngico (enfermedad) en el campo!
Tomate de campo abierto
Roya del espárrago
Roya del espárrago Puccinia asparagi se ve favorecida por un clima húmedo y cálido. Pequeñas cantidades de lluvia y viento distribuirán las urediasporas, mientras que las fuertes lluvias pueden arrastrarlas hasta el suelo. Por esta razón, un periodo de humedad de la hoja con más de 10 mm de lluvia no se considera un periodo de infección. Los periodos de humedad foliar debidos a lluvias ligeras y rocíos de 3 a 8 horas con temperaturas de 25°C a 10°C pueden ser periodos de infección para las urediasporas en verano y a finales de verano.
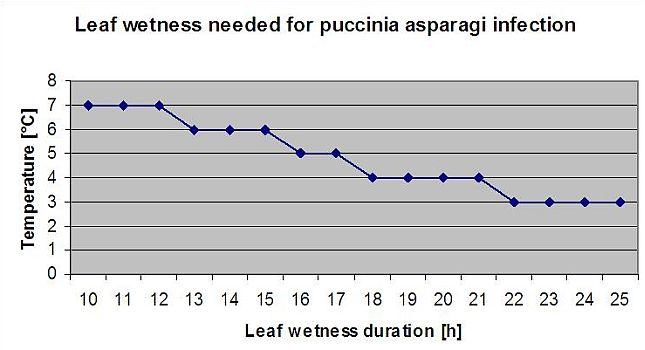
Tizón de la hoja del Stemphylium
Stemphylium El tizón de la hoja está causado por el hongo Stemphylium vesicarium. En las hojas aparecen lesiones pequeñas, de color amarillo claro a marrón y empapadas de agua. Estas pequeñas lesiones crecen hasta convertirse en manchas alargadas que con frecuencia se unen dando lugar a hojas marchitas. Las lesiones suelen adquirir un color entre marrón claro y tostado en el centro y, posteriormente, entre marrón oliva oscuro y negro a medida que se desarrollan las esporas de este patógeno. S. vesicarium normalmente invade el tejido muerto y moribundo de la cebolla, como las puntas de las hojas, las lesiones de mancha púrpura y mildiú velloso, el tejido lesionado y el tejido senescente. La infección suele limitarse a las hojas y no se extiende a las escamas del bulbo. Las lesiones suelen producirse en el lado de la hoja orientado hacia el viento dominante. Los largos periodos de calor y humedad favorecen el desarrollo de la enfermedad.
Stemphylium versicarium El modelo se basa en los trabajos de SUHERI y PRICE en la cebolla y de LLorent, VILARDELL, BUGIANI, GHERARDI y MONTESINO en la pera. Se calculan curvas de infección para infecciones débiles, moderadas y graves. Depende de la historia de la enfermedad de la localización si un tratamiento tiene que ser tomado en consideración por una infección débil, moderada o fuerte.
Con esta separación en situaciones favorables, moderadamente favorables y muy favorables, corresponde al agricultor decidir la magnitud de la presión de la enfermedad en un campo concreto y si tiene que cubrir una infección específica.
Temperatura: 11-30°C
Humedad de la hoja > 0 (inicio de la infección) o humedad relativa > 90% (sólo si ya había una infección antes del cálculo y aún persiste)
Infección leve (11-30°C), infección moderada (13-30°C), infección grave (16-30°C), una matriz con la duración de la humedad de la hoja (véase más arriba).
Reset: si la humedad rel. es inferior a 70%.
S. versicarium infecciones existe a menudo junto con Alternaria porri infecciones. Por ello, el modelo TomCast (Alternaria) se utiliza con bastante frecuencia para ambas.
Mancha foliar por Cercospora
Este modelo estima la fecha de la primera aparición de C. beticola sobre la base de las temperaturas medias diarias acumuladas desde el 1 de enero superiores a 5°C. Se toma el umbral de 1006,2°C en periodos con humedad relativa superior a 60% y si no tuviéramos humedad relativa es válido un umbral de 1081,9°C.
Este modelo se ha desarrollado para Italia y se utiliza en Italia y Alemania.
Para el año 2010 en Estiria, CercoPrim indica el 19 de junio para la primera pulverización. Esta es aproximadamente la misma fecha que el modelo de riesgo Pessl Instruments o el modelo DIV habrían indicado para esparcir las variedades susceptibles.
Enfermedad de la mancha púrpura
El patógeno
La enfermedad de la mancha púrpura en espárragos y helechos está causada por el hongo Stemphylium vesicarium. El hongo sobrevive al invierno en forma de esporas sexuales (ascosporas) en un saco (ascus) que se produce en estructuras que pasan el invierno (pseudotecios) y que aparecen como pequeños puntos negros en los restos de espárragos de la temporada anterior. El sitio las ascosporas son liberadas del ascus por la lluvia y pueden ser transportadas por el viento hasta las plantas de espárrago recién emergidas, donde causan la infección primaria de la temporada de cultivo. Estas nuevas infecciones dan lugar a esporas (conidios) producidas por un proceso asexual, que a su vez pueden causar infecciones secundarias, un proceso que se repite mientras las temperaturas y las precipitaciones sean favorables.
La enfermedad
La aparición de la mancha púrpura como problema importante en la producción de espárragos en Michigan puede deberse a la adopción de un sistema de cultivo sin laboreo, según el cual el helecho seco de la temporada anterior se pica en abril y se deja en la superficie del suelo. Este residuo persiste durante la temporada de cosecha (mediados de junio) y es visible durante el periodo de crecimiento del helecho (de finales de junio a septiembre) y es la fuente de ascosporas que inician las infecciones a principios de la temporada de crecimiento. Los síntomas de la enfermedad son La enfermedad aparece como numerosas manchas violáceas ligeramente hundidas con centros marrones que aparecen en los turiones y helechos cosechados. Las lesiones en los turiones suelen encontrarse en el lado de barlovento, ya que la arena que sopla causa heridas que favorecen la infección. Durante los años epidémicos pueden producirse manchas en 60-90% los turiones, lo que puede provocar el rechazo de la cosecha, especialmente para la venta en el mercado fresco. Las manchas también aparecen en los helechos espárrago, afectando al tallo principal, las ramas secundarias y las agujas (cladofilas). Una infección grave del helecho puede provocar la defoliación prematura de la planta. El aumento de la gravedad de la enfermedad de la mancha púrpura se asocia a periodos prolongados de precipitaciones, niebla o rocío.
Créditos del texto: Mary K. Hausbeck, Profesora y Extensionista Especialista, Universidad Estatal de Michigan, Departamento de Patología Vegetal, E. Lansing
TomCast para espárragos
Antecedentes: TOMCAST (TOMato disease foreCASTing) es un modelo informático basado en datos de campo que intenta predecir el desarrollo de enfermedades fúngicas, a saber Tizón temprano, mancha foliar por Septoria y antracnosis en los tomates. Los registradores de datos colocados en el campo registran cada hora la humedad y la temperatura de las hojas. Estos datos se analizan durante un periodo de 24 horas y pueden dar lugar a la formación de un Valor de Gravedad de la Enfermedad (VGE); básicamente, un incremento del desarrollo de la enfermedad. A medida que se acumulan DSV, la presión de la enfermedad sigue aumentando en el cultivo. Cuando el número de DSV acumulados supera el intervalo de pulverización, se recomienda una aplicación de fungicida para aliviar la presión de la enfermedad.
TOMCAST deriva del modelo original F.A.S.T. (Forecasting Alternaria solani on Tomatoes) desarrollado por los doctores Madden, Pennypacker y MacNab en la Universidad Estatal de Pensilvania (PSU). El modelo F.A.S.T. de la PSU fue modificado posteriormente por el Dr. Pitblado en el Ridgetown College de Ontario en lo que ahora reconocemos como el modelo TOMCAST utilizado por la Extensión Universitaria del Estado de Ohio.
DSV son: Un Valor de Gravedad de la Enfermedad (VGE) es la unidad de medida dada a un incremento específico del desarrollo de la enfermedad (tizón temprano).
En otras palabras, un DSV es una representación numérica de la rapidez o lentitud con que se acumula la enfermedad (tizón temprano) en un campo de tomates. El DSV viene determinado por dos factores: la humedad de la hoja y la temperatura durante las horas de "humedad de la hoja". A medida que aumenta el número de horas de humedad de la hoja y la temperatura, el DSV se acumula a un ritmo más rápido. Vea la Tabla de Valores de Severidad de la Enfermedad a continuación.
Por el contrario, cuando hay menos horas de humedad foliar y la temperatura es más baja, los DSV se acumulan lentamente, si es que lo hacen. Cuando el número total de DSV acumulados supera un límite preestablecido, denominado intervalo o umbral de pulverización, se recomienda una pulverización fungicida para proteger el follaje y el fruto del desarrollo de la enfermedad.
El intervalo de pulverización (que determina cuándo se debe pulverizar) puede oscilar entre 15 y 20 DSV. El DSV exacto que debe utilizar un agricultor suele proporcionarlo el transformador y depende de la calidad del fruto y del uso final de los tomates. Seguir un intervalo de pulverización de 15 DSV es un uso conservador del sistema TOMCAST, lo que significa que pulverizará con más frecuencia que un agricultor que utilice un intervalo de pulverización de 19 DSV con el sistema TOMCAST. La compensación está en el número de pulverizaciones aplicadas durante la temporada y la posible diferencia en la calidad de la fruta.
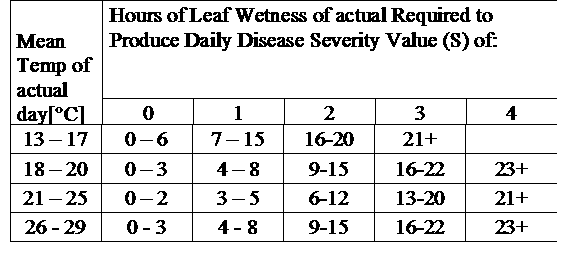 TomCast con espárragos
TomCast con espárragos
La investigación ha determinado que el pronosticador de enfermedades Tom-Cast es una alternativa prometedora a la fumigación de helechos basada en el calendario en los campos de espárragos comerciales. Tom-Cast alerta a los cultivadores cuando la las condiciones ambientales son favorables para el desarrollo de la enfermedad de la mancha púrpura (periodos prolongados de rocío o lluvia acompañados de temperaturas cálidas). Los fungicidas eficaces aplicados según el pronosticador de enfermedades Tom-Cast permiten a los productores controlar la enfermedad de la mancha púrpura del espárrago, al tiempo que ahorran dinero y preservan el medio ambiente.
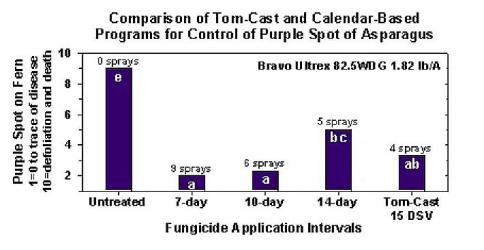
Crédito del texto: Jim Jasinski, Coordinador de TOMCAST para OHIO, INDIANA y MICHIGAN
Modelo de infección por mancha púrpura
En Stemphylium versicarium El modelo de infección se basa en los trabajos de SUHERI y PRICE en cebolla y LLorent, VILARDELL, BUGIANI, GHERARDI y MONTESINO en pera.
Se calculan las curvas de infección para infecciones leves, moderadas y graves.
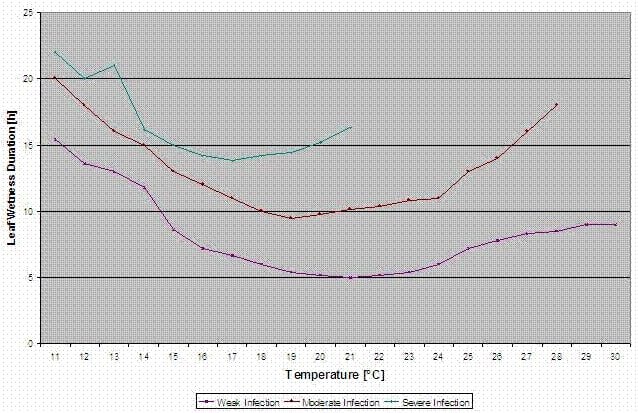
Con esta separación en situaciones favorables, moderadamente favorables y muy favorables, corresponde al agricultor decidir la magnitud de la presión de la enfermedad en un campo concreto y si tiene que cubrir una infección específica.
Condiciones:
Temperatura: 11-30°C
Humedad de la hoja > 0 (inicio de la infección) o humedad relativa > 90% (sólo si ya había una infección antes del cálculo y aún persiste)
Infección leve (11-30°C), infección moderada (13-30°C), infección grave (16-30°C), una matriz con la duración de la humedad de la hoja (véase más arriba).
Reset: si la humedad rel. es inferior a 70%.
Equipamiento recomendado
Compruebe qué conjunto de sensores se necesita para vigilar las posibles enfermedades de este cultivo.