
Vid modelos de enfermedad
Mildiú velloso
Patógeno
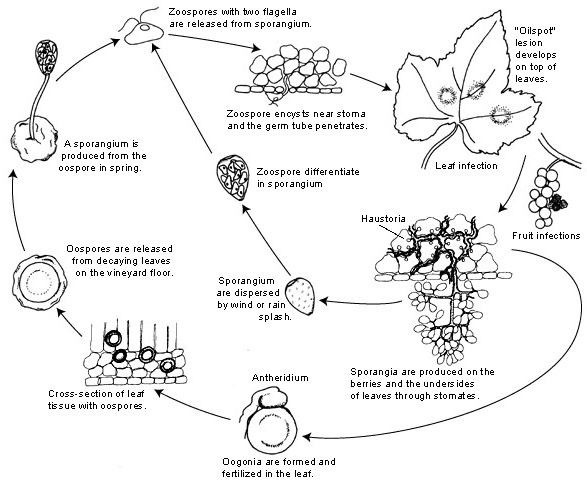
El patógeno del mildiú velloso de la uva es Plasmopara viticola. Es un parásito obligado, lo que significa que necesita órganos verdes y frescos de la vid para crecer. Tiene dos fases de reproducción, asexual y sexual: las zoosporas y las oosporas. Por lo tanto, existen dos fases de infección: la infección primaria y la secundaria.
La infección primaria comienza con la germinación de las oosporas invernantes, que forman esporangios en primavera, cuando el clima se vuelve cálido. Los esporangios se producen por la noche, ya que la luz solar inhibe la esporulación. Las oosporas de paredes gruesas ayudan al patógeno a sobrevivir a las duras condiciones invernales y a iniciar la infección primaria. Los esporangios se dispersan por la lluvia o el viento y liberan zoosporas en el agua libre. Para que la infección tenga éxito, es necesario que la humedad de las hojas o las precipitaciones sean suficientemente prolongadas.
La infección secundaria sólo es posible en presencia de manchas de aceite maduras y se produce por zoosporas y esporangios. Las zoosporas y los esporangios son muy sensibles a la baja humedad y a la luz, lo que reduce su viabilidad, por lo que la mayor parte de la infección se produce poco después de su liberación. Las zoosporas penetran en los tejidos de las plantas a través de tubos germinativos y desarrollan hifas para seguir infectando. Estas hifas forman lesiones aceitosas tras un periodo de incubación que oscila entre 5 y 21 días dependiendo de la temperatura - cuanto más baja sea la temperatura, más tiempo tarda.
Cuando vuelve a hacer frío, lo que es desfavorable para el patógeno, éste pasa a la producción sexual, produciendo oosporas. Estas oosporas permanecen latentes durante el invierno, y el ciclo se repite.
Síntomas

Aparecen pequeñas lesiones amarillas en la superficie superior de las hojas, a veces rodeadas de halos parduscos. Las manchas de aceite se expanden e integran a medida que maduran y los halos se desvanecen. Posteriormente, los esporangios producen un mildiu algodonoso blanco en el envés de las lesiones, al que sigue la necrosis. También aparecen zonas marrones aceitosas en brotes, tallos y bayas. En las noches cálidas y húmedas, pueden cubrirse de un vello blanco debido a la esporulación. La infección grave provoca la caída prematura.
Modelos FieldClimate
- Hay dos modelos en FieldClimate: infección primaria y secundaria.
- El primer gráfico muestra el tiempo de incubación tras una infección. Los gráficos inferiores muestran el progreso de la infección para un nivel de gravedad débil, moderado y grave. Se considera que hay infección cuando la curva ascendente del gráfico alcanza 100% - se puede considerar la fumigación si se muestra un nivel de infección grave.
Infección primaria
Sensores necesarios:
- Temperatura del aire
- Humedad relativa
- Humedad de las hojas
- Precipitación
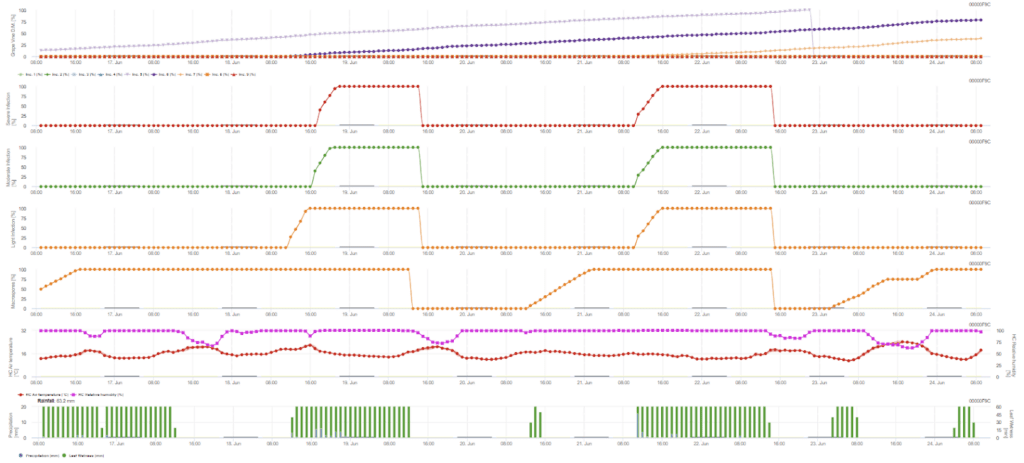
La infección primaria se comprueba si el clima es adecuado para el desarrollo de esporangios. Esto es así siempre que las hojas estén húmedas o que la humedad relativa después de la lluvia no descienda por debajo de 70%. Los esporangios pueden desarrollarse en un plazo de 16 a 24 horas en función de la temperatura. Una lluvia continua de 5 mm se interpreta como una lluvia fuerte que puede propagar las zoosporas.
Infección secundaria
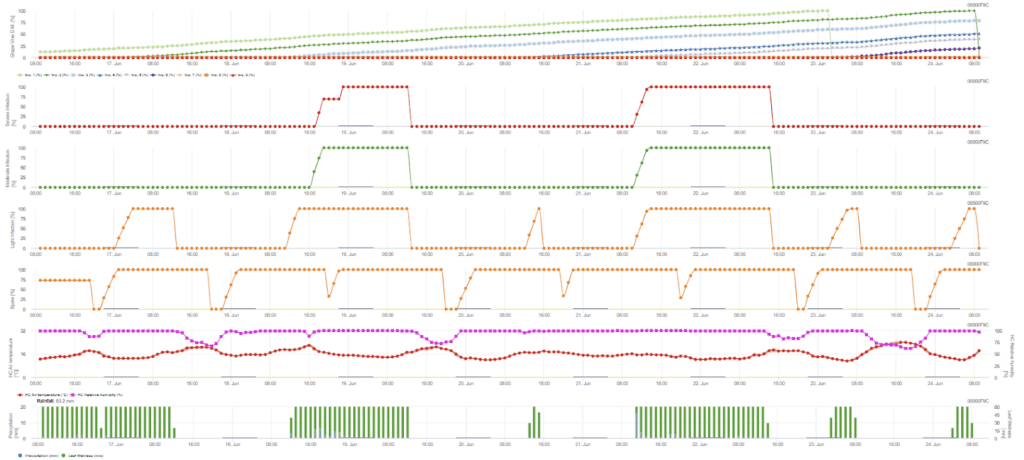
Sensores necesarios:
- Temperatura del aire
- Humedad relativa
- Humedad de las hojas
- Precipitación
La infección secundaria se verifica si la temperatura es superior a 12 °C y la humedad relativa es superior a 95%. La tasa de producción de esporangios aumenta con temperaturas de hasta 23 °C. Si esta condición se prolonga durante un acumulado horario de más de 50 °C, suponemos que la esporulación ha finalizado y que existen nuevos esporangios en el viñedo. Los 50 °C acumulados corresponden a 4 horas con 13 °C o 3 horas con 17 °C, por ejemplo. Los esporangios mueren rápidamente cuando hace más calor y está más seco - cuando la humedad relativa cae por debajo de 50%, la ponemos a 0 y cuando la temperatura supera los 29 °C, no puede haber esporulación.
Literatura
- Ash, G. (2000). Mildiu de la uva. The Plant Health Instructor.
- Gessler, C., Pertot, I., & Perazzolli, M. (2011). Plasmopara viticola: una revisión de los conocimientos sobre el mildiu velloso de la vid y la gestión eficaz de la enfermedad. Phytopathologia Mediterranea, 50(1), 3-44.
- Kennelly, M. M., Gadoury, D. M., Wilcox, W. F., Magarey, P. A., & Seem, R. C. (2007). Primary infection, lesion productivity, and survival of sporangia in the grapevine downy mildew pathogen Plasmopara viticola. Phytopathology, 97(4), 512-522.
- Koledenkova, K., Esmaeel, Q., Jacquard, C., Nowak, J., Clément, C., & Ait Barka, E. (2022). Plasmopara viticola the causal agent of downy mildew of grapevine: from its taxonomy to disease management. Frontiers in Microbiology, 13, 889472.
Mildiú polvoroso
Patógeno
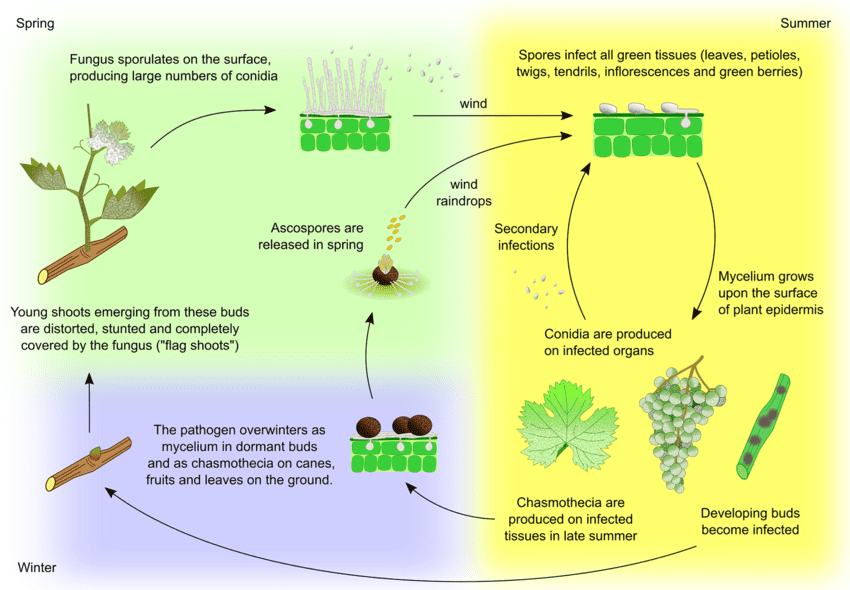
El patógeno del oídio en la uva es Uncinula necator. Existen dos fuentes principales de inóculo: el micelio invernante y las ascosporas de los cleistotecios, cuya importancia puede variar en función de la región.
El micelio produce brotes bandera en primavera. Los brotes bandera son brotes parcial o totalmente cubiertos de moho que se forman a partir de yemas infectadas latentes. Al formarse colonias en su interior, estos brotes son bien visibles y a menudo presentan hojas deformadas.
Los cleistotecios liberan ascosporas a principios de primavera. Las precipitaciones son un factor importante para la liberación de ascosporas. A medida que aumenta la temperatura, la dehiscencia se produce con mayor frecuencia. Las ascosporas germinan en 12 horas, formando tubos germinativos y apresorios en los tejidos vegetales, lo que da lugar a la formación de colonias dispersas.
La infección secundaria se produce a través de conidios producidos en las colonias. Al igual que las ascosporas, germinan y desarrollan tubos germinativos y apresorios. U. necator no necesita agua libre para la infección ni una humedad relativa elevada para la formación de conidios. Cuando las condiciones climáticas se vuelven menos favorables, el hongo forma cleistotecios. Pasa el invierno sobreviviendo en cleistotecios o como micelio vegetativo en yemas infectadas latentes y el ciclo se repite.
Síntomas

Los síntomas se pueden encontrar en todas las partes verdes de la vid. Los brotes desarrollan colonias y se cubren de micelio blanco grisáceo, conocido como "brotes bandera". Producen hojas deformadas. Las colonias de mildiu también se encuentran en las hojas, en la parte inferior o en ambos lados. Las bayas desarrollan manchas gris ceniza y se parten en los casos graves. Los sarmientos presentan manchas de color marrón rojizo oscuro y pueden morir desde las puntas.
Modelos FieldClimate
Infección por ascosporas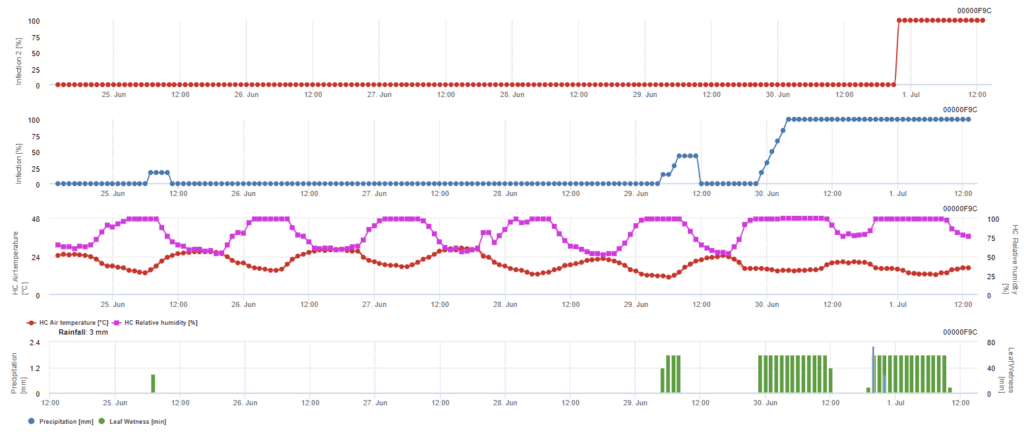
Sensores necesarios:
- Temperatura del aire
- Humedad relativa
- Humedad de la hoja
- Precipitación
Este modelo se recomienda cuando las ascosporas se forman durante la época fría del invierno (por lo que no hay infección por micelio). La infección por ascosporas predice la liberación de ascosporas y la infección inicial basándose en las temperaturas medias durante periodos prolongados de humedad de las hojas. Para el cálculo, se requieren aproximadamente 2,5 mm de precipitaciones para liberar las ascosporas, seguidas de un mínimo de 8 a 12 horas de humedad foliar y temperaturas entre 10 y 15°C. Una vez que se ha producido la infección, el modelo pasa a una fase de evaluación del riesgo de enfermedad (modelo Californian Risk) y se basa en los efectos de la temperatura sobre la tasa de reproducción del patógeno.
Modelo de riesgo californiano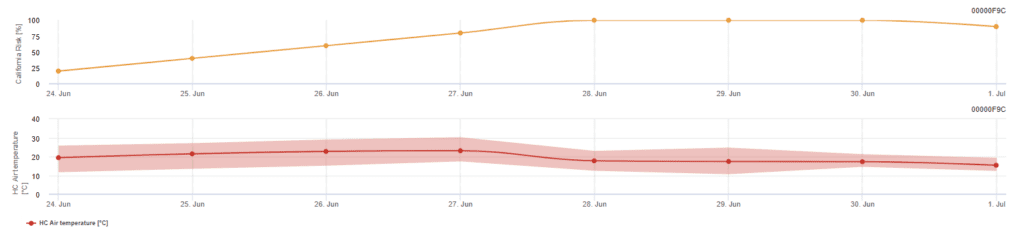
Sensores necesarios:
- Temperatura del aire
El modelo se basa en estudios de laboratorio realizados en California. Tras la liberación y germinación de las ascosporas (modelo), las temperaturas influyen en el posterior desarrollo y reproducción del oídio. Evalúa las temperaturas y valora el riesgo de desarrollo del oídio mediante un índice de 0 a 100 puntos.
Se necesitan tres días seguidos con un mínimo de seis horas consecutivas de temperatura entre 21 y 30'c para iniciar el índice de evaluación del riesgo. Se ganan 20 puntos por cada día que reúna 6 o más horas consecutivas entre 21 y 32°C y se pierden 10 puntos por los que no lo hagan o cuando la temperatura supere los 32°C o baje de 21°C.
Los valores bajos del índice, de 0~30, indican que el patógeno no se reproduce. Un índice de 40~50 se considera moderado e implica una tasa de reproducción del oídio de aproximadamente 15 días. Los valores de índice superiores a 60 indican que el patógeno se reproduce rápidamente (cada 5 días) y que el riesgo de epidemia es grande.
Modelo de riesgo Pessl Instruments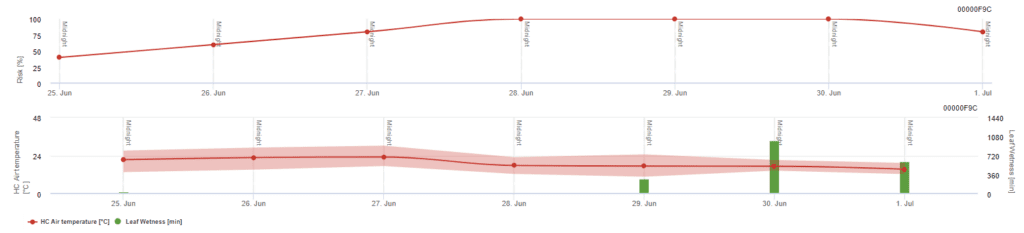
Sensores necesarios:
- Temperatura del aire
- Humedad de las hojas
Además de la temperatura del aire, la humedad de la hoja puede ser un factor orientativo, ya que largos periodos de humedad de la hoja conducen al establecimiento de un hongo antagonista (Ampelomyces quisqualis), que provoca una disminución de U. necator. Los fundamentos del modelo son equivalentes a los del modelo Californian Risk, pero en este modelo también se tiene en cuenta la humedad de las hojas. Una humedad de la hoja superior a 8 horas conlleva una disminución de 10 puntos.
Los valores bajos del índice, de 0~20, indican que el patógeno no se está reproduciendo. Un índice de 20~60 se considera moderado y es válido un intervalo de pulverización normal. Los valores de índice superiores a 60 indican que el patógeno se reproduce rápidamente (cada 5 días) y que el riesgo de epidemia es elevado, por lo que se recomienda reducir el intervalo de pulverización.
Literatura
- Gadoury, D. M., & Pearson, R. C. (1990). Ascocarp dehiscence and ascospore discharge in Uncinula necator. Phytopathology, 80(4), 393-401.
- Gadoury, D. M., & Pearson, R. C. (1990). Germination of ascospores and infection of Vitis by Uncinula necator. Phytopathology, 80(11), 1198-1203.
- Hall, T. W. (2000). Epidemiology of grape powdery mildew, Uncinula necator, in the Willamette Valley.
- Halleen, F., & Holz, G. (2001). An Overview of the Biology, Epidemiology and Control of Uncinula Necator (Powdery Mildew) on Grapevine, with Ref Ere Nee to South Africa. Revista sudafricana de enología y viticultura, 22(2), 111-121.
- Rügner, A., Rumbolz, J., Huber, B., Bleyer, G., Gisi, U., Kassemeyer, H. H., & Guggenheim, R. (2002). Formación de estructuras de hibernación de Uncinula necator y colonización de la vid en condiciones de campo. Patología vegetal, 51(3), 322-330.
Podredumbre negra
Patógeno
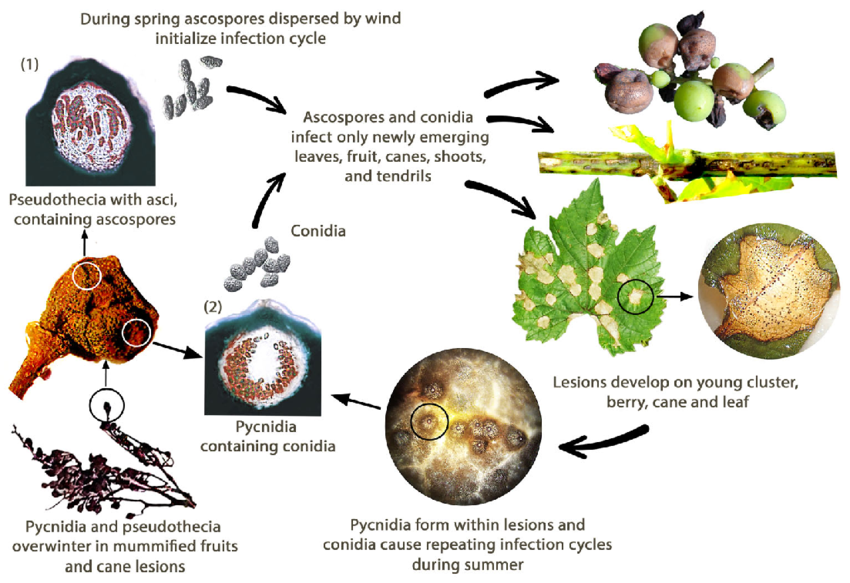
La podredumbre negra de la vid está causada por el hongo Guignardia bidwellii. El hongo pasa el invierno en diversas partes de la vid y puede sobrevivir más de dos años en las lesiones de los sarmientos infectados.
En primavera, los picnidios producen conidios (esporas asexuales) y los pseudotecios generan ascosporas (esporas sexuales). Los conidios suelen dispersarse a corta distancia, mientras que las ascosporas pueden infectar a mayor distancia. Estas esporas son transportadas por el viento y la lluvia para infectar tejidos jóvenes de hospedadores susceptibles, iniciando infecciones primarias. Los conidios también sirven como inóculo secundario, contribuyendo a la propagación rápida y repetida de la enfermedad.
Durante el mes de agosto, los picnidios se transforman en una fase de hibernación que produce pseudotecios, los cuales generan ascosporas. Estas ascosporas son fuentes importantes de infecciones primarias en la primavera siguiente.
Síntomas

Se desarrollan manchas de color marrón rojizo que acaban fusionándose, a menudo rodeadas de pequeños puntos negros, que son estructuras fúngicas conocidas como picnidios que producen conidios. Las hojas jóvenes y de crecimiento rápido son particularmente más susceptibles a esta infección.
Las infecciones de la fruta suelen producirse después de la caída del cáliz, y la mayoría de los síntomas se manifiestan cuando la fruta tiene entre la mitad y casi todo su tamaño. Inicialmente, aparecen pequeñas manchas rodeadas por un anillo marrón, que luego se agrandan y oscurecen, cubriendo finalmente toda la baya a medida que se desarrolla la enfermedad. En pocos días, las bayas infectadas pueden momificarse, romperse o caer prematuramente.
Además, también se ven afectadas otras partes de la planta, como brotes, tallos y zarcillos. Se desarrollan lesiones ovaladas de color púrpura a negro, y los picnidios se dispersan por la superficie de estas lesiones.
Modelo FieldClimate
Viticultura Modelo de podredumbre negra
Sensores necesarios:
- Temperatura del aire
- Humedad relativa
- Humedad de las hojas
- Precipitación
El modelo se basa originalmente en la bibliografía publicada por Spotts, pero con la modificación de Daniel Molitor. La revisión ha introducido tres clases de severidad (ligera, moderada y severa) similares al diseño de los modelos de sarna del manzano. A temperaturas cálidas, el periodo de humectación de la hoja de 8 horas es suficiente para favorecer las infecciones y se supone que una infección se completa cuando un gráfico alcanza 100%.
La gravedad de la infección depende de la duración del periodo óptimo de temperatura y humedad del hongo. Las infecciones que cumplen los criterios de Spotts se califican de infecciones leves. Las infecciones que cumplen los criterios de Spott por 150% y 200% se califican de infecciones moderadas y graves, respectivamente.
Dependiendo de la presión de infección, las infecciones deben cubrirse preventivamente o debe aplicarse una pulverización curativa poco después de la infección. En el clima semiárido moderado del Mosela o de la mayoría de las zonas vitícolas austriacas, no se recomendaría la pulverización tras determinar una infección leve.
Literatura
- Wilcox, Wayne F. "Podredumbre negra Guignardia bidwellii". Ficha de identificación de la enfermedad nº 102GFSG-D4. 2003. Cornell. 24 oct. 2010
- http://www.nysipm.cornell.edu/factsheets/grapes/diseases/grape_br.pdf
- Ellis, Michael A. "Hoja informativa Recursos Agrícolas y Naturales: Grape Black Rot". Departamento de Patología Vegetal. Extensión Estatal de la Universidad de Ohio. 2008
- http://ohioline.osu.edu/hyg-fact/3000/pdf/HYG_3004_08.pdf
- Molitor, D. (2009). Untersuchungen zur Biologie und Bekämpfung der Schwarzfäule (Guignardia bidwellii) an Weinreben. Gesellschaft zur Förderung der Forschungsanstalt Geisenheim.
- Ries, S. M. (1999). Informes sobre enfermedades de las plantas: Black Rot of Grape. Integrated Pest Management at the Uni. of Illinois. http://ipm. illinois. edu/diseases/series700/rpd703.
- Spotts, R. A. (1977). Effect of leaf wetness duration and temperature on the infectivity of Guignardia bidwellii on grape leaves. Phytopathology, 67(11), 1378-1381.
- Szabó, M., Csikász-Krizsics, A., Dula, T., Farkas, E., Roznik, D., Kozma, P., & Deák, T. (2023). Black rot of grapes (Guignardia bidwellii)-A comprehensive overview. Horticulturae, 9(2), 130.
- http://extension.cropsciences.illinois.edu/fruitveg/pdfs/771-BlackRotOfGrape.pdf
- https://www.missouribotanicalgarden.org/gardens-gardening/your-garden/help-for-the-home-gardener/advice-tips-resources/insects-pests-and-problems/diseases/fruit-spots/black-rot-of-grapes
Polillas de las bayas
Patógeno

Lobesia botrana suele completar de dos a tres generaciones al año según las regiones. La primera generación (mayo y junio) sólo afecta a las flores, por lo que el tratamiento sólo es necesario si las poblaciones de polillas son particularmente elevadas. La segunda generación (julio y agosto) y la tercera causan los mayores daños, siendo la tercera especialmente dañina, ya que coincide con la maduración de las uvas. La cuarta generación puede aparecer en climas más cálidos, pero el tratamiento no suele ser necesario, ya que coincide con la vendimia.
La polilla pasa el invierno en forma de pupas en capullos y, cuando suben las temperaturas en primavera, emergen los adultos de la primera generación, en la que los machos suelen aparecer antes que las hembras. El vuelo de la primera generación comienza cerca de la brotación y dura de 4 a 5 semanas, durante las cuales se produce el apareamiento. Uno o dos días después del apareamiento, las hembras ponen entre 80 y 160 huevos.
Los huevos, de 0,6 a 0,8 mm de diámetro, son visibles a simple vista. Inicialmente de color blanco cremoso, se vuelven amarillos a medida que se desarrolla el embrión, con el color negro de la cabeza de la larva. Los huevos eclosionan al cabo de 66 días-grado (DDC), aproximadamente entre 7 y 11 días. Las larvas se agrupan en las partes de las flores y su desarrollo dura de 20 a 30 días. A continuación se produce la pupación y los adultos emergen entre 6 y 14 días después.
El "grado-día" se calcula midiendo cuánto supera la temperatura media diaria una determinada temperatura umbral de base necesaria para el desarrollo. A medida que las temperaturas suben por encima de la base, los grados-día se acumulan.
Las polillas adultas miden de 6 a 8 mm de longitud y tienen una envergadura de 11 a 13 mm. Las hembras son ligeramente más grandes que los machos, aunque ambos tienen alas con un patrón de mosaico similar.
Los huevos de la segunda y tercera generación eclosionan más rápido, en un plazo de 3 a 5 días. Las hembras ponen los huevos individualmente en bayas sombreadas y, una vez eclosionadas, las larvas entran en las bayas y las ahuecan. En otoño, las noches de más de 11 horas desencadenan la diapausa, una fase de reposo que permite a las pupas tolerar mejor el frío, lo que les permite pasar el invierno.
Síntomas
Las orugas de la primera generación se alimentan de las inflorescencias de la vid, ahuecan los botones florales y los hacen girar para protegerlos, lo que provoca daños dentro del racimo. En la segunda generación, las larvas se dirigen a las bayas en desarrollo, creando puntos de entrada para patógenos fúngicos como Botrytis cinerea. Esta alimentación directa causa daños visibles, normalmente marcados por manchas oscuras alrededor de los puntos de alimentación. La tercera generación causa los daños más importantes, ya que las larvas penetran en las bayas maduras y se alimentan de ellas.
Quedan bayas arrugadas y excrementos de larvas. Quedan jirones de tejido epidérmico de la baya vagamente adheridos a los pedicelos, junto con la "piel" seca y ahuecada de la baya.
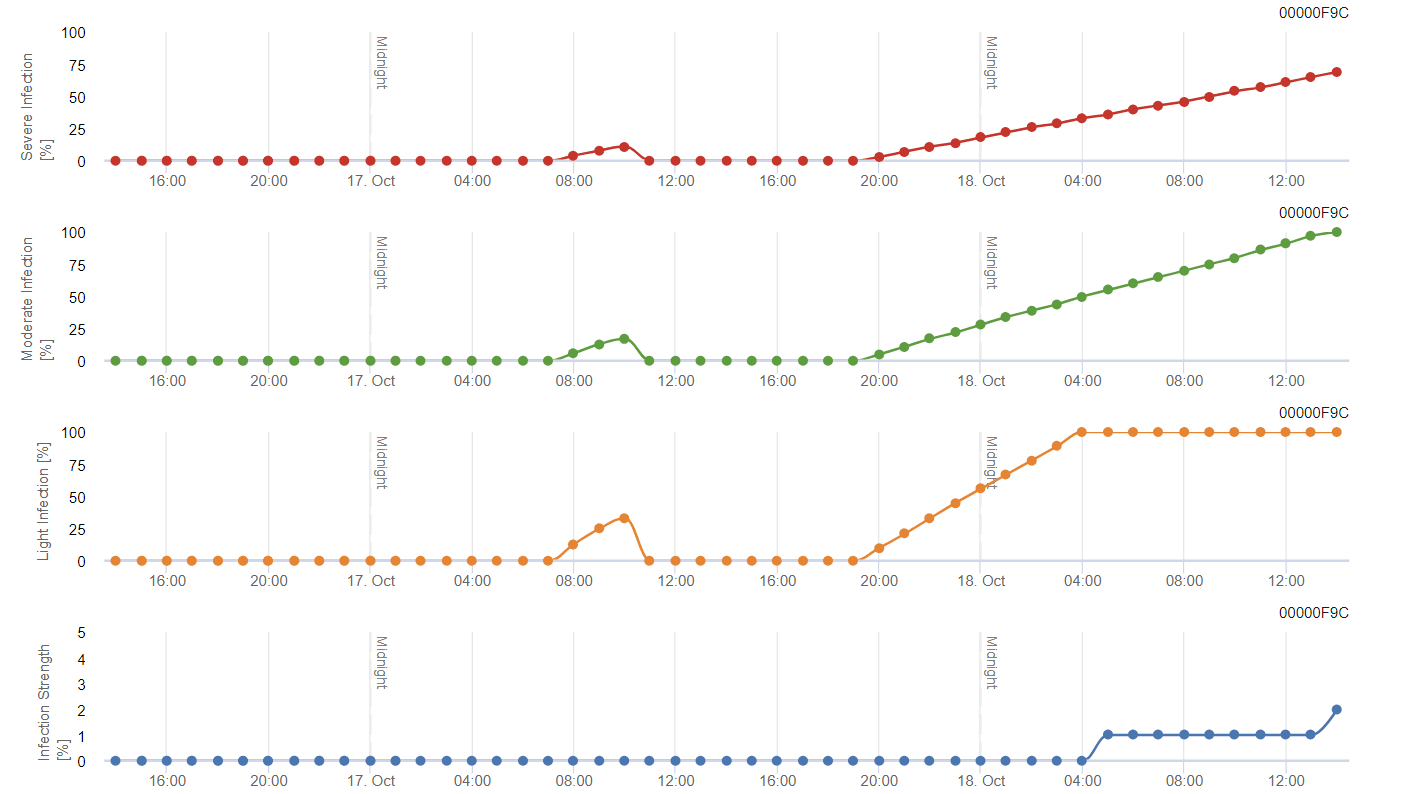
Modelo FieldClimate
Modelo de polilla de la vid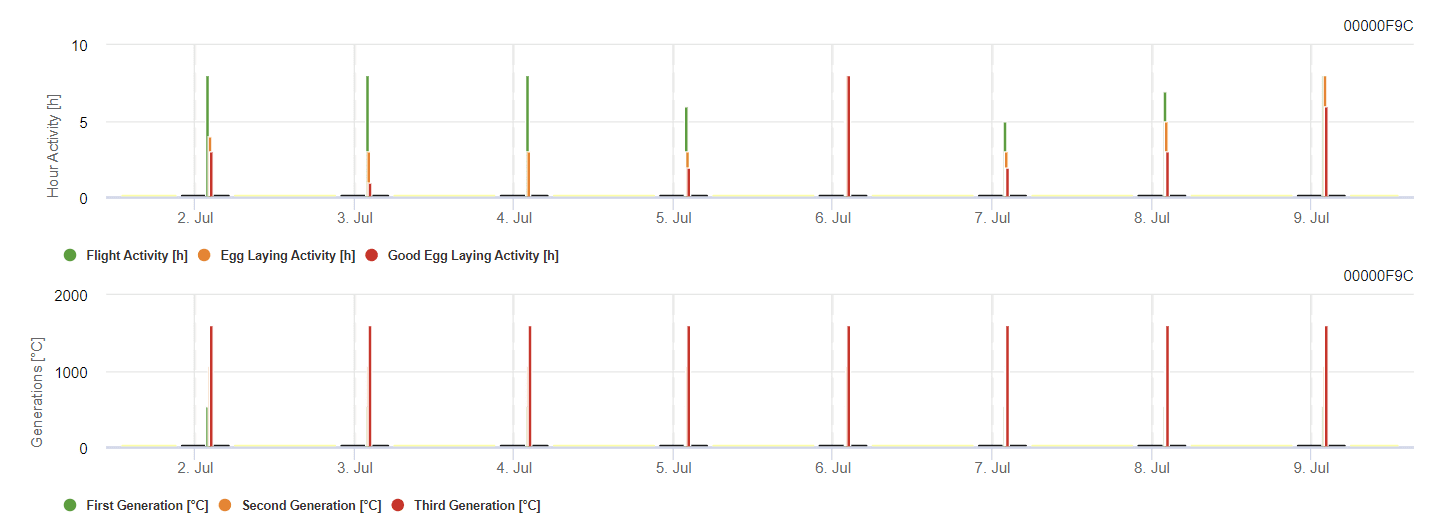
Sensor necesario:
- Temperatura del aire
El modelo calcula el riesgo en función de la temperatura del aire. El primer gráfico muestra los periodos de actividad de vuelo con puesta de huevos y las buenas actividades de puesta de huevos del insecto. El segundo gráfico muestra la generación que cabe esperar en ese periodo. En el tercer gráfico se muestran los datos climáticos, que muestran la acumulación de grados-día (temperaturas > 8°C hasta 24°C por hora dividido por 24).
Literatura
- Varela, L. G., Smith, R. J., Cooper, M. L., & Hoenisch, R. W. (2010). Polilla europea de la vid, Lobesia botrana. Viñedos del valle de Napa. Pract. Winery Vineyard, 2010, 1-5.
- https://ipm.ucanr.edu/invasive-and-exotic-pests/european-grapevine-moth/
- https://www.ages.at/en/plant/plant-health/pests-from-a-to-z/grape-berry-moth
Moho gris
Patógeno
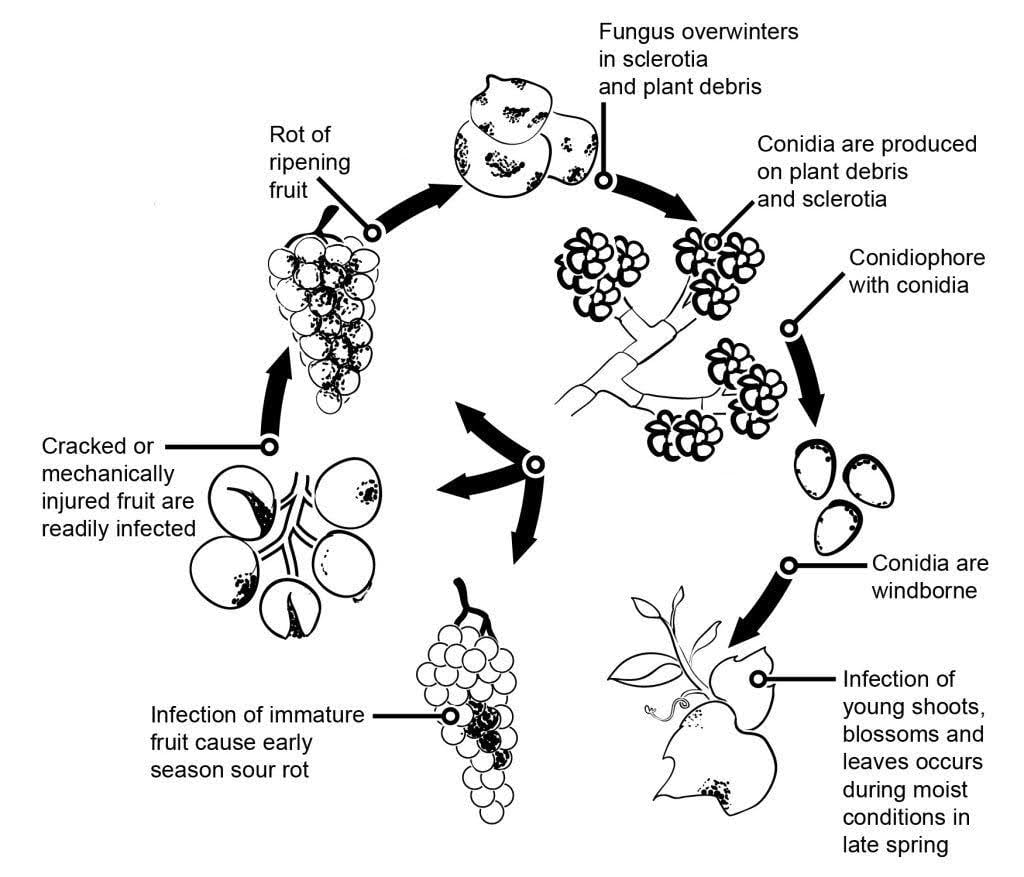
El agente patógeno del moho gris en la vid es Botrytis cinerea.
La epidemiología del moho gris está muy influida por las infecciones latentes iniciadas por las infecciones de las flores. Se han identificado varias vías que van de la flor al fruto: El hongo infecta el estípite de la flor y alcanza el óvulo, donde permanece latente debido al mecanismo de defensa preformado de la planta. Las infecciones a través de estambres, pétalos y sépalos también son críticas. B. cinerea puede infectar los estambres y crecer sistemáticamente hacia el receptáculo, extendiéndose al pedicelo y a los tejidos vasculares de las bayas. Otras vías también implican el crecimiento saprofítico del patógeno.
Los micelios o esclerocios invernantes son las principales fuentes de infección en primavera. El viento y la lluvia producen y dispersan conidios (esporas asexuales). Al aterrizar, los conidios germinan, formando tubos germinativos y apresorios que penetran e infectan la planta. El hongo puede permanecer latente hasta que la fruta madura y aumenta el contenido de azúcar. Las conidias generadas a partir de fuentes primarias de inóculo siguen un ciclo diurno de iniciación, producción y diseminación.
Aunque la fase sexual de B. cinerea rara vez se observa, el patógeno se vuelve más activo a medida que las bayas maduran. El mayor contenido de azúcar en las bayas aumenta la susceptibilidad a la infección. Del mismo modo, las flores son muy susceptibles cuando senecen, y el abundante polen aumenta la gravedad de la infección.
Síntomas

El moho gris afecta sobre todo a los granos de uva maduros, que al principio parecen blandos y empapados de agua. Con el tiempo, las bayas adquieren un color marrón rojizo y se arrugan. En condiciones favorables, se cubren de masas grises de micelio fúngico y conidios. Las bayas sanas también pueden infectarse por contacto directo con las enfermas.
El hongo también puede causar un tizón de la flor, que puede provocar importantes pérdidas de cosecha al principio de la temporada. Aunque las infecciones foliares son raras, cuando se producen empiezan como manchas verdes opacas a lo largo de las nervaduras, que acaban convirtiéndose en lesiones necróticas.
Modelo FieldClimate
Modelo general de molde gris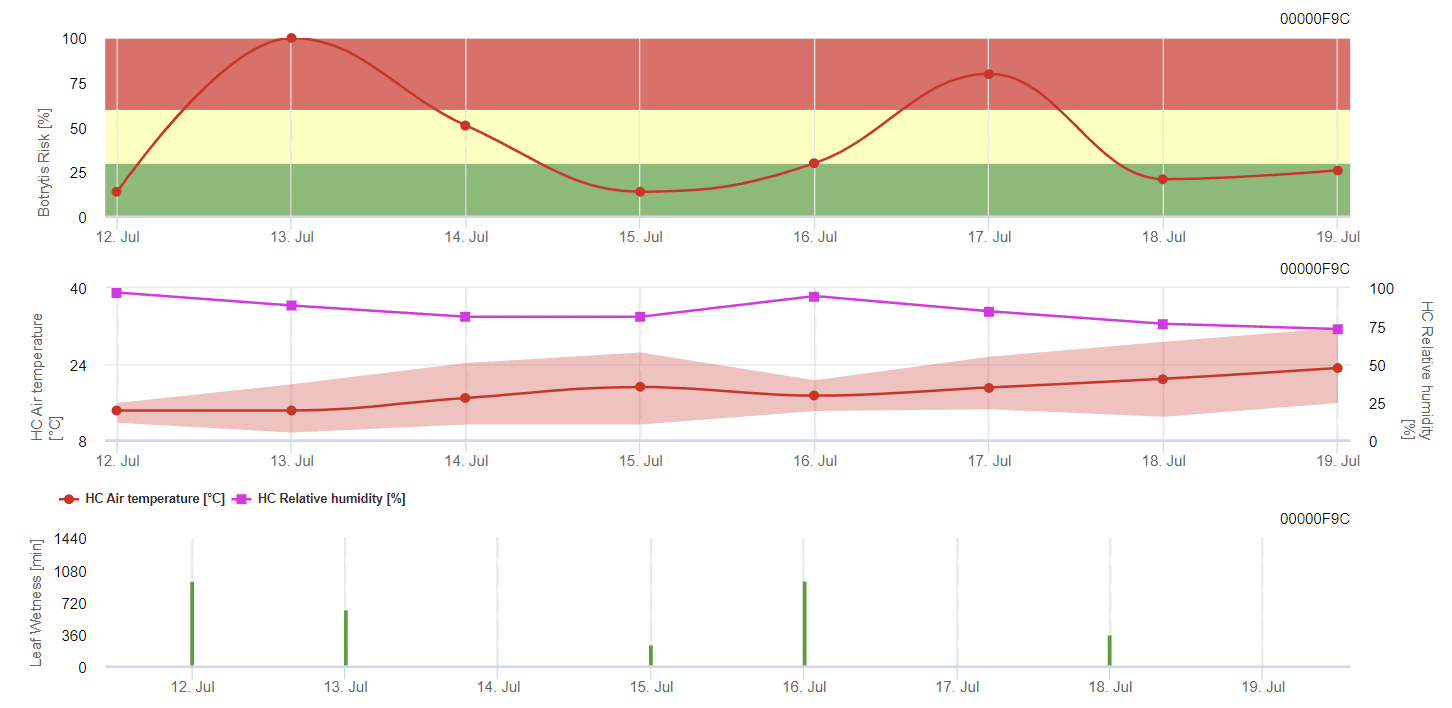
Sensores necesarios:
- Temperatura del aire
- Humedad relativa
- Humedad de las hojas
B. cinerea está relacionado con el clima húmedo. El hongo requiere una humedad relativa elevada o la presencia de agua libre para la infección. Los periodos cálidos con un periodo prolongado de humedad en las hojas aumentan el riesgo de B. cinerea, mientras que los periodos secos lo reducen. La infección se produce en los brotes jóvenes durante los periodos húmedos prolongados o las dañinas tormentas de granizo.
El modelo calcula el riesgo en un valor de 0 a 100%. Este valor indica la presión de B. cinerea en ese momento - si tenemos un valor de 100%, significa que ha habido varias veces un periodo de humedad lo suficientemente largo como para infectar el tejido susceptible. Calculamos los llamados "puntos húmedos" entre la humedad de la hoja y la temperatura con un máximo inicial de 38400 puntos (comienzo de la temporada, que muestra un riesgo de 30%). Después de este periodo, cada periodo húmedo con unos 4000 puntos húmedos aumenta el riesgo en 10%, o por el contrario, cada periodo seco reduce el riesgo en ⅕ del valor anterior.
Literatura
- Broome, J. C., English, J. T., Marois, J. J., Latorre, B. A., & Aviles, J. C. (1995). Development of an infection model for Botrytis bunch rot of grapes based on wetness duration and temperature. Phytopathology, 85(1), 97-102.
- Elmer, P. A., & Michailides, T. J. (2007). Epidemiology of Botrytis cinerea in orchard and vine crops. En Botrytis: biology, pathology and control (pp. 243-272). Dordrecht: Springer Netherlands.
- Williamson, B., Tudzynski, B., Tudzynski, P., & Van Kan, J. A. (2007). Botrytis cinerea: la causa de la enfermedad del moho gris. Molecular plant pathology, 8(5), 561-580.
- Ciliberti, N., Fermaud, M., Roudet, J., & Rossi, V. (2015). Environmental conditions affect Botrytis cinerea infection of mature grape berries more than the strain or transposon genotype. Fitopatología, 105(8), 1090-1096.
Antracnosis
Patógeno
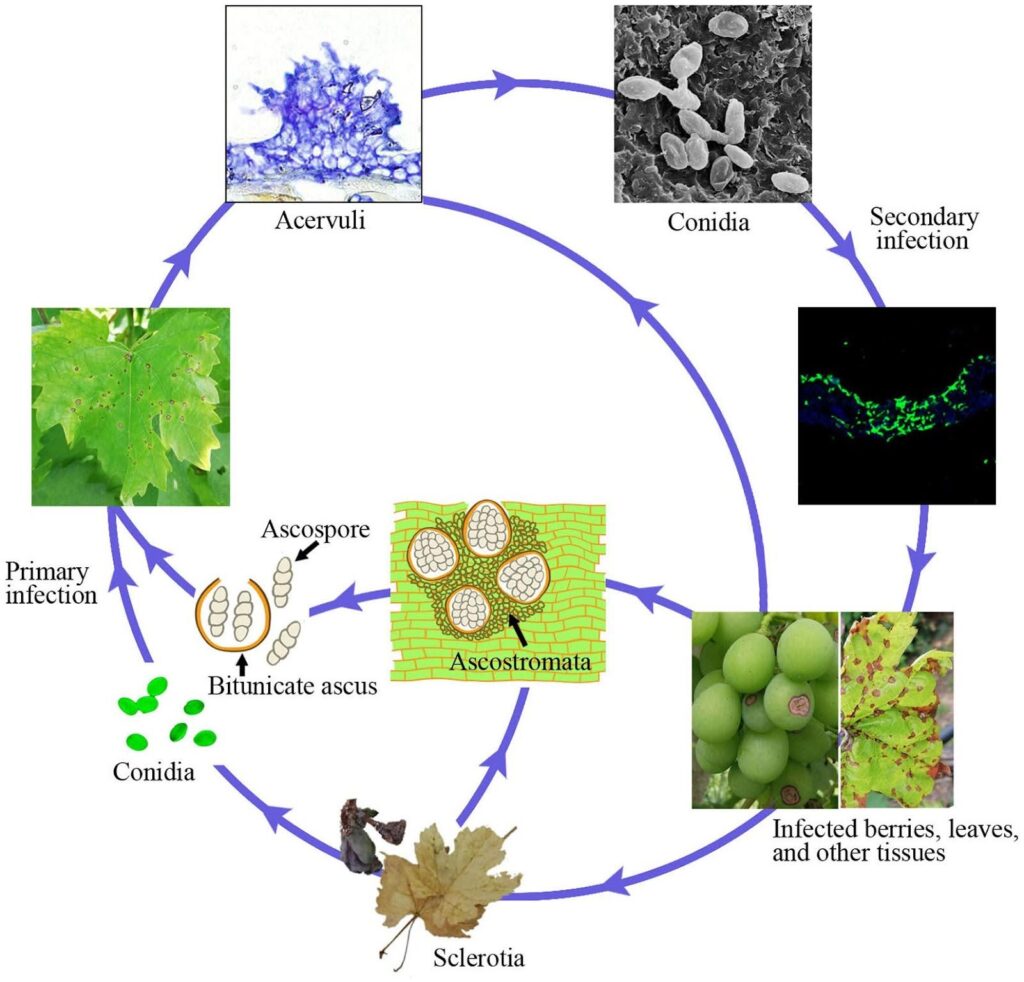
La antracnosis de la vid está causada por el patógeno Elsinoe ampelina.
Las cañas infectadas son la principal fuente de la enfermedad. Los esclerocios y micelios que sobreviven en las lesiones y bayas durante el invierno se activan en primavera y producen ascosporas (esporas sexuales) y conidios (esporas asexuales) en condiciones húmedas (lluvia o rocío durante 24 horas) dentro del intervalo de temperaturas de 2~40°C.
Estas esporas se dispersan a nuevos tejidos por salpicaduras de lluvia y viento y, una vez posadas, germinan y forman tubos germinativos y apresorios, iniciando una nueva infección. Pueden infectar hojas nuevas, brotes, zarcillos y bayas jóvenes. El clima cálido reduce la duración de la humedad necesaria para la infección inicial y el periodo de incubación. La germinación óptima de las esporas se produce a 25~30°C, siendo necesario un mínimo de 3~4 horas de humectación de las hojas. En infecciones a temperaturas en torno a los 10°C, el periodo de incubación es de unos 14 días.
A medida que avanza la colonización, surgen acérvulos y se producen nuevas conidias, que sirven como inóculo de infección secundaria. Son responsables de la infección rápida y posterior en la temporada.
Síntomas
E. ampelina Ataca a las partes aéreas y suculentas de la vid, incluidos sarmientos, hojas, pecíolos, zarcillos, raquis y bayas; las lesiones más comunes se producen en sarmientos y bayas. Las uvas tienen resistencia ontogénica a los hongos, por lo que los tejidos jóvenes son más susceptibles.
Al principio aparecen pequeñas manchas de color marrón rojizo que se agrandan con el tiempo húmedo y se vuelven ligeramente hundidas, con un centro gris rodeado de un margen oscuro. A veces, los síntomas pueden parecer lesiones por granizo. El centro necrótico de las hojas suele caer, creando un aspecto de "agujero de tiro".
En caso de infección grave, las plantas pueden presentar una defoliación precoz, retraso en el crecimiento de las cañas, rotura de tallos, caída de bayas y retraso en el desarrollo y maduración de las bayas.
Modelo FieldClimate
Modelo de antracnosis en viticultura
Sensores necesarios:
- Temperatura del aire
- Humedad relativa
- Humedad de las hojas
- Precipitación
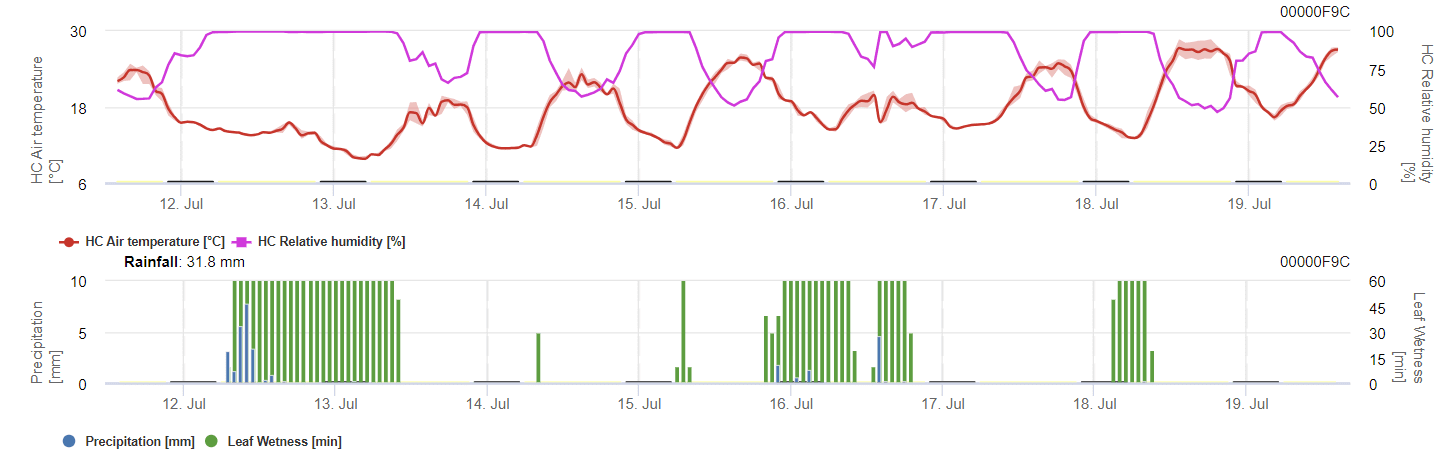
El modelo calcula el riesgo de antracnosis teniendo en cuenta la temperatura del aire, la humedad relativa, la humedad de las hojas y las precipitaciones.
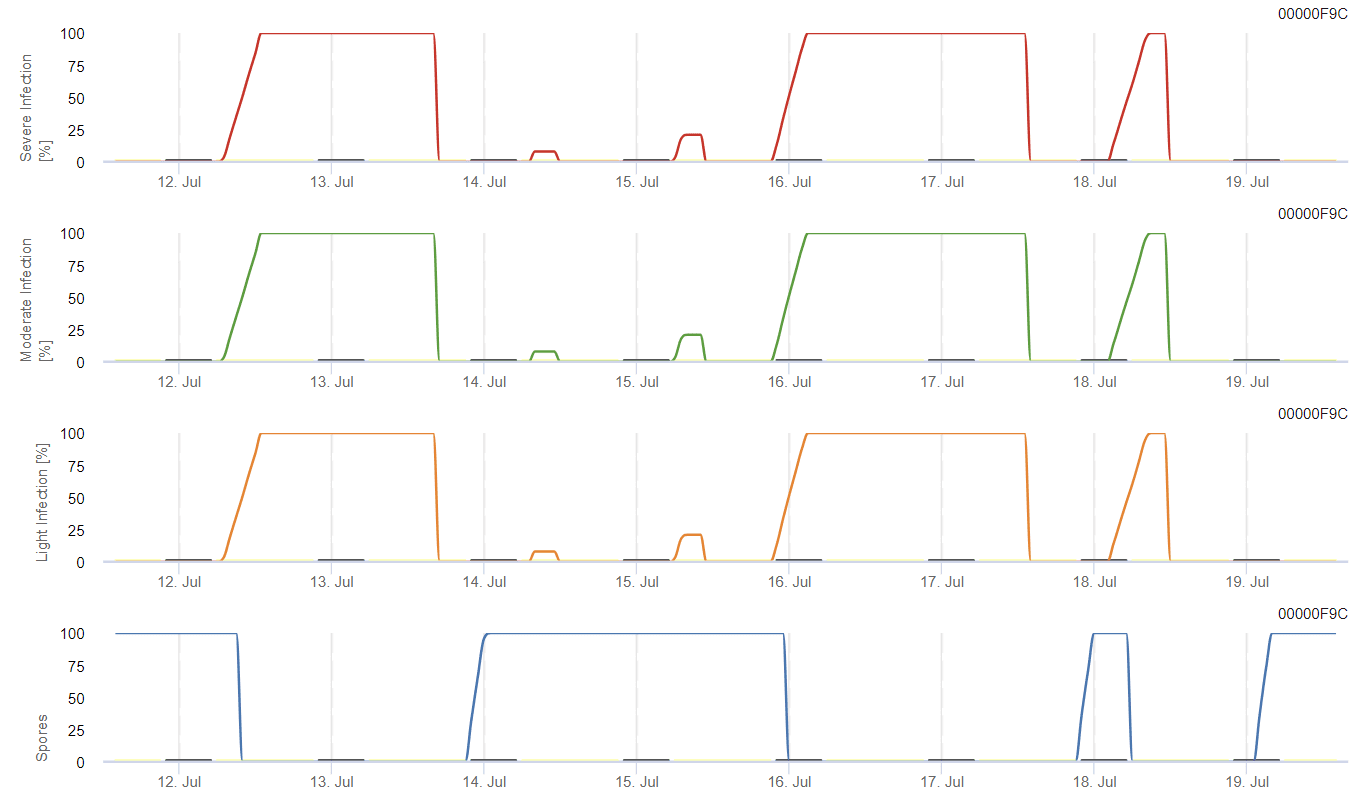
El posible desarrollo de una infección débil, moderada y grave se muestra en gráficos separados. Se supone que una infección es completa cuando la curva creciente alcanza 100%. El último gráfico muestra la esporulación de E. ampelina; si el valor allí alcanza 100%, se supone que las esporas de E. ampelina están presentes.
Para que las esporas invernantes se desarrollen, las condiciones deben cumplir un rango de temperatura de 2 a 40°C, una humedad relativa superior a 90% o la humedad de las hojas. Una vez que el desarrollo de las esporas alcanza los 100%, comienza a calcularse la infección. La gravedad de la infección depende de las condiciones de humedad (eventos de lluvia). Sin embargo, si la humedad desciende por debajo de 50%, se deja de calcular tanto el desarrollo de las esporas como la infección.
Literatura
- Li, Z., Dos Santos, R. F., Gao, L., Chang, P., & Wang, X. (2021). Current status and future prospects of grapevine anthracnose caused by Elsinoe ampelina: An important disease in humid grape-growing regions. Molecular Plant Pathology, 22(8), 899-910
PHOMOPSIS MANCHA DE LA CAÑA Y DE LA HOJA
Patógeno
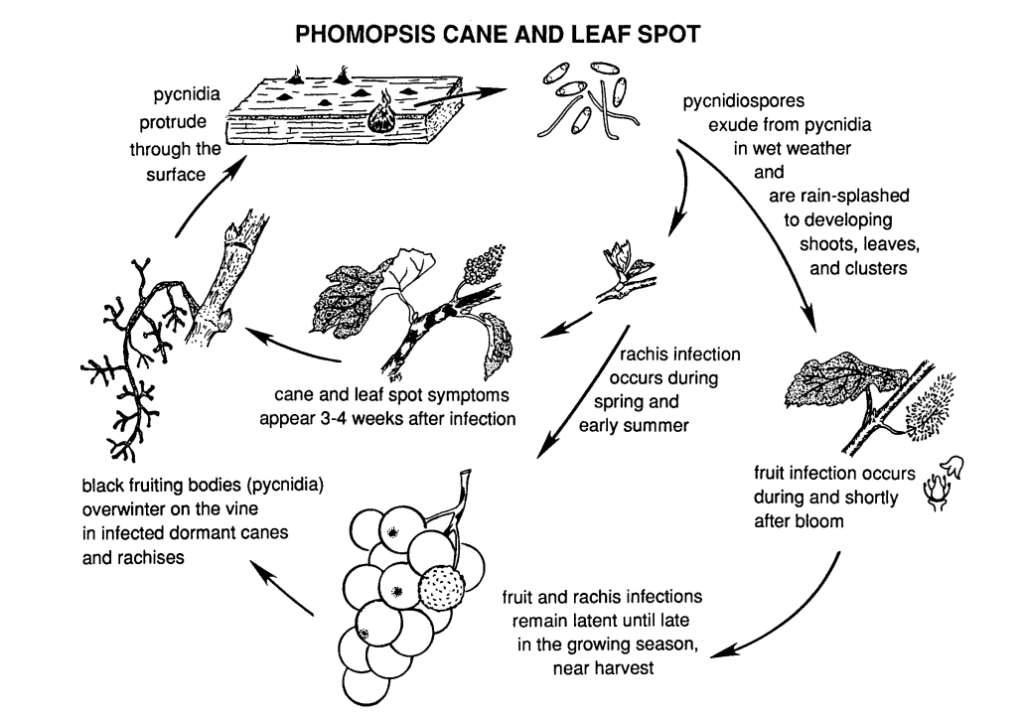
La Phomopsis cane and leaf spot en la vid está causada por Phomopsis viticola.
El hongo pasa el invierno en las partes leñosas de la vid y vuelve a activarse en la primavera siguiente. Una vez que suben las temperaturas y comienzan las lluvias primaverales, las esporas se liberan de las estructuras de hibernación llamadas picnidios. A medida que las esporas se dispersan a través de la lluvia y el viento hacia nuevos tejidos, la infección se propaga.
El período de infección primaria suele coincidir con las lluvias de principios de primavera, comenzando poco después de la brotación, cuando los brotes muestran una fase temprana de crecimiento. Los brotes jóvenes, las puntas de los brotes, los racimos de frutos y el raquis son vulnerables a la infección. Aunque las puntas de los brotes pueden infectarse durante toda la temporada de crecimiento, las infecciones son más comunes desde la brotación hasta la floración. En los frutos, el patógeno puede permanecer latente hasta que los frutos maduran. El periodo de incubación suele durar entre 3 y 4 semanas.
Síntomas
En hojas y pecíolos aparecen pequeñas manchas oscuras con centros negros rodeados de márgenes amarillos, que acaban por unirse. Las hojas basales pueden deformarse y arrugarse, y es posible que no alcancen su tamaño completo. Cuando los pecíolos están muy infectados, amarillean y se caen, provocando la caída de las hojas. Las hojas crean un efecto paraguas que reduce nuevas infecciones por esporas.
Manchas similares aparecen en los brotes, haciendo que las capas epidérmicas se agrieten en los focos de infección. A medida que las manchas se fusionan, las zonas infectadas de los brotes adquieren una textura costrosa. En casos graves, los brotes pueden atrofiarse, romperse o incluso morir.
Las lesiones en el raquis provocan su hundimiento y fragilidad. Tras un periodo de latencia en verano, el hongo se reactiva a principios de otoño, provocando la pudrición de las bayas y los racimos. Aunque las infecciones de la fruta no son extensas en general, se forman manchas en las bayas, a menudo acompañadas de motas negras (picnidios) en la piel de la baya. En condiciones húmedas, los picnidios pueden rezumar masas de esporas amarillas, lo que provoca la decoloración del fruto, una textura áspera y su momificación.
La madera infectada muestra un aspecto blanqueado en la época de latencia. Las cañas y espolones gravemente infectados muestran decoloraciones oscuras mezcladas con zonas blanqueadas en la corteza. También pueden aparecer picinidios en la superficie. Las bajas temperaturas, junto con el deterioro de la función del floema y el xilema, debilitan y matan las cañas, los espolones y las yemas.
Modelo FieldClimate
Modelo de infección por Phomopsis en viticultura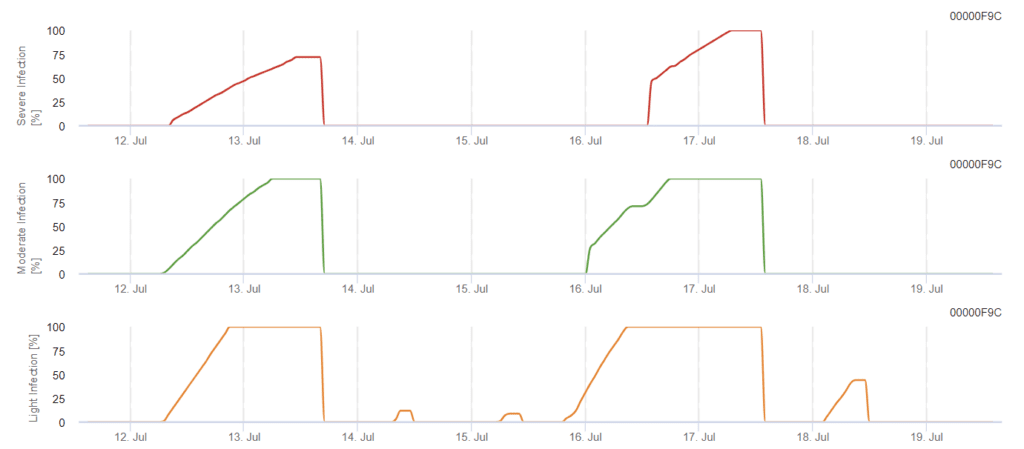
Sensores necesarios:
- Temperatura del aire
- Humedad relativa
- Humedad de las hojas
- Precipitación
El modelo determina el riesgo de infección por Phomopsis en el intervalo de temperaturas de 5 a 35°C y en condiciones húmedas (humedad de las hojas, humedad relativa alta). La gravedad de la infección depende de la cantidad de lluvia (más de 2 mm), ya que las esporas se distribuyen más rápidamente al material vegetal sano. Cuando se muestra la infección por 100%, indica que se han medido las condiciones óptimas en el campo para infectar el tejido vegetal y, por tanto, deben tenerse en cuenta las medidas fitosanitarias.
Literatura
- https://agriculture.vic.gov.au/biosecurity/plant-diseases/grapevine-diseases/phomopsis-cane-and-leaf-spot-of-grapevines
- Bettiga, L. J. (Ed.). (2013). Manejo de plagas de la uva (Vol. 3343). Publicaciones UCANR.
- Pscheidt, J. W., & Pearson, R. C. (1991). Phomopsis cane & leaf spot.
Equipamiento recomendado
Compruebe qué conjunto de sensores se necesita para vigilar las posibles enfermedades de este cultivo.
