Plátano modelos de enfermedad
El plátano es una de las frutas más importantes del mundo. En su forma dulce como plátano dólar y en su forma no dulce para cocinar, es parte principal de la dieta de los habitantes de los países tropicales. Desde finales del siglo XIX, el plátano empieza a convertirse en la fruta más importante del comercio mundial. El plátano producido en América Central y el Caribe empezó a exportarse a EE.UU. y Europa. Hoy en día, el plátano es una parte importante de la base frutícola de los países industrializados. Con el aumento de los ingresos en China y Europa del Este, los nuevos mercados están generando nuevas demandas de plátanos.
Hay dos aspectos importantes enfermedades de las manchas foliares en plátanos: Sigatoka amarilla y Sigatoka negra. La Sigatoka amarilla causada por el hongo Mycosphaerella musicola se ha extendido por todas las zonas productoras de plátanos, mientras que la Sigatoka negra causada por el hongo M. fijiensis var. difformis en Fiyi. La Sigatoka negra muestra una virulencia mucho mayor que la Sigatoka amarilla y por ello se ha convertido en la enfermedad más importante del plátano en la mayoría de los países productores.
Enfermedad de la Sigatoka negra
El trabajo se basa en los dos artículos siguientes:
- Enfermedad de la mancha negra de la hoja; Pests and Diseases of American Samoa Number 10, American Samoa Community College Community & Natural Resources Cooperative Research & Extension. 2004
- Sigatoka negra Un hilo conductor creciente para el cultivo del plátano; Douglas H. Marín, Del Monte Fresh Produce; Ronald A. Romero, Chiquita Brands; Mauricio Guzmán, Corporación Bananera Nacional de Costa Rica; Turner B. Sutton, Universidad Estatal de Carolina del Norte, Raleigh.
La mancha negra de la hoja (BLS), o "Sigatoka negra", es la enfermedad foliar más dañina del plátano en todo el mundo. Afecta a la mayoría de las zonas tropicales y subtropicales, con pérdidas de 30-50%. El primer caso de BLS en el Pacífico se registró hace 40 años en el valle de Sigatoka, Fiyi. La mayoría de los fungicidas utilizados en la producción bananera son para controlar el BLS. El plátano tipo Cavendish 'Williams', cultivado por la mayoría de los productores comerciales, es muy susceptible a la enfermedad fúngica. Las plantas infectadas tienen menos hojas, lo que da lugar a menos frutos y más pequeños, un retraso en la cosecha, una maduración prematura y una fruta de menor calidad.
Impacto potencial
La sigatoka negra causa la destrucción del tejido de la hoja del plátano, lo que afecta a la capacidad fotosintética de la planta y puede reducir el rendimiento hasta en un 50%. La sigatoka negra es uno de los principales factores responsables del declive de las industrias exportadoras de plátanos en las naciones del Pacífico Sur. Las plantaciones comerciales que producen plátanos para la exportación tienen que mantener un costoso programa de fumigación con fungicidas para controlar la sigatoka negra, y han sido criticadas por motivos medioambientales y de salud humana. Sin embargo, si no se controla, la fruta producida en plantas enfermas puede madurar prematuramente durante el transporte y causar más pérdidas. Los estragos de la enfermedad se controlaron mediante pulverizaciones químicas en años posteriores (15-17 aplicaciones de fungicidas), pero esto incrementó considerablemente el coste de producción.
Plantas afectadas
Sólo se han registrado síntomas definitivos de sigatoka negra en Musa (Plátanos), Musa paradisiaca (Plátanos), Musa acuminata (plátano silvestre) y Musa acuminata (subsp. bantesii y la subsp. zebrina). Los cultivares difieren en su reacción al patógeno. Se desconoce la inmunidad y es posible que otras especies y subespecies silvestres de Musa están infectados, pero la enfermedad no se desarrolla de forma significativa. Mycosphaerella fijiensis también puede atacar la fase de plántula de los plátanos silvestres.
Época en que se produce
Las esporas de sigatoka negra se forman fácilmente durante los veranos tropicales y subtropicales o en condiciones de alta humedad y precipitacionesespecialmente si hay una película de agua libre en las hojas. El principal medio de propagación es a través de la lluvia o la salpicadura de esporas, pero más adelante en el desarrollo de la enfermedad las esporas también se descargan forzosamente en las corrientes de aire. La infección se produce en las hojas más jóvenes de la planta durante e inmediatamente después del despliegue, pero las hojas más viejas son más propicias para el desarrollo de la enfermedad. Los síntomas visuales evidentes aparecen unos 15-20 días después de la infección inicial.
Síntomas
Los primeros síntomas aparentes de infección de las hojas son líneas cortas de color marrón rojizo de unos 2 mm de longitud. Las líneas se convierten en rayas marrones de 20-30 mm de longitud que se ensanchan en manchas elípticas, marrones en el envés de la hoja, negras en el haz. Las manchas están ligeramente hundidas y rodeadas de un halo amarillento. A continuación, el centro de la mancha grande se vuelve gris, bordeado por una línea negra y un halo amarillo. Por último, las manchas se fusionan, matando a la hoja.
Epidemiología
Tanto los conidios como las ascosporas desempeñan un papel en la propagación de la enfermedad. Los conidios se forman en condiciones de alta humedadespecialmente si hay una película de agua libre en las hojas. Se forman durante el desarrollo de las primeras fases de la enfermedad (especialmente durante la fase 2, la fase 3 y la fase 4). Los principales medios de dispersión son el agua de lluvia y las salpicaduras; las conidias no se desprenden con el viento. Los conidios se asocian principalmente con la propagación local de la enfermedad y son importantes durante los periodos de alta humedad, fuertes lluvias frecuentes y chubascos intermitentes.
Porque M. fijiensis produce relativamente pocas conidias, se considera que las ascosporas son más importantes en la propagación de la Sigatoka negra (4,20). Sin embargo, Jacome et al. (10) afirmaron que los conidios son capaces de causar cantidades significativas de enfermedad, y los síntomas de la enfermedad son idénticos a los causados por la infección de ascosporas. Indicó que los conidios adquieren mayor importancia durante los períodos secos, cuando el desarrollo de la enfermedad se retrasa debido a la presencia de condiciones climáticas menos propicias (10). Las ascosporas son el principal medio de dispersión a mayores distancias dentro de las plantaciones y en nuevas zonas, y son el medio habitual de propagación durante periodos prolongados de clima húmedo (3,4,6,10, 11,15).
Las ascosporas se producen en pseudotecios en lesiones maduras, que son comunes en las hojas más viejas de la planta o en hojas muertas que yacen en el suelo. Meredith y Lawrence (14) informaron de que los pseudotecios se producen en ambos lados de la superficie de la hoja, pero el número es mayor en la superficie adaxial. Por el contrario, Gauhl et al. (6) encontraron que se producían más pseudotecios y ascosporas en la superficie abaxial de la hoja. Aunque Burt et al. (2) encontraron que se liberan aproximadamente 4,5 ascosporas por pseudotecio, este número parece muy bajo teniendo en cuenta la alta concentración de inóculo que está presente en el aire después de la lluvia (4).
Liberación de ascosporas
Requiere la presencia de una película de agua de lluvia o rocío que impregna los pseudotecios y provoca la expulsión forzosa de las ascosporas a través de la capa límite de la hoja, donde son diseminadas por las corrientes de aire (15,20). La maduración de los pseudotecios requiere saturación de los tejidos de las hojas muertas durante aproximadamente 48 h (3,4,7,10,11,15). En condiciones hawaianas, las concentraciones de ascosporas aumentaron durante la noche, fueron máximas hacia las 0600 h y disminuyeron significativamente durante el día. En los días lluviosos, las concentraciones máximas se produjeron poco después de que empezara a llover. Los aumentos estacionales de las concentraciones medias diarias de ascosporas se asocian a un aumento de las precipitaciones y de la humedad relativa (15). Gauhl (4), trabajando con bananos, reportó resultados similares bajo condiciones costarricenses. Mientras que Meredith et al. (15) no encontraron evidencia de que la producción o liberación de ascosporas se viera afectada por las temperaturas mínimas, Gauhl (4) determinó que existe una reducción en la producción de inóculo durante los meses más secos (o menos lluviosos) del año en la zona caribeña de Costa Rica, que es también la estación con las temperaturas más bajas. Las ascosporas se dispersan por el viento; sin embargo, la dispersión a larga distancia se limita a unos cientos de kilómetros debido a su susceptibilidad a la radiación ultravioleta (17). No se ha demostrado una relación consistente entre la descarga de ascosporas y el desarrollo de la enfermedad, lo que limita la utilidad de la captura de esporas para el pronóstico de la enfermedad (5,11). Las ascosporas se depositan principalmente en la superficie inferior de la hoja durante el despliegue de una hoja nueva, produciendo un patrón de banda de infecciones en el lado que se expone primero, lo cual es un reflejo de la mayor deposición de esporas en la hoja cilíndrica de candela durante su despliegue en comparación con toda la lámina abierta de la hoja. En consecuencia, la mayoría de las infecciones se producen en la superficie abaxial de las hojas (3,7).
Infección
Los tubos germinativos tardan aproximadamente de 48 a 72 h en penetrar en los estomas (1,20), aunque el hongo puede crecer epifíticamente en la superficie de la hoja hasta 6 días antes de penetrar realmente en las hojas (1). Infección exitosa se fomenta mediante la ampliación periodos de alta humedad y presencia de agua libre en las hojas (3,7,13). La germinación máxima se produce cuando hay agua libre presente. Los conidios germinan en un rango más amplio de humedad relativa (92 a 100%) que las ascosporas (98 a 100%). El efecto de temperatura sobre la germinación puede caracterizarse por una función de respuesta cuadrática, con un óptimo estimado de 26,5°C (10). Stover (21) observó un crecimiento máximo de los tubos germinativos de ascosporas a 26 a 28°C después de 24 h de incubación. Jacome y Schuh (8,9) informaron de que las hojas más viejas eran más susceptibles; sin embargo, E. Bureau (comunicación personal) y Romero (18) observaron que las hojas más jóvenes son más susceptibles (de la primera a la tercera) que las más viejas.
Periodo de incubación
El tiempo entre la infección y la aparición de los síntomas varía según las condiciones climáticas y la susceptibilidad de la planta (68). En banano, se estima que el momento de la infección foliar coincide con la emergencia de una nueva hoja desde el ápice del pseudotallo (20). Bajo condiciones muy favorables en Costa Rica, y con un hospedero susceptible, el periodo de incubación puede ser tan corto como de 13 a 14 días, mientras que durante los períodos de clima desfavorable, la duración del período de incubación puede extenderse hasta 35 días. Existen informes similares de Nigeria sobre plátanos (16). Durante la estación lluviosa, el período de incubación fue de 14 días, pero en la estación seca fue de 24 días. La duración del periodo de incubación también varía con la susceptibilidad del cultivar a M. fijiensis. El período de incubación fue de 26,2 y 25,1 días, respectivamente, en los cultivares FHIA 1 y FHIA 2, dos híbridos sintéticos tetraploides desarrollados por la FHIA, en comparación con los 22,4 días del cultivar susceptible Grande Naine (19).
Tras penetrar en la hoja, las hifas de <M. fijiensis Colonizan las células adyacentes durante aproximadamente 7 días sin ninguna evidencia de alteración de las células. Las hifas vegetativas pueden emerger de los estomas y crecer en la superficie de la hoja y penetrar en los estomas adyacentes o producir conidióforos y conidias. Este crecimiento epifítico permite al hongo colonizar el tejido foliar adyacente, lo que da lugar a un rápido desarrollo de los síntomas (4,20). M. fijiensis tiene mayor capacidad para penetrar en varios estomas que el M. musicolalo que da lugar a un mayor manchado que con el patógeno anterior (20).
Periodo latente
Aunque pueden producirse conidios en lesiones que presenten síntomas tempranos de M. fijiensis y contribuyen a la epidemia, el periodo de latencia se define por el momento en que el hongo empieza a producir lesiones con pseudotecios y ascosporas maduros, que son la principal fuente de inóculo. Al igual que el periodo de incubación, el periodo de latencia también varía en función de las condiciones meteorológicas, la susceptibilidad del hospedador y la intensidad de las infecciones. En Guápiles (Costa Rica), el periodo de latencia oscila entre 25 días durante la estación lluviosa (de junio a diciembre) y 70 días durante la estación seca. Cuando el clima es muy propicio para la descarga de ascosporas y la infección, se producen muchas infecciones en las hojas. Cuando las infecciones son densas, se unen rápidamente en una etapa muy temprana de desarrollo, acelerando la aparición de manchas maduras que se caracterizan por la presencia de pseudotecios y ascosporas (22). En estas condiciones, las hojas resultan rápida y gravemente dañadas. El periodo de latencia también varía en función del nivel de resistencia. Por ejemplo, el tiempo desde la emergencia de la hoja hasta el primer síntoma de mancha madura bajo las mismas condiciones naturales para el cultivar Curraré, un plátano de cocina perteneciente al subgrupo plátano, fue de 44 días comparado con 34 días para el cultivar Valery, un plátano perteneciente al subgrupo Cavendish (4). El término "tiempo de desarrollo de la enfermedad" es ampliamente usado en la literatura del banano en los trópicos para referirse al periodo latente, y se define como el tiempo entre la infección y la formación de manchas maduras. Otro término comúnmente usado en la literatura bananera es "tiempo de evolución de los síntomas" o "periodo de transición", que es el tiempo desde los primeros síntomas hasta la aparición de manchas maduras (6). El tiempo de evolución de los síntomas da una buena indicación de la rapidez con la que la enfermedad progresa en las hojas.
Literatura:
- Beveraggi, A. 1992. Etude des interactions hôte-parasite chez des bananiers sensibles et résistants inoculés par Cercospora fijiensis responsable de la maladie des raies noires. Thèse de 3ème cycle. Université de Montpellier, Montpellier, France.
- Burt, J. P. A., Rosenberg, L. J., Rutter, J., Ramírez, F., y González, O. H. 1999. Predicción de la propagación aérea de Mycosphaerella fijiensis, causante de la enfermedad de la Sigatoka negra del plátano: Estimación del número de peritecios y ascosporas. Ann. Biol. 135:369-377.
- Fullerton, R. A. 1994. Sigatoka Leaf Diseases.Pages 12-14 in: Compendio de Enfermedades de Frutas Tropicales. R. C. Ploetz, G. A. Zentmyer, W. T. Nishijinia, K. G. Rohrbach, and H. D. Ohr, eds. American Phytopathological Society, St. Paul, MN.
- Gauhl, F. 1994. Epidemiología y Ecología de la Sigatoka negra (Mycosphaerella fijiensis Morelet) en Plátano y Banano (Musa spp.) en Costa Rica, América Central. INIBAP, Montpellier, Francia.
- Gauhl, F. 2002. ¿Son las trampas de esporas una herramienta útil para predecir el desarrollo de la enfermedad Sigatoka en plantaciones comerciales de banano? Página 22 en: Int. Workshop Mycosphaerella Leaf Spot Dis. Bananas, 2nd - Programme and Abstracts. (Abstr.)
- Gauhl, F., Pasberg-Gauhl, C., y Jones, D. R. 2000. Ciclo de la enfermedad y epidemiología. Páginas 56-62 en: Enfermedades del Plátano, Abacá y Enset. D. R. Jones, ed. CAB International, Wallingford, Reino Unido.
- González, M. 1987. Enfermedades del cultivo del banano. Oficina de Publicaciones de la Universidad de Costa Rica, San José.
- Jacome, L. H., y Schuh, W. 1992. Efectos de la duración de la humedad de la hoja y la temperatura en el desarrollo de la enfermedad Sigatoka negra en banano infectado por Mycosphaerella fijiensis var. difformis. Fitopatología 82:515-520.
- Jacome, L. H., y Schuh, W. 1993. Effect of temperature on growth and conidial production in vitro, and comparison of infection and aggressiveness in vivo among isolates of Mycosphaerella fijiensis var. difformis. Trop. Agric. 70:51-59.
- Jacome, L. H., Schuh, W., y Stevenson, R. E. 1991. Effect of temperature and relative humidity on germination and germ tube development of Mycosphaerella fijiensis var. difformis. Fitopatología 81:1480-1485.
- Jeger, M. J., Eden-Green, S., Thresh, J. M., Johanson, J. M., Waller, J. M., y Brown, A. E. 1995. Enfermedades del plátano. Páginas 317-381 en: Bananas and Plantains. S. Gowen, ed. Chapman & Hall, Londres.
- Marín, D. H., y Romero, R. A. 1992. El combate de la Sigatoka negra. Boletín No. 4, Departamento de Investigaciones, Corporación Bananera Nacional, Costa Rica.
- Mayorga, M. H. 1990. La Raya negra (Mycosphaerella fijiensis Morelet) del plátano y del banano. I. Ciclo de vida del patógeno bajo las condiciones del Urabá. Revista ICA 25:69-77.
- Meredith, D. S., y Lawrence, J. S. 1969. Enfermedad de las estrías negras de la hoja del plátano (Mycosphaerella fijiensis): Symptoms of disease in Hawaii, and notes on the conidial state of the causal fungus. Trans. Br. Mycol. Soc. 52:459-476.
- Meredith, D. S., Lawrence, J. S., y Firman,I. D. 1973. Ascospore release and dispersal on black leaf streak disease of bananas (Mycosphaerella fijiensis). Trans. Br. Mycol. Soc. 60:547-554.
- Mobambo, K. N., Gauhl, F., Pasberg-Gauhl, C., y Zuofa, K. 1996. Season and plant age effect evaluation of plantain for response to black Sigatoka disease. Crop Prot. 15:609- 614.
- Parnell, M., Burt, P. J. A., y Wilson, K. 1998. The influence of exposure to ultraviolet radiation in simulated sunlight on ascospores causing black Sigatoka disease of banana and plantain. Int. J. Biometeorol. 42:22-27.
- Romero, R. A. 1995. Dinámica de poblaciones de Mycosphaerella fijiensis resistentes a fungicidas y epidemiología de la Sigatoka negra del plátano. Ph.D. diss. North Carolina State, Raleigh.
- Romero, R. A., y Sutton, T. B. 1997. Reacción de cuatro genotipos de Musa a tres temperaturas frente a aislados de Mycosphaerella fijiensis de diferentes regiones. Plant Dis. 81:1139-1142.
- Stover, R. H. 1980. Sigatoka leaf spot of bananas and plantains. Plant Dis. 64:750-756.
- Stover, R. H. 1983. The effect of temperature on ascospore germ tube growth of Mycosphaerella musicola and Mycosphaerela fijiensis var. difformis. Fruits 38:625-628.
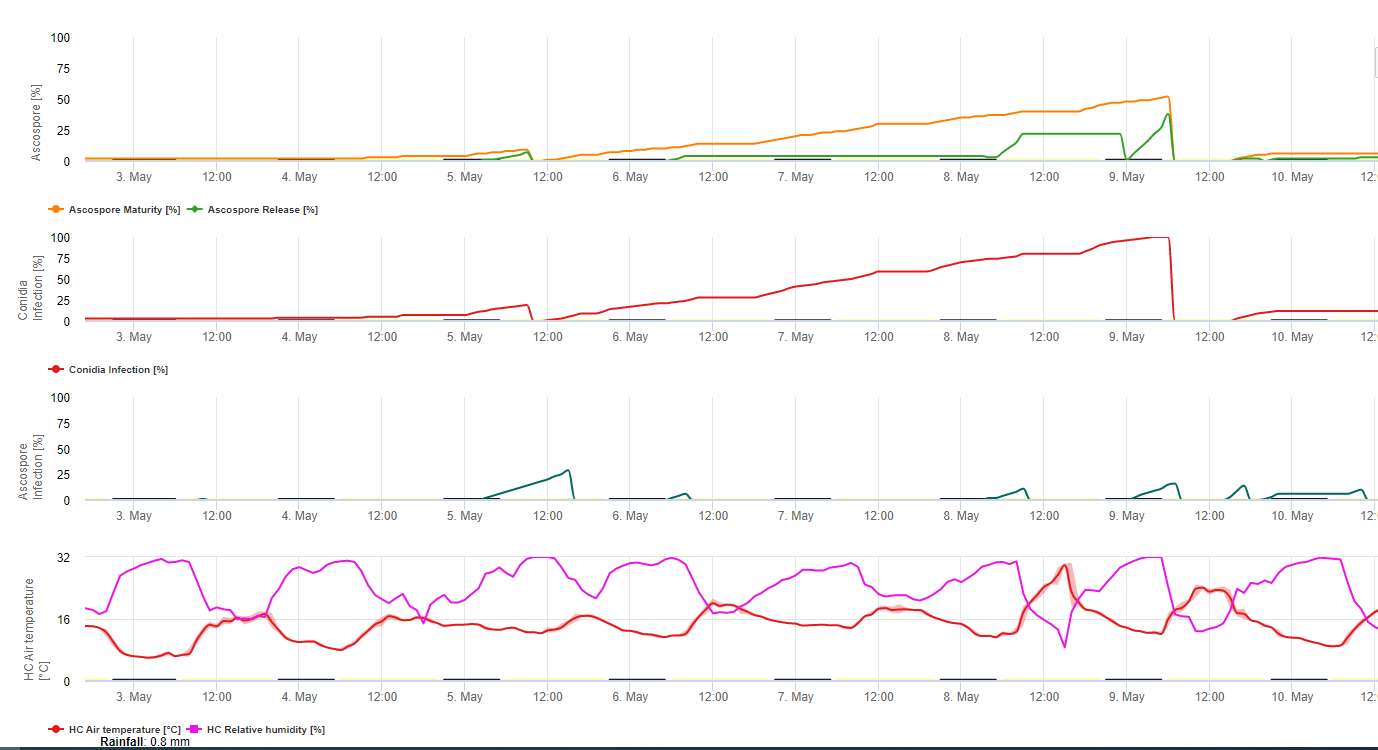
Modelo de infección por Sigatoka negra
El Modelo de Infección Sigatoka en FieldClimate.com consiste en un Modelo para:
- Formación de ascosporas
- Descarga de ascosporas
- Infección por ascosporas
El modelo de formación de conidios utiliza la humedad relativa y la temperatura del aire. La formación de conidios se produce si la humedad relativa es igual o superior a 70%. La velocidad de formación de conidios depende de la temperatura. La temperatura óptima para la formación de conidios es de 27°C a 30°C. A esta temperatura máxima, se formarán conidios si tenemos una humedad relativa de 70% durante más de 24 horas. Si hace más frío o más calor, la formación máxima de conidios tardará 32 horas.
El modelo para la formación de ascosporas utiliza también la temperatura y la humedad relativa. La formación de ascosporas tiene lugar si la humedad relativa es igual o superior a 70%. La temperatura óptima vuelve a ser de 27 °C a 30 °C. A esta temperatura, el máximo de ascosporas se alcanza al cabo de 48 horas. A temperaturas inferiores, se tarda 2 días en formar la cantidad máxima de ascosporas.
La descarga de ascosporas tiene lugar durante la lluvia. La mayor cantidad de ascosporas se libera al principio de la lluvia. Por lo tanto, las esporas se liberarán al principio de la infección. La cantidad de ascosporas liberadas está limitada al número de ascosporas formadas.
La infección tiene lugar durante los periodos de humedad de la hoja o de humedad relativa superior a 90%. Si la temperatura es óptima, la infección finalizará tras 12 horas de condiciones de humedad. Si la temperatura no es tan alta necesitará de 15 a 24 horas.
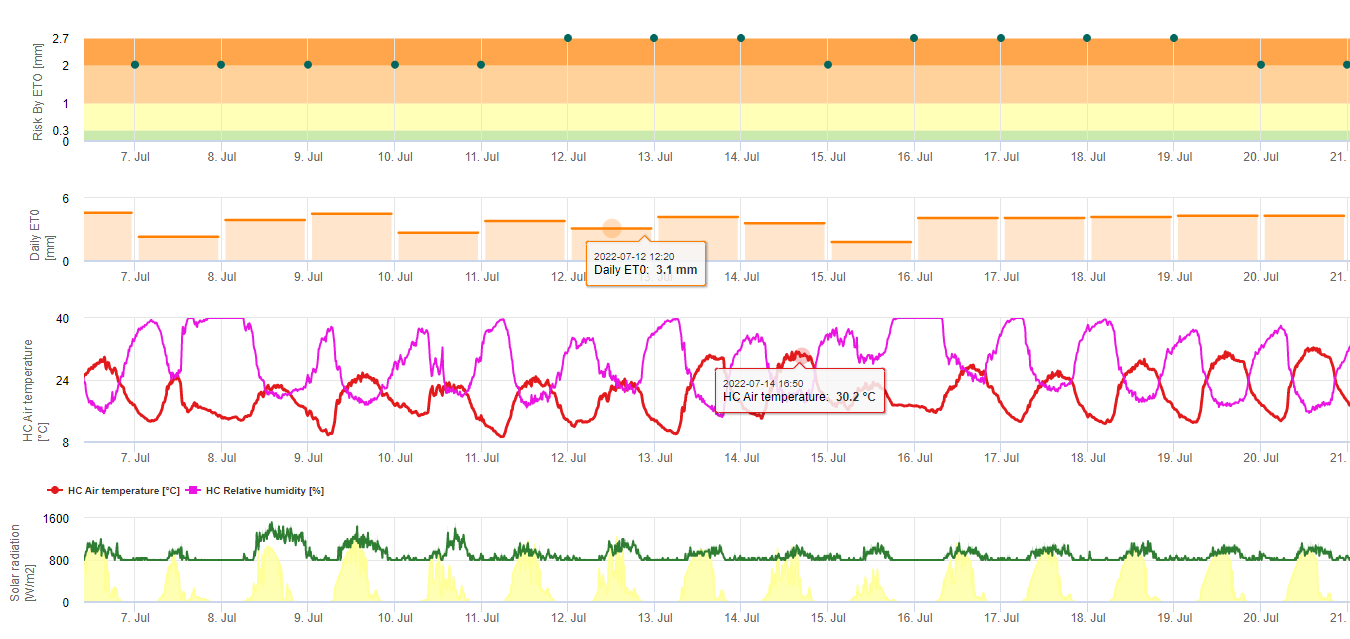
Modelo de riesgo de la Sigatoka negra
Un modelo (riesgo Sigatoka por ET) se basa en a) La determinación de la evapotranspiración (sensores necesarios: temperatura, humedad relativa, velocidad del viento y radiación global). Este modelo se basa en los trabajos de Ganry, J. & Meyer,J.P. (1972): La lutte contrôlée contre le Cercospora aux Antilles. Bases climatiques de l'avertissement. Fruits 27(11):767-774. En este estudio se utilizó el ETpiche para evaluar la favorabilidad climática a la sigatoka. Field.Climate utiliza la ecuación "Penman Montheith" (es la más general y ampliamente utilizada para el cálculo de la ET de referencia) en lugar de la ETpiche. Si la Evapotranspiración acumulada de los últimos 7 días es:
> 40 mm Sin riesgo
> 30 mm Riesgo bajo
> 22 mm Riesgo medio
< 22 mm Alto riesgo
Información para la evaluación del aerosol de Sigatoka negra
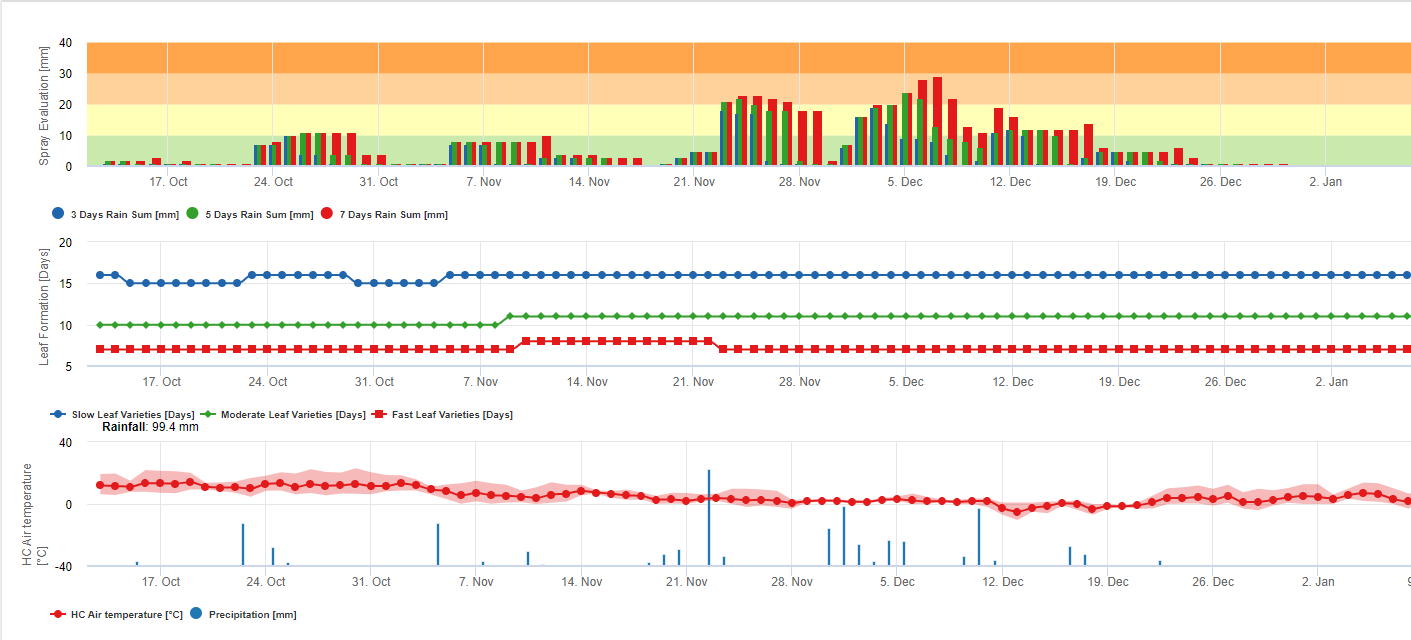
Acumulación de lluvia para evaluación de residuos en FieldClimate:
Si la lluvia es >= 3 mm, se contabiliza y acumula:
- 3 días
- 5 días
- 7 días
La lluvia-suma acumulada da como resultado un Gráfico en referencia a un umbral de 10, 20 y 30 mm.
Formación de hojas para la evaluación de residuos en FieldClimate:
Si las temperaturas del aire diurno y nocturno son:
12-14°C y 12-13°C tarda 23, 16 ó 21 días 15-17°C y 14-15°C tarda 20, 14 ó 10 días 18-20°C y 16-22°C tarda <15, <12 ó <8 días 21-27°C y 16-22°C tarda <13, <11 ó <6 días 28-30°C y 23-24°C tarda <14, <12 ó <8 días 31-40°C y 25-40°C tarda 20, 14 ó 10 días en formar todas las hojas en variedades con formación de hojas media, rápida y muy rápida.
Esta información debería ayudar a evaluar el tejido no protegido. Por lo tanto, las razones podrían ser una gran cantidad de lluvia desde la última aplicación de medidas fitosanitarias (los residuos ya se han lavado o se han formado hojas nuevas.
Equipamiento recomendado
Compruebe qué conjunto de sensores se necesita para vigilar las posibles enfermedades de este cultivo.