Banana modelli di malattia
La banana è uno dei frutti più importanti a livello mondiale. Nella sua forma dolce, come Dollar Banana, e nella sua forma non dolce, in cucina, è una delle principali componenti della dieta delle popolazioni dei paesi tropicali. Dalla fine del XIX secolo la banana inizia a diventare il frutto più importante del commercio mondiale. Le banane prodotte in America Centrale e nei Caraibi iniziarono a essere esportate negli Stati Uniti e in Europa. Oggi la banana è una parte importante della base frutticola dei paesi industriali. Con l'aumento dei redditi in Cina e nell'Europa orientale, nuovi mercati producono nuove richieste di banane.
Ci sono due importanti malattie da macchie fogliari nelle banane: Sigatoka giallo e Sigatoka nero. La Sigatoka gialla causata dal fungo Mycosphaerella musicola si è diffusa in tutte le aree di coltivazione delle banane, mentre la Sigatoka nera causata dal fungo M. fijiensis var. difformis è stata riscontrata nelle Fiji. La Sigatoka nera mostra una virulenza molto più elevata rispetto alla Sigatoka gialla e per questo motivo è diventata la malattia più importante per le banane nella maggior parte dei Paesi produttori.
Malattia della sigatoka nera
Il lavoro si basa sui due articoli seguenti:
- Malattia delle foglie nere; Parassiti e malattie delle Samoa americane numero 10, American Samoa Community College Community & Natural Resources Cooperative Research & Extension. 2004
- Sigatoka nera Un filo in più per la coltivazione delle banane; Douglas H. Marín, Del Monte Fresh Produce; Ronald A. Romero, Chiquita Brands; Mauricio Guzmán, National Banana Corporation of Costa Rica; Turner B. Sutton, Università di Stato della Carolina del Nord, Raleigh.
L'infestazione fogliare nera (BLS), o "Black Sigatoka", è la malattia fogliare più dannosa del banano a livello mondiale. Colpisce la maggior parte delle aree tropicali e subtropicali, con perdite riportate di 30-50%. La prima segnalazione di BLS nel Pacifico risale a 40 anni fa nella Sigatoka Valley, nelle Fiji. La maggior parte dei fungicidi utilizzati nella produzione di banane serve a controllare la BLS. Il banano di tipo Cavendish "Williams", coltivato dalla maggior parte dei coltivatori commerciali, è molto suscettibile alla malattia fungina. Le piante infette hanno un numero inferiore di foglie, il che porta a un numero inferiore di frutti e a frutti più piccoli, a un raccolto ritardato, a una maturazione precoce e a frutti di qualità inferiore.
Impatto potenziale
La sigatoka nera causa la distruzione del tessuto fogliare del banano, che influisce sulle capacità fotosintetiche della pianta e può ridurre le rese fino a 50%. La sigatoka nera è uno dei principali fattori responsabili del declino delle industrie di esportazione delle banane nelle nazioni del Pacifico meridionale. Le piantagioni commerciali che producono banane per l'esportazione devono mantenere un costoso programma di irrorazione di fungicidi per controllare la sigatoka nera e sono state criticate per considerazioni ambientali e di salute umana. Tuttavia, se non controllati, i frutti prodotti su piante malate possono maturare prematuramente durante la spedizione e causare ulteriori perdite. La devastazione della malattia è stata controllata con irrorazioni chimiche negli anni successivi (15-17 applicazioni di fungicidi), ma ciò ha aumentato notevolmente i costi di produzione.
Piante colpite
I sintomi definitivi della Black sigatoka sono stati registrati solo su Musa (Banane), Musa paradisiaca (Piantaggine), Musa acuminata (Banana selvatica) e Musa acuminata (subsp. bantesii e la subsp. zebrina). Le cultivar si differenziano per la loro reazione al patogeno. L'immunità non è nota ed è possibile che altre specie e sottospecie selvatiche di Musa sono infetti, ma la malattia non si sviluppa in modo significativo. Mycosphaerella fijiensis può attaccare anche le piantine di banane selvatiche.
Stagione in cui si verifica il fenomeno
Le spore della sigatoka nera si formano prontamente durante le estati tropicali e subtropicali o in condizioni di elevata umidità e precipitazionisoprattutto se sulle foglie è presente una pellicola d'acqua libera. Il principale mezzo di diffusione è la pioggia o lo spruzzo di spore, ma più avanti nello sviluppo della malattia le spore vengono anche rilasciate forzatamente nelle correnti d'aria. L'infezione si verifica sulle foglie più giovani della pianta durante e subito dopo lo srotolamento, ma le foglie più vecchie sono più favorevoli allo sviluppo della malattia. I sintomi visivi evidenti compaiono circa 15-20 giorni dopo l'infezione iniziale.
Sintomi
I primi sintomi apparenti dell'infezione fogliare sono brevi linee bruno-rossastre lunghe circa 2 mm. Le linee si trasformano in striature marroni lunghe 20-30 mm che si allargano in macchie ellittiche, marroni sulla parte inferiore della foglia, nere sulla superficie superiore. Le macchie sono leggermente infossate e circondate da un alone giallastro. Successivamente, il centro della grande macchia diventa grigio, delimitato da una linea nera e da un alone giallo. Infine, le macchie si fondono, uccidendo la foglia.
Epidemiologia
Sia i conidi che le ascospore svolgono un ruolo nella diffusione della malattia. I conidi si formano in condizioni di elevata umiditàsoprattutto in presenza di una pellicola d'acqua libera sulle foglie. Si formano durante lo sviluppo dei primi stadi della malattia (in particolare durante lo stadio 2 del trattino, lo stadio 3 della macchia e lo stadio 4 della macchia). I principali mezzi di dispersione sono la pioggia e gli spruzzi; i conidi non vengono staccati dal vento. I conidi sono associati soprattutto alla diffusione locale della malattia e sono importanti durante i periodi di elevata umidità, di frequenti e forti piogge e di rovesci intermittenti.
Perché M. fijiensis producendo relativamente pochi conidi, le ascospore sono considerate più importanti nella diffusione della Sigatoka nera (4,20). Tuttavia, Jacome et al. (10) hanno affermato che i conidi sono in grado di causare quantità significative di malattia e i sintomi della malattia sono identici a quelli causati dall'infezione da ascospore. Ha indicato che i conidi diventano più importanti durante i periodi di siccità, quando lo sviluppo della malattia è ritardato dalla presenza di condizioni climatiche meno favorevoli (10). Le ascospore sono il mezzo principale per dispersione su distanze maggiori all'interno delle piantagioni e in nuove aree, e sono il mezzo abituale di diffusione durante i lunghi periodi di tempo umido (3,4,6,10, 11,15).
Le ascospore sono prodotte in pseudoteche nelle lesioni mature, che sono comuni sulle foglie più vecchie della pianta o nelle foglie morte che giacciono sul terreno. Meredith e Lawrence (14) hanno riportato che gli pseudoteci sono prodotti su entrambi i lati della superficie fogliare, ma un numero maggiore è presente sulla superficie adassiale. Al contrario, Gauhl et al. (6) hanno riscontrato una maggiore produzione di pseudoteci e ascospore sulla superficie abassiale della foglia. Sebbene Burt et al. (2) abbiano riscontrato che per ogni pseudotecio vengono rilasciate circa 4,5 ascospore, questo numero sembra molto basso se si considera l'alta concentrazione di inoculo presente nell'aria dopo la pioggia (4).
Rilascio di ascospore
Richiede la presenza di una pellicola d'acqua dovuta alla pioggia o alla rugiada che imbibisce gli pseudoteci e provoca l'espulsione forzata delle ascospore attraverso lo strato limite della foglia, dove vengono disseminate dalle correnti d'aria (15,20). La maturazione degli pseudoteci richiede una saturazione dei tessuti delle foglie morte per circa 48 ore (3,4,7,10,11,15). In condizioni hawaiane, le concentrazioni di ascospore sono aumentate durante la notte, hanno raggiunto il massimo intorno alle 06:00 e sono diminuite significativamente durante il giorno. Nei giorni di pioggia, i picchi di concentrazione si sono verificati poco dopo l'inizio della pioggia. Gli aumenti stagionali delle concentrazioni medie giornaliere di ascospore sono associati all'aumento delle precipitazioni e dell'umidità relativa (15). Gauhl (4), lavorando con le banane, ha riportato risultati simili in condizioni di Costa Rica. Mentre Meredith et al. (15) non hanno trovato prove che la produzione o il rilascio di ascospore fosse influenzato dalle temperature minime, Gauhl (4) ha determinato una riduzione della produzione di inoculo durante i mesi più secchi (o meno piovosi) dell'anno nella zona caraibica del Costa Rica, che è anche la stagione con le temperature più basse. Le ascospore sono disperse dal vento; tuttavia, la dispersione a lunga distanza è limitata a poche centinaia di chilometri a causa della loro suscettibilità alle radiazioni ultraviolette (17). Non è stata dimostrata una relazione coerente tra la dispersione delle ascospore e lo sviluppo della malattia, limitando così l'utilità della cattura delle spore per la previsione della malattia (5,11). Le ascospore si depositano principalmente sulla superficie inferiore della foglia durante lo srotolamento di una nuova foglia, producendo un pattern di infezioni a bande sul lato esposto per primo, che riflette la maggiore deposizione di spore sulla foglia cilindrica di candela durante lo srotolamento rispetto all'intera lamina aperta della foglia. Di conseguenza, la maggior parte delle infezioni si verifica sulla superficie abassiale delle foglie (3,7).
Infezione
I tubi germinali impiegano circa 48-72 ore per penetrare negli stomi (1,20), anche se il fungo può crescere epifiticamente sulla superficie fogliare per un massimo di 6 giorni prima di penetrare effettivamente nelle foglie (1). Infezione riuscita è promosso da un'estesa periodi di elevata umidità e presenza di acqua libera sulle foglie (3,7,13). La germinazione massima avviene in presenza di acqua libera. I conidi germinano in un intervallo più ampio di umidità relativa (da 92 a 100%) rispetto alle ascospore (da 98 a 100%). L'effetto di temperatura sulla germinazione può essere caratterizzata da una funzione di risposta quadratica, con un optimum stimato a 26,5°C (10). Stover (21) ha osservato la crescita massima dei tubi germinativi delle ascospore a Da 26 a 28°C dopo 24 ore di incubazione. Jacome e Schuh (8,9) hanno riferito che le foglie più vecchie sono più suscettibili; tuttavia, E. Bureau (comunicazione personale) e Romero (18) hanno osservato che le foglie più giovani sono più suscettibili (dalla prima alla terza) di quelle più vecchie.
Periodo di incubazione
Il tempo che intercorre tra l'infezione e la comparsa dei sintomi varia a seconda delle condizioni climatiche e della suscettibilità della pianta (68). Nel banano, si stima che il momento dell'infezione fogliare coincida con la comparsa di una nuova foglia dall'apice dello pseudofusto (20). In condizioni molto favorevoli in Costa Rica, e con un ospite suscettibile, il periodo di incubazione può essere di 13-14 giorni, mentre durante i periodi di clima sfavorevole, la durata del periodo di incubazione può estendersi fino a 35 giorni. Rapporti simili provengono dalla Nigeria e riguardano la piantaggine (16). Durante la stagione delle piogge, il periodo di incubazione era di 14 giorni, mentre nella stagione secca era di 24 giorni. La durata del periodo di incubazione varia anche in base alla suscettibilità della cultivar a M. fijiensis. Il periodo di incubazione è stato rispettivamente di 26,2 e 25,1 giorni nelle cultivar FHIA 1 e FHIA 2, due ibridi sintetici tetraploidi sviluppati da FHIA, rispetto ai 22,4 giorni della cultivar suscettibile Grande Naine (19).
Dopo essere penetrate nella foglia, le ife di <M. fijiensis colonizzano le cellule adiacenti per circa 7 giorni senza alcuna evidenza di rottura delle cellule. Le ife vegetative possono emergere dagli stomi e crescere sulla superficie della foglia e penetrare negli stomi adiacenti o produrre conidiofori e conidi. Questa crescita epifita permette al fungo di colonizzare il tessuto fogliare adiacente, con conseguente rapido sviluppo dei sintomi (4,20). M. fijiensis ha una maggiore capacità di penetrare in diversi stomi rispetto a M. musicola, che risulta in una maggiore macchia rispetto al precedente patogeno (20).
Periodo latente
Sebbene i conidi possano essere prodotti nelle lesioni che presentano i primi sintomi di M. fijiensis e contribuiscono all'epidemia, il periodo di latenza è definito dal momento in cui il fungo inizia a produrre lesioni con pseudoteche e ascospore mature, che sono la principale fonte di inoculo. Come il periodo di incubazione, anche il periodo di latenza varia in base alle condizioni climatiche, alla suscettibilità dell'ospite e all'intensità delle infezioni. Il periodo di latenza varia da 25 giorni durante la stagione delle piogge (da giugno a dicembre) a 70 giorni durante la stagione secca a Guapiles, in Costa Rica. Quando il clima è molto favorevole alla fuoriuscita delle ascospore e all'infezione, si verificano molte infezioni sulle foglie. Quando le infezioni sono dense, si aggregano rapidamente in uno stadio di sviluppo molto precoce, accelerando la comparsa di macchie mature caratterizzate dalla presenza di pseudoteche e ascospore (22). In queste condizioni, le foglie vengono rapidamente e gravemente danneggiate. Il periodo di latenza varia anche in base al livello di resistenza. Ad esempio, il tempo trascorso dall'emergenza delle foglie al primo sintomo di macchia matura nelle stesse condizioni naturali per la cultivar Curraré, una banana da cucina appartenente al sottogruppo della piantaggine, è stato di 44 giorni rispetto ai 34 giorni della cultivar Valery, una banana appartenente al sottogruppo Cavendish (4). Il termine "tempo di sviluppo della malattia" è ampiamente utilizzato nella letteratura sulla banana ai tropici per indicare il periodo di latenza, ed è definito come il tempo che intercorre tra l'infezione e la formazione di macchie mature. Un altro termine comunemente usato nella letteratura sul banano è "tempo di evoluzione dei sintomi" o "periodo di transizione", che è il tempo che intercorre tra i primi sintomi e la comparsa delle macchie mature (6). Il tempo di evoluzione dei sintomi fornisce una buona indicazione della velocità con cui la malattia progredisce sulle foglie.
Letteratura:
- Beveraggi, A. 1992. Studio delle interazioni ospite-parassita in bananieri sensibili e resistenti inoculati da Cercospora fijiensis responsabile della malattia delle razze nere. Tesi di laurea del 3º ciclo. Università di Montpellier, Montpellier, Francia.
- Burt, J. P. A., Rosenberg, L. J., Rutter, J., Ramírez, F. e González, O. H. 1999. Previsione della diffusione aerea di Mycosphaerella fijiensis, causa della malattia della Sigatoka nera del banano: Stime del numero di periteci e ascospore. Ann. Appl. Biol. 135:369-377.
- Fullerton, R. A. 1994. Malattie delle foglie di Sigatoka. Pagine 12-14 in: Compendio delle malattie dei frutti tropicali. R. C. Ploetz, G. A. Zentmyer, W. T. Nishijinia, K. G. Rohrbach e H. D. Ohr, eds. American Phytopathological Society, St. Paul, MN.
- Gauhl, F. 1994. Epidemiologia ed ecologia della Sigatoka nera (Mycosphaerella fijiensis Morelet) su piantaggine e banano (Musa spp.) in Costa Rica, America Centrale. INIBAP, Montpellier, Francia.
- Gauhl, F. 2002. Le trappole per spore sono uno strumento utile per prevedere lo sviluppo della malattia Sigatoka nelle piantagioni di banane commerciali? Pagina 22 in: Int. Workshop Mycosphaerella Leaf Spot Dis. Banane, 2° - Programma e Abstracts. (Abstr.)
- Gauhl, F., Pasberg-Gauhl, C. e Jones, D. R. 2000. Ciclo ed epidemiologia della malattia. Pagine 56-62 in: Malattie del Banano, dell'Abacá e dell'Enset. D. R. Jones, ed. CAB International, Wallingford, Regno Unito.
- González, M. 1987. Le malattie della coltivazione del banano. Oficina de Publicaciones de la Universidad de Costa Rica, San José.
- Jacome, L. H. e Schuh, W. 1992. Effetti della durata dell'umidità fogliare e della temperatura sullo sviluppo della malattia di Sigatoka nera su banane infettate da Mycosphaerella fijiensis var. difformis. Fitopatologia 82:515-520.
- Jacome, L. H. e Schuh, W. 1993. Effetto della temperatura sulla crescita e sulla produzione di conidi in vitro e confronto dell'infezione e dell'aggressività in vivo tra isolati di Mycosphaerella fijiensis var. difformis. Trop. Agric. 70:51-59.
- Jacome, L. H., Schuh, W. e Stevenson, R. E. 1991. Effetto della temperatura e dell'umidità relativa sulla germinazione e sullo sviluppo del tubo germinale di Mycosphaerella fijiensis var. difformis. Fitopatologia 81:1480-1485.
- Jeger, M. J., Eden-Green, S., Thresh, J. M., Johanson, J. M., Waller, J. M. e Brown, A. E. 1995. Malattie del banano. Pagine 317-381 in: Banane e Pianteggine. S. Gowen, ed. Chapman & Hall, Londra.
- Marín, D. H. e Romero, R. A. 1992. La lotta alla Sigatoka negra. Bollettino n. 4, Departamento de Investigaciones, Corporación Bananera Nacional, Costa Rica.
- Mayorga, M. H. 1990. La Raya negra (Mycosphaerella fijiensis Morelet) del plátano e del banano. I. Ciclo di vita del patógeno nelle condizioni dell'Urabá. Revista ICA 25:69-77.
- Meredith, D. S. e Lawrence, J. S. 1969. Malattia delle foglie nere del banano (Mycosphaerella fijiensis): Sintomi della malattia nelle Hawaii e note sullo stato conidiale del fungo causale. Trans. Br. Mycol. Soc. 52:459-476.
- Meredith, D. S., Lawrence, J. S. e Firman, I. D. 1973. Rilascio e dispersione delle ascospore nella malattia della striatura fogliare nera del banano (Mycosphaerella fijiensis). Trans. Br. Mycol. Soc. 60:547-554.
- Mobambo, K. N., Gauhl, F., Pasberg-Gauhl, C. e Zuofa, K. 1996. Valutazione dell'effetto della stagione e dell'età della piantaggine sulla risposta alla malattia della Sigatoka nera. Crop Prot. 15:609- 614.
- Parnell, M., Burt, P. J. A. e Wilson, K. 1998. L'influenza dell'esposizione ai raggi ultravioletti in luce solare simulata sulle ascospore che causano la malattia della Sigatoka nera del banano e della piantaggine. Int. J. Biometeorol. 42:22-27.
- Romero, R. A. 1995. Dinamica delle popolazioni di Mycosphaerella fijiensis resistenti ai fungicidi ed epidemiologia della Sigatoka nera delle banane. Tesi di dottorato. North Carolina State, Raleigh.
- Romero, R. A. e Sutton, T. B. 1997. Reazione di quattro genotipi di Musa a tre temperature a isolati di Mycosphaerella fijiensis provenienti da diverse regioni. Plant Dis. 81:1139-1142.
- Stover, R. H. 1980. Macchia fogliare Sigatoka di banane e platani. Plant Dis. 64:750-756.
- Stover, R. H. 1983. Effetto della temperatura sulla crescita del tubo germinativo dell'ascospora di Mycosphaerella musicola e Mycosphaerela fijiensis var. difformis. Frutti 38:625-628.
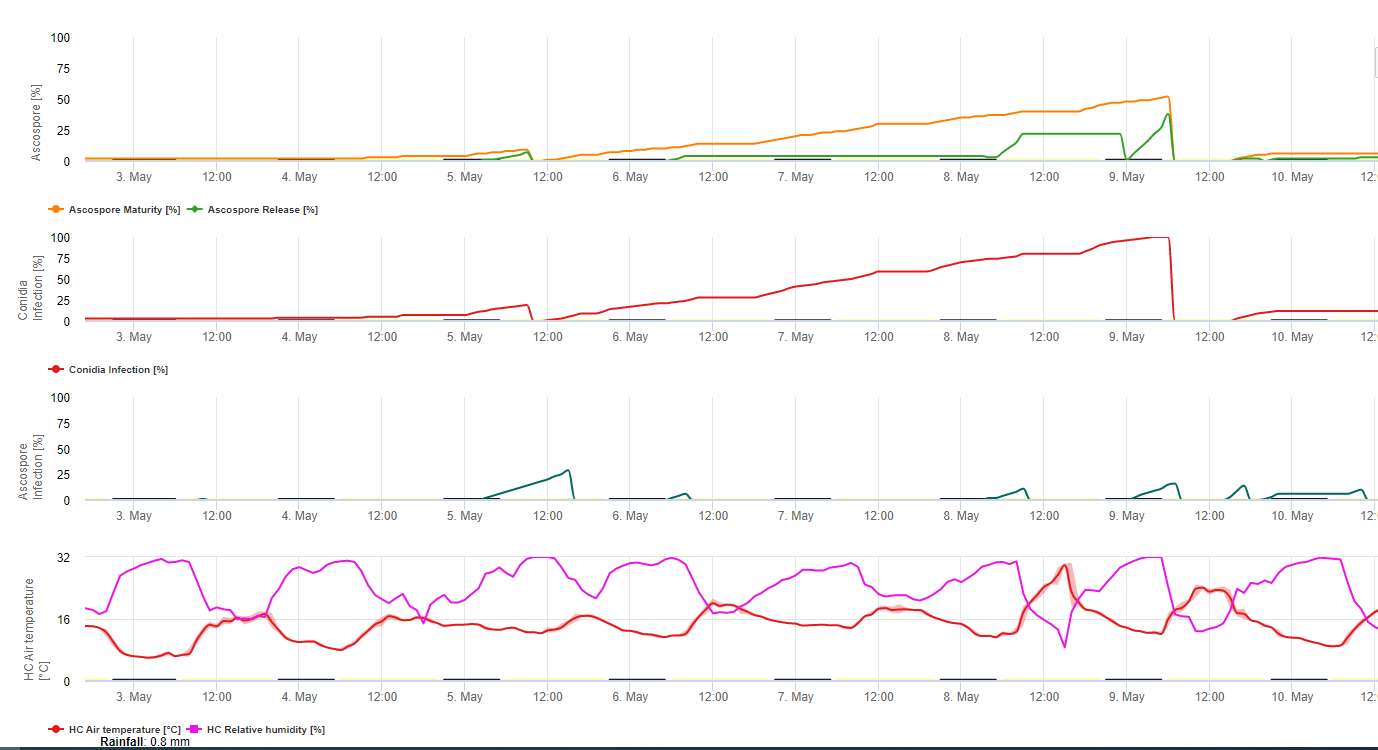
Modello di infezione da Sigatoka nera
Il modello di infezione Sigatoka su FieldClimate.com consiste in un modello per:
- Formazione delle ascospore
- Scarico delle ascospore
- Infezione da ascospore
Il modello per la formazione di conidi utilizza l'umidità relativa e la temperatura dell'aria. La formazione di conidi avviene se l'umidità relativa è uguale o superiore a 70%. La velocità di formazione dei conidi dipende dalla temperatura. La temperatura ottimale per la formazione dei conidi è compresa tra i 27°C e i 30°C. A questa temperatura massima, i conidi si formeranno se l'umidità relativa è pari a 70% per più di 24 ore. Se la temperatura è più bassa o più calda, la formazione massima di conidi avverrà in 32 ore.
Il modello per la formazione di ascospore utilizza anche la temperatura e l'umidità relativa. La formazione delle ascospore avviene se l'umidità relativa è pari o superiore a 70%. Anche in questo caso la temperatura ottimale è compresa tra 27 °C e 30 °C. A questa temperatura, il massimo delle ascospore si raggiunge dopo 48 ore. A temperature inferiori, occorrono 2 giorni per formare la quantità massima di ascospore.
Lo scarico delle ascospore avviene durante la pioggia. La maggior parte delle ascospore viene rilasciata all'inizio della pioggia. Pertanto le spore vengono rilasciate all'inizio dell'infezione. La quantità di ascospore rilasciate è limitata al numero di ascospore formate.
L'infezione avviene durante i periodi di umidità fogliare o di umidità relativa superiore a 90%. In condizioni di temperatura ottimale, l'infezione termina dopo 12 ore di umidità. Se la temperatura non è così elevata, saranno necessarie dalle 15 alle 24 ore.
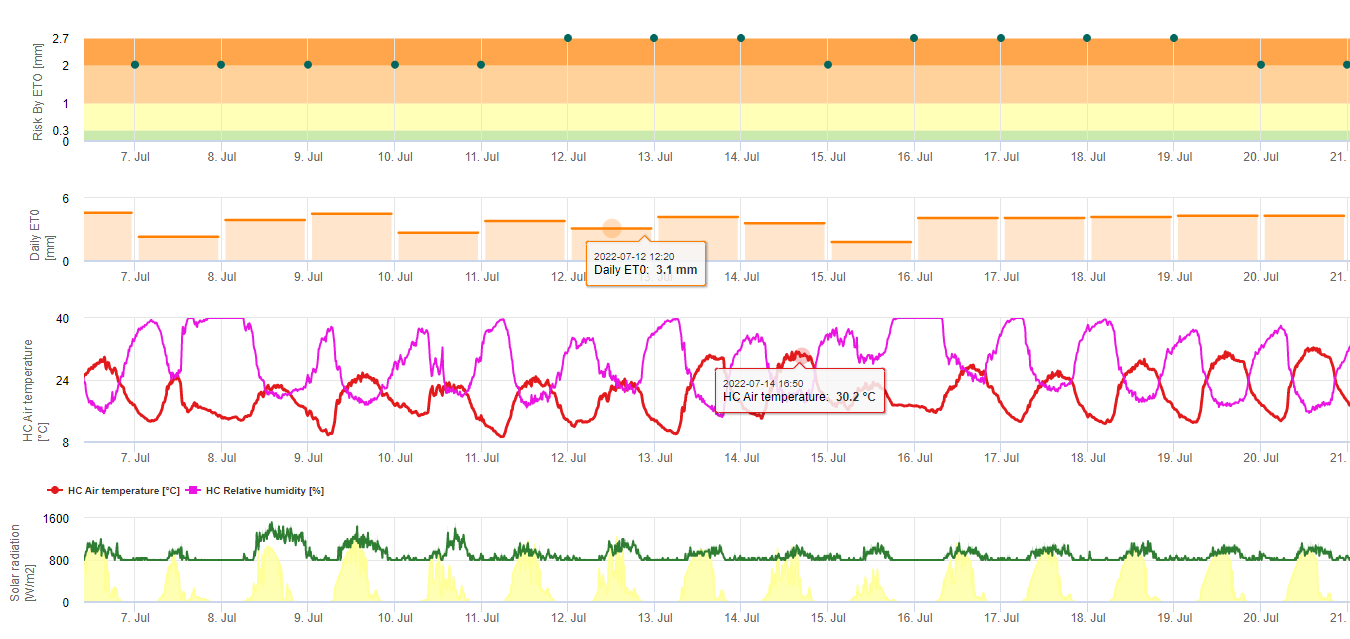
Modello di rischio di Black Sigatoka
Un modello (rischio Sigatoka da parte di ET) si basa su a) La determinazione del rischio di evapotraspirazione (sensori necessari: temperatura, umidità relativa, velocità del vento e radiazione globale). Questo modello si basa sul lavoro di Ganry, J. & Meyer, J.P. (1972): La lutte contrôlée contre le Cercospora aux Antilles. Basi climatiche dell'avversità. Fruits 27(11):767-774. In questo studio è stato utilizzato l'ETpiche per valutare il favore climatico nei confronti della sigatoka. Field.Climate utilizza l'equazione "Penman Montheith" (la più generale e diffusa per il calcolo dell'ET di riferimento) al posto dell'ETpiche. Se l'evapotraspirazione accumulata negli ultimi 7 giorni è:
> 40 mm Nessun rischio
> 30 mm Basso rischio
> 22 mm Rischio medio
< 22 mm Alto rischio
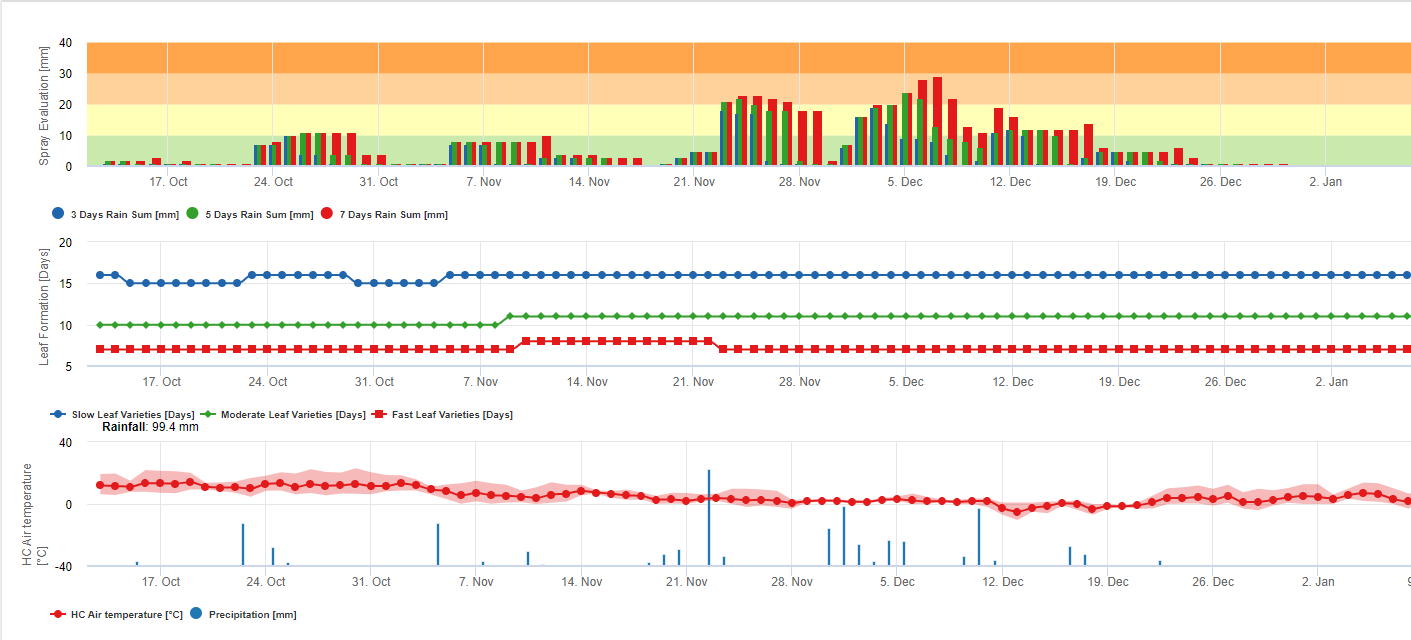
Informazioni per la valutazione dello spray Black Sigatoka
Accumulo di pioggia per la valutazione dei residui su FieldClimate:
Se la pioggia è >= 3 mm, viene contata e accumulata:
- 3 giorni
- 5 giorni
- 7 giorni
Il cumulo di pioggia risulta in un grafico in riferimento a una soglia di 10, 20 e 30 mm.
Formazione di foglie per la valutazione dei residui su FieldClimate:
Se le temperature dell'aria diurna e notturna sono:
12-14°C e 12-13°C occorrono 23, 16 o 21 giorni 15-17°C e 14-15°C occorrono 20, 14 o 10 giorni 18-20°C e 16-22°C occorrono <15, <12 o <8 giorni 21-27°C e 16-22°C occorrono <13, <11 o <6 giorni 28-30°C e 23-24°C occorrono <14, <12 o <8 giorni 31-40°C e 25-40°C occorrono 20, 14 o 10 giorni per la formazione di tutte le foglie nelle varietà con formazione fogliare media, rapida e molto rapida.
Queste informazioni dovrebbero aiutare a valutare i tessuti non protetti. I motivi potrebbero essere un'elevata quantità di pioggia dall'ultima applicazione di misure fitosanitarie (i residui sono già stati lavati via o si sono formate nuove foglie).
Attrezzatura consigliata
Verificare quale set di sensori è necessario per monitorare le potenziali malattie di questa coltura.