Cânhamo e linum modelos de doenças
Apodrecimento da Esclerotínia
A podridão da esclerotina afecta uma vasta gama de plantas, particularmente espécies não lenhosas. A podridão esclerotínica é causada por S. sclerotinia sclerotiorum. A podridão de Sclerotinia pode afectar as plantas em qualquer fase da produção, incluindo as plântulas, plantas maduras e produtos colhidos. As plantas com tecido senescente ou morto são particularmente susceptíveis à infecção.
Sintomas
A área infectada de uma planta adquire inicialmente um aspecto verde escuro ou castanho-água, podendo depois tornar-se mais pálida na cor. O micélio branco denso de algodão geralmente desenvolve-se e a planta começa a murchar e eventualmente morre. As estruturas de repouso ou sobrevivência (esclerócio) são produzidas externamente em partes afectadas da planta e internamente em cavidades de medula do caule. Os esclerócios são duros, negros, de forma irregular, na sua maioria de 2-4 mm de tamanho, e difíceis de ver uma vez incorporados no solo.
Fontes de doenças e propagação
O ciclo de vida de S. sclerotiorum inclui tanto uma fase de solo como uma fase de ar. Esclerócio de S. sclerotiorum pode sobreviver no solo durante dez anos ou mais. Germinam para produzir pequenos corpos de frutificação em forma de funil (apotecia) que têm aproximadamente 1 cm de diâmetro. As apotecias produzem esporos transportados pelo ar, que podem causar infecção quando aterram numa planta hospedeira susceptível, quer através de flores, quer por germinação directa nas folhas. Ocasionalmente, a infecção das bases do caule pode ocorrer quando os filamentos fúngicos (micélio) se desenvolvem directamente a partir de Esclerócio perto da superfície. Desenvolvem-se novos esclerócios em tecido vegetal infectado e quando a planta morre permanecem na superfície do solo ou podem ser incorporados durante o cultivo subsequente do solo.
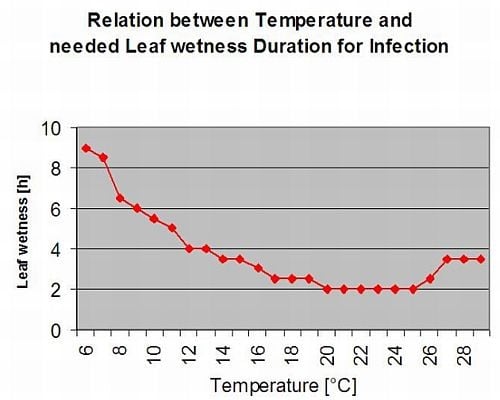
Condições de Infecção
Após um período de frio no Inverno, os esclerócios, invernando nos 5 cm superiores do solo, germinam a partir da Primavera para produzir apotecia, quando a temperatura do solo é de 10°C ou superior e o solo é húmido. Os esclerócios não germinam em solo seco ou quando a temperatura do solo é superior a 25°C. Os esclerócios enterrados abaixo de 5 cm no solo têm menos probabilidades de germinar. Uma vez que as apotecias estejam completamente formadas, a libertação de esporos pode ocorrer no claro ou no escuro, mas depende da temperaturapor isso tende a atingir o auge por volta do meio-dia. A Apothecia pode durar cerca de 20 dias a 15 a 20°C, mas murcha após menos de 10 dias a 25°C. Para ervas floríferas, esporos que aterram em pétalas e estames germinam rapidamente (germinação em 3-6 horas e infecção em 24 horas) em condições óptimas de 15-25°C, contínuo humidade das folhas e elevada humidade dentro da cultura. A infecção subsequente de folhas e caules depende da queda e colagem de pétalas nas folhas. O risco de infecção aumenta se as folhas estiverem molhadas, porque isto provoca a colagem de mais pétalas. As pétalas infectadas mortas ou senescentes fornecem nutrientes para a invasão do fungo nas folhas e caules. Para ervas não floríferas, a infecção é principalmente por esporos transportados pelo ar que aterram directamente nas folhas. Os esporos podem sobreviver nas folhas durante várias semanas até que ocorram condições favoráveis à infecção das folhas. A germinação e infecção por esporos dependem da presença de nutrientes nas folhas, quer de feridas vegetais, quer de material vegetal senescente. Quanto às ervas floríferas, as condições óptimas de germinação e infecção por esporos são de 15-25°C com humidade contínua das folhas e elevada humidade. Uma vez ocorrida a infecção das plantas, o progresso rápido da doença é favorecido por condições quentes (15-20°C) e húmidas em culturas densas.
Modelo de Infecção por Esclerotinia
Infecção de plantas por S. sclerotiorum
A germinação carpogénica de esclerócio é estimulada por períodos de humidade contínua do solo. Formam-se apotecias na superfície do solo a partir das quais os ascósporos são libertados para o ar. A infecção da maioria das espécies de culturas está principalmente associada aos ascósporos, mas a infecção directa de tecido vegetal intacto e saudável de ascósporos germinativos geralmente não ocorre. Em vez disso, a infecção de tecido foliar e de caule de plantas saudáveis resulta apenas quando os ascósporos em germinação colonizam tecidos mortos ou senescentes, geralmente partes florais como pétalas abscisas, antes da formação de estruturas infecciosas e da penetração. A germinação miceliogénica de esclerócios na superfície do solo também pode resultar na colonização de matéria orgânica morta com subsequente infecção de plantas vivas adjacentes. No entanto, em algumas culturas, por exemplo A germinação miceliogénica do micélio do girassol pode iniciar directamente o processo de infecção das raízes e do caule basal resultando em murchidão. O estímulo para a germinação miceliogénica e infecção no girassol não é conhecido mas depende provavelmente de sinais nutricionais na rizosfera derivados de plantas hospedeiras.
O processo de infecção
A infecção de tecidos saudáveis depende do formação de um appressoriumque podem ser simples ou complexos em estrutura, dependendo da superfície do hospedeiro. Na maioria dos casos, a penetração é directamente através da cutícula e não através de estômagos. As appressorias desenvolvem-se a partir de ramificações dicotómicas terminais de hifas que crescem na superfície do hospedeiro e consistem numa almofada de hifas largas, multi-septiciais e curtas que são orientadas perpendicularmente à superfície do hospedeiro à qual estão ligadas por mucilagem. As appressorias complexas são frequentemente referidas como almofadas de infecção. Embora os trabalhadores anteriores considerassem a penetração da cutícula como sendo um processo puramente mecânico, há fortes provas de estudos ultra-estruturais de que a digestão enzimática da cutícula também desempenha um papel no processo de penetração. Pouco se sabe sobre S. sclerotiorum cutinases, no entanto, o genoma codifica pelo menos quatro enzimas cutinase-like (Hegedus inédito). Uma grande vesícula, formada na ponta do appressorium antes da penetração, parece ser libertada para a cutícula hospedeira durante a penetração. Após a penetração da cutícula, forma-se uma vesícula subcuticulosa a partir da qual as grandes hifas saem em leque e dissolvem a parede subcuticulosa da epiderme.
Infecção por degradação enzimática das células epidémicas: O ácido oxálico actua em preocupação com enzimas degradantes da parede celular, como a poligalacturonase (PG), para provocar a destruição do tecido hospedeiro, criando um ambiente propício ao ataque de PG à pectina na lamela do meio. Isto, por sua vez, liberta derivados de baixo peso molecular que induzem a expressão de genes adicionais de PG. De facto, a actividade global do PG é induzida pela pectina ou monossacarídeos derivados da pectina, como o ácido galacturónico, e é reprimida pela presença de glucose. O exame dos padrões de expressão dos genes Sspg individuais revelou que a interacção entre os PG e com o hospedeiro durante as várias fases da infecção é finamente coordenada. (Dwayne D. Hegedus *, S. Roger Rimmer: Sclerotinia sclerotiorum: Quando "ser ou não ser" um agente patogénico? FEMS Microbiology Letters 251 (2005) 177-184)
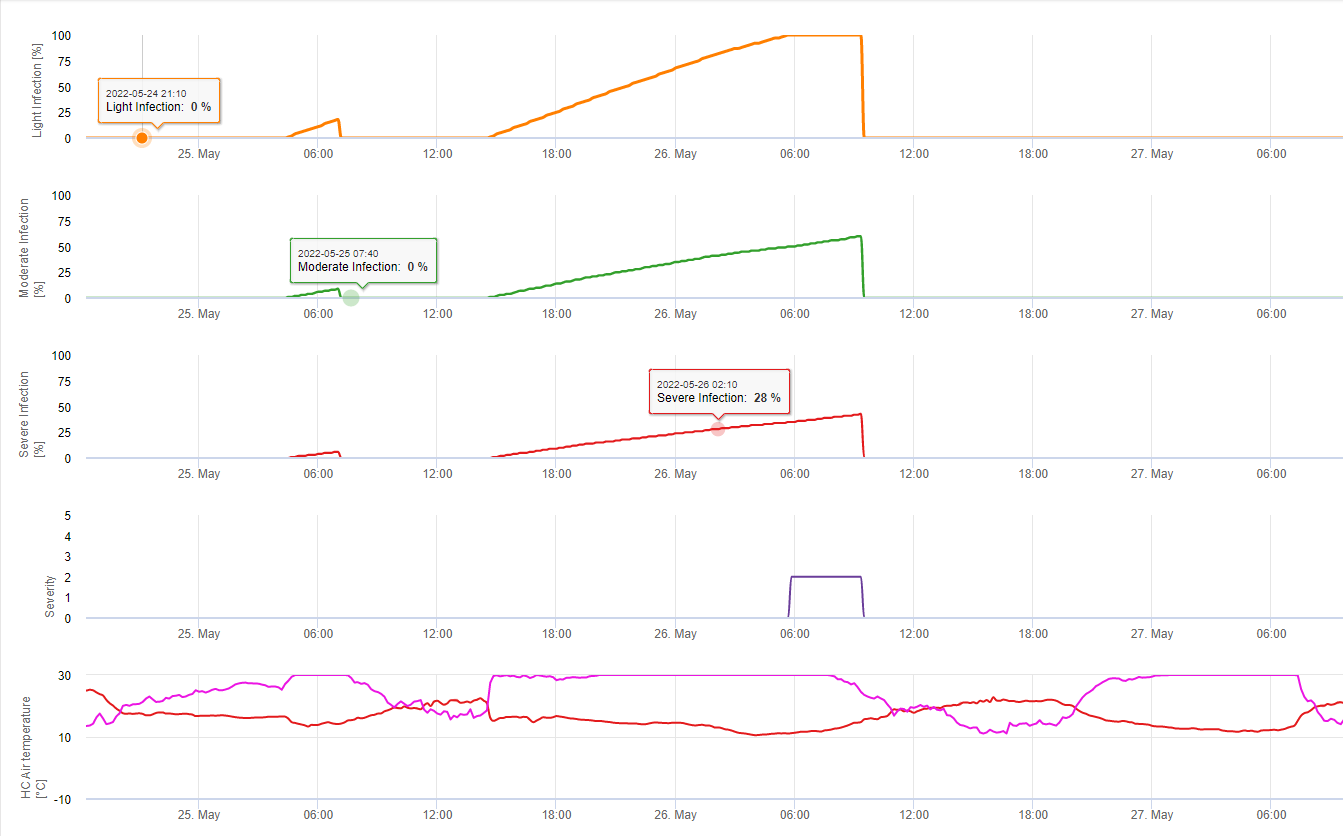
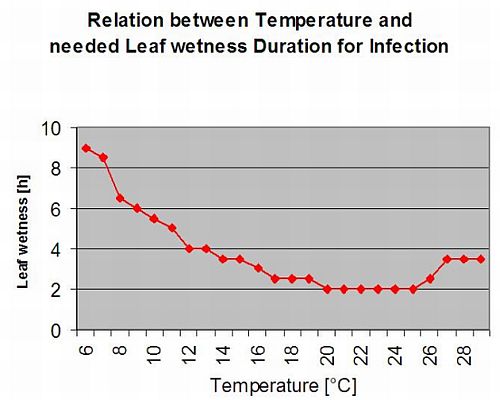
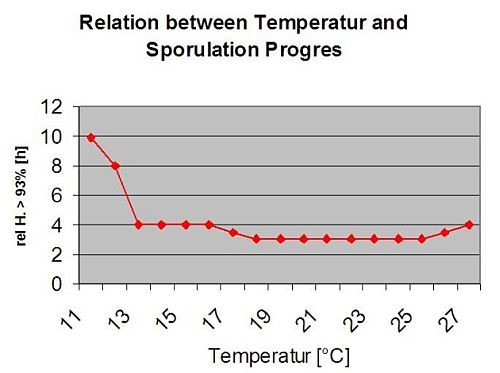
A procura de condições climáticas para a infecção por S. sclerotiorum tem de ter em consideração a formação da apotecia, a esporulação, a infecção directa por apotecia (mesmo que não seja muito frequente) e a infecção por micelia estabelecida por degradação encímica das células epidémicas.
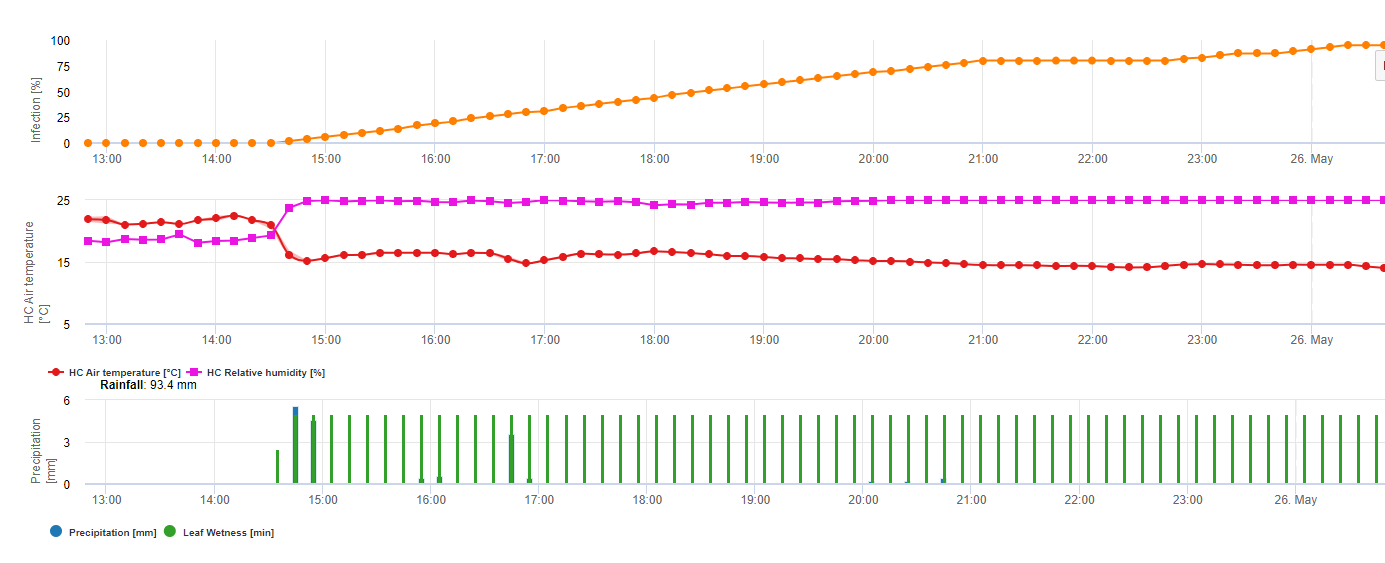
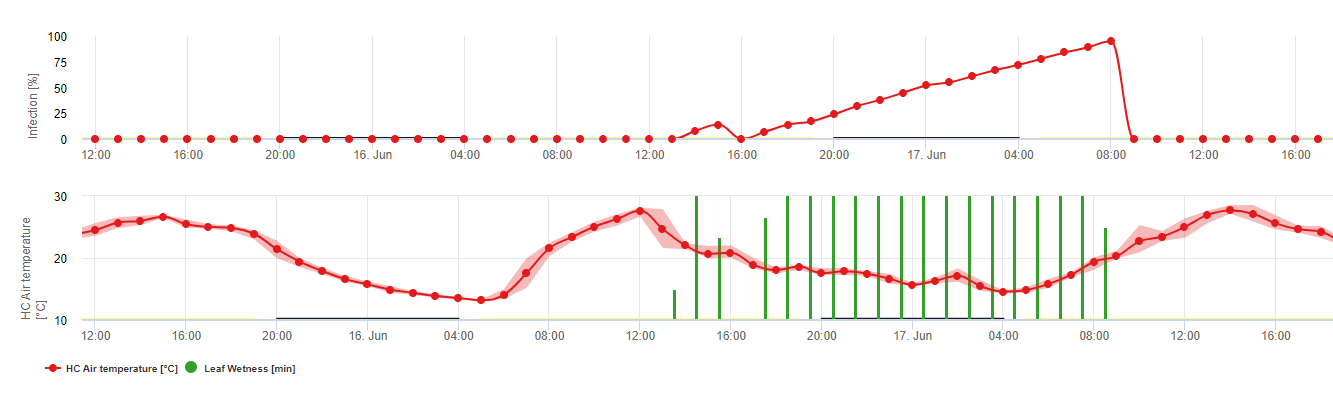
Formação e esporulação de apotecia ocorre se um chuva de mais de 8 mm é seguido por um período de alta humidade relativa com duração superior a 20 horas à temperatura óptima de 21°C a 26°C.
Infecção directa por Apothecia pode ser esperado após um período de humidade das folhas seguido de 16 horas de relativa humildade superior a 90% sob óptimo 21°C a 26°C ("infecção de appressoria"). Onde se pode esperar um crescimento saprófito seguido de uma degradação encímica das células epidérmicas ("infecção hidrolítica") sob uma humidificação relativa ligeiramente inferior de 80% com duração de 24 horas sob condições óptimas de 21°C a 26°C.
Literatura:
- Lumsden, R.D. (1976) Enzimas pectolíticas de Sclerotinia sclerotiorum e a sua localização em feijão infectado. Pode. J. Bot. 54,2630–2641.
Tariq, V.N. e Jeffries, P. (1984) Appressorium formation by Sclerotinia sclerotiorum: scanning electron microscopy. Trans. Brit. Mycol. Soc. 82, 645-651. - Boyle, C. (1921) Estudos sobre a fisiologia do parasitismo. VI. Infecção por Sclerotinia libertiana. Ann. Bot. 35, 337–347.
Abawi, G.S., Polach, F.J. e Molin, W.T. (1975) Infecção de feijão por ascósporos de Whetzelinia sclerotiorum. Fitopatologia 65, 673-678. - Tariq, V.N. e Jeffries, P. (1986) Ultrastrutura de penetração de Phaseolus spp. por Sclerotinia sclerotiorum. Can. J. Bot. 64, 2909– 2915.
- Marciano, P., Di Lenna, P. e Magro, P. (1983) Ácido oxálico, enzimas degradantes da parede celular e pH na patogénese e o seu significado na virulência de dois isolados de Sclerotinia sclerotiorum no girassol. Fisiol. Plant Pathol. 22, 339–345.
- Fraissinet-Tachet, L. e Fevre, M. (1996) Regulation by galacturonic acid of ppectinolytic enzyme production by Sclerotinia sclerotiorum. Moeda. Microbiol. 33, 49–53.
Utilização prática do modelo Sclerotinia
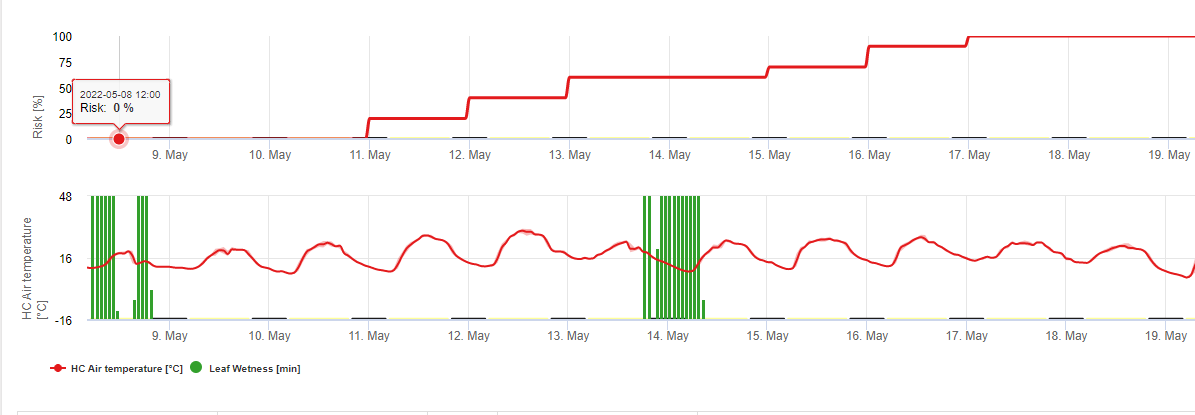
O Modelo de Infecção da Perna Branca mostra os períodos em que o formação de boticário são esperados. Se estes períodos são coinitentes com o período de floração da semente de colza ou canola, temos de esperar S. sclerotiorum infecções durante um período húmido. Os esporos formados na apotecia podem estar disponíveis durante um a vários dias. A oportunidade das infecções é indicada pelo cálculo do progresso da infecção por infecções directas ou indirectas por appressoria ou por degradação da parede celular encímica. Se a linha de progressão da infecção atingir 100%, é necessário assumir uma infecção. Estas infecções devem ser cobertas preventivas ou fungicidas com uma acção curativa contra S. sclerotiorum tem de ser utilizado.
Bolor cinzento
Biologia do Molde Cinzento
Molde Cinzento (Botrytis cinerea) é uma doença devastadora com elevado impacto económico na produção. B. cinerea infecta as flores e os frutos perto da maturidade.
O patogéneo fúngico tem uma gama de hospedeiros muito ampla, infectando mais de 200 hospedeiros diferentes. O crescimento fúngico existe de forma saprófita e parasitária.
Sintomas
Nos girassóis, o patogénico causa um bolor cinzento na cabeça e no caule. Enquanto isso, as folhas começam a secar. Estes sintomas ocorrem durante o amadurecimento dos grãos na cabeça. Observam-se manchas castanhas na parte de trás. Estas manchas são cobertas pelo micélio fúngico e esporos, dando a aparência de um pó. Os esporos podem ser espalhados durante condições de tempo húmido.
Os esclerócios negros privados de medula aparecem nos detritos da cultura após a colheita ou directamente sobre as plantas, se forem colhidos demasiado tarde.
O fungo sobrepõe-se durante o Inverno na superfície do solo ou no solo como micélio ou esclerócio. Na Primavera, a forma de sobre-internação começa a germinar e a produzir conídios. Estas conidias são espalhadas pelo vento e pela chuva e infectam novos tecidos vegetais.
A germinação é possível com humidade relativa superior a 85%. A temperatura de germinação óptima é de 18°C. O agente patogénico fúngico pode reproduzir-se vezes sem conta.
Opções de controlo: O controlo de sementes pode proteger as plantas da humidificação. O controlo químico é difícil devido à resistência do agente patogénico. Por conseguinte, são feitas tentativas de estratégias naturais de controlo com Trichoderma harzianum.
Condições para a infecção por modelagem
B. cinerea as infecções estão relacionadas com humidade livre. Portanto, na produção em campo aberto humidade das folhasque é um bom indicador, é determinado.
Bulger et al. (1987) estudaram a correlação entre os períodos de humidade das folhas durante a floração e a ocorrência de bolor cinzento nos frutos. Descobriram que para um maiores riscos de infecção a 20°C é necessário um período de tempo superior a 32 horas de molhamento das folhas. A temperaturas mais baixas, os períodos de humidade das folhas têm de ser mais longos para a infecção da doença.
FieldClimate indica o risco de Botrytis cinerea na base de os períodos de humidade das folhas e a temperatura durante estes períodos.
O gráfico abaixo mostra a duração das folhas molhadas em dependência da temperatura real necessária para um Botrytis infecção. Se o risco for superior a 0 cada período de molhamento das folhas superior a 4 horas aumentará o risco pela mesma relação.
Assume-se que um dia com um período de humidade das folhas inferior a 4 horas é um dia seco e reduzirá o risco até 20% do valor real.
Utilização prática do Modelo do Molde Cinzento: O modelo indica períodos com um risco de Botrytis infecção. Este período de risco durante a floração do morango levará a frutos infectados. Quanto maior for a duração do período de risco e quanto maior for o risco maior será a probabilidade e o número de frutos infectados. O risco, que pode ser tomado em consideração, depende do mercado. Os produtores, que estão a vender os seus frutos ao supermercado, não correrão qualquer risco, sabendo que não são capazes de vender frutos infectados. Enquanto os cultivadores, que vendem os seus frutos directamente às pessoas, são capazes de assumir um risco mais elevado.
Literatura:
- Bulger M.A., Ellis M. A., Madden L. V. (1987): Influence of temperature and wetness duration on infection of strawberry flowers by Botrytis cinerea and disease incidence of fruit originating from infected flowers. Ecologia e Epidemiologia; Vol 77 (8): 1225-1230.
- Sosa-Alvarez M., Madden L.V., Ellis M.A. (1995): Efeitos da temperatura e da duração da humidade na esporulação de Botrytis cinerea nos resíduos de folhas de morango. Doença das plantas 79, 609-615.
Arroz castanho
O míldio da Batata e do Tomate
Randall C. Rowe, Sally A. Miller, Richard M. Riedel, Ohio State University Extension Service
O míldio é uma doença muito comum tanto da batata como do tomate. Causa manchas foliares e manchas de tubérculo na batata, e manchas foliares, podridão dos frutos e lesões no caule do tomate. A doença pode ocorrer numa vasta gama de condições climáticas e pode ser muito destrutiva se não for controlada, resultando muitas vezes numa desfoliação completa das plantas. Em contraste com o nome, raramente se desenvolve cedo, mas geralmente aparece na folhagem madura.
Sintomas
Nas folhas de ambas as culturas, os primeiros sintomas aparecem geralmente nas folhas mais velhas e consistem em pontos mortos pequenos, irregulares, castanhos escuros a pretos, de tamanho que varia entre um ponto preciso e 1/2 polegada de diâmetro. À medida que as manchas se alargam, podem formar-se anéis concêntricos como resultado de padrões de crescimento irregulares pelo organismo no tecido da folha. Isto dá à lesão um aspecto característico de "ponto alvo" ou "olho de touro". Há frequentemente uma auréola estreita e amarela à volta de cada mancha e as lesões são normalmente delimitadas por veias. Quando as manchas são numerosas, podem crescer juntas, fazendo com que as folhas infectadas fiquem amarelas e morram. Normalmente, as folhas mais antigas tornam-se infectadas primeiro e secam e caem da planta à medida que a doença progride pelo caule principal.
No tomate, as infecções do caule podem ocorrer em qualquer idade, resultando em áreas pequenas, escuras, ligeiramente afundadas, que se alargam para formar pontos circulares ou alongados com centros de cor mais clara. Marcas concêntricas, semelhantes às das folhas, desenvolvem-se frequentemente em lesões do caule. Se forem utilizadas sementes infestadas para iniciar transplantes de tomate, as plântulas podem ficar húmidas logo após a sua emergência. Quando grandes lesões se desenvolvem na linha do solo em caules de transplantes ou plântulas, as plantas podem ficar cingidas, uma condição conhecida como "podridão do colar". Tais plantas podem morrer quando colocadas no campo ou, se os caules estiverem enfraquecidos, podem partir-se no início da estação. Algumas plantas podem sobreviver com sistemas radiculares reduzidos se porções de caules acima do cancro desenvolverem raízes onde entram em contacto com o solo. Tais plantas, contudo, produzem geralmente poucos ou nenhuns frutos. As lesões nos caules são muito menos comuns e destrutivas na batata.
A queda da flor e a mancha de caules de frutos, juntamente com a perda de frutos jovens, podem ocorrer quando a floração precoce ataca os tomates na fase de floração. Nos frutos mais velhos, o míldio provoca manchas escuras e de pele afundada, geralmente no ponto de fixação do caule. Estas manchas podem aumentar para envolver toda a parte superior do fruto, mostrando frequentemente marcas concêntricas como as das folhas. As áreas afectadas podem ser cobertas com massas negras aveludadas de esporos. Os frutos podem também ser infectados na fase verde ou madura através de fissuras de crescimento e outras feridas. Os frutos infectados caem frequentemente antes de atingirem a maturidade.
Nos tubérculos de batata, o míldio da erva resulta em lesões superficiais que parecem um pouco mais escuras do que a pele saudável adjacente. As lesões são geralmente ligeiramente afundadas, circulares ou irregulares, e variam em tamanho até 3/4 polegadas de diâmetro. Existe normalmente uma margem bem definida e por vezes ligeiramente elevada entre tecido saudável e doente. Internamente, o tecido apresenta uma podridão castanha a negra, seca, geralmente não mais de 1/4 a 3/8 polegadas de profundidade. Podem formar-se fissuras profundas em lesões mais antigas. A infecção do tubérculo é invulgar em condições de Ohio.
Pathogen
A praga precoce é causada pelo fungo, Alternaria solani, que sobrevive em folhas ou tecidos de caule infectados no solo ou no solo. Este fungo está universalmente presente nos campos onde estas culturas têm sido cultivadas. Também pode ser transportado em sementes de tomate e em tubérculos de batata. Formam-se esporos em detritos vegetais infestados à superfície do solo ou em lesões activas numa gama de temperaturas bastante ampla, especialmente em condições alternadas de humidade e seca. São facilmente transportados por correntes de ar, solo soprado pelo vento, chuva salpicada, e água de irrigação. A infecção de folhas ou tecidos de caule susceptíveis ocorre em tempo quente e húmido com orvalho ou chuva intensa. O míldio pode desenvolver-se muito rapidamente em meados ou finais da estação e é mais grave quando as plantas são stressadas por má nutrição, seca, ou outras pragas. A infecção dos tubérculos de batata ocorre através de aberturas naturais na pele ou através de lesões. Os tubérculos podem entrar em contacto com esporos durante a colheita e as lesões podem continuar a desenvolver-se no armazenamento.
TOMCAST (Jim Jasinski, Coordenador do TOMCAST para OHIO, INDIANA, & MICHIGAN)
Antecedentes
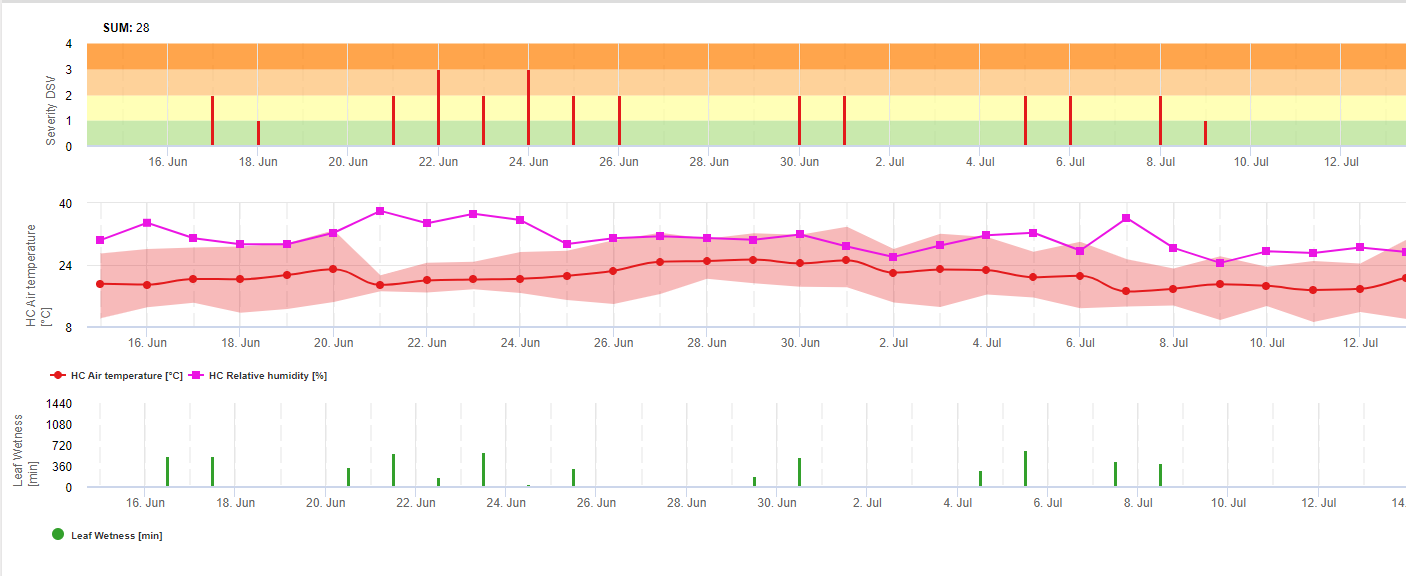
TOMCAST (TOMato disease foreCASTing) é um modelo informático baseado em dados de campo que tenta prever o desenvolvimento de doenças fúngicas, nomeadamente o Early Blight, Septoria Leaf Spot e Anthracnose no tomate. Os registadores de dados colocados no campo estão a registar dados horários de humidade das folhas e temperatura. Estes dados foram analisados durante um período de 24 horas e podem resultar na formação de um valor de severidade da doença (DSV); essencialmente um incremento do desenvolvimento da doença. À medida que o DSV se acumula, a pressão da doença continua a aumentar sobre a cultura. Quando o número de DSV acumulado excede o intervalo de pulverização, recomenda-se uma aplicação de fungicida para aliviar a pressão da doença.
TOMCAST
Aplicações de fungicidas de cronometragem para o flagelo precoce, Septoria leaf spot, e Anthracnose
Um sistema de previsão de doenças baseado no tempo chamado TOMCAST, desenvolvido pelo Dr. Ron Pitblado no Ridgetown College of Agricultural Technology em Ontário, Canadá, pode ser usado para cronometrar aplicações fungicidas para três doenças fúngicas: a ferrugem precoce (causada por Alternaria solani), a mancha foliar Septoria (causada por Septoria lycopersici), e a antracnose da fruta (causada por Colletotrichum coccodes). Se o late blight estiver presente no seu condado ou condados adjacentes, ou se estiverem presentes condições para o movimento de esporos na sua área, utilize o sistema de previsão do Simcast late blight para cronometrar as aplicações fungicidas.
NOTA CAUTELAR IMPORTANTE:
O TOMCAST não é útil em quintas que têm um historial de doenças bacterianas. Se normalmente tem problemas com manchas bacterianas, manchas, ou cancro nos seus tomates, não deve usar TOMCAST porque os intervalos de pulverização recomendados não serão suficientes para o controlo de doenças bacterianas se estiver a misturar o cobre com as suas aplicações fungicidas. Encontre aqui informações sobre como reduzir as doenças bacterianas: http://extension.psu.edu/plants/vegetable-fruit/news/2015/farming-like-you-expect-bacterial-diseases
TOMCAST utiliza dados de humidade e temperatura das folhas para calcular os valores de gravidade da doença (DSV's), como se mostra no Quadro 1.
TOMCAST é derivado do modelo original F.A.S.T. (Forecasting Alternaria solani on Tomatoes) desenvolvido por Drs. Madden, Pennypacker, e MacNab ? na Universidade Estadual da Pensilvânia (PSU). O modelo PSU F.A.S.T. foi ainda modificado pelo Dr. Pitblado no Ridgetown College em Ontário, no que agora reconhecemos como o modelo TOMCAST utilizado pela Ohio State University Extension.
DSV são A Disease Severity Value (DSV) é a unidade de medida dada a um incremento específico do desenvolvimento da doença (Early Blight). Por outras palavras, um DSV é uma representação numérica do quão rápido ou lento a doença (Early Blight) se está a acumular num campo de tomate. O DSV é determinado por dois factores; humidade das folhas e temperatura durante as horas "leaf wet". À medida que o número de horas de "folha molhada" e a temperatura aumentam, o DSV acumula a um ritmo mais rápido. Ver a tabela de valores de severidade da doença abaixo.
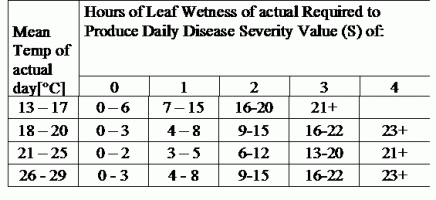
Inversamente, quando há menos horas húmidas de folhas e a temperatura é mais baixa, o DSV acumula-se lentamente, se é que se acumula. Quando o número total de DSV acumulados excede um limite predefinido, chamado intervalo ou limiar de pulverização, recomenda-se um spray fungicida para proteger a folhagem e a fruta do desenvolvimento de doenças.

O intervalo de pulverização (que determina quando se deve pulverizar) pode variar entre 15-20 DSV. O DSV exacto que um produtor deve utilizar é normalmente fornecido pelo processador e depende da qualidade da fruta e da utilização final dos tomates. Seguindo um intervalo de 15 DSV spray é uma utilização conservadora do sistema TOMCAST, o que significa que pulverizará mais frequentemente do que um cultivador que utiliza um intervalo de 19 DSV spray com o sistema TOMCAST. A troca está no número de pulverizações aplicadas durante a estação e no potencial de diferença na qualidade da fruta.
UTILIZAÇÃO DO TOMCAST
Os tomates cultivados num raio de 10 milhas de uma estação de notificação devem beneficiar da função de gestão de doenças do TOMCAST para ajudar a prever o flagelo precoce, Septoria, e Antracnose. Se decidir experimentar TOMCAST nesta estação, por favor tenha em mente três conceitos muito importantes.
Um: Se esta é a primeira vez que utiliza o sistema, recomenda-se que apenas parte da sua área seja colocada no programa para ver como se ajusta aos seus padrões de qualidade e estilo operacional.
Dois: Use TOMCAST como guia para ajudar a melhorar as aplicações fungicidas de tempo, percebendo que em algumas estações pode realmente aplicar mais produto do que um programa de horário definido pode exigir.
Três: Quanto mais um campo de tomate provém de um local de notificação aumenta a probabilidade de distorção na acumulação de DSV, ou seja, o valor notificado pode ser alguns DSV mais alto ou mais baixo do que o verificado pela localização do campo. Isto deve ser tomado em consideração quando a aplicação de fungicidas está provavelmente a alguns dias de distância. Ouça os relatórios DSV das estações próximas e triangule para o seu próprio local como a melhor forma de estimar aproximadamente a sua acumulação de DSV.
PRIMEIRA PULVERIZAÇÃO USANDO TOMCAST
Tem havido alguma discussão ao longo dos anos sobre a aplicação do primeiro spray quando se seguiu o TOMCAST. A regra estabelecida no Guia de Produção Vegetal de 1997 centra-se em torno da data de plantio.
As plantas de tomateiro que entram no campo antes de 20 de Maio devem ter o primeiro spray aplicado quando o DSV para essa área exceder 25 ou quando chegar uma data segura de falha de 15 de Junho. O cofre de segurança só é utilizado se não tiver sido tratado desde 20 de Maio, e é um meio de eliminar o inóculo inicial da doença. Após a primeira pulverização, estes tomates são subsequentemente tratados quando o intervalo de pulverização escolhido (intervalo 15-20 DSV) é excedido.
Os tomates plantados após 20 de Maio são tratados quando excedem o intervalo de pulverização escolhido (intervalo 15-20 DSV) ou quando não foram tratados até à data de segurança de 15 de Junho. Por conseguinte, é fundamental comparar a data de plantação do tomate com a data de início do relatório DSV nessa área para orientar o processo de decisão de pulverização.
Doença da perna negra
Ciclo da doença
A doença tem quatro fases principais sobre a violação das sementes oleaginosas de Inverno:
1. As fontes de infecção mais importantes para as plantas recém-emergidas são os esporos transportados pelo ar produzidos em restolho de colza após a colheita. Os corpos frutíferos que produzem esporos transportados pelo ar precisam de cerca de 20 dias com chuva para amadurecerem, por exemplo, os esporos foram libertados cedo após a chuva de Agosto em 2005 e em 2006, mas no final de 2003 quando esse mês estava seco.
2. Os esporos transportados pelo ar, libertados principalmente em dias de chuva, infectam as folhas para produzir a fase de mancha foliar. Os sintomas aparecem após 5-7 dias a 15-20°C, mas demoram mais de 30 dias a desenvolver-se a 3°C.
3. Não são visíveis sintomas enquanto o fungo cresce desde a mancha da folha, descendo o pecíolo, até ao caule. A taxa de crescimento para baixo do pecíolo pode ser de até 5mm/dia a 15-20°C, mas diminui para 1mm/dia a 3-5°C. Os fungicidas não dão nenhum controlo uma vez que o caule tenha sido infectado.
4. O fungo espalha-se dentro do caule, levando a sintomas visíveis de cancro do caule cerca de seis meses após a infecção da folha. A mancha precoce das folhas leva a cancro precoce do caule, o que tem maior probabilidade de reduzir o potencial de rendimento.
Compreender a variação
Clima: As chuvas de Agosto e Setembro são o factor chave que determina o início da mancha foliar. Uma precipitação acima da média, particularmente em Agosto, indica um risco precoce.
Biologia
Leptosphaeria maculans ou Phoma lingam sobrevive ao período entre colheitas como micélio e pseudotecia nos resíduos das colheitas. No Canadá, o tecido foliar não persiste tempo suficiente para permitir o desenvolvimento de pseudotecia, mas a pseudotecia forma-se no tecido basal do caule. Após a maturidade, a pseudotecia produz ascósporos.
Os ascósporos do fungo são libertados após chuva, quando as temperaturas estão entre 8-12ºC/46-54ºF. Estes esporos podem ser dispersos pelo vento durante centenas de metros (jardas). As picnídeas podem e fazem o Inverno facilmente em restolho, mas como os picnídeos não são transportados pelo ar de forma significativa, são de menor importância para iniciar o primeiro ciclo de doença.
Os ascósporos germinam na presença de água livre de 4-28ºC (40-82ºF). Penetração é através dos estômagos. O agente patogénico também pode ser transmitido através de sementes. As sementes podem ser infectadas e/ou infestadas pelo agente patogénico. As sementes infectadas podem dar origem a plântulas infectadas, mas os níveis de contaminação das sementes são sempre muito baixos. As infecções primárias ocorrem geralmente nos cotilédones ou nas folhas de roseta basal da planta. O tempo húmido favorece estas infecções primárias.
O fungo invade os espaços intercelulares entre a paliçada e as camadas epidérmicas da folha. Esta fase biotrófica sem sintomas é seguida pela invasão da mesofila com a consequente morte de células e o aparecimento de lesões cinzento-esverdeadas. As hifas continuam a ramificar-se através do tecido da folha até atingirem uma veia foliar. O fungo coloniza então o córtex e/ou o parênquima xilema do pecíolo. Na junção do pecíolo e do caule, o fungo invade o córtex do caule onde provoca um cancro. É neste ponto que a resistência do caule é expressa e determina a capacidade da doença de prosseguir para a fase prejudicial do cancro do caule. Os cancros do caule formam-se quando as plantas se aparafusam (produzem um caule erecto a partir da roseta em que se formam as flores). Os cancros do caule desenvolvem-se mais rapidamente a 20-24ºC/68-75ºF e são mais severos sob condições de stress, tais como lesões mecânicas, por insectos ou herbicidas.
Os picnidiosporos (conidia) são libertados da picnídea em condições húmidas numa mucilagem, uma solução aquosa e pegajosa. Estes esporos são responsáveis por ciclos secundários da doença, mas os ascósporos são a fonte mais importante de inóculo porque são mais infecciosos e são transportados pelo ar.
Os pynidiospores são dispersos para novos locais de infecção por manchas de chuva. Os picnidiosporos germinam mais lentamente do que os ascósporos e requerem mais de 16 horas de humidade contínua na gama de temperaturas óptimas de 20-25ºC/68-77ºF. O período mínimo de latência (o tempo desde a infecção até à produção de novo inóculo) após a infecção por picnidiosporos é de 13 dias. Embora ocorram infecções secundárias por picnidiosporos, a maioria das perdas são devidas a infecções primárias de folhas por ascósporos que levam a cancro basal do caule e ao eventual alojamento das plantas.
Modelo para Primeira Infecção Possível no Outono
O desenvolvimento de uma epidemia de cancro do tronco de foma é separado em três fases.
1) No primeira faseA data de início das epidemias de manchas de folhas de phoma no Outono foi prevista a partir dos dados meteorológicos do Verão. Uma vez que o cancro do caule de phoma é uma doença monocíclica (um ciclo por estação de crescimento), a data no Outono em que a mancha foliar começa a desenvolver-se é um factor crucial que afecta a gravidade das epidemias de cancro do caule de phoma nos caules no Verão seguinte (West et al. 2001). A data em que a mancha foliar phoma começa no Outono é estimada a partir da temperatura e pluviosidade durante o período entre a colheita da cultura anterior e o estabelecimento da nova cultura. Onde aproximadamente 4 mm de chuva farão a ocorrência da Doença da Perna Negra um dia antes e o impacto da temperatura é maior no início do período em meados do Verão do que no Outono.
Se a infecção por ascósporos é possível fazer ao clima do Outono, temos de procurar as necessidades climáticas da infecção por ascósporos.
2) Neste segunda fase podemos procurar por ascósporos maduros. Para amadurecer os ascósporos é necessário, dependendo da temperatura, mais de 288 horas de temperatura do ar entre 5 e 25°C e humidade relativa superior a 85%. Agora precisa de 4 mm ou chuva ou mais para distribuir os ascósporos. Um período de humidade das folhas tem de iniciar uma infecção por ascósporos e se puder ser completado dentro de 8 horas sob temperatura óptima.
Mais tarde, no autum e na conidia primaveril, podem formar-se lesões maduras da doença da perna negra.
3) No terceira fase temos de esperar infecções de conidia, que são iniciadas por um período de molhamento das folhas e que são comletidas por períodos de humidade relativa superior a 85% durante mais de 8 horas à temperatura óptima.
Utilização prática dos modelos Black Leg
O Modelo Black Leg começa com a avaliação se uma infecção Black Leg for possível no final do Verão e início do Outono. Esta parte do modelo pode ser usada como um prognóstico negativo. Foi testado para o clima do Reino Unido para estimar a primeira ocorrência de P. lingam infecções. Este modelo é válido para o clima fresco e húmido. Deve ser usado com alguma cautela em clima continental como a Hungria ou a Áustria. Os modelos para a maturação Ascospore, ascospore realize e ascospore infecção estão a mostrar possíveis infecções ascospore durante o Outono. Estes modelos baseiam-se na biologia do agente patogénico e muito provavelmente mostrarão mais infecções de ascósporos do que se pode encontrar no campo. Isto porque, com base nos dados climáticos, não sabemos nada sobre a densidade de inóculos e os pré-campos dos campos de colza. De qualquer modo, se um ou vários ascósporos forem adequados às fases susceptíveis das plantas após o aparecimento de infecções por P. lingam e infecções secundárias por conidia têm de ser esperadas durante os períodos quentes e húmidos no Outono ou Primavera.
As infecções por conidia são indicadas para os períodos de humidade das folhas necessários para uma infecção por conidia.
Doença de Septoria
Há duas grandes doenças de Septoria no trigo. Estas são a mancha Septoria tritici, incitada pelo fungo Septoria tritici (teleomorfo: Mycophaerella graminicola), e Septoria nodorum mancha, causada pelo fungo Septoria nodorum (teleomorph: Leptosphaeria nodorum). Ambas as doenças causam graves perdas de rendimento relatadas entre 31 e 53 por cento (Eyal, 1981; Babadoost e Herbert, 1984; Polley e Thomas, 1991). A nível mundial, mais de 50 milhões de hectares de trigo, que crescem principalmente nas zonas de grande pluviosidade, são afectados. Durante os últimos 25 anos, estas doenças têm vindo a aumentar e tornaram-se um importante factor limitador da produção de trigo em certas áreas. Sob epidemias graves, os grãos de cultivares de trigo susceptíveis são murchos e não estão aptos para moagem. As epidemias de Septoria tritici blotch e Septoria nodorum blotch de trigo estão associadas a condições climáticas favoráveis (chuvas frequentes e temperaturas moderadas), práticas culturais específicas, disponibilidade de inóculos e presença de cultivares de trigo susceptível (Eyal et al., 1987).
Septoria spp. Biologia
Após Erick De Wolf, Septoria Tritici Blotch, Kansas State University, Abril de 2008 Septoria tritici mancha conhecida como mancha de folha manchada, é causada pelo fungo Septoria tritici. Está distribuído em todas as zonas de cultivo de trigo do mundo e é um problema grave em muitas regiões. A mancha Septoria tritici é mais prejudicial quando a doença ataca as folhas superiores e as cabeças das variedades susceptíveis no final da estação.
Sintomas
Septoria tritici Os sintomas da mancha aparecem pela primeira vez no Outono. Os sintomas iniciais são pequenas manchas amarelas nas folhas. Estas lesões tornam-se frequentemente bronzeadas leves à medida que envelhecem, e os corpos de frutificação fúngica podem ser vistos embutidos nas lesões nos awns. As lesões têm forma irregular e variam de elípticas a longas e estreitas (Figura 1). As lesões contêm pequenas manchas redondas e pretas que são os corpos de frutificação do fungo. Os corpos de frutificação negros parecem grãos de pimenta preta e podem geralmente ser vistos sem a ajuda de uma lupa. A doença começa nas folhas inferiores e progride gradualmente até à folha da bandeira. As bainhas das folhas também são susceptíveis de ataque. Em anos húmidos, o fungo mancha foliar manchado pode deslocar-se para as cabeças e causar lesões castanhas nas glumas e nas mucosas conhecidas como mancha de glume. Estas lesões tornam-se frequentemente bronzeadas leves à medida que envelhecem e os corpos de frutificação fúngica são frequentemente vistos embutidos nas lesões nos awns.
A fase de mancha de calcário pode causar perda significativa de rendimento, mas a relação entre a gravidade da doença e a perda de rendimento não é bem compreendida. Septoria tritici mancha pode ser confundida com outras doenças das folhas que têm sintomas muito semelhantes: mancha de bronzeado e Stagonspora nodorum mancha, por exemplo. É comum que as plantas sejam infectadas por mais do que uma destas doenças foliares, e pode ser necessário um exame laboratorial para diagnosticar com precisão quais as doenças mais prevalecentes. O exame laboratorial é quase sempre necessário para distinguir a causa da mancha de calcário. Conhecer as espécies não é importante para as decisões de pulverização, porque as três doenças respondem de forma semelhante aos fungicidas. No entanto, saber que doenças são mais prevalentes é uma parte importante da selecção de variedades, porque diferentes genes controlam a resistência às doenças.
A forma mais fiável de distinguir a Septoria tritici blotch das outras doenças é através da presença dos corpos de frutificação de fungos negros. O fungo que provoca a mancha de bronzeado não produz este tipo de estrutura reprodutiva. Contudo, em condições húmidas, o fungo que causa a mancha de Stagonospora nodorum produzirá corpos de frutificação castanhos-claros. Para além da diferença de cor, estas estruturas são também menores do que as produzidas pela Septoria tritici.
Ciclo de vida
Septoria tritici sobrevive durante todo o Verão aos resíduos de uma colheita anterior de trigo e inicia infecções no Outono. Há algumas provas de que o fungo é capaz de sobreviver em associação com outros hospedeiros de gramíneas e sementes de trigo. Estas fontes do fungo são provavelmente mais importantes quando os resíduos do trigo estão ausentes. Independentemente da rotação ou das práticas de gestão de resíduos, existe normalmente inóculo suficiente para iniciar infecções na queda. Septoria tritici A mancha é favorecida pelo tempo fresco e húmido. A gama óptima de temperaturas é de 16 a 21 °C; no entanto, podem ocorrer infecções durante os meses de Inverno a temperaturas tão baixas como 5 °C. A infecção requer pelo menos 6 horas de humidade das folhas, e até 48 horas de humidade são necessárias para uma infecção máxima. Uma vez ocorrida a infecção, o fungo leva 21 a 28 dias para desenvolver os corpos de frutificação negra característicos e produzir uma nova geração de esporos. Os esporos produzidos nestes corpos de frutificação são exsudados em massas pegajosas e requerem chuva para os espirrar sobre as folhas superiores e cabeças.
Infecção por Septoria tritici
Pycnidiosporos de S. tritici germinar em água livre de ambas as extremidades do esporo ou de células intercalares (Weber, 1922). A germinação dos esporos só começa cerca de 12 horas após o contacto com a folha. Os tubos germinativos crescem aleatoriamente sobre a superfície da folha. Weber (1922) observou apenas a penetração directa entre as células epidérmicas, mas outros concluíram que a penetração através de estomas abertos e fechados é o principal meio de penetração do hospedeiro (Benedict, 1971; Cohen e Eyal, 1993; Hilu e Bever, 1957). Kema et al. (1996) observaram apenas a penetração estomatológica. As hifas que crescem através dos estomas tornam-se apertadas a cerca de 1 μm de diâmetro, tornando-se depois mais largas após atingirem a cavidade substomatal.
As hifas crescem paralelamente à superfície da folha sob as células epidérmicas, depois através da mesofila para as células da epiderme inferior, mas não para a epiderme. Não se formam haustorias e o crescimento hifálico é limitado pelas células esclerênquimas em redor dos feixes vasculares, excepto quando as hifas são muito densas. Os feixes vasculares não são invadidos. As hifas crescem intercelularmente ao longo das paredes celulares através da mesofila, ramificando-se num septo ou no meio de uma célula. Não aparecem sintomas macroscópicos durante cerca de 9 dias, excepto para uma célula ocasionalmente morta, mas as células mesofílicas morrem rapidamente após 11 dias. As picnídeas desenvolvem-se em câmaras substomatais. As hifas raramente crescem em células hospedeiras (Hilu and Bever, 1957; Kema et al, 1996; Weber, 1922).
A infecção bem sucedida só ocorre após pelo menos 20 horas de elevada humidade. Apenas algumas manchas castanhas se desenvolvem se as folhas permanecerem húmidas durante 5-10 horas após a deposição de esporos (Holmes e Colhoun, 1974) ou até 24 horas (Kema et al., 1996). As relações hospedeiro-parasita são as mesmas em trigo resistente ou susceptível. A germinação de esporos na superfície da folha é a mesma, independentemente da susceptibilidade. O número de penetrações bem sucedidas é aproximadamente o mesmo, mas o crescimento hifálico é mais rápido em cultivares susceptíveis, resultando em mais lesões. As hifas estendem-se 44 Sessão 2 - B.M. Cunfer para além da área necrótica em todas as cultivares. Uma toxina pode desempenhar um papel na patogénese (Cohen e Eyal, 1993; Hilu e Bever, 1957). Em contraste, a colonização foi grandemente reduzida numa linha resistente (Kema et al., 1996).
Stagonospora (Septoria) e Septoria Pathogens de Cereais: O Processo de Infecção
B.M. Cunfer, Departamento de Fitopatologia, Universidade da Geórgia, Griffin, GA
O processo de infecção foi estudada mais intensamente para o Stagonospora (Septoria) nodorum e Septoria tritici. Um estudo aprofundado sobre Septoria passerinii está disponível. Quase toda a informação relatada é relativa à infecção por picnidiosporos. No entanto, o processo de infecção por outras formas de esporos é bastante semelhante. A informação apresentada é sobretudo para a infecção de folhas em condições óptimas. Alguns estudos foram feitos com plantas de plântulas intactas, enquanto outros foram conduzidos com folhas descoladas. Infecção do coleóptero de trigo e das plântulas por S. nodorum foi descrito em pormenor por Baker (1971) e revisto por Cunfer (1983). Embora não tenham sido feitas comparações precisas, parece que o processo de infecção tem muitas semelhanças em cada sistema hospedeiro-parasita e é típico de muitos agentes patogénicos necrotróficos. As informações sobre factores que influenciam o desenvolvimento dos sintomas e a expressão da doença estão excluídas, mas foram revistas por outros autores (Eyal et al., 1987; King et al., 1983; Shipton et al., 1971). Inclui-se um resumo dos factores que afectam a longevidade dos esporos na superfície da folha.
Papel do Cirrus e da Sobrevivência dos Esporos sobre a superfície da folha A informação mais detalhada sobre a função dos cirros que revestem os picnidiosporos exsudados do picnídio é para S. nodorum. O cirrus é um gel composto por compostos proteicos e sacarídeos. A sua composição e função são semelhantes às de outros fungos nos Sphaeropsidales (Fournet, 1969; Fournet et al., 1970; Griffiths e Peverett, 1980). Os principais papéis dos componentes dos cirros são a protecção dos picnidiosporos contra a dessecação e a prevenção da germinação prematura.
O cirrus protege os picnídeos para que alguns permaneçam viáveis pelo menos 28 dias (Fournet, 1969). Quando o cirro foi diluído com água, se a concentração da solução de cirro era >20%, menos que 10% de picnidiosporos germinou. Com uma concentração menor, os componentes fornecem nutrientes que estimulam a germinação dos esporos e o alongamento dos tubos germinativos. O comprimento dos tubos de germes aumentou até 15% de concentração de cirrus, depois diminuiu moderadamente em concentrações mais elevadas (Harrower, 1976). Brennan et al. (1986) relataram uma maior germinação em fluido de cirro diluído. Os componentes dos cirros reduziram a germinação a 10-60% de humidade relativa. Uma vez dispersos os esporos, os efeitos estimulantes do fluido dos cirros são provavelmente negligenciáveis (Griffiths e Peverett, 1980).
A 35-45% de humidade relativa, esporos de S. tritici em cirri permaneceu viável pelo menos 60 dias (Gough e Lee, 1985). Os componentes dos cirros podem actuar como inibidores da germinação dos esporos, ou o elevado potencial osmótico dos cirros pode impedir a germinação. Picnidiosporos de S. nodorum não sobreviveu durante 24 horas a uma humidade relativa superior a 80% a 20 C. Os esporos sobreviveram duas semanas ou mais a uma humidade relativa <10% (Griffiths e Peverett, 1980). Quando o fluido de cirrus de S. nodorum foi diluído com água, cerca de dois terços dos picnidiosporos perderam viabilidade em 8 horas, e após 30 horas à luz do dia, apenas 5% germinou. Quando os esporos foram armazenados no escuro, 40% permaneceu viável após 30 horas (Brennan et al., 1986).
Conídios secos de S. nodorum, à sombra e sob a luz solar directa, sobreviveu ao ar livre pelo menos 56 horas (Fernandes e Hendrix, 1986a). A germinação de S. nodorum pycnidiospores foi inibida por UV-B contínuo (280-320 nm), enquanto que a germinação de S. tritici não estava. A extensão do tubo de germes sob UV-B contínuo foi inibida para ambos os fungos, em comparação com a escuridão (Rasanayagam et al., 1995).
Infecção por Septoria nodorum
O processo de penetração do hospedeiro e desenvolvimento de S. nodorum dentro da folha foi examinada em pormenor por vários investigadores (Baker and Smith, 1978, Bird and Ride 1981, Karjalainen and Lounatmaa, 1986; Keon and Hargreaves, 1984; Straley, 1979; Weber, 1922). Os picnidiosporos tendem a alojar-se nas depressões entre duas células epidérmicas, e muitas tentativas de penetração das folhas começam aí. Os esporos germinam na superfície da folha em resposta à humidade livre (Fernandes e Hendrix, 1986b). Começam a germinar 2-3 horas após a deposição, e após 8 horas a germinação pode atingir 90%. A penetração das folhas começa cerca de 10 horas após a deposição dos esporos (Bird and Ride, 1981; Brönnimann et al., 1972; Holmes e Colhoun, 1974).
No início da germinação, o tubo germinal é rodeado por um material amorfo que se prende à folha. Os tubos germinativos que crescem de uma extremidade ou outra de um esporo e de células intercalares tendem a crescer ao longo das depressões entre células e são frequentemente orientados ao longo do longo eixo da folha (O'Reilly e Downes, 1986). As hifas de esporos não presentes nas depressões crescem aleatoriamente com ramificações ocasionais (Straley, 1979). Forma-se um appressorium com uma cavilha de infecção que penetra a cutícula e as paredes periclinais das células epidérmicas directamente no lúmen celular, resultando na morte rápida das células.
Muitas penetrações são primeiro o crescimento subcuticular ou lateral de uma hifa que ocorre dentro da parede celular antes do crescimento no citoplasma (Bird and Ride, 1981; O'Reilly and Downes, 1986). A penetração através de estomas abertos e fechados também ocorre e pode ser mais rápida que a penetração directa (Harrower, 1976; Jenkins, 1978; O'Reilly e Downes, 1986; Straley, 1979). Os tubos germinativos ramificam-se nos estomas e nas junções das células epidérmicas. A penetração de um tubo de germes num estômago pode ocorrer sem formação de um appressorium. A penetração ocorre por vezes através de tricomas (Straley, 1979). Aparentemente, a maioria das tentativas de penetração falham, com papilas densas formadas nas células no local da tentativa de penetração (Karjalainen e Lounatmaa, 1986; Bird and Ride, 1981).
Após a penetração, as células epidérmicas morrem rapidamente e tornam-se lenhificadas, e as hifas crescem para a mesofila. As células mesofílicas tornam-se deformadas, e o material lignificado é depositado fora de algumas células, que depois colapsam. A lenhificação ocorre antes de as hifas alcançarem a célula. O processo é o mesmo em todas as cultivares, mas desenvolve-se mais lentamente em cultivares resistentes. As hifas crescem intercelularmente entre as células epidérmicas, depois para a mesofila. Quando a mesofila é penetrada, a deterioração cloroplástica começa dentro de 6-9 dias (Karjalainen e Lounatmaa, 1986).
No entanto, a taxa fotossintética começa a diminuir dentro de um dia após a infecção e antes dos sintomas serem visíveis (Krupinsky et al, 1973). O tecido esclerênquima em redor dos feixes vasculares previne a infecção do tecido vascular. Os feixes vasculares bloqueiam a propagação de hifas através da mesofila, excepto quando o tecido de esclerênquima é jovem e não está totalmente formado (Baker e Smith, 1978).
O Stagonospora nodorum liberta uma vasta gama de enzimas degradantes da parede celular incluindo amilase, pectina metil esterase, poligalacturonases, xilanases, e celulase in vitro e durante a infecção de folhas de trigo (Baker, 1969; Lehtinen, 1993; Magro, 1984). A informação relacionada com a degradação da parede celular pelas enzimas concorda com as observações histológicas. Estas enzimas podem actuar em conjunto com toxinas. A sensibilidade enzimática pode estar relacionada com a resistência e taxa de colonização fúngica (Magro, 1984). Como muitos necrotrofos, os agentes patogénicos Septoria e Stagonospora produzem compostos fitotóxicos in vitro. A deterioração celular e a morte antes do crescimento hifálico em tecido mesofílico (Bird and Ride, 1981) é consistente com a produção de toxinas. Contudo, não foi estabelecido um papel definitivo para as toxinas no processo de infecção e a sua relação com a resistência do hospedeiro (Bethenod et al, 1982; Bousquet et al, 1980; Essad e Bousquet, 1981; King et al, 1983). As diferenças na gama de hospedeiros entre estirpes de trigo e cevada adaptadas à cevada são de S. nodorum pode estar relacionada com a produção de toxinas (Bousquet e Kollmann, 1998). O início da germinação dos esporos e a percentagem de esporos germinados não são influenciados pela susceptibilidade do hospedeiro (Bird and Ride, 1981; Morgan 1974; Straley, 1979; Straley and Scharen, 1979; Baker and Smith, 1978).
Bird and Ride (1981) relatou que a extensão dos tubos de germes na superfície da folha era mais lenta em cultivares resistentes do que em cultivares susceptíveis. Este mecanismo, expresso pelo menos 48 horas após a deposição de esporos, indica resistência de pré-penetração ao alongamento dos tubos germinativos. Houve menos penetrações bem sucedidas em cultivares resistentes, e a penetração prosseguiu mais lentamente em cultivares resistentes (Baker and Smith, 1978; Bird and Ride, 1981). A lenhificação foi proposta para limitar a infecção tanto em cultivares resistentes como susceptíveis, mas outros factores abrandaram o desenvolvimento fúngico em linhas resistentes. Nas linhas susceptíveis, a Hyphae de crescimento mais rápido pode escapar à lenhificação das células hospedeiras.Quatro dias após a inoculação da cevada com um biótipo de trigo isolado de S. nodorumAs hifas cresceram através da cutícula e por vezes nas camadas externas de celulose das paredes celulares epidérmicas. Papilas espessas foram depositadas sob as hifas de penetração e as células não foram penetradas (Keon e Hargreaves, 1984).
Infecção por Septoria passerinii: Green e Dickson (1957) apresentam uma descrição detalhada do processo de infecção de S. passerinii sobre a cevada. O processo de infecção é semelhante a S. tritici. Tal como S. tritici, o tempo necessário para a penetração das folhas é consideravelmente maior do que para S. nodorum. Os tubos germinativos ramificam-se e crescem sobre a superfície da folha ao acaso, mas por vezes ao longo de depressões entre as células epidérmicas. A penetração das folhas é quase exclusivamente através dos estomas. As hifas da germinação tornam-se inchadas, e se a penetração não for bem sucedida, as hifas continuam a alongar-se. Nenhuma penetração ocorre 48 horas após a deposição de esporos. Após 72 horas, os tubos de germes engrossam sobre os estomas, crescem entre as células de guarda e sobre as superfícies das células acessórias e para as cavidades sub-matais. A penetração directa entre as células epidérmicas só raramente é observada.
A germinação de esporos e a penetração do hospedeiro são as mesmas em cultivares resistentes e susceptíveis. Há muito menos extensão de hifas dentro das folhas em cultivares resistentes e as papilas são observadas em muitas mas não em todas as paredes celulares. As hifas crescem sob a epiderme de um estoma para outro, mas não penetram entre as células epidérmicas. A mesofila é colonizada, mas sem forma de haustoria. Após as células mesofílicas se tornarem necróticas, as células epidérmicas colapsam. O desenvolvimento micelial na folha é esparso e geralmente bloqueado por feixes vasculares. Nas folhas mais jovens, se a bainha vascular estiver menos desenvolvida, as hifas passam entre o feixe e a epiderme. Formam-se picnídeas em cavidades substomatais, principalmente na superfície superior da folha (Green e Dickson, 1957).
Factores que afectam a longevidade dos esporos sobre a superfície das folhas Entre os agentes patogénicos dos cereais Stagonospora e Septoria, só foram comunicadas informações definitivas sobre o processo de infecção para S. nodorum, S. triticie S. passerinii. Como muitos outros agentes patogénicos necrotróficos, nenhum dos grupos de agentes patogénicos suscita a reacção hipersensível. Uma diferença significativa no processo de infecção entre os agentes patogénicos Septoria e Stagonospora é que a germinação e a penetração dos esporos se processa muito mais rapidamente para S. nodorum do que para S. tritici e S. passerinii. Isto tem uma influência significativa na epidemiologia das doenças.
Os agentes patogénicos Septoria penetram na planta principalmente através dos estomas, enquanto S. nodorum penetra tanto directamente como através dos estômagos. S. nodorum penetra e mata as células epidérmicas rapidamente, mas S. tritici e S. passerinii não matar células epidérmicas até que as hifas tenham ramificado através da mesofila da folha e comece a necrose rápida. Os estudos histológicos do crescimento fúngico após a penetração do hospedeiro correspondem aos dados gerados a partir de estudos epidemiológicos de resistência do hospedeiro. A resistência abranda a taxa de colonização do hospedeiro, mas não tem um efeito apreciável no processo de desenvolvimento da lesão.
Os mecanismos de controlo da resposta do hospedeiro, quer relacionados com enzimas e toxinas ou outros metabolitos libertados pelos agentes patogénicos durante a infecção, ainda não estão claros. Há pouca informação sobre a infecção por ascósporos. O processo de infecção é provavelmente muito semelhante ao dos picnidiosporos. Os ascósporos de Phaeosphaeria nodorum germinam numa vasta gama de temperaturas, e os seus tubos germinativos penetram directamente na folha. No entanto, segundo Rapilly et al. (1973), os ascósporos, ao contrário dos picnidiosporos, não germinam em água livre.
Modelo de Infecção Septoria spp.
As infecções de Septoria são possíveis a baixas temperaturas enquanto que temperaturas inferiores a 7°C podem não levar a uma infecção no prazo de 2 dias. A temperatura óptima da doença é atingida na área de 16 a 21°C. As infecções são possíveis dentro de um período de elevada humidade relativa ou humidade foliar de 14 horas ou mais. Para satisfazer as condições, decidimos separar em modelos para infecções fracas, moderadas e graves. As infecções fracas podem ser dadas se for possível que o patogénico infecte o tecido hospedeiro. Isto significa que infecções fracas podem ter lugar se as temperaturas estiverem no mínimo e os períodos de humidade foliar forem de duração crítica. Uma infecção moderada terá lugar em condições em que a maioria dos ensaios de infecção conduza a resultados razoáveis e as infecções graves terão lugar em condições em que o agente patogénico tenha condições óptimas para a infecção.

Começa a infecção depois de uma chuva de 0,5 mm. Decidimos não utilizar um modelo para a formação de picnídeas. A condição necessária para a formação de picnídeas é suposta ser um período com humidade relativa superior a 85%. Espera-se que o tempo de vida das picnídeas seja de 24 horas. Em todos os climas onde a Septoria tritici tem a possibilidade de infectar, encontraremos 2 horas a cumprir esta condição quase todos os dias à volta do nascer do sol.
Avaliação da gravidade da infecção: Para podermos avaliar a pressão da infecção Septoria tritici entre a fase 10 (primeira folha através do coleóptero) e a fase 32 (nó dois pelo menos 2 cm acima do nó 1) e entre 32 e 51 (início do cabeçalho) temos de avaliar a gravidade das infecções com base nas condições climáticas. Esta avaliação é feita numa escala de 1 a 5. É dada uma severidade de 1 se a condição para uma infecção fraca estiver preenchida e tiver chovido menos de 5 mm, caso contrário, o vlaue de severidade correspondente será 2. É dada uma severidade de 3 se uma infecção moderada estiver preenchida e tiver chovido menos de 5 mm. Se tiver chovido mais de 5 mm durante uma infecção moderada ou menos de 5 mm durante uma infecção grave, é dada uma gravidade de 4.
Uma infecção grave com mais de 5 mm de chuva corresponde a um valor de gravidade de 5.
Septoria tritici avaliação da pressão da doença: O clima é apenas um dos factores que descem sobre a pressão da doença no campo. Os outros dois factores são a história do campo e a susceptibilidade da variedade cultivada. Se conseguirmos acumular os valores de gravidade da doença do estádio 10 ao estádio 32 até ao valor de 4, podemos esperar uma fraca pressão da doença pelo clima. Se este valor atingir 6, podemos esperar uma pressão moderada da doença e se atingir 10, podemos esperar uma pressão elevada da doença pelo clima. O conhecimento da susceptibilidade da variedade e da história do campo levar-nos-á a pulverizar ou não sobre uma pressão de doença fraca ou moderada nesta situação. Ter um valor acumulado de 10 pode levar a uma pulverização na fase 32 de qualquer forma. A decisão de uma pulverização numa fase posterior é mais dependente do clima da Primavera. Se formos capazes de acumular os valores de gravidade desde a fase 10 a um valor de 6, podemos esperar uma fraca pressão da doença. Se este valor atingir 10, podemos esperar uma pressão moderada da doença e se este valor atingir 15, podemos esperar uma pressão elevada da doença na situação climática.
No FieldClimate mostramos o Septoria tritici Gravidade juntamente com as três gravidades diferentes de infecção num gráfico (ver acima). Devido a precipitação excessiva e longos períodos de humidade das folhas para uma infecção grave por S. tritici estiveram em pleno campo nos dias 14 e 16 de Maio. Os níveis de severidade atingem o valor mais alto de 5 em 14 de Maio, o que significa que um elevado risco de infecção é agora.
A biologia da infecção por Stagonospora nodorum difere de alguma forma de S. tritici, mas esta diferença não é suficientemente grande para um modelo separado. Por isso sugerimos a utilização deste modelo para todo o complexo de doenças de Stagnospora e Septoria em cereais, incluindo S. passerinii. S. tritici e S. passerinii tendem a precisar de períodos de molhamento das folhas mais longos do que S. nodorum. Em áreas com uma pressão elevada de S. nodorum As infecções classificadas a um fraco dando um valor de gravidade de 2 devem ser tratadas mais seriamente do que noutras áreas.
Para Septoria nodorum um modelo de risco é mostrado no FieldClimate (ver acima). Um risco elevado foi determinado nos dias 17 de Junho e 7 de Julho (100%). Dependendo da fase das plantas susceptíveis de infecção, as medidas de protecção das plantas têm de ser tidas em conta se o risco atingir 80% (ver também previsão do tempo do soro, protecção das plantas). Se o risco fosse 100% e já tivesse sido determinada uma infecção, as medidas sistémicas de protecção das plantas (aplicação curativa) têm de ser tomadas para proteger a planta.
Antracnose
Várias espécies de fungos patogénicos das plantas do género Colletotrichum causar antracnose em pimentos e muitos outros vegetais e frutas. Até finais dos anos 90, a antracnose em pimentos e tomates estava apenas associada a fruta madura ou amadurecida. Desde essa altura, estabeleceu-se uma forma mais agressiva da doença. Esta forma ataca o pimento em qualquer fase do desenvolvimento da fruta e pode ameaçar a rentabilidade das culturas do pimento nas áreas onde se estabelece. Esta doença pode também afectar o tomate, morangos, e possivelmente outras culturas fruteiras e hortícolas.
Sintomas
As lesões circulares ou angulares afundadas desenvolvem-se em frutos imaturos de qualquer tamanho. Muitas vezes formam-se lesões múltiplas em frutos individuais. Quando a doença é grave, as lesões podem coalescer. Muitas vezes, massas de esporos fúngicos rosa a laranja formam-se em anéis concêntricos na superfície das lesões. Em lesões mais antigas, podem observar-se estruturas negras denominadas acervuli. Com uma lente de mão, estas parecem pequenos pontos negros; sob um microscópio, parecem tufos de pequenos pêlos negros. O patogénio forma esporos rápida e profusamente e pode propagar-se rapidamente por uma cultura de pimenta, resultando em perda de rendimento até 100%. As lesões podem também aparecer em caules e folhas como manchas castanhas de forma irregular com bordos castanhos escuros.
Pathogen
Esta forma de antracnose de pimenta é causada pelo fungo Colletotrichum acutatum. O agente patogénico sobrevive em detritos vegetais de culturas infectadas e em outras espécies vegetais susceptíveis. O fungo não é transportado pelo solo durante longos períodos na ausência de detritos vegetais infestados. O fungo também pode ser introduzido numa cultura em sementes infestadas. Durante períodos quentes e húmidos, os esporos são salpicados pela chuva ou pela água da rega de fruta doente a fruta saudável. Os frutos doentes actuam como fonte de inóculo, permitindo que a doença se propague de planta para planta dentro do campo. O fungo sobrevive dentro e sobre as sementes. A antracnose é introduzida no campo em transplantes infectados ou pode sobreviver entre estações em detritos vegetais ou em hospedeiros de ervas daninhas. Os hospedeiros alternativos incluem ervas daninhas e outras plantas em Solanaceae (tomateiro, batata, beringela) embora as infecções destes hospedeiros sejam extremamente raras na Florida. Os frutos são infectados quando esporos do fungo ou detritos infestados são salpicados pela chuva sobre plantas pimenteiras. Novos esporos são produzidos dentro do tecido infectado e depois são dispersos por outros frutos. Os trabalhadores podem também deslocar esporos com equipamento ou durante a manipulação de plantas infectadas. A infecção ocorre geralmente durante o tempo quente e húmido. Temperaturas à volta de 80° F (27° C) são temperaturas óptimas para o desenvolvimento de doenças, embora a infecção ocorra tanto a temperaturas mais altas como a temperaturas mais baixas. Perdas graves ocorrem durante o tempo chuvoso porque os esporos são lavados ou salpicados para outros frutos, resultando em mais infecções. É mais provável que a doença se desenvolva em frutos maduros que estejam presentes durante um longo período na planta, embora possa ocorrer tanto em frutos imaturos como em frutos maduros. A antracnose pode infectar de 15 °C a 30 °C. Mas uma humidade das folhas longas é necessário para satisfazer as necessidades de uma infecção. À temperatura óptima de 20°C a 25°C ainda 12 horas de humidade das folhas são necessárias. Uma temperatura mais elevada ou mais fria necessitará de períodos de chicotada das folhas ainda mais longos (sem função linear/arranjo necessário para o cálculo). FieldClimate calcula os possíveis eventos de infecção com base na humidade das folhas e as temperaturas durante este evento.
O míldio
Biologia de Plasmopara viticola (Downy Mildew)
P. viticola é um parasita obrigatório. O que significa que órgãos verdes e frescos da vinha são necessários para crescer. Durante o período sem vegetação persiste a formação de corpos frutíferos, os chamados oósporos. Os oósporos de oomycetes podem sobreviver a períodos muito longos no solo. Portanto, podemos encontrar míldio em locais onde as infecções não são possíveis em cada ano. Na primavera, quando o solo superior estiver suficientemente húmido e quente, os oósporos formarão a chamada macrosporangia, que pode libertar até 200 zoósporos em água livre. Os zoósporos movem-se até às folhas e aglomerados pelo vento em gotículas de água. Têm dois flagelos e movem-se numa película de água no lado negativo das folhas ou dos cachos e bagas jovens para encontrar um estoma para entrar no tecido vegetal. Entram e germinam no estoma, no qual transferem todo o seu plasma em menos de uma hora. Em estudos microscópicos, a descoberta do estoma, a encistação e a germinação para o estoma foi concluída em 90 minutos.
P. viticola cresce no espaço intercelular e alimenta-se de hemostorias que penetram as células epidérmicas e parenquimatosas. Em dependência da temperatura e humidade relativa, desenvolve um crescimento intercelular suficiente com suficientes haustorias para formar um corpo de substrato que preenche toda a área do substrato e que levanta o tecido epidérmico do tecido parenquimatoso. Isto leva ao sintoma visível da mancha de óleo.
Oomycetes são esporulando na ausência de luz quando a humidade relativa é muito elevado. Em P. viticola não há sporulação se as temperaturas forem inferiores a 12°C e a humidade relativa for inferior a 95%. Os esporangiaforos são formados pelas vesículas do substrato e sairão do estoma. Os esporângios recém-formados são pegajosos e só podem ser removidos dos esporângios pela água. Durante a diminuição da humidade relativa, os esporângios tornam-se tentativa e também podem ser removidos pelo vento.
Os esporângios libertarão até 20 zoosporos em água livre. Estes zoosporos também têm de ser distribuídos pelo vento em gotículas de água para chegarem às folhas frescas, ou os esporângios podem ser distribuídos pela chuva ou pelo próprio vento. O processo de infecção da infecção primária e secundária é o mesmo.
Fazer à grande importância da fase sexual para a hibernação do agente patogénico, podemos assumir tipos de acasalamento adequados em todas as vinhas onde ocorre míldio da videira. A formação de zoósporos tem lugar em folhas mais velhas durante o Verão e no início do Outono.
Infecção primária em detalhe
As infecções provenientes dos oósporos são chamadas infecções primárias. Este termo é enganador, uma vez que várias infecções primárias podem ocorrer no início do Verão. Em eventos epidemiológicos, a infecção primária não desempenha um papel importante se houver manchas de óleo suficientes nas vinhas e o potencial de infecção dos esporos de Verão (esporângios) exceder os esporos.
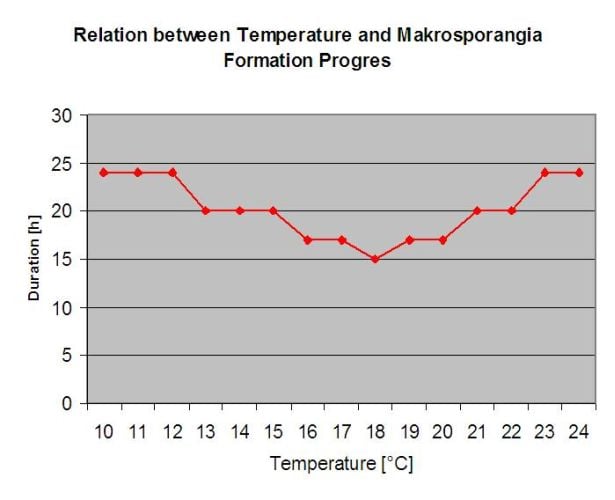
Os oósporos de Inverno desenvolvem-se para os chamados macrosporangia sempre que há humidade relativa suficiente para cerca de 24 horas. Os macrosporângios libertam os seus zoosporos em água livre e chuva intensa (como numa trovoada). Os esporos são transportados para as folhas das videiras e/ou rebentos verdes. Infecções primárias, portanto, precisa de mais tempo de chuva períodos ou várias trovoadas sucessivas. A primeira chuva faz com que as folhas caídas sejam saturadas com água e a chuva forte nos dias seguintes faz com que as macrosporângios libertem os seus zoospórdios, que atingem as folhas ou rebentos da videira. Para o sucesso da infecção, é necessário um período suficientemente longo de humidade das folhas para permitir que os zoósporos alcancem o estoma das folhas ou rebentos e os infectem (a Ilustração acima mostra o ciclo de desenvolvimento do míldio da videira (Plasmopara viticola).
O Modelo para o Downy Mildew verifica primeiro, se o tempo é adequado para o desenvolvimento de macrosporangia. Este é o caso desde que as folhas estejam molhadas, ou que a humidade relativa após a chuva não desça abaixo de 70%. Dependendo da temperatura, as macrosporângios podem desenvolver-se dentro de 16 a 24 horas. Se as macrosporângias maduras estiverem disponíveis, serão mostradas graficamente na exibição da infecção primária por Downy Mildew. Se as macrosporângios estiverem presentes, uma forte precipitação pode espalhar os seus zoospóros. Uma chuva contínua de 5 mm é interpretada como uma chuva forte e os zoósporos são espalhados, uma infecção primária é mais do que possível se a humidade das folhas tiver durado o tempo suficiente.
Infecções Secundárias
Infecções secundárias de Plasmopara viticola só são possíveis se já existirem manchas de óleo maduras na sua vinha ou perto dela. As manchas de óleo estão maduras quando são capazes de esporângio (produzir esporângios). Os esporângios só são produzidos por noite. A luz solar inibe a esporulação. Os esporângios são produzidos se for mais quente que 12°C e a humidade relativa é muito elevado. A taxa de produção de esporângios aumenta com a temperatura até 24°C. A temperatura óptima para o esporângio nas castas europeias (Vitis vinifera) é de cerca de 24°C. Se as temperaturas excederem os 29°C, não se pode fazer qualquer esporulação. No nosso modelo, verificamos se humidade de mais de 95% ocorre durante a noite. Se esta condição durar uma temperatura horária acumulada de mais de 50°C, a esporulação terminou e novos esporângios de Plasmopara existem na vinha. Por exemplo, 50°C horas correspondem a 4 horas com 13°C ou 3 horas com 17°C.
O gráfico seguinte mostra a relação entre as condições de temperatura e humidade (humidade relativa, humidade foliar, precipitação) que são utilizadas para modelar os eventos de infecção em fieldclimate.com.
Sporangia de Plasmopara viticola têm uma vida útil limitada. Quanto mais quente for e quanto mais seco for o ar, mais rápido morrem (em ng.fieldclimate.com, reiniciamos para 0 quando r.h. é inferior a 50%). Morrem definitivamente no próximo período de orvalho ou molhamento das folhas, que é demasiado curto para infecção. A aptidão dos esporângios mais antigos é, portanto, bastante limitada. O nosso modelo pressupõe que a vida útil dos esporângios seja limitada a um dia.
Para causar novas infecções, os esporângios devem ser distribuídos. Há duas formas de distribuição de esporos: Se chover imediatamente após a formação dos esporângios, estes propagam-se com os salpicos de chuva. Se as folhas da videira permanecerem tempo suficiente molhadas, um nível elevado de Plasmopara viticola As infecções têm lugar. Se a manhã seguinte começar sem chuva e com uma humidade decrescente, os esporângios secos abscisam-se dos seus ramos. Mesmo um ligeiro movimento de ar os transportará para folhas saudáveis. A menos que chova em breve, eles morrerão.
Infecção Primária por Downy Mildew
As infecções são mostradas após o desenvolvimento dos macrósporos (laranja, quinto gráfico) em três classes de gravidade diferentes (fraco: laranja, moderado: verde, severo: vermelho) dependendo da quantidade de chuva e, portanto, da distribuição dos esporos na vinha. Se a infecção 100% for determinada, são dadas condições óptimas para entrar no tecido vegetal (curativo de protecção vegetal) e a curva de incubação (primeiro gráfico) começa a aumentar. Se a incubação terminar (100%) e nenhuma protecção vegetal tiver sido tomada em consideração, os sintomas (manchas de óleo) deveriam ter sido verificados no campo.
1. A curva de progresso da infecção e após a infecção completa o consequente período de incubação (tempo entre a infecção e os sintomas visíveis no campo).
2. Uma curva de progresso da infecção é determinada quando a macrosporângio ou esporângio estão presentes e as folhas estão molhadas. Aumenta com a humidade contínua das folhas e a temperatura. Se a curva de progresso da infecção atingir 100%, pode assumir-se que a infecção está completa. A curva de progresso da incubação, que pertence à infecção específica, começa a ser calculada com o início de uma infecção. Se uma infecção não puder ser completada, a curva de incubação também será interrompida.
3. As condições meteorológicas são apresentadas na mesma página com os resultados do modelo da doença. Portanto, pode verificar com um olhar a temperatura, humidade relativa, chuva e humidade das folhas durante a infecção.
4. O modelo está a apontar datas de infecção para infecções primárias e secundárias de míldio da videira. Esta é a informação mais crítica. As infecções, que ainda não foram cobertas nem por fungicidas preventivos nem curativos, podem ser desastrosas para o rendimento/qualidade. Mais informações sobre a gravidade das infecções (fraco/moderado/severde) podem ser úteis para decidir a estratégia de protecção das plantas na dependência da história da vinha (quantidade de inóculo), variedade e experiência dos anos anteriores.
Estratégias de protecção das plantas
- Os fungicidas profilácticos e sistémicos ou curativos são amplamente utilizados para o controlo do míldio. Os produtos químicos profiláticos são aplicados antes, mas o mais próximo possível de um evento de infecção no período de maior susceptibilidade do hospedeiro, entre o comprimento do rebento de 10 cm e as bagas do tamanho de ervilha.
- Os produtos químicos profilácticos também podem ser utilizados pulverizando o mais próximo possível antes de uma previsão de chuva de mais de 2mm (para o círculo primário).
- O fungicida curativo deve ser aplicado o mais cedo possível após um evento de infecção (infecção 100%) e antes do aparecimento de manchas de óleo. Ter consciência de prevenir o desenvolvimento da resistência aos fungicidas.
- O controlo da vinha para detectar a presença de míldio (manchas de azeite) deve ser feito regularmente e tendo em conta pelo menos 200 vinhas. É considerado um risco, se forem observadas mais de duas manchas de azeite por 50 videiras.
O modelo baseia-se nas publicações de MUELLER-THURGAU, ARENS, MUELLER e SLEUMER, BLAESER, HERZOG, GEHMANN e muitos outros trabalhadores ligados à rede de investigação sobre a epidemiologia do míldio da videira e do oídio desde o início do século XIX.
Pó de oídio
O oídio do tomate pode ser causado por três agentes patogénicos em todo o mundo.
Leveillula taurica (Oidiopsis taurica) é um agente patogénico de uma vasta gama de espécies hospedeiras em climas áridos a semi-áridos quentes na Ásia, Mediterrâneo, África, e mais recentemente no sudoeste dos Estados Unidos.
Erysiphe orontii (E. cichoracearum e E. Polifaga) é outra espécie comum a muitas plantas hospedeiras, tanto em regiões temperadas como tropicais.
E como uma terceira espécie Odium lycopersicum.
Factores para o Desenvolvimento de Doenças
- níveis de humidade relativa > 50% (humidade relativa óptima > 90%)
- não é necessária água livre nas superfícies foliares
- gama de temperaturas: 10-35 °C (melhor abaixo de 30 °C)
O míldio em pó é uma doença induzida por inóculos. Por conseguinte, apenas podem ser determinados períodos de risco, factor principal para os danos, por exemplo, o surto é o inóculo inicial (que está activo numa vasta gama de temperaturas). Assim, para as cintas de controlo: combinar a modelação do período de risco com a monitorização do inóculo fúngico (doença) no campo!
Tomate de campo aberto
Ferrugem dos espargos
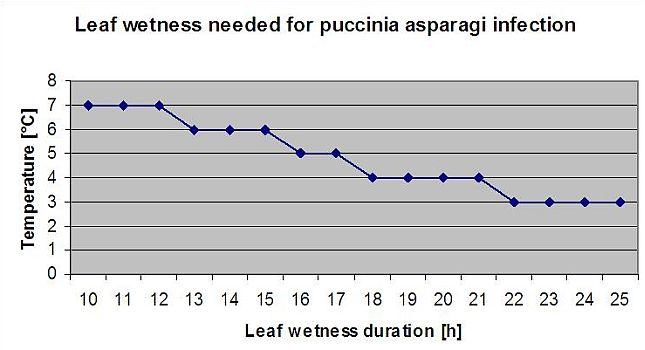
Ferrugem dos espargos Puccinia asparagi é favorecido por um clima húmido e quente. Pequenas quantidades de chuva e vento distribuem os urediaspores, enquanto as chuvas fortes podem lavá-los até ao solo. Por esta razão, um período de humidade das folhas com mais de 10 mm de chuva não é tomado para um período de infecção. Os períodos de chuvas leves e orvalho de 3 a 8 horas com temperaturas de 25°C até 10°C podem ser períodos de infecção para os urediasporos no Verão e no final do Verão.
Estemphylium foliar blight
Stemphylium o míldio da folha é causado pelo fungo Estemphylium vesicarium. Pequenas lesões pequenas, de amarelo claro a castanho e embebidas em água desenvolvem-se nas folhas. Estas pequenas lesões desenvolvem-se em manchas alongadas que frequentemente coalescem, resultando em folhas debilitadas. As lesões tornam-se geralmente castanhas claras a bronzeadas no centro e depois castanhas escuras a pretas à medida que os esporos deste agente patogénico se desenvolvem. S. vesicarium normalmente invade tecido de cebola morto e moribundo, tais como pontas de folhas, lesões de mancha roxa e míldio, tecido ferido, e tecido senescente. A infecção geralmente permanece restrita às folhas e não se estende às escamas do bulbo. As lesões ocorrem geralmente no lado da folha virado para o vento dominante. Longos períodos de condições húmidas quentes encorajam o desenvolvimento de doenças.
Stemphylium versicarium modelo baseia-se no trabalho de SUHERI e PRICE em cebolas e LLorent, VILARDELLL, BUGIANI, GHERARDI e MONTESINO em pêra. As curvas de infecção para infecções fracas, moderadas e graves são computadas. Depende do historial da doença do local em que se encontra o soro, o tratamento deve ser tomado em consideração por uma infecção fraca, moderada ou pesada.
Com esta separação em situações favoráveis, moderadamente favoráveis e muito favoráveis, cabe ao cultivador decidir quão grande será a pressão da doença num campo específico e se ele tem de cobrir uma infecção específica.
Temperatura: 11-30°C
Humidade das folhas: > 0 (início para infecção) ou humidade rel. > 90% (apenas se já existia uma infecção antes calculada e ainda está a aguentar)
infecção leve (11-30°C), infecção moderada (13-30°C), infecção severa (16-30°C), matriz com duração de molhamento das folhas (ver acima)
Repor: se a humidade rel. for inferior a 70%.
S. versicarium as infecções existem frequentemente juntamente com Alternaria porri infecções. Portanto, o modelo TomCast (Alternaria) é muito frequentemente utilizado para ambos.
Mancha foliar de Cercospora
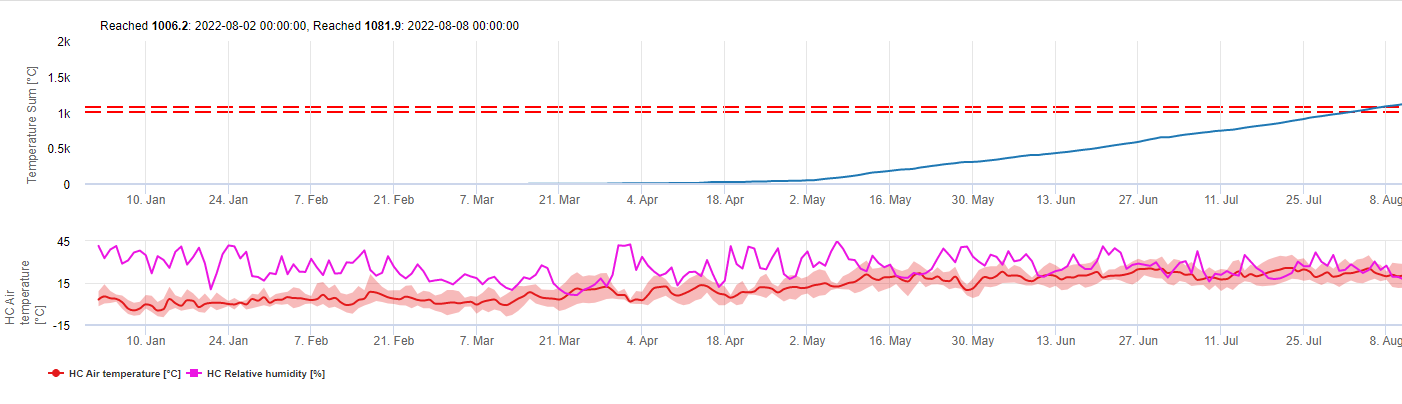
Este modelo estima a data da primeira ocorrência de C. beticola com base nas temperaturas médias diárias acumuladas desde o dia 1 de Janeiro acima dos 5°C. É necessário um limiar de 1006,2°C em períodos com humidade relativa superior a 60% e se não tivermos humidade relativa, é válido um limiar de 1081,9°C.
Este modelo foi desenvolvido para a Itália e é utilizado em Itália e na Alemanha.
Para o ano 2010 em Styria CercoPrim indica o 19 de Junho para o primeiro spray. Esta é aproximadamente a mesma data que o modelo de risco Pessl Instruments ou o modelo DIV teria indicado para aspergir variedades susceptíveis.
Doença da mancha púrpura
O Pathogen
A doença da mancha roxa em lanças de espargos e samambaia é causada pelo fungo Estemphylium vesicarium. O fungo sobrevive ao inverno como esporos sexuais (ascósporos) num saco (ascus) produzido em estruturas de Inverno (pseudotecia) que aparecem como pequenos pontos negros em detritos de espargos da estação anterior. O os ascósporos são libertados do ascus pela chuva e podem ser transportados pelo vento para as plantas de espargos recentemente surgidas, onde causam a infecção primária da estação de crescimento. Estas novas infecções resultam em esporos (conidia) produzidos por um processo assexuado, que por sua vez podem causar infecções secundárias, um processo que se repete desde que as temperaturas e a pluviosidade sejam favoráveis.
A Doença
O aparecimento da mancha roxa como um problema significativo na produção de espargos no Michigan pode dever-se à adopção de um sistema cultural "no till till", em que o feto seco da estação anterior é cortado em Abril e deixado na superfície do solo. Este resíduo persiste durante a época de colheita (meados de Junho) e é visível durante o período de crescimento da samambaia (finais de Junho a Setembro) e é a fonte de ascósporos que iniciam infecções no início da época de crescimento. Os sintomas da doença são: A doença aparece como numerosas manchas arroxeadas, ligeiramente afundadas, com centros castanhos que ocorrem em lanças e samambaias colhidas. As lesões nas lanças são frequentemente encontradas no lado do barlavento, porque o sopro de areia provoca feridas que favorecem a infecção. Durante anos epidémicos, a mancha pode ocorrer em 60-90% das lanças e pode resultar na rejeição da cultura, especialmente para a venda de produtos frescos no mercado. Também ocorrem manchas nos fetos dos espargos, afectando o caule principal, ramos secundários e agulhas (cladophylls). Uma infecção grave da samambaia pode resultar na desfoliação prematura da planta. O aumento da gravidade da doença da mancha roxa está associado a longos períodos de chuvas, nevoeiro ou orvalho.
Crédito de texto: Mary K. Hausbeck, Professora e Especialista em Extensão, Michigan State University, Department of Plant Pathology, E. Lansing
TomCast para Espargos
Antecedentes: O TOMCAST (TOMato disease foreCASTing) é um modelo informático baseado em dados de campo que tenta prever o desenvolvimento de doenças fúngicas, nomeadamente Early Blight, Septoria Leaf Spot e Anthracnose em tomates. Os registadores de dados colocados no campo estão a registar dados horários de humidade das folhas e de temperatura. Estes dados são analisados durante um período de 24 horas e podem resultar na formação de um Valor de Gravidade da Doença (DSV); essencialmente um incremento do desenvolvimento da doença. À medida que o DSV se acumula, a pressão da doença continua a aumentar sobre a cultura. Quando o número de DSV acumulado excede o intervalo de pulverização, recomenda-se uma aplicação de fungicida para aliviar a pressão da doença.
TOMCAST é derivado do modelo original F.A.S.T. (Forecasting Alternaria solani on Tomatoes) desenvolvido pelo Dr. Madden, Pennypacker, e MacNab na Universidade Estadual da Pensilvânia (PSU). O modelo PSU F.A.S.T. foi ainda modificado pelo Dr. Pitblado no Ridgetown College em Ontário, no que agora reconhecemos como o modelo TOMCAST utilizado pela Ohio State University Extension.
DSV são: Um Valor de Gravidade da Doença (DSV) é a unidade de medida dada a um incremento específico do desenvolvimento da doença (Early Blight).
Por outras palavras, um DSV é uma representação numérica de quão rápida ou lenta a doença (Early Blight) se está a acumular num campo de tomate. O DSV é determinado por dois factores: humidade da folha e temperatura durante as horas de "molho da folha". À medida que o número de horas de folha molhada e a temperatura aumenta, o DSV acumula a um ritmo mais rápido. Ver a Tabela de Valores de Gravidade da Doença abaixo.
Inversamente, quando há menos horas húmidas de folhas e a temperatura é mais baixa, o DSV acumula-se lentamente, se é que se acumula. Quando o número total de DSV acumulados excede um limite predefinido, chamado intervalo ou limiar de pulverização, recomenda-se um spray fungicida para proteger a folhagem e a fruta do desenvolvimento de doenças.
O intervalo de pulverização (que determina quando se deve pulverizar) pode variar entre 15-20 DSV. O DSV exacto que um produtor deve utilizar é normalmente fornecido pelo processador e depende da qualidade da fruta e da utilização final dos tomates. Seguindo um intervalo de 15 DSV spray é uma utilização conservadora do sistema TOMCAST, o que significa que pulverizará mais frequentemente do que um cultivador que utiliza um intervalo de 19 DSV spray com o sistema TOMCAST. A troca está no número de pulverizações aplicadas durante a estação e no potencial de diferença na qualidade da fruta.
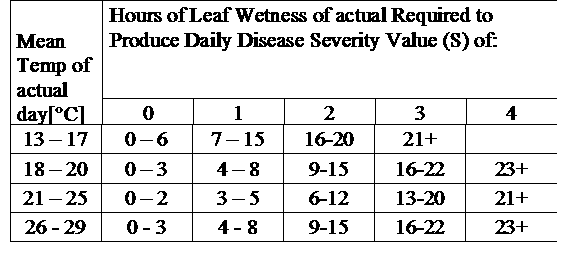 TomCast com Espargos
TomCast com Espargos
A investigação determinou que o Tom-Cast Disease forecaster é uma alternativa promissora à pulverização de samambaia em campos comerciais de espargos com base em calendário. O Tom-Cast alerta os cultivadores quando o as condições ambientais são favoráveis ao desenvolvimento da doença da mancha roxa (períodos prolongados de orvalho ou de chuva acompanhados de temperaturas quentes). Os fungicidas eficazes aplicados de acordo com a previsão da doença de Tom-Cast permitem aos cultivadores gerir a doença da mancha roxa dos espargos, poupando dinheiro e preservando o ambiente.
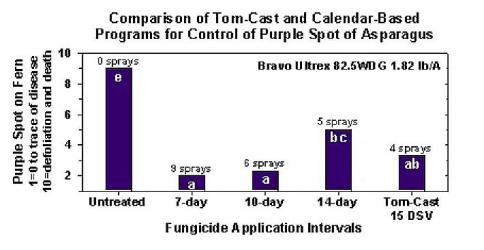
Crédito de texto: Jim Jasinski, Coordenador de TOMCAST PARA OHIO, INDIANA, & MICHIGAN
Modelo de infecção por manchas roxas
O Stemphylium versicarium modelo de infecção baseia-se no trabalho de SUHERI e PRICE em cebolas e LLorent, VILARDELLL, BUGIANI, GHERARDI e MONTESINO em pêra.
As curvas de infecção para infecções leves, moderadas e graves são computadas.
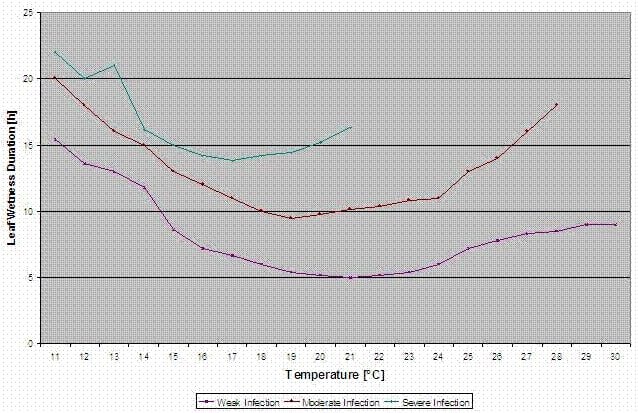
Com esta separação em situações favoráveis, moderadamente favoráveis e muito favoráveis, cabe ao cultivador decidir quão grande será a pressão da doença num campo específico e se ele tem de cobrir uma infecção específica.
Condições:
Temperatura: 11-30°C
Humidade da folha > 0 (início para infecção) ou humidade rel. > 90% (apenas se já havia uma infecção antes calculada e ainda está a aguentar)
infecção leve (11-30°C), infecção moderada (13-30°C), infecção severa (16-30°C), uma matriz com duração de molhamento das folhas (ver acima)
Repor: se a humidade rel. for inferior a 70%.
Equipamento recomendado
Verificar que conjunto de sensores é necessário para monitorizar as potenciais doenças desta cultura.