Verificar que conjunto de sensores é necessário para monitorizar as potenciais doenças desta cultura.

Banana modelos de doenças
A banana é um dos frutos mais importantes a nível mundial. Na sua forma doce como a Banana Dólar e na sua forma culinária não doce, é uma parte principal da dieta das pessoas que vivem em países tropicais. Desde os finais do século XIX, a banana começa a tornar-se o fruto mais importante do comércio mundial. A banana produzida na América Central e nos Caraíbas começou a exportar para os EUA e para a Europa. Hoje em dia a banana é uma parte importante da base de fruta dos países industriais. Com o aumento dos rendimentos na China e na Europa de Leste, novos mercados estão a produzir novas exigências para a banana.
Há dois importantes doenças das manchas foliares em bananas: Sigatoka Amarelo e Sigatoka Negro. A Sigatoka Amarela causada pelo fungo Mycosphaerella musicola tem sido espalhada por todas as áreas de cultivo da Banana, enquanto a Sigatoka Negra causada pelo fungo M. fijiensis var. difformis foi encontrado em Fiji. A Sigatoka Negra está a mostrar uma virulência muito superior à da Sigatoka Amarela e, por essa razão, tornou-se a doença mais importante da Banana na maioria dos países produtores de bananas.
Doença de Sigatoka Negra
O trabalho é baseado nos dois artigos seguintes:
-• Doença da Black Leaf Streak; Pests and Diseases of American Samoa Number 10, American Samoa Community College Community & Natural Resources Cooperative Research & Extension. 2004
-• Sigatoka Negra Um Fio Crescente para o Cultivo da Banana; Douglas H. Marín, Del Monte Fresh Produce; Ronald A. Romero, Chiquita Brands; Mauricio Guzmán, National Banana Corporation of Costa Rica; Turner B. Sutton, North Carolina State University, Raleigh
A faixa da folha negra (BLS), ou "Black Sigatoka", é a doença foliar mais prejudicial das bananas em todo o mundo. A maioria das áreas dos trópicos e subtropicais são afectadas, com perdas relatadas de 30-50%. O primeiro relato de BLS no Pacífico foi há 40 anos atrás no Vale de Sigatoka, Fiji. A maioria dos fungicidas utilizados na produção de bananas é para controlar a BLS. A banana do tipo "Williams", cultivada pela maioria dos cultivadores comerciais, é muito susceptível à doença fúngica. As plantas infectadas têm menos folhas, o que leva a menos e menores frutos, a uma colheita atrasada, ao amadurecimento prematuro e a frutos de menor qualidade.
Impacto potencial
A sigatoka preta causa a destruição do tecido foliar da bananeira, o que afecta as capacidades fotossintéticas da planta e pode reduzir os rendimentos em até 50%. A sigatoka negra é um dos principais factores responsáveis pelo declínio das indústrias de exportação de banana nas Nações do Pacífico Sul. As plantações comerciais que produzem bananas para exportação têm de manter um dispendioso programa de pulverização fungicida para controlar a sigatoka negra, e têm sido criticadas com base em considerações ambientais e de saúde humana. Contudo, se não forem controladas, as frutas produzidas em plantas doentes podem amadurecer prematuramente durante a expedição e causar mais perdas. A devastação da doença foi controlada por pulverizações químicas nos anos seguintes (15-17 aplicações fungicidas), mas isto aumentou consideravelmente o custo de produção.
Vegetais afectados
Os sintomas definidos de sigatoka negra só foram registados em Musa (Bananas), Musa paradisiaca (Plátanos), Musa acuminata (Banana selvagem) e Musa acuminata (subsp. bantesii e subsp. zebrina). Os cultivares diferem na sua reacção ao patogénico. A imunidade não é conhecida e é possível que outras espécies e subespécies selvagens de Musa estão infectados, mas a doença não se desenvolve significativamente. Mycosphaerella fijiensis pode também atacar a fase de muda das bananas selvagens.
Época de ocorrência
Os esporos negros sigatoka formam-se facilmente durante os verões tropicais e subtropicais ou em condições de elevada humidade e precipitaçãoespecialmente se houver uma película de água livre sobre as folhas. O principal meio de propagação é a lavagem com chuva ou salpicos de esporos, mas mais tarde, no desenvolvimento da doença, os esporos são também descarregados à força nas correntes de ar. A infecção ocorre nas folhas mais jovens da planta durante e imediatamente após o desenrolar da doença, mas as folhas mais velhas são mais propícias ao desenvolvimento da doença. Os sintomas visuais óbvios aparecem cerca de 15-20 dias após a infecção inicial.
Sintomas
Os primeiros sintomas aparentes de infecção foliar são linhas curtas, castanho-avermelhadas com cerca de 2 mm de comprimento. As linhas transformam-se em estrias castanhas de 20-30 mm de comprimento que se alargam em manchas elípticas, castanhas na parte inferior da folha, pretas na superfície superior. As manchas são ligeiramente afundadas e rodeadas por uma auréola amarelada. A seguir, o centro da grande mancha torna-se cinzento, rodeado por uma linha preta e uma auréola amarela. Finalmente, as manchas fundem-se, matando a folha.
Epidemiologia
Tanto a Conidia como os ascósporos desempenham papéis na propagação da doença. A forma de conídio em condições de elevada humidadeespecialmente se houver uma película de água livre sobre as folhas. Formam-se durante o desenvolvimento das primeiras fases da doença (especialmente durante a fase de traço 2, fase de listras3, e fase de manchas 4). Os principais meios de dispersão são a chuva e os salpicos; as conídias não são separadas pelo vento. As conidias estão sobretudo associadas à propagação local da doença e são importantes durante períodos de elevada humidade, orvalho pesado frequente, e chuviscos intermitentes.
Porque M. fijiensis produz relativamente poucas conidias, os ascósporos são considerados mais importantes na propagação da Sigatoka negra (4,20). Contudo, Jacome et al. (10) afirmaram que as conidias são capazes de causar quantidades significativas de doença, e os sintomas da doença são idênticos aos causados pela infecção por ascósporos. Ele indicou que as conidias tornam-se mais importantes durante os períodos secos, quando o desenvolvimento da doença é atrasado devido à presença de condições climáticas menos favoráveis (10). Os ascósporos são o principal meio de dispersão em distâncias mais longas dentro das plantações e em novas áreas, e são o meio habitual de propagação durante longos períodos de tempo de chuva (3,4,6,10, 11,15).
Os ascósporos são produzidos em pseudotecia em lesões maduras, que são comuns nas folhas mais velhas da planta ou em folhas mortas deitadas no chão. Meredith e Lawrence (14) relataram que as pseudotecias são produzidas em ambos os lados da superfície da folha, mas números mais elevados estão presentes na superfície adaxial. Pelo contrário, Gauhl et al. (6) descobriram que foram produzidas mais pseudotecias e ascósporos na superfície da folha abaxial. Embora Burt et al. (2) tenham descoberto que aproximadamente 4,5 ascósporos são libertados por pseudotécio, este número parece muito baixo considerando a alta concentração de inóculo que está presente no ar após a chuva (4).
Libertação Ascospore
Requer a presença de uma película de água da chuva ou do orvalho que imbibe a pseudotecia e resulta na ejecção forçada dos ascósporos através da camada limite da folha, onde são disseminados por correntes de ar (15,20). A maturação da pseudotecia requer saturação dos tecidos das folhas mortas durante aproximadamente 48 h (3,4,7,10,11,15). Sob condições havaianas, as concentrações de ascósporos aumentaram durante a noite, foram mais elevadas cerca das 0600 h, e diminuíram significativamente durante o dia. Em dias de chuva, os picos de concentração ocorreram pouco depois do início da chuva. Os aumentos sazonais das concentrações médias diárias de ascósporos estão associados ao aumento da precipitação e da humidade relativa (15). Gauhl (4), trabalhando com bananas, relatou resultados semelhantes em condições costarriquenhas. Enquanto Meredith et al. (15) não encontraram provas de que a produção ou libertação de ascósporos tenha sido afectada pelas temperaturas mínimas, Gauhl (4) determinou que há uma redução na produção de inóculos durante os meses mais secos (ou menos chuvosos) do ano na zona das Caraíbas da Costa Rica, que é também a estação com as temperaturas mais baixas. Os ascósporos são dispersos pelo vento; no entanto, a dispersão a longa distância é limitada a algumas centenas de quilómetros devido à sua susceptibilidade à radiação ultravioleta (17). Não foi demonstrada uma relação consistente entre a descarga de ascósporos e o desenvolvimento de doenças, limitando assim a utilidade da armadilha de esporos para a previsão de doenças (5,11). Os ascósporos são depositados principalmente na superfície inferior da folha durante o desenrolar de uma nova folha, produzindo um padrão de bandas de infecções no lado que é exposto pela primeira vez, o que é um reflexo do aumento da deposição de esporos na folha cilíndrica da candela durante o seu desenrolar, em oposição a toda a lâmina aberta da folha. Consequentemente, a maioria das infecções ocorre na superfície abaxial das folhas (3,7).
Infecção
Os tubos de germes levam aproximadamente 48 a 72 h para penetrar os estomas (1,20), embora o fungo possa crescer epífita na superfície da folha por até 6 dias antes de penetrar realmente as folhas (1). Infecção bem sucedida é promovida pela extensão períodos de elevada humidade e a presença de água livre nas folhas (3,7,13). A germinação máxima ocorre quando há água livre presente. As conidias germinam numa gama mais ampla de humidade relativa (92 a 100%) do que os ascósporos (98 a 100%). O efeito de temperatura sobre a germinação pode ser caracterizada por uma função de resposta quadrática, com um óptimo estimado de 26,5°C (10). Stover (21) observou um crescimento máximo de tubos de germes ascósporos a 26 a 28°C após 24 h de incubação. Jacome e Schuh (8,9) relataram que as folhas mais velhas eram mais susceptíveis; contudo, E. Bureau (comunicação pessoal) e Romero (18) observaram que as folhas mais novas são mais susceptíveis (da primeira à terceira) do que as mais velhas.
Período de incubação
O tempo entre a infecção e o aparecimento dos sintomas varia de acordo com as condições meteorológicas e a susceptibilidade das plantas (68). Nas bananas, estima-se que o tempo de infecção da folha coincide com o aparecimento de uma nova folha a partir do ápice do pseudostem (20). Em condições muito favoráveis na Costa Rica, e com um hospedeiro susceptível, a período de incubação pode ser tão curto como 13 a 14 dias, enquanto que durante períodos de tempo desfavorável, a duração do período de incubação pode estender-se até 35 dias. Existem relatórios semelhantes da Nigéria sobre plátanos (16). Durante a estação chuvosa, o período de incubação foi de 14 dias, mas na estação seca foi de 24 dias. A duração do período de incubação também varia em função da susceptibilidade da cultivar à M. fijiensis. O período de incubação foi de 26,2 e 25,1 dias, respectivamente, nas cultivares FHIA 1 e FHIA 2, dois híbridos sintéticos tetraplóides desenvolvidos pela FHIA, em comparação com 22,4 dias na cultivar susceptível Grande Naine (19).
Depois de penetrar na folha, as hifas de <M. fijiensis colonizar as células adjacentes durante aproximadamente 7 dias sem qualquer evidência de perturbação das células. As hifas vegetativas podem emergir dos estomas e crescer na superfície da folha e penetrar nos estomas adjacentes ou produzir conidióforos e conidias. Este crescimento epífito permite que o fungo colonize o tecido foliar adjacente, o que resulta num rápido desenvolvimento de sintomas (4,20). M. fijiensis tem uma maior capacidade de penetrar vários estomas do que M. musicolaque resulta numa maior mancha do que com o antigo agente patogénico (20).
Período latente
Embora as conidias possam ser produzidas em lesões que apresentem sintomas iniciais de M. fijiensis e contribuir para a epidemia, o período latente é definido pelo momento em que o fungo começa a produzir lesões com pseudotecia madura e ascósporos, que são a principal fonte de inóculo. Tal como o período de incubação, o período latente também varia de acordo com as condições climáticas, a susceptibilidade do hospedeiro, e a intensidade das infecções. O período de latência variou de 25 dias durante a estação chuvosa (Junho a Dezembro) a 70 dias durante a estação seca em Guapiles, Costa Rica. Quando o tempo é altamente propício à descarga de ascósporos e infecções, muitas infecções ocorrem nas folhas. Quando as infecções são densas, coalescem rapidamente numa fase muito precoce de desenvolvimento, acelerando o aparecimento de manchas maduras que se caracterizam pela presença de pseudotecia e ascósporos (22). Nessas condições, as folhas são rápida e gravemente danificadas. O período de latência também varia de acordo com o nível de resistência. Por exemplo, o tempo desde a emergência da folha até ao primeiro sintoma de mancha madura sob as mesmas condições naturais para a cultivar Curraré, uma banana de cozedura pertencente ao subgrupo banana, foi de 44 dias em comparação com 34 dias para a cultivar Valery, uma banana pertencente ao subgrupo Cavendish (4). O termo "tempo de desenvolvimento da doença" é amplamente utilizado na literatura sobre bananas nos trópicos para se referir ao período latente, e é definido como o tempo entre a infecção e a formação de manchas maduras. Outro termo comum utilizado na literatura da banana é "tempo de evolução dos sintomas" ou "período de transição", que é o tempo desde os primeiros sintomas até ao aparecimento de pontos de maturação (6). O tempo de evolução dos sintomas dá uma boa indicação da rapidez com que a doença está a progredir nas folhas.
Literatura:
- Beveraggi, A. 1992. Etude des interactions hôte-parasite chez des bananiers sensibles et résistants inoculés par Cercospora fijiensis responsible de la maladie des raies noires. Thèse de 3ème cycle. Université de Montpellier, Montpellier, França.
- Burt, J. P. A., Rosenberg, L. J., Rutter, J., Ramírez, F., e González, O. H. 1999. Previsão da propagação por via aérea de Mycosphaerella fijiensis, causa da doença de Sigatoka negra na banana: Estimativas dos números de peritécio e ascósporos. Ann. Aplic. Biol. 135:369-377.
- Fullerton, R. A. 1994. Sigatoka Leaf Diseases.Páginas 12-14 in: Compêndio de Doenças das Frutas Tropicais. R. C. Ploetz, G. A. Zentmyer, W. T. Nishijinia, K. G. Rohrbach, e H. D. Ohr, eds. American Phytopathological Society, St. Paul, MN.
- Gauhl, F. 1994. Epidemiologia e Ecologia da Sigatoka negra (Mycosphaerella fijiensis Morelet) sobre banana e banana (Musa spp.) na Costa Rica, América Central. INIBAP, Montpellier, França.
- Gauhl, F. 2002. São armadilhas de esporos uma ferramenta útil para prever o desenvolvimento da doença de Sigatoka em plantações comerciais de bananeiras. Página 22 in: Int. Workshop Mycosphaerella Leaf Spot Dis. Bananas, 2º - Programa e Resumos. (Abstr.)
- Gauhl, F., Pasberg-Gauhl, C., e Jones, D. R. 2000. Ciclo da doença e epidemiologia. Páginas 56-62 in: Doenças da Banana, Abacá e Enset. D. R. Jones, ed., D. R. Jones. CAB International, Wallingford, Reino Unido.
- González, M. 1987. Enfermedades del cultivo del banano. Oficina de Publicaciones de la Universidad de Costa Rica, San José.
- Jacome, L. H., e Schuh, W. 1992. Efeitos da duração da humidade das folhas e da temperatura no desenvolvimento da doença de Sigatoka negra na banana infectada por Mycosphaerella fijiensis var. difformis. Fitopatologia 82:515-520.
- Jacome, L. H., e Schuh, W. 1993. Efeito da temperatura no crescimento e produção conidial in vitro, e comparação da infecção e agressividade in vivo entre isolados de Mycosphaerella fijiensis var. difformis. Trop. Agric. 70:51-59.
- Jacome, L. H., Schuh, W., e Stevenson, R. E. 1991. Efeito da temperatura e humidade relativa na germinação e desenvolvimento do tubo germinal de Mycosphaerella fijiensis var. difformis. Fitopatologia 81:1480-1485.
- Jeger, M. J. J., Eden-Green, S., Thresh, J. M., Johanson, J. M., Waller, J. M., e Brown, A. E. 1995. Banana diseases. Páginas 317-381 in: Bananas e plátanos. S. Gowen, ed. Chapman & Hall, Londres.
- Marín, D. H., e Romero, R. A. 1992. El combate de la Sigatoka negra. Boletín No. 4, Departamento de Investigaciones, Corporación Bananera Nacional, Costa Rica.
- Mayorga, M. H. 1990. La Raya negra (Mycosphaerella fijiensis Morelet) del plátano y del banano. I. Ciclo de vida del patógeno bajo las condiciones del Urabá. Revista ICA 25:69-77.
- Meredith, D. S., e Lawrence, J. S. 1969. Doença das folhas negras da banana (Mycosphaerella fijiensis): Sintomas de doença no Havai, e notas sobre o estado conidial do fungo causal. Trans. Br. Mycol. Soc. 52:459-476.
- Meredith, D. S., Lawrence, J. S., e Firman,I. D. 1973. Libertação e dispersão de ascósporos sobre a doença das folhas negras das bananas (Mycosphaerella fijiensis). Trans. Br. Mycol. Soc. 60:547-554.
- Mobambo, K. N., Gauhl, F., Pasberg-Gauhl, C., e Zuofa, K. 1996. Avaliação da estação e do efeito da idade das plantas para resposta à doença de Sigatoka negra. Prot. de cultivo. 15:609- 614.
- Parnell, M., Burt, P. J. A., e Wilson, K. 1998. The influence of exposure to ultraviolet radiation in simulated sunlight on ascospores causing black Sigatoka disease of banana and plantain. Int. J. Biometeorol. 42:22-27.
- Romero, R. A. 1995. Dinâmica das populações resistentes aos fungicidas de Mycosphaerella fijiensis e epidemiologia da Sigatoka negra das bananas. Diss. de doutoramento. Estado da Carolina do Norte, Raleigh.
- Romero, R. A., e Sutton, T. B. 1997. Reacção de quatro genótipos Musa a três temperaturas para isolar de Mycosphaerella fijiensis de diferentes regiões. Planta Dis. 81:1139-1142.
- Stover, R. H. 1980. Sigatoka mancha de folhas de banana e plátanos. Planta Dis. 64:750-756.
- Stover, R. H. 1983. O efeito da temperatura no crescimento do tubo de germes ascósporos de Mycosphaerella musicola e Mycosphaerela fijiensis var. difformis. Frutos 38:625-628.
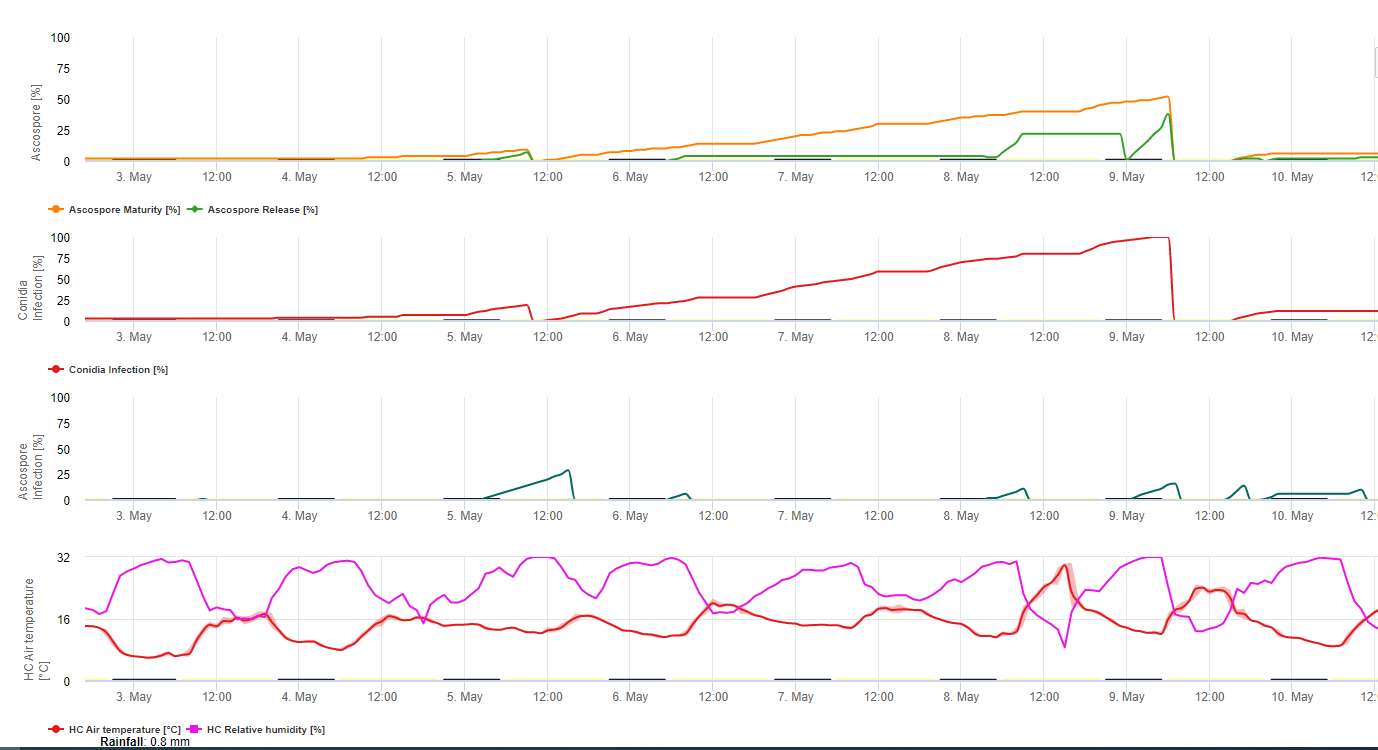
Modelo de Infecção Sigatoka Negra
O Modelo de Infecção Sigatoka no FieldClimate.com consiste de um Modelo para:
- Formação Ascospore
- Descarga Ascospore
- Infecção por Ascósporos
O Modelo para a Formação de Conidia utiliza a humidade relativa e a temperatura do ar. A formação de Conidia acontece se a humidade relativa for igual ou superior a 70%. A velocidade de formação das conidias depende da temperatura. A temperatura óptima para a formação de conídios é de 27°C a 30°C. A esta temperatura máxima, a formação de conídios ocorrerá se tivermos 70% de humidade relativa durante mais de 24 horas. Se for mais fresco ou mais quente, a formação máxima de conídios demorará 32 horas.
O Modelo para a Formação Ascospore utiliza também a temperatura e a humidade relativa. A formação de ascósporos ocorre se a humidade relativa for igual ou superior a 70%. A temperatura óptima novamente é de 27 °C a 30 °C. A esta temperatura, o máximo de ascósporos é atingido após 48 horas. A temperaturas inferiores, serão necessários 2 dias para formar a quantidade máxima de ascósporos.
A descarga ascospore tem lugar durante a chuva. A principal quantidade de ascósporos é libertada no início da chuva. Portanto, os esporos serão libertados no início da infecção. A quantidade de ascósporos libertados é limitada ao número de ascósporos formados.
A Infecção ocorre durante períodos de humidade foliar ou humidade relativa superior a 90%. Sob temperatura óptima, a infecção será terminada após 12 horas de condições húmidas. Se a temperatura não for tão alta, precisará de 15 a 24 horas.
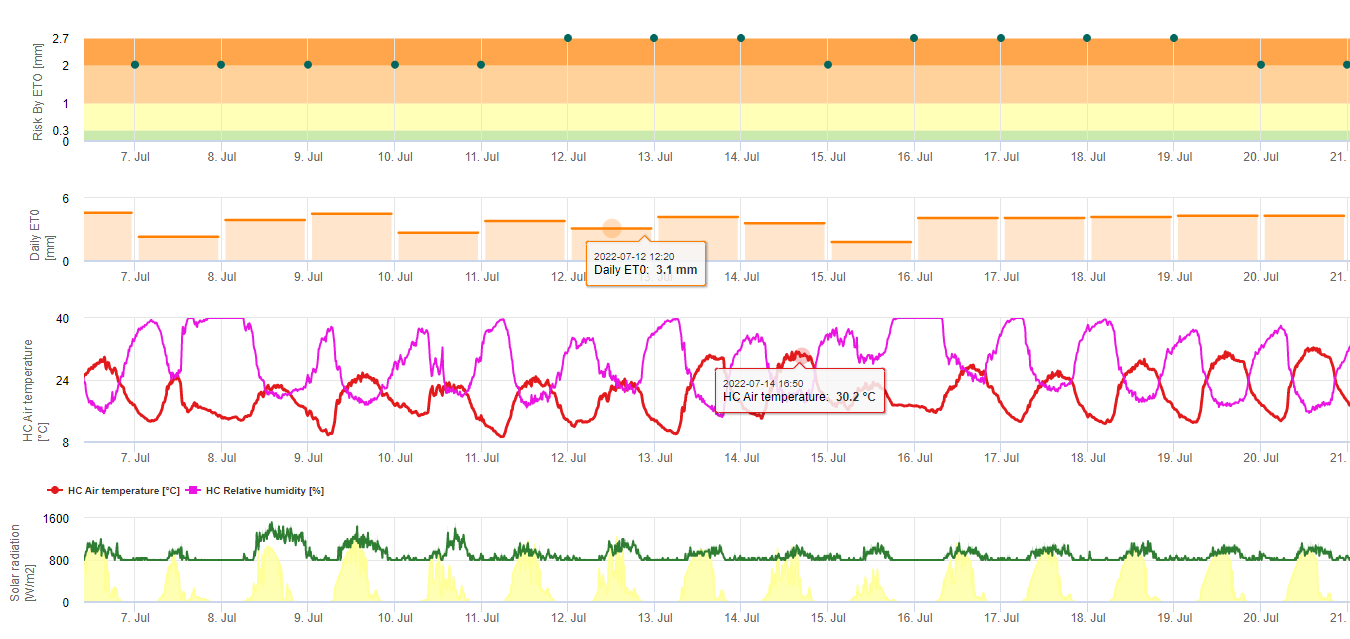
Modelo de Risco Sigatoka Negro
Um Modelo (Sigatoka risk by ET) baseia-se em a) A determinação do evapotranspiração (sensores necessários: temperatura, humidade rel., velocidade do vento e radiação globar). Este modelo é baseado no trabalho de Ganry, J. & Meyer,J.P. (1972): La lutte contrôlée contre le Cercospora aux Antilles. Bases climáticas de l'avertissement. Frutos 27(11):767-774. Neste estudo, o ETpiche foi utilizado para avaliar a favorabilidade climática à sigatoka. Field.Climate utiliza a equação "Penman Montheith" (é a equação mais geral e amplamente utilizada para o ET de referência de cálculo) em vez de ETpiche. Se a evapotranspiração acumulada dos últimos 7 dias for:
> 40 mm Sem risco
> 30 mm Risco baixo
> 22 mm Risco médio
< 22 mm Risco elevado
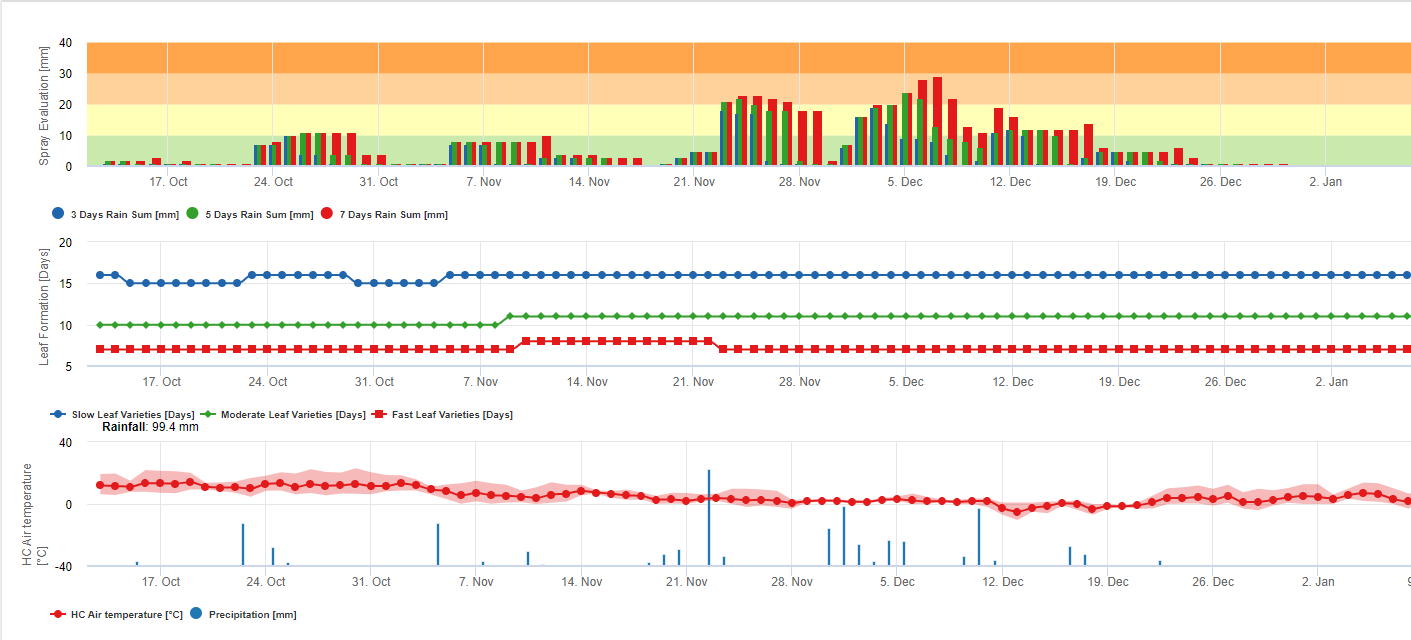
Informação para Avaliação do Spray Sigatoka Negro
Acumulação de chuva para avaliação de resíduos no FieldClimate:
Se a chuva for >= 3mm, é contada e acumulada para:
- 3 dias
- 5 dias
- 7 dias
A soma de chuva acumulada resulta num Gráfico em referência a um limiar de 10, 20 e 30 mm.
Formação de folhas para avaliação de resíduos no FieldClimate:
Se as temperaturas do ar diurno e nocturno forem:
12-14°C e 12-13°C leva 23, 16, ou 21 dias 15-17°C e 14-15°C leva 20, 14, ou 10 dias 18-20°C e 16-22°C leva <15, <12, ou <8 dias 21-27°C e 16-22°C leva <13, <11, ou <6 dias 28-30°C e 23-24°C leva <14, <12, ou <8 dias 31-40°C e 25-40°C leva 20, 14, ou 10 dias para formar todas as folhas em variedades com formação média, rápida e muito rápida das folhas.
Esta informação deve ajudar a avaliar os tecidos desprotegidos. Assim, as razões podem ser uma grande quantidade de chuva desde a última aplicação das medidas de protecção das plantas (os resíduos já são lavados ou formam-se novas folhas.